Journal of Advances in Physical Chemistry
Vol.
08
No.
02
(
2019
), Article ID:
30148
,
11
pages
10.12677/JAPC.2019.82004
Study on Characters of Oseltamivir by Density Functional Theory
Ye Liu, Cunhai Liu, Jilei Zhang, Dezhi Su
School of Basic Sciences for Aviation, Naval Aviation University, Yantai Shandong
Received: Apr. 23rd, 2019; accepted: May 3rd, 2019; published: May 10th, 2019

ABSTRACT
The oseltamivir is studied at the 6-31G(d) basis set level, using the B3LYP method of density functional theory, and the stable structure and its infra-red spectrum are gained. After researched, according to vibration modes, the infra-red spectrum of methyl oseltamivir mainly lies in three different regions: (0~1000) cm−1, (1000~2000) cm−1, (2000~4000) cm−1. In addition, due to the existence of degeneracy and non-infrared activity, the practicable number of the spectral line is less than that of the normal modes.
Keywords:Oseltamivir, Density Functional Theory, Infra-Red Spectrum, Non-Infrared Activity
奥司他韦的密度泛函理论研究
柳叶,刘存海,张纪磊,宿德志
海军航空大学航空基础学院,山东 烟台
收稿日期:2019年4月23日;录用日期:2019年5月3日;发布日期:2019年5月10日

摘 要
本文应用密度泛函理论的B3LYP方法,在6-31G(d)基组水平上对奥司他韦分子进行了理论计算,得到了分子的稳定构型及其红外光谱。研究发现根据分子振动类型的不同,奥司他韦的红外振动光谱主要分布在(0~1000) cm−1、(1000~2000) cm−1和(2000~4000) cm−1三个区域。此外,由于存在简并和无红外活性的现象,红外谱中实际谱线的数目小于实际简正振动的数目。
关键词 :奥司他韦,密度泛函理论,红外光谱,无红外活性

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
奥司他韦(Oseltamivir)是一种作用于神经氨酸酶的特异性抑制剂,其抑制神经氨酸酶的作用,其作用靶点是分布于流感病毒表面的神经氨酸酶。神经氨酸酶在病毒的生活周期中扮演了重要角色,流感病毒在宿主细胞内复制表达和组装之后,会以出芽的形式突出宿主细胞,但与宿主细胞以凝血酶–唾液酸相连接,神经氨酸酶以唾液酸为作用底物,可催化唾液酸水解,解除成熟病毒颗粒与宿主细胞之间的联系,使之可以自由移动侵袭其他健康的宿主细胞。抑制神经氨酸酶的活性可以阻止病毒颗粒的释放,切断病毒的扩散链。奥司他韦对由H5N1、H9N2等亚型流感病毒引起的流行性感冒有治疗和预防的作用。在起病后24小时内服用奥司他韦的患者,病程会减短30%~40%,病情会减轻25%,作为预防用药,奥司他韦对流感病毒暴露者的保护率在80%~90%。此外,奥司他韦有较好的药代动力学性质,在口服30分钟后被吸收,有75%以盐酸盐的形式进入循环,而未成盐的只有5%进入循环。2~3小时后血浓度达到峰值,其在体内可以定向分布至肺部、支气管、鼻窦、中耳等部位。奥司他韦在体内经肾脏以羧酸原药的形式排泄,清除半衰期6~10小时。近年来,人们对奥司他韦的研究越来越热衷。2017年 [1] ,刘红等通过对120名甲型H1N1流感患者采用口服磷酸奥司他韦联合抗病毒口服液进行治疗,结果表明磷酸奥司他韦治疗甲型H1N1流感联合抗病毒口服液治疗临床疗效显著,不良反应小,甲流病毒抗原转阴率高。2017年 [2] ,孙双璐等采用临床对比试验的方法研讨了磷酸奥司他韦治疗流行性感冒的临床疗效,结果表明磷酸奥司他韦治疗流行性感冒效果显著,能够缩短患者症状改善时间,不良反应少。
密度泛函理论 [3] [4] 采用电子密度来处理复杂电子体系,已被广泛地应用于各个领域,可方便的研究物质的各种特性。本文运用Gaussian 09计算程序,在B3LYP/6
2. 计算方法
首先利用GaussView和ChemOffice软件构建了奥司他韦分子的初始构型,然后运用Gaussian 09计算程序中的HF/3-21g(d)方法对分子构型进行了初步优化,然后在B3LYP/6-31G(d)方法水平上对分子构型进行了最终优化,得到了奥司他韦分子的稳定构型,并对所得构型进行频率计算和分析,得到了红外光谱。本文中频率计算采用0.9613 [5] 的修正因子进行矫正。
3. 结果与讨论
3.1. 奥司他韦分子的结构
奥司他韦分子的稳定构型如图1所示。表1中列出了奥司他韦分子的相关结构参数,整个分子中含有C-C、H-C、C-O、H-N、C-N和O-N六种化学键。在各C-C键中,15C-10C键长最长为1.544 Å,6C-5C、12C-10C和18C-15C三个键的键长均为1.532 Å,22C-12C和2C-1C的键长均为1.530 Å,而35C-32C、41C-40C和5C-4C的键长分别为1.517 Å、1.514 Å和1.512Å,3C-2C、30C-3C和4C-3C的键长分别为1.511 Å、1.497 Å和1.325 Å。在分子结构中,仅存在3个H-N键,其中28H-27N和29H-27N的键长均为1.002 Å,39H-26N的键长为0.995 Å。而在N原子参与形成的三个C-N键中,26N-6C的键长为1.455 Å,27N-1C和26N -40C的键长分别1.450 Å和1.358 Å。在O原子参与形成的各化学键中,32C-31O的键长最长为1.426 Å,10C-9O和9O-5C的键长均为1.423 Å和1.401 Å,而31O-30C、45O-40C和50O-30C的键长分别为1.322 Å、1.201 Å和1.193 Å。在所形成的H-N键中,47H-1C的键长最长为1.088 Å,17H-15C、46H-2C和14H-12C的键长均为1.087 Å,13H-12C、21H-18C、43H-41C、25H-22C和36H-35C四个化学键的键长均为1.086 Å,20H-18C、23H-22C、49H-5C和38H-35C的键长均为1.085 Å,而34H-32C和8H-4C的键长均分别为1.079 Å和1.073 Å,33H-32C和42H-41C均为1.080 Å。在各原子所形成的键角中,∠50O-30C-3C的键角最大为125˚,∠5C-4C-3C为124˚,∠10C-9O-5C、∠4C-3C-2C和∠45O-40C-26N均为123˚,∠40C-26N-6C、∠30C-3C-2C和∠32C-31O-30C三个键角分别为122˚、120˚和119˚,而∠8H-4C-3C、∠39H-26N-6C和∠41C-40C-26N三个尖角分别为118˚、116˚和115˚,各键角中最小的为∠11H-10C-9O,其值为102˚,∠33H-32C-31O为104˚,∠16H-15C-10C和47H-1C-27N均为107˚,∠34H-32C-31O、∠43H-41C-40C、∠42H-41C-40C、∠7H-2C-1C和∠27N-1C-2C五个化学键均为109˚,∠48H-6C-5C、∠49H-5C-4C和∠13H-12C-10C均为108˚。在各原子所形成地二面角中,20H-18C-15C-10C为−179˚,5C-4C-3C-2C为0˚,8H-4C-3C-2C˚和32C-31O-30C-3C分别为180˚,表面参与形成这些二面角的各原子出现在同一面内。但也存在其他角度的二面角,这也间接表明奥司他韦分子构型的对称性比较差。
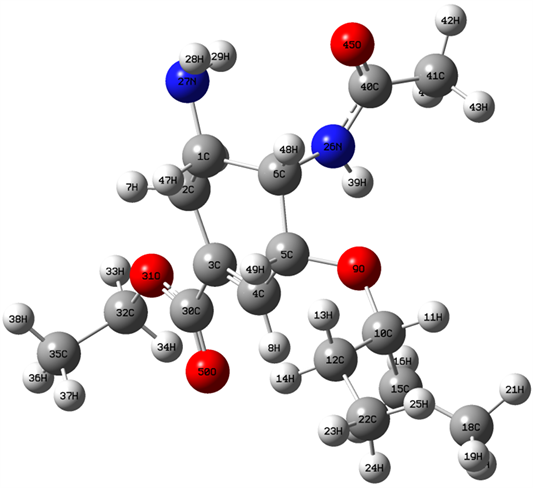
Figure 1. Stable structure of oseltamivir
图1. 奥司他韦分子的稳定构型
Table 1. Structure parameters of oseltamivir
表1. 奥司他韦分子的部分结构参数
3.2. 奥司他韦分子的红外振动光谱
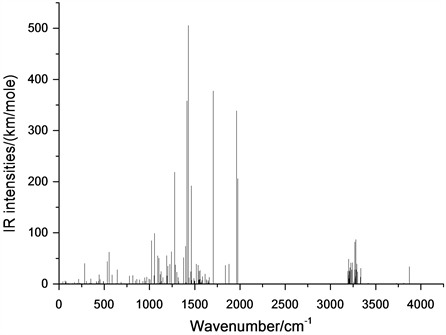
Figure 2. Infra-red spectrum of oseltamivir
图2. 奥司他韦分子的红外光谱
红外光谱 [5] 是光谱的一种,它是由于物质因受红外光的作用,引起分子或原子基团的振动,若振动频率恰与红外光波段的某一频率相等时就引起共振吸收,使光的透射强度减弱,进而形成。红外吸收强度决定于振动时偶极矩变化的大小。若振动过程中偶极矩变化较大,则跃迁几率就会越大,红外光谱强度就会较强;反之,强度就会较弱 [6] 。
标准状况下(1大气压,298.15 K),奥司他韦分子的红外光谱如图2所示。分析发现,奥司他韦分子的红外光谱中谱线数目少于分子的简正振动的数目,分析认为这主要是由于光谱中出现了无红外活性的现象和简并现象 [7] 。根据分子的振动类型的不同可将奥司他韦分子的红外振动光谱划分为三个区域:(0~1000) cm−1、(1000~2000) cm−1、(2000~4000) cm−1。此外,基本上红外光谱的每条谱峰都是由多个振动模式叠加而成的。
在(0~1000) cm−1区域中,分子振动类型主要是各基团的整体转动或摆动,以及环状结构的呼吸振动。由于该区域中的谱峰所对应的分子振动没有引起分子偶极矩的较大变化,甚至大量分子振动模式出现了无红外活性的现象,致使区域中红外光谱的整体强度较低。该区域的最强峰出现在553 cm−1位置,它是由含41C的甲基基团整体转动、含35C的甲基基团整体转动和含27N的NH2基团摆动的复合振动引起地,次强峰出现在532 cm−1位置,其对应的分子振动模式主要是含18C的甲基基团整体转动和含22C的甲基基团整体转动的复合振动造成地。含35C的甲基基团整体转动和含18C的甲基基团整体摆动的复合振动在282 cm−1位置引起一较强共振峰,而644 cm−1位置共振峰是由含27N的NH2基团摆动引起地,但其强度较低。含35C的CH3基团的整体摆动和环状结构的呼吸振动在442 cm−1位置引起一较强共振峰,但强度较含22C的CH3基团的整体摆动在586 cm−1位置引起地共振峰的强度高。环状结构中,与3C相连的支链的整体摆动在815 cm−1位置引起一共振峰,与5C相连的支链在778 cm−1位置引起一共振峰,但二者强度均较低。969 cm−1位置共振峰是由环状结构的呼吸振动引起地,而环状结构的呼吸振动与含18C的甲基基团的整体摆动的复合振动在946 cm−1位置形成一较强共振峰。350 cm−1位置共振峰是由含12C和22C链状结构的整体摆动引起地,而含15C和18C的链状结构的整体摆动在993 cm−1位置引起一共振峰,但相比而言,前者强度较大。在215 cm−1位置出现两双重简并的现象,其分子振动模式分别为含41C的甲基基团的整体转动和18C的甲基基团整体转动,而同时在859 cm−1位置出现了三重简并现象,其分子振动模式分别为含35C的甲基基团整体摆动、环状结构的呼吸振动与27N的整体摆动的复合振动,以及含12C、18C和35C三个甲基基团的整体转动的复合振动。此外,在12 cm−1、118 cm−1和264 cm−1三个位置出现了无红外活性的现象,对应的分子振动模式分别为含41C的CH3基团的整体摆动,含18C的CH3基团的整体摆动,以及环状结构中与6C相连的支链的整体摆动。
在(1000~2000) cm−1区域,分子振动类型主要是面外弯曲振动(含面外摇摆振动和扭曲振动)和变形振动(含对称变形振动和不对称变形振动),以及面内弯曲振动(含面内摇摆振动和剪式振动)。该区域中红外光谱的整体强度较强,该区域的最强峰出现在1428 cm−1位置,其分子振动模式为13H和14H的扭曲振动、16H和17H的扭曲振动,以及24H和25H扭曲振动的复合振动,如图3所示,该振动峰也是整个红外光谱的最强峰;该区域次强峰出现在1705 cm−1位置,它主要是由28H和29H的扭曲振动造成地,如图4所示,它也是整个红外光谱的次强峰。7H和46H的扭曲振动、28H和29H的扭曲振动、47H的面内摇摆振动和23H和25H的扭曲振动的复合振动在1277 cm−1位置引起一共振峰,如图5所示。但强度较1975 cm−1位置的共振峰略高,其分子振动模式主要是33H和34H的面外振动,如图6,而同时33H和34H的扭曲振动在1463 cm−1位置引起一共振峰,但强度较低,分子振动模式如图7所示。如图8所示,35H和36H的面外摇摆振动在1054 cm−1位置引起一共振峰,但二者的扭曲振动在1022 cm−1位置形成一共振峰。1398 cm−1位置的共振峰分子振动模式主要是含41C的的CH3基团中三个H原子的对称变形振动引起地,1242 cm−1位置共振峰则是由含18C的CH3基团中三个H原子的对称变形振动引起地。含22C的CH3基团中三个H原子的不对称振动在1189 cm−1位置引起一共振峰,1091 cm−1位置的共振峰是由28H和29H的面外摇摆振动与24H和25H的剪式振动的复合振动引起地。含35C的甲基基团中的三个碳氢键的对称变形振动在1102 cm−1位置造成一较强共振峰,而含35C的甲基基团中的三个碳氢键的不对称变形振动与7H和46H剪式振动的复合振动在1877 cm−1位置造成一共振峰的出现,但强度偏弱。16H和17H面内摇摆振动在1517 cm−1位置引起一共振峰,20H和21H剪式振动在1227 cm−1位置引起一共振峰,二者强度较低。1285 cm−1位置的共振峰是由13H和14H的面内摇摆振动引起地,1538 cm−1位置的共振峰是由23H和25H的面外摇摆振动造成地。此外,在1203 cm−1位置出现了三重简并的现象,其对应的分子振动模式分别为含18C的甲基基团中的三个碳氢键的不对称变形振动与16H和17H的扭曲振动的复合振动、23H和25H的剪式振动与19H和21H的扭曲振动的复合振动,以及含35C的CH3基团的对称变形振动、含41C的CH3基团的不对称变形振动及23H和25H的剪式振动的复合振动。在1640 cm−1和1251 cm−1两个位置出现了无红外活性的现象,其对应的分子振动模式分别为43H和44H的扭曲振动与19H和20H的扭曲振动的复合振动,以及含35C的CH3基团的不对称变形振动与13H和14H的面外摇摆振动的复合振动。
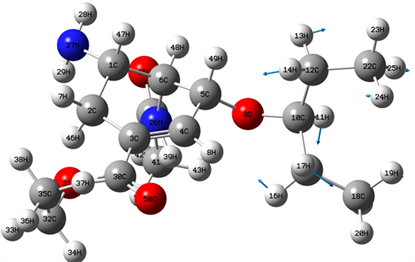
Figure 3. 1428 cm−1 vibration mode
图3. 1428 cm−1位置谱线振动模式
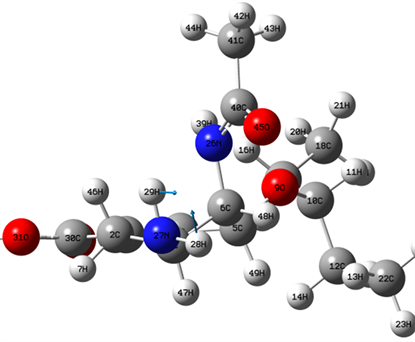
Figure 4. 1705 cm−1 vibration mode
图4. 1705 cm−1位置谱线振动模式
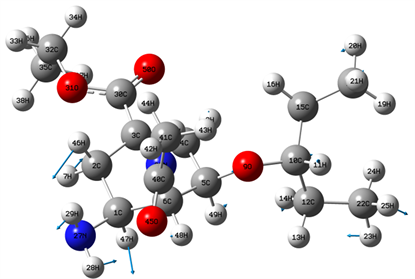
Figure 5. 1277 cm−1 vibration mode
图5. 1277 cm−1位置谱线振动模式

Figure 6. 1975 cm−1 vibration mode
图6. 1975 cm−1位置谱线振动模式
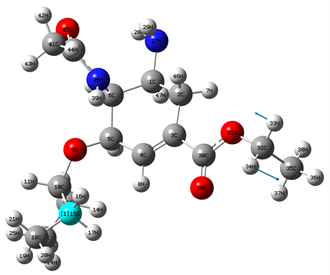
Figure 7. 1463 cm−1 vibration mode
图7. 1463 cm−1位置谱线振动模式
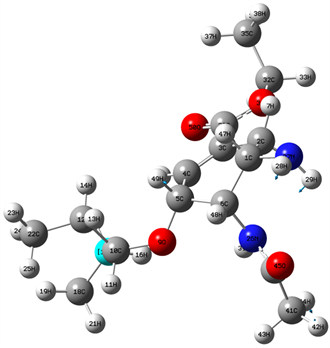
Figure 8. 1054 cm−1 vibration mode
图8. 1054 cm−1位置谱线振动模式
在(2000~4000) cm−1区域,分子的振动类型主要为各原子的伸缩振动(含对称伸缩振动和反对称伸缩振动)。该区域最强峰出现在3279 cm−1位置,对应的分子振动模式为23H和25H的对称伸缩振动与13H和19H伸缩振动的复合振动,分子振动模式如图9所示。次强峰出现在3270 cm−1位置,它是由36H的伸缩振动造成地,如图10所示。3280 cm−1位置的共振峰是由33H和34H的对称伸缩振动与36H和38H的反对称伸缩振动,以及7H的伸缩振动的复合振动引起地,而16H和17H对称伸缩振动与13H和14H的对称伸缩振动,以及19H和20H的对称伸缩振动的复合振动在3202 cm−1位置引起一较强共振峰。11H的伸缩振动、13H和14H的反对称伸缩振动、16H的伸缩振动、24H和25H的反对称伸缩振动、49H的伸缩振动的复合振动在3242 cm−1位置造成一共振峰。3225 cm−1位置的共振峰对应的振动模式为11H、13H和49H的伸缩振动的复合振动,如图11所示。39H的伸缩振动在3871 cm−1位置引起一较强共振峰,如图12所示。此外,7H和46H的对称伸缩振动在3216 cm−1位置,而33H和34H的反对称伸缩振动与37H和38H的反对称伸缩振动的复合振动在3334 cm−1位置形成一共振峰,但强度较前者略低。7H和48H各自伸缩振动的复合振动在3284 cm−1位置引起成一共振峰,而3267 cm−1位置的共振峰是由16H和17H的反对称伸缩振动、20H和21H的反对称伸缩振动,以及23H和25H的反对称伸缩振动共同引起地。与其他区域相比,在该区域的红外中没有兼并现象的出现,但在3416 cm−1和3730 cm−1两个位置出现了无红外活性的现象,对应的分子振动模式分别为8H的伸缩振动,以及28H和29H的对称伸缩振动。
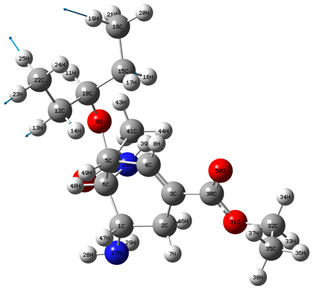
Figure 9. 3279 cm−1 vibration mode
图9. 3279 cm−1振动模式
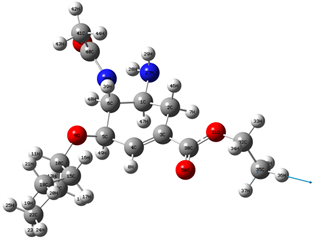
Figure 10. 3270 cm−1 vibration mode
图10. 3270 cm−1振动模式
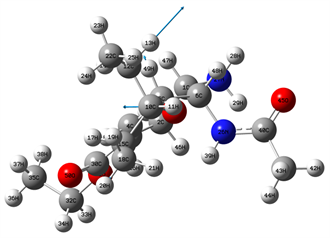
Figure 11. 3225 cm−1 vibration mode
图11. 3225 cm−1振动模式
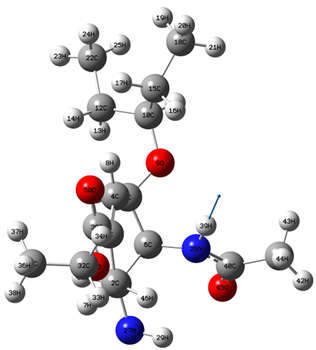
Figure 12. 3871 cm−1 vibration mode
图12. 3871 cm−1振动模式
4. 小结
本文通过量化计算获得了奥司他韦分子的稳定构型及红外振动光谱,并在此基础上详细分析了奥司他韦分子的结构特点,发现其分子构型的对称性较差。通过对红外光谱的研究发现,在(0~1000) cm−1区域对应的分子的振动类型主要为各基团的整体转动或摆动,以及环状结构的呼吸振动,在(1000~2000) cm−1谱线整体强度较强,这一区域内的谱峰所对应的分子振动模式主要是面外弯曲振动、变形振动和面内弯曲振动,在光谱的特征谱带区(2000~4000) cm−1分子的振动类型主要是伸缩振动。此外,光谱中出现了简并和无红外活性的现象。
文章引用
柳 叶,刘存海,张纪磊,宿德志. 奥司他韦的密度泛函理论研究
Study on Characters of Oseltamivir by Density Functional Theory[J]. 物理化学进展, 2019, 08(02): 29-39. https://doi.org/10.12677/JAPC.2019.82004
参考文献
- 1. 刘红, 徐瑞芳. 磷酸奥司他韦联合抗病毒口服液治疗甲型H1N1流感的临床观察[J]. 中国中医急症, 2017, 26(8): 1474-1476.
- 2. 孙双璐. 磷酸奥司他韦治疗流行性感冒的临床效果观察[J]. 黑龙江医药, 2017, 30(6): 1327-1329.
- 3. 陈晓岚, 张守仁, 屈凌波, 等. 新型白杨素–7–氨基磷酸酯衍生物的合成与波谱学研究[J]. 波谱学杂志, 2009, 26(2): 239-246.
- 4. 张伏龙. 硅锗杂硫烯酮及其相关分子的量子化学计算研究[J]. 甘肃联合大学学报(自然科学版), 2008(6): 135-139.
- 5. Wong, M.W., Wiberg, K.B. and Frisch, M.J. (1991) Hartree-Fock Second Derivatives and Electric Field Properties in a Solvent Reaction Field: Theory and Application. The Journal of Chemical Physics, 95, 8991-8996.https://doi.org/10.1063/1.461230
- 6. 董庆年. 红外光谱法[M]. 北京: 化学工业出版社, 1979: 8-10.
- 7. 王莉, 何勇, 刘飞, 等. 应用光谱技术和支持向量机分析方法快速检测啤酒糖度和pH值[J]. 红外与毫米波学报, 2008, 27(1): 51-55.
