Asian Case Reports in Veterinary Medicine
Vol.
08
No.
01
(
2019
), Article ID:
30040
,
8
pages
10.12677/ACRPVM.2019.81001
Research Status and Development Trend of Extraction Technology of Crude Heparin Sodium
Shunshun Shu1, Qian Mi1, Chengrong Han1, Fengyun Zhang1, Shangwen Tang2, Jun Niu1*
1C.P. Food (Xiangyang) Co. Ltd., Xiangyang Hubei
2Hubei College of Arts and Sciences, Xiangyang Hubei

Received: Apr. 10th, 2019; accepted: Apr. 23rd, 2019; published: Apr. 30th, 2019

ABSTRACT
Heparin sodium is the sodium salt of heparin, which has great medical and biological value. The clinical application of heparin has gradually expanded, and the population of drug users has gradually increased, which has led to the expansion of the global heparin drug market and the growth of the demand for crude heparin sodium. Based on the development status of crude heparin sodium extraction technology at home and abroad, the extraction process of crude heparin sodium was comprehensively evaluated, and the development trend of crude heparin sodium at home was prospected.
Keywords:Crude Heparin Sodium, Extraction Technology, Anticoagulant Mechanism, Purification of Heparin Sodium, Development Trend

猪肠粘膜中肝素钠提取技术的 研究现状和发展趋势
舒顺顺1,米倩1,韩成荣1,张凤云1,汤尚文2,牛军1*
1正大食品(襄阳)有限公司,湖北 襄阳
2湖北文理学院,湖北 襄阳

收稿日期:2019年4月10日;录用日期:2019年4月23日;发布日期:2019年4月30日

摘 要
肝素钠是肝素的钠盐,具有非常大的医学和生物学价值,肝素临床应用范围逐渐扩大,用药患者群体也逐渐增加,进而带动全球肝素类药品市场扩大和粗品肝素钠需求增长。论文基于国内外粗品肝素钠提取技术的发展现状,综合评价了提取粗品肝素钠工艺,并对国内粗品肝素钠的发展趋势进行展望。
关键词 :粗品肝素钠,提取工艺,抗凝机制,纯化,发展趋势

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肝素是临床应用广泛的抗凝剂,平均分子量在10~20 kDa之间,结构复杂,其基本骨架是由1, 4-糖醛酸和葡萄糖胺以糖苷键连接起来的重复二糖组成的线性多糖链 [1]。肝素钠可预防和治疗动、静脉血栓和肺栓塞,可作为人工心肺、腹膜透析或血液透析治疗时的抗凝血药物,近年来研究证明肝素钠还有降血脂、抗癌、抗病毒、抗炎、抗过敏、抗中膜平滑肌细胞增生、降低血液粘稠度等作用 [2] [3]。
自发现肝素钠已经过了一百多年,但迄今还没有一种人工合成的产品能完全替代它,它仍然是最重要的抗凝血和抗血栓药物,只能从动物的组织中提取 [4]。目前肝素钠的工厂规模化生产大多以猪小肠粘膜为原材料,中国是世界第一养猪大国,生猪存栏量占全球58.5% [5],拥有全球最丰富的肝素生产原料,是全球粗品肝素和原料药最大生产国 [6]。我国从十九世纪八十年代推广盐解工艺,从猪小肠里提取肝素钠,一般需要3000根以上猪小肠才能生产1亿单位;到九十年代,人们采用酶解工艺生产肝素,一般需要2000~2500根猪小肠才能生产1亿单位 [7]。目前这两种工艺都在使用,一般需要1500~1800根猪小肠生产1亿单位,采用最多的工艺为酶解/盐解–树脂吸附–洗脱–乙醇沉淀–干燥–粉碎 [8]。本文通过对肝素钠的发展、作用机制、提取方法进展及发展趋势做一综述。
2. 肝素的发展和作用机制
肝素被发现于20世纪初期,他的发现通常归功于McLean和Howell,至于谁最先发现存在很大的争论 [9]。20世纪20年代肝素实现商业化,1929年,Charles Best和Arthur Charles进一步纯化肝素;1933年,Arthur Charles和他的同事David Scott发表系列论文,概述了从牛肝脏中分离粗制肝素以及提纯肝素的方法 [10]。1938年肝素预防血栓试验获得成功,自此肝素成为临床上常用的抗凝血药 [11]。至今肝素仍然是世界上最有效和临床用量最大的抗凝血药物,已被很多国家《药典》收入。
1968年,Abildgaard [12] 命名了抗凝血酶III (AT-III),现在证实肝素可与AT-III的赖氨酸部位结合,AT-Ⅲ的反应部位(精氨酸残基)更易与对具有丝氨酸蛋白酶活性的凝血因子形成复合物,从而灭活凝血因子(如XIIa、XIa和Xa、IXa、IIIa等),抑制纤维蛋白原转变为纤维蛋白 [13] [14]。与抑制凝血因子不同(如图1),抗凝血酶诱导的凝血酶失活需要形成三元复合物肝素–抗凝血酶–凝血酶 [15]。
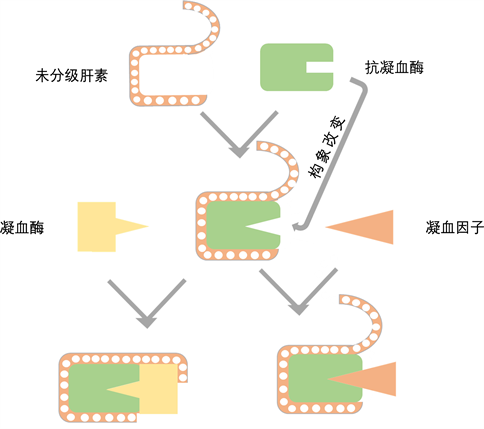
Figure 1. Anticoagulation mechanism of heparin sodium
图1. 肝素钠抗凝血机制
3. 粗品肝素钠制取工艺
肝素生产工艺的目的是在不降解原料(如解聚和/或脱硫)的前提下,最大限度地提高原料中高电荷、高分子量肝素链的收率 [16]。典型的肝素钠制取工艺可以分为五个不同的部分(图2)。每一个部分都将在本文中讨论。

Figure 2. (a) Schematic representation of an industrial heparin purification process; (b) Discussed topics per section
图2. (a)为猪肠粘膜制取粗品肝素钠工艺;(b)为每节讨论的主题
3.1. 原料来源
用于生产肝素钠的生物材料(如粘膜或牛肺)应取自满足人类食用要求的健康动物,这就需要肝素生产商提供完全可追溯的肝素产业链 [16]。第一个肝素生产方案是从狗或牛肺中提取,之后其来源主要为猪小肠和牛肺。2000年,由于担心牛肝素感染“疯牛病”病毒(Bovine spongiform encephalopathy, BSE),美国将牛肝素从市场召回,自此欧美等许多国家都禁用牛源肝素,而选择猪源肝素 [17]。但是有些国家(如印度)仍然允许使用牛源肝素,另出于宗教的原因,牛源肝素受到一些人的青睐。我国大都采用猪小肠粘膜提取肝素钠,猪小肠粘膜中肝素含量丰富,在刮制肠粘膜后仍可腌制成肠衣,但是健康的猪小肠原料短缺,猪小肠价格居高不下,同时生产的肠衣有售后之忧,国内外越来越多的人开始寻找物美价廉的替代物。
由于猪源肝素相比于反刍动物肝素没有朊病毒污染的风险,造成血小板减少症(heparin-induced thrombocytopenia, HIT)、血栓综合征等不良反应的概率偏小 [18],所以利用猪廉价内脏提取肝素钠备受关注。在我国猪肺来源丰富价格便宜,成为替代猪小肠提取肝素钠的的理想替代物。但由于猪肺中含有气管,其分解物中含有大量的硫酸软骨素和乙酰肝素,肝素与猪肺中肥大细胞结合紧密,所以以猪肺为原料提取出来的肝素钠效价低杂质高。张晓娟等 [19] 用猪肺提取粗品肝素钠,粗品和纯化后产品的提取率分别为0.81%和0.05%,羊血浆法测定的粗品和纯化后产品效价分别为6.5 U/mg和108.3 U/mg,同时确定猪肺肝素钠的效价测定方法,探索猪肺肝素钠产业化生产的可行性。
由于牛“疯牛病”患病率大幅下降和肝素提取过程对减少朊病毒的技术显著提高,目前美国对重新引入牛肝素的争论正在进行中 [17]。2017年Cyrus Bett等 [20] 用仓鼠“263K骚痒病”代替“疯牛病”,采用肝素制造过程的典型四步纯化方案模拟对添加标记的“骚痒病”因子进行清除研究,依此建议美国重新引进安全的牛肝素。羊肝素与牛肝素一样没有宗教的限制,由于其具有携带“羊瘙痒症(Scrapie)”朊病毒的潜在可能,现在一般用于科研用途。
哺乳动物中还有用单峰骆驼提取肝素的研究,非哺乳动物中有从鱼类内脏、鸡副产品、虾等中提取肝素钠的研究,不同物种来源的肝素特点如表1 [16] 所示。
Table 1. Overview of characteristic of heparin derived from different sources
表1. 不同物种来源的肝素特点
注:a代表药典规范中猪源肝素平均分子量;b代表从牛肠黏膜中提取的肝素;c代表96%的肝素分子量 ≤ 8.0 kDa。
3.2. 分解
本节主要讨论从猪肠粘膜中提取肝素钠的工艺,获取肠粘膜的一个典型过程是先去除肠内的杂物,然后在盐溶液中浸泡,最后刮出粘膜,每头猪能获得0.8 kg的肠粘膜 [21]。获取的肠粘膜中通常加入防腐剂和氧气清除剂来限制微生物的生长。猪肠粘膜分解的方法有很多,常用的有盐解法、酶解法、酶解结合法等 [22]。
盐解法分解工艺的主要原理是在破碎的动物内脏组织溶液中加入一定量的氯化钠,氯化钠与肝素反应生成肝素钠溶于水中,再使用大孔阴离子树脂吸附。盐解法提取肝素钠工艺操作简单,但由于肝素和其他粘多糖一样是与蛋白质形成复合物的形式存在,盐解法难以使肝素完全释放造成提取效率低。肠粘膜中加入蛋白酶,能够使肠粘膜充分裂解和去除肝素–蛋白质复合物中的蛋白质,提高肝素游离度,这种方法称为酶解法。酶解法不仅能提高肝素钠提取率,还能获得高活性肝素钠。汤彬彩等 [23] 利用2709碱性蛋白酶和胰蛋白酶组合而成的复合酶催化酶解肝素钠,与现有单一蛋白酶酶解工艺相比,肝素得率提高了6%。
分解液中含有大量的酶、蛋白质、多肽、核酸、油脂等大分子有机物,不仅影响肝素的释放,而且降低了肝素钠与树脂结合效率,导致肝素钠提取效率低、杂质高、效价低。董浩等 [24] 通过酶法与膜分离技术和沉淀技术的有效结合,改善肝素钠提取工艺,将肝素钠效价提高至160 U/mg。于海宁等 [25] 探索了固定化胰蛋白酶对猪小肠黏膜的酶解作用,在最佳工艺条件下获得肝素酶解液效价高达15.28 U;又如杨涛等 [26] 研究了先对猪小肠粘膜液除杂后提取肝素工艺,与传统工艺相比,肝素粗品的纯度至少提高5.66%。
分解步骤中影响肝素钠提取的因素有很多,包括猪肠的新鲜程度、蛋白酶的种类和比例、氯化钠的用量、pH值、温度、除杂技术等,为提高肝素钠的产量和质量需正确把握各工艺环节找出最佳工艺条件。
3.3. 获取
肝素在溶液中呈强电荷的聚阴离子状态,与强碱性的大孔树脂有较强的亲和力,容易被吸附而分离纯化 [27]。因此,从猪小肠黏膜中提取纯化粗品肝素钠大都会采用阴离子交换树脂吸附法。该方法的原理主要是采用阴离子交换树脂对肝素进行吸附后用低浓度盐溶液洗去树脂上残留的粘多糖等杂质,然后再用高浓度的盐溶液置换出树脂上吸附的肝素,从而使肝素分离并纯化 [28]。徐俊涛等 [7] 研究了不同交换树脂对肝素钠的吸附和提取性能,发现FPA98CL树脂吸附肝素性能最强,最佳吸附条件为:吸附液pH 9.0,吸附时间5 h,温度50℃,盐浓度0.3 mol/L,树脂质量浓度3.2%。
通过吸附洗脱后得到的洗脱液一般采用醇沉法将肝素钠纯化沉淀出来,按洗脱液体积加入1.5~2倍的乙醇,于低温下沉淀24 h以上,温度越低,肝素钠越容易析出。将析出的肝素钠沉淀物在分别用适量的无水乙醇,丙酮淋泡脱水,得到粗品肝素沉淀 [29]。干燥肝素的方法主要有直接烘干法、冷冻干燥法和喷雾干燥法等。
3.4. 精制
从猪小肠粘膜中提取的粗品肝素钠仍含有相当数量的蛋白质、核酸及其他粘多糖等成分,因此粗品肝素钠必须经过精制,其过程主要是对粗品肝素钠进行除杂和脱色。肝素钠精制工艺流程图如图3所示。
 a为一次氧化法,b为二次氧化法,c为酶解结合一次氧化法,d为酶解结合树脂吸附法。
a为一次氧化法,b为二次氧化法,c为酶解结合一次氧化法,d为酶解结合树脂吸附法。
Figure 3. Flow chart of heparin sodium purification process
图3. 肝素钠精制工艺流程图
除杂一般采用调节酸碱度对原料进行预处理。脱色分为氧化法脱色和非氧化法脱色,氧化法主要有一次氧化法、二次氧化法、酶法结合氧化法等。氧化法常用的氧化剂为高锰酸钾和过氧化氢,高锰酸钾做氧化剂时的缺点有肝素活性损失大,生成的二氧化锰难以消除色泽差,回收率低 [30],所以过氧化氢应用比较广泛。但由于氧化法可能对肝素的结构造成破坏,国际市场已经明确提出需要非氧化法精制的肝素产品 [31]。非氧化法主要有酶解结合法、离子交换层析法、亲和层析法、凝胶过滤层析法等 [32]。宋大巍等 [33] 探讨了酶法结合D500大孔树脂分离纯化粗品肝素,在最佳吸附和解吸调价下制的的精品肝素效价高达189 IU/mg,比原料(78 IU/mg)提高2.42倍,效价回收率为97.2%,表明此法可减少对精致过程中肝素生物效价的破坏,且提高了精品肝素的得率。
3.5. 废水处理和利用
肝素废水主要有两股,一股是洗肠废水,即洗肠、刮肠过程中产生的废水;另一股是酶解废水,即酶解、树脂提取过程中产生的废水 [33]。废水中的无机物主要为NaCl、Na2SO4等,有机物主要为酶、蛋白质、氨基酸、脂肪、酒精、丙酮等,属于具有“三高”有机废水,即高盐(25,000~35,000 mg/L)、高有机物(15,800~25,500 mg/L)、高氨氮(1320~2350 mg/L) [34]。目前肝素钠废水处理技术主要是物化法、生物法以及物化生物法 [35]。物化法主要有电解微滤技术、混凝技术、膜分离技术等,生物法主要有活性污泥法、生物膜法、生物絮凝法、生物吸附法等,物化生物法即前两种方法的结合使用。杨红薇等 [36] [37] [38] 在2014年到2017年间研究了使用SBR (Sequencing Batch Reactor Activated Sludge Process)法处理高盐肝素废水技术,并从金属离子间的拮抗效应出发,分别研究了K+、Ca2+、Mg2+三种金属离子和Zn2+、Mn2+两种金属离子对污泥性能的影响。
目前,肝素钠有机废水资源化利用已经被开发研究,主要用于提取蛋白质、氨基酸、硫酸乙酰肝素、抗菌肽等有机物质。杨彬 [39] 利用三氯化铁、膨润土和硅藻土三种沉淀剂来提取肝素废水中的蛋白质,按照其最佳工艺,肠衣肝素废水蛋白沉淀率达51.13%,废水溶液变清澈,COD去除率达80.94%。汤彬彩等 [40] 提出了一种从肝素废水中提取类肝素的工艺。
4. 粗品肝素钠发展趋势
肝素产业在多年的发展过程中,已经形成了一条完整的产业链,全球肝素产业链如图4所示。肝素产品分为上游、中游和下游三个产品等级,在产品的转化过程中,产品的价值大幅提升。首先生产企业从健康生猪的小肠粘膜中提取并制成粗品肝素钠,由于其含有杂蛋白等杂质,需经进一步提纯后成为肝素原料药。肝素原料药通常以钠盐或钙盐的形式存在,称为标准肝素钠(Heparin Sodium)或标准肝素钙(Heparin Calcium)。肝素原料药主要用于生产标准肝素制剂或低分子肝素原料药,后者可进一步用于低分子肝素制剂的生产。

Figure 4. The chain of the heparin industry
图4. 肝素产业链
2016年7月由国家心血管病中心组织编撰的《中国心血管病报告2015》在上海发布。报告指出:中国现有心血管疾病者已达到2.9亿人,且呈现出快速增长趋势。在可预见的未来,肝素将继续在现代医学所需的抗凝治疗中发挥关键作用,并在很大程度上不受其他抗凝药物竞争的威胁。因此,肝素的未来与其说取决于其性质的改善和竞争,不如说取决于肝素能否以合理的成本持续提供足够数量、高质量的肝素 [41]。
我国是全球最大的肝素类产品出口国,主要包括肝素粗品、肝素原料药。我国肝素类行业的企业具有上游高度集中、下游资源不足的特点。今后企业竞争力将体现在肝素钠原料、制剂一体化上。我国低分子肝素制剂市场仍处于起步阶段,临床使用的肝素制剂,特别是低分子肝素制剂,大部分从国外进口。未来我国肝素行业将会进一步整合上下游产业,更多的向肝素制剂和低分子肝素原料和制剂发展。
文章引用
舒顺顺,米 倩,韩成荣,张凤云,汤尚文,牛 军. 猪肠粘膜中肝素钠提取技术的研究现状和发展趋势
Research Status and Development Trend of Extraction Technology of Crude Heparin Sodium[J]. 亚洲兽医病例研究, 2019, 08(01): 1-8. https://doi.org/10.12677/ACRPVM.2019.81001
参考文献
- 1. St, A.K., Onishi, A., Fu, L., et al. (2016) Analysis of Heparins Derived from Bovine Tissues and Comparison to Porcine Intestinal Heparins. Clinical and Applied Thrombosis/Hemostasis, 22, 520. https://doi.org/10.1177/1076029616643822
- 2. Papa, A., Danese, S., Gasbarrini, A., et al. (2000) Review Article: Potential Therapeutic Applications and Mechanisms of Action of Heparin in Inflammatory Bowel Disease. Alimentary Pharmacology and Therapeutics, 14, 1403-1409. https://doi.org/10.1046/j.1365-2036.2000.00860.x
- 3. 董斌, 朱宇, 吴丹, 等. 肝素泵在血液透析中的临床应用与故障处理[J]. 中国医学装备, 2018(2): 132-134.
- 4. 彭向宇. 百特事件后我国肝素企业首位度分析[J]. 肉类工业, 2014(2): 52-53.
- 5. 刘文涛, 顾立伟. 关于中国与美国养猪业的比较研究[J]. 中国畜牧杂志, 2016, 52(6): 3-7.
- 6. 荣嫡. 肝素类: 出口量价齐跌逼产业加速升级[N]. 医药经济报, 2014-03-10(006).
- 7. 徐俊涛, 翟海港, 方永卫, 等. 肝素钠吸附提取工艺优化研究[J]. 肉类工业, 2018(2): 31-34.
- 8. 王忠民. 猪小肠生产肝素钠新工艺[J]. 农村经济与科技, 2000, 11(5): 43-43.
- 9. Yates, E.A. and Rudd, T.R. (2016) Recent Innovations in the Structural Analysis of Heparin. International Journal of Cardiology, 212, S5-S9. https://doi.org/10.1016/S0167-5273(16)12002-9
- 10. Lim, G.B. (2017) Milestone 1: Discovery and Purification of Heparin. Nature Reviews Cardiology. https://doi.org/10.1038/nrcardio.2017.171
- 11. James, A.M. (1997) The Development of Heparin in Toronto. Journal of the History of Medicine and Allied Science, 52, 310-337. https://doi.org/10.1093/jhmas/52.3.310
- 12. Tahir, R. (2007) A Review of Unfractionated Heparin and Its Moni-toring. U.S. Pharmacist, 32, 26-36.
- 13. 何为贵, 潘启超. 肝素抗凝机制研究的进展及其临床应用[J]. 国外医学(内科学分册), 1983(8): 384-388.
- 14. Rosenberg, R.D. and Damus, P.S. (1973) The Purification and Mechanism of Action of Human Antithrombin-Heparin Cofactor. Journal of Biological Chemistry, 248, 6490-6505.
- 15. Middeldorp, S. (2008) Heparin: From Animal Organ Extract to Designer Drug. Thrombosis Research, 122, 753-762. https://doi.org/10.1016/j.thromres.2007.07.004
- 16. Janytzen, V.D.M., Kellenbach, E. and Van Den Bos, L.J. (2017) From Farm to Pharma: An Overview of Industrial Heparin Manufacturing Methods. Molecules, 22, 1025. https://doi.org/10.3390/molecules22061025
- 17. Keire, D., Mulloy, B., Chase, C., et al. (2015) Diversifying the Global Heparin Supply Chain: Reintroduction of Bovine Heparin in the United States? Pharmaceutical Technology, 28, 36.
- 18. 张培蕾, 周耕, 程永德. 肝素诱导性血小板减少症相关研究进展[J]. 介入放射学杂志, 2017, 26(5): 385-389.
- 19. 张晓娟, 熊双丽, 钟雨婷. 猪肺肝素钠提取工艺优化、分离与初步鉴定[J]. 精细化工, 2014, 31(5): 597-602.
- 20. Bett, C., Grgac, K., Long, D., et al. (2017) A Heparin Purification Process Removes Spiked Transmissi-ble Spongiform Encephalopathy Agent. The AAPS Journal, 19, 765-771. https://doi.org/10.1208/s12248-017-0047-y
- 21. Vreeburg, J.W. and Baauw, A. (2009) Method for Preparation of Heparin from Mucosa. Patent No. WO2010/110654 A1.
- 22. 马志科, 马丽. 动物器官中肝素钠提取方法研究进展[J]. 动物医学进展, 2016, 37(5): 106-108.
- 23. 汤彬彩, 童永刚, 潘卫春, 等. 复合酶酶解肝素钠的工艺研究[J]. 现代化工, 2015, 35(3): 98-100.
- 24. 董浩, 丁凌霄, 罗志良, 等. 酶法与膜分离结合高效提取肝素钠的工艺研究[J]. 食品工业, 2014(9): 158-160.
- 25. 于海宁, 张鹏, 陶艳红, 等. 固定化酶解猪小肠黏膜制备肝素的工艺研究[J]. 天然产物研究与开发, 2016, 28(2): 300-306.
- 26. 杨涛, 万端极, 吴正奇, 邹华荣, 马超. 肝素粗品提取新工艺研究[J]. 食品研究与开发, 2015, 36(2): 52-55.
- 27. 童永刚, 汤彬彩, 马青青, 等. 粗品肝素钠吸附工艺的优化研究[J]. 应用化工, 2015, 44(12): 2289-2292.
- 28. 姬胜利, 桑青, 张天民. 肝素的来源控制、结构分析以及结构与生物活性关系的研究进展[J]. 中国药学杂志, 2012, 22(9): 660-663.
- 29. 罗喜牛, 沈静, 王新昌. 肝素钠粗品生产工艺[J]. 中国医药工业杂志, 1999, 30(5): 202-205.
- 30. 李红心. 肝素钠的精制及效价分析[J]. 山西大学学报(自然科学版), 2005, 28(4): 429-431.
- 31. 徐俊涛, 王玉芬, 谢华, 等. 粗品肝素钠精制工艺优化研究[J]. 食品与机械, 2012, 28(4): 206-208.
- 32. 王国栋, 杨佳艺, 杨佳, 等. 肝素提取纯化技术研究进展[J]. 食品工业科技, 2012, 33(9): 436-440.
- 33. 宋大巍, 刘昆, 张丽萍. 酶法结合D500大孔树脂分离纯化粗品肝素[J]. 中国生物制品学杂志, 2016, 29(3): 292-299.
- 34. 翟建, 姜春华, 鲁秀国. 肠衣–肝素钠加工废水处理技术进展[J]. 食品工业, 2013, 34(8): 192-194.
- 35. 马彦峰. 肝素钠废水水质解析[J]. 科技创新与应用, 2015(15): 61-62.
- 36. 杨红薇, 陈佼, 何婷. SBR法处理高盐肝素废水运行参数优化研究[J]. 工业安全与环保, 2015, 41(2): 7-9.
- 37. 杨红薇, 陈佼, 张建强. K+、Ca2+、Mg2+对高盐肝素废水处理的影响[J]. 环境工程学报, 2014, 8(10): 4267-4272.
- 38. 杨红薇, 罗芳林, 郭天明. Zn2+、Mn2+对SBR工艺处理高盐肝素废水的影响[J]. 工业水处理, 2017, 37(8): 20-24.
- 39. 杨彬, 孙军锋, 武梦言, 等. 肝素钠生产废水处理及蛋白回收[J]. 环境科学研究, 2016, 29(9): 1385-1392.
- 40. 汤彬彩, 童永刚, 潘卫春, 等. 从肝素副产物废蛋白中提取类肝素工艺研究[J]. 现代化工, 2015(11): 125-128.
- 41. Onishi, A., St, A.K., Dordick, J.S., et al. (2016) Heparin and Anticoagulation. Frontiers in Bioscience, 21, 1372-1392. https://doi.org/10.2741/4462
NOTES
*通讯作者。
