Advances in Microbiology
Vol.05 No.03(2016), Article ID:18492,7
pages
10.12677/AMB.2016.53003
Laser Mutation and Combined Antibiotics Resistance Selection to Daptomycin Producing Strains
Yongfei Jiang*, Ping Chen, Qiuping Wu
Livzon Group Fuzhou Fuxing Pharmaceutical Co. Ltd., Fuzhou Fujian

Received: Aug. 17th, 2016; accepted: Aug. 31st, 2016; published: Sep. 7th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
In this paper, He-Na laser irradiation and antibiotics resistance selection method were used to screen daptomycin high-producing strains. He-Na laser irradiation was applied to screen daptomycin high-producing strain from original strain of Streptomyces roseosporus DA15-2. The optimum mutagenesis dose was irradiation power 20 mW and irradiation time for 20 min, which was determined based on survival rate and positive mutation rate. The mutant strains on the plates of combined antibiotics resistance of daptomycin and Streptomyces at different concentrations were screened and a mutant strain DA15-23 was obtained, whose yield of daptomycin was 100 mg/L, which increased 75.8% compared to that of the parental strain. It was demonstrated that laser irradiation and antibiotics resistance selection combined method provided a fast and effective way of screening Streptomyces roseosporus.
Keywords:Daptomycin, Streptomyces roseosporus, He-Na Laser Irradiation, Resistance Selection

达托霉素生产菌的激光诱变及组合抗性筛选
蒋永飞*,陈萍,巫秋萍
丽珠集团福州福兴医药有限公司,福建 福州

收稿日期:2016年8月17日;录用日期:2016年8月31日;发布日期:2016年9月7日

摘 要
本文结合He-Na激光诱变技术及抗生素抗性筛选方法选育达托霉素高产菌株。以达托霉素生产菌玫瑰孢链霉菌DA15-2为出发菌株,利用激光技术进行诱变育种,结果通过对致死率和正突变率的考察,适宜的诱变剂量为辅照功率20 mW及辅照时间20 min。在不同浓度梯度的达托霉素及链霉菌复合抗性平板上筛选诱变后的菌株,筛选到一株产达托霉素发酵单位100 mg/L的菌株DA15-23,比出发菌株提高了75.8%。实验证明结合激光诱变及抗生素抗性筛选得到了高产达托霉素的菌株。
关键词 :达托霉素,玫瑰孢链霉菌,He-Na激光诱变,抗性筛选

1. 引言
达托霉素(Daptomycin)是由美国礼莱公司最先发现的环脂肽类抗生素。它由玫瑰孢链霉菌(Streptomyces roseosporus)发酵产生。达托霉素化学结构独特,含有13个氨基酸,其中10个氨基酸形成圆环,另外3个氨基酸肽链N-末端的色氨酸与一癸酸侧链相连 [1] 。达托霉素是通过钙离子介导攻击细胞膜从而杀死微生物 [2] 。达托霉素独特的环脂肽结构及作用机制,使其不会产生像其他抗生素所产生的交叉耐药性的影响。达托霉素对15个不同属和35个不同种的革兰氏阳性菌引起的复杂的皮肤感染十分有效,尤其是耐青霉素的肺炎链球菌(PRSP),耐万古霉素的肠球菌(VRE),糖肽类敏感的金葡菌(GISA)以及耐甲氧西林的金葡菌(MRSA) [2] [3] 。达托霉素在医疗体系广泛的应用引起了大众对其生物合成的关注。
目前高产抗生素菌株选育方法除传统的物理化学方法外,还有生物学方法。代谢组学可以有效提高菌株生产能力,Huang等人通过构建玫瑰孢链霉菌的重组代谢通路使三个目的基因过表达从而提高其生产能力,构建的工程菌与亲本比较产达托霉素能力提高了43.2% [3] 。段向东等在适宜的条件下制备玫瑰孢链霉菌的原生质体,经紫外诱变后培养,最后筛选到高产菌株D-35,该菌株的平均发酵单位较出发菌株高了87.9% [4] 。我们知道大多数次级代谢产物总是产量很低难以满足工艺生产的需求。虽然这些方法目标明确,但是成本太高且操作复杂,无法应用于大规模工业化生产。卢文玉等人利用20 mM激光辐射对玫瑰孢链霉菌进行照射,筛选出突变菌株,摇瓶发酵后达托霉素产量达81.2 mg/L,比出发菌株提高了39% [5] 。本文采用激光诱变结合抗生素抗性筛选玫瑰孢链霉菌,先采用激光诱变加大出发菌株的突变率,再用达托霉素和链霉素进行抗性筛选,从而使菌株改良,提高了其产达托霉素的能力。激光作为一种新型物理诱变方法,可通过诱发生物体产生热、压力、光、电、电磁场等多种效应而获得诱变菌株 [6] 。而筛选产生菌对自身代谢产物的耐受性提高,会有利于抗生素产量的提高 [7] 。范晶华选用链霉素作为筛选剂选育达托霉素高产菌株,其原理是链霉菌产抗生素能力与链霉素抗性基因之间存在对应关系 [8] 。
2. 材料和方法
2.1. 菌株
玫瑰孢链霉菌和金黄色葡萄球菌由本实验室保存。
2.2. 培养基及培养条件
2.2.1. 培养基
玫瑰孢链霉菌斜面培养基DAX(g/L):葡萄糖20,酵母提取物20,CaCO3 2,琼脂15。筛选培养基DAS(g/L):葡萄糖20,酵母提取物20,Fe(NH4)2(SO4)2•6H2O 1.0,琼脂10。
种子培养基DAY(g/L):糊精20,胰蛋白胨大豆肉汤30,pH7.0。发酵培养基DAF(g/L):麦芽糊精30,黄豆粉10,Fe(NH4)2(SO4)2∙6H2O 1.0。
金黄色葡萄球菌LB培养基(g/L):酵母粉5,蛋白胨10,NaCl 10,琼脂8,pH6.8。
以上培养基均于121℃高压蒸汽灭菌25分钟备用。
2.2.2. 培养条件
斜面及筛选培养基培养条件:温度30℃,培养时间8~10天(依菌落外观而定)。种子培养:吸取2 mL孢子浓度106个/mL的孢子悬浮液于装有50 mL种子培养基的250 mL三角瓶中,30℃,230 rpm摇床培养27小时。摇瓶发酵培养:吸取1 mL种子培养液转接入装有50 mL发酵培养基中,30℃,230 rpm摇床培养135小时。
2.3. 生物检测法
抗性菌株的抑菌效果测定: 先配一定量的LB培养基,灭菌后将其冷却至60℃左右,加入0.2 mL指示菌((金黄色葡萄球菌,测得细菌浓度为6.5 × 108 CFU/mL),混匀后倒入培养皿。待琼脂凝固后,用灭菌竹签将待测小琼脂块(含待测菌株)倒置于上述的培养基中,置于37℃培养箱中培养,2天后观察抑菌圈大小。
2.4. 激光诱变条件的确定
激光类型为He-Ne激光,6328埃。吸取4 mL孢子浓度106个/mL的孢子悬浮液于无菌培养皿中,将其置于激光束下方20 cm处,按照射时间为5、10、15、20、25 min,照射强度为10、15、20、25 mW进行组合诱变。未经照射的原始菌液作为空白对照。用菌液涂布法分离后进行单菌落计数,并计算诱变致死率:致死率(%) = (对照组菌落数 − 诱变所得菌落数)/对照组菌落数 × 100% [9] 。
2.5. 抗生素最低抑制浓度(MIC)的确定
将出发菌株孢子悬浮液稀释100倍后均匀涂布在含不同浓度梯度的达托霉素和链霉素的平板上,培养8~10天,培养温度30℃。观察每个平板的菌落生在情况。菌落形态发生明显变化,致死率即将达到100%时的浓度即为最低抑制浓度(MIC)。
2.6. 抗生素抗性突变株的分离
首先将稀释100倍后的出发菌株孢子悬浮液涂布于不同达托霉素和链霉素的组合抗性平板上,得出最低组合抑菌浓度。再将激光诱变的孢子悬液涂布于组合抑菌浓度抗性平板上。30℃培养5天,长出的菌落即为抗性突变株。
2.7. 达托霉素效价的测定
将孢子菌悬液接种到种子培养基上,用长好的种子培养基接发酵,接种量5%。发酵结束后,取1 mL发酵液置于离心管中,10,000 r/min离心5 min,将上清液用0.22 μm的一次性针头过滤器过滤,滤液用HPLC法测定。
HPLC法操作条件:C8色谱柱。标准流动相:流动相A为取14 g磷酸二氢铵溶于3000 ml水调pH3.20,用0.45微米滤膜过滤,加入600 ml乙腈;流动相B为100%乙腈。流速1 ml/min;柱温30℃;进样温度8℃;检测波长220 nm,紫外检测;进样量为5 μL。
达托霉素标准品的标准曲线绘制参照范晶华的操作 [8] 。
2.8. 主要仪器
He-Ne激光器(功率为0~30 mW,波长为632.8 nm),Continuum生产。
高效液相色谱仪(Agilent1260)。
3. 结果与分析
3.1. 激光诱变条件
按照射时间为5、10、15、20、25 min,照射强度为10、15、20、25 mW进行组合诱变。诱变的致死率及正突变率呈规律性变化。据文献报道低剂量照射强度(5 mW)下,随照射时间延长,致死率变化不大,都较低,不符合实验要求 [9] 。本实验探索在照射强度(20 mW)下,不同照射时间菌株的致死率和正突变率。当照射强度为20 mW,随照射时间增加,菌株的致死率逐渐增大,而正突变率在20分钟时出现峰值。因此照射时间为20分钟时,菌株的致死率为63%,正突变率3.9% 为最佳诱变条件,结果如图1所示。
3.2. 达托霉素及链霉素最低抑制浓度的确定
按2.5抗生素最低抑制浓度(MIC)的确定进行耐受性测定。结果表明,达托霉素和链霉素对出发菌株的最大筛选浓度分别为400 mg/L和0.8 mg/L (见表1)。两种抗生素组合的最大筛选浓度为0.6*MIC。
3.3. 激光诱变结合抗生素抗性筛选结果
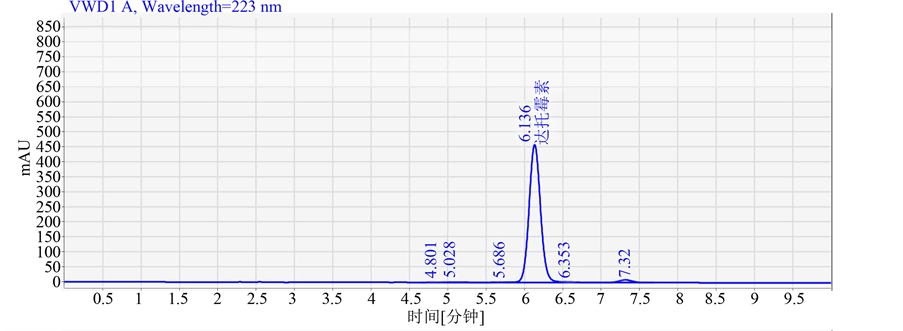
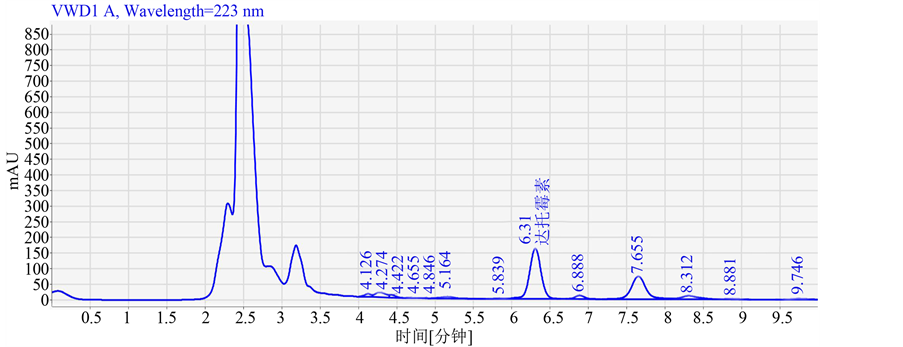
将孢子菌悬液在激光照射强度为20 mW,照射20分钟进行诱变,然后分别涂布于含有400 mg/L达托霉素、0.8 mg/L链霉素及0.6*MIC 组合抗性平板上,30℃暗箱培养5天。挑选长势好的单菌落接种摇瓶种子,再接发酵。发酵液按2.7达托霉素效价的测定进行分析。结果显示,采用激光诱变和组合抗性筛选得到一株发酵水平显著提高的玫瑰孢链霉菌da15-23,菌落如图2所示,菌落形态描述如表2所示。其产达托霉素发酵单位100 mg/L,比出发菌株提高了75.8%,发酵结果用HPLC法测定达托霉素(见图3)。图3为发酵样品与标准品的HPLC图比较。

Figure 1. The optimum mutagenesis dose of laser irradiation
图1. 激光诱变最佳条件

Figure 2. Original strain of Streptomyces roseosporus (a) and screened Streptomyces roseosporus (b)
图2. 原始菌株(a)和抗性菌株(b)
Table 1. The tolerance determination of daptomycin and streptomycin for Streptomyces roseosporus
表1. 玫瑰孢链霉菌对达托霉素及链霉素的耐受性测定
Table 2. Morphological character comparison between mutant strain and the original strain
表2. 抗性菌株与出发菌株菌落形态差异比较
 (a)
(a)
 (b)
(b) (c)
(c)
Figure 3. The HPLC chromatograph of standard sample and fermentation sample. A is the HPLC chromatograph of standard sample; B is the HPLC chromatograph of fermentation sample before mutation; C is the HPLC chromatograph of fermentation sample after mutation
图3.标准本品与发酵样品的HPLC图谱。A图为标准品的HPLC图谱;B图为诱变前发酵样品的HPLC图谱;C图为诱变后发酵样品的HPLC图谱
4. 结论
现在工业育种诱变方法主要有物理诱变和化学诱变。化学诱变危险性较高,物理诱变中紫外诱变最常用,然而穿透力低。本文选择的激光诱变克服了以上缺陷。激光作为一种新型物理诱变方法,可通过诱发生物体产生热、压力、光、电、电磁场等多种效应而获得诱变菌株 [6] 。
引入抗生素抗性来筛选菌株是工业上较常用的育种方法。本实验采用激光诱变结合达托霉素和链霉素抗性筛选的方法得到抗性基因突变株,其中玫瑰孢链霉菌DA15-23产达托霉素发酵单位100 mg/L,比出发菌株提高了75.8%。结果说明采用激光诱变联合达托霉素和链霉素抗性筛选的方法可以提高达托霉素生产水平。并且和传统诱变方法及筛选方法比较,本文的联合法加快了育种进程。
基金项目
闽科计[2011]53号2012年福建省区域科技重大资助项目(项目编号:2012Y3001)。
文章引用
蒋永飞,陈 萍,巫秋萍. 达托霉素生产菌的激光诱变及组合抗性筛选
Laser Mutation and Combined Antibiotics Resistance Selection to Daptomycin Producing Strains[J]. 微生物前沿, 2016, 05(03): 19-25. http://dx.doi.org/10.12677/AMB.2016.53003
参考文献 (References)
- 1. Thorne, G.M. and Alder, J. (2002) Daptomycin: A Novel Lipopeptide Antibody. Clinical Microbiology Newsletter, 24, 33-40. http://dx.doi.org/10.1016/S0196-4399(02)80007-1
- 2. 谭尚忠. 达托霉素研究进展[J]. 中国药事, 2006, 20(6): 375-377.
- 3. Huang, D., Wen, J.P., Wang, G.Y., Yu, G.H., Jia, X.Q. and Chen, Y.L. (2012) In Silico Aided Metabolic Engineering of Streptomyces roseosporus for Daptomycin Yield Impovement. Applied Microbiology and Biotechnology, 94, 637- 649. http://dx.doi.org/10.1007/s00253-011-3773-6
- 4. 段向东, 贾啸静, 陈丽华, 等. 原生质体紫外诱变选育达托霉素高产菌株[J]. 化学与生物工程, 2014, 31(5): 59-62.
- 5. 卢文玉, 闻建平, 范晶华, 等. 激光诱变玫瑰孢链霉菌结合链霉素抗性筛选法选育达托霉素高产菌株[J]. 微生物学通报, 2006, 33(3): 114-117.
- 6. 赵欣颖, 胡以华, 顾有林, 等. 微生物凝聚粒子群的激光透射率研究[J]. 光学学报, 2015, 35(6): 222-228.
- 7. 张智翔, 段然, 敬科举, 等. 组合抗性筛选法选育达托霉素高产菌株[J]. 中国抗生素杂志, 2012, 37(3): 202-206.
- 8. 范晶华. 达托霉素高产菌株选育及发酵条件优化[D]: [硕士学位论文]. 天津: 天津大学, 2007.
- 9. 刘建龙, 魏显起, 郭航. 一株缬氨酸产生菌的激光诱变育种[J]. 中国激光, 2016, 43(3): 102-108.
