Advances in Microbiology
Vol.05 No.04(2016), Article ID:19142,18
pages
10.12677/AMB.2016.54005
Advances in Coupled Sorption Biodegradation Models for Organic Pollutants in Soil
Jiao Hu, Qi Yu, Guangyao Sheng*
State Key Laboratory of Pollution Control and Resource Reuse, College of Environmental Science and Engineering, Tongji University, Shanghai

Received: Nov. 16th, 2016; accepted: Dec. 2nd, 2016; published: Dec. 5th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Bioavailability of pollutants in soil is one of the main factors that determine their environmental fate. It is a key to the successful implementation of bioremediation of polluted soil. Sorption of organic pollutants occurs once they enter soil, and subsequently influence the bioavailability of the pollutants. To accurately predict the bioavailability of organic pollutants in soil, coupled sorption-biodegradation models need to be established. This paper introduces five coupled sorption-biodegradation models used in the literature to account for the bioavailability of pesticides and polycyclic aromatic hydrocarbons in soil and sediment as influenced by sorption. The overall objective of this paper is to offer proper ideas for soil pollution control and remediation. This is achieved by summarizing the establishment of these models, their evaluations and applications, and by discussing potential problems associated with these models.
Keywords:Soil, Organic Pollutants, Model, Bioavailability, Sorption

土壤有机污染物的吸附–生物降解耦合模型 研究进展
胡姣,郁祁,盛光遥*
同济大学环境科学与工程学院,污染控制与资源利用国家重点实验室,上海
收稿日期:2016年11月16日;录用日期:2016年12月2日;发布日期:2016年12月5日

摘 要
污染物的微生物可利用性是控制其环境归趋的主要因素之一,也是决定受污染土壤的微生物修复技术成败的关键。有机污染物进入土壤后发生吸附作用,进而影响其生物可利用性。正确预测有机污染物在土壤环境中的微生物可利用性,需要建立可靠的吸附–降解动力学模型。本文介绍了五种国内外常用的有关农药和多环芳烃在土壤/沉积物上的吸附–降解耦合模型,综述了模型建立过程、评价方法、适用范围,探讨了现有模型在实际应用中的共性问题,以期为土壤污染的控制和修复提供思路。
关键词 :土壤,有机污染物,模型,微生物可利用性,吸附

1. 引言
现代工农业生产生活过程产生排放大量有机物,如化学农药、多环芳烃(PAHs)、多氯联苯(PCBs)及抗生素(ATBs)等,使土壤污染成为全球性的环境问题,土壤有机污染的修复日益迫切 [1] [2] 。当前土壤污染修复技术中,生物修复因其具有低耗、高效、安全及属于纯生态过程等显著优点而受到越来越多的重视 [3] [4] 。鉴于修复主体的不同,受有机物污染的土壤生物修复技术可分为植物修复、动物修复、微生物修复及其联合修复技术 [5] ,其中微生物修复技术是最具应用和发展前景的生物修复环保技术之一 [6] 。
有机污染物的微生物可利用性是影响它们环境归趋的主要因素之一,也是决定受污染土壤和沉积物的微生物修复技术的成败关键 [7] [8] [9] 。早期研究认为,有机污染物的微生物可利用性取决于微生物能够接近有机物分子并发生直接碰撞的能力。当微生物细胞和有机物分子在水土体系中共存时,二者均可同时存在于土壤溶液(水相)中及吸附在土壤上,但只有水相中的有机物分子才能够与微生物发生直接的碰撞,从而进行有机物的微生物降解 [10] 。在此基础上提出的有关吸附对微生物降解影响的理论认为:有机物一旦吸附于土壤上,与微生物的直接接触受到限制,就不能发生微生物降解。
越来越多的研究表明,吸附态污染物也能够被微生物利用 [11] - [19] ,至少污染物解吸至土壤溶液中对于生物降解来说不是一个必要条件 [20] [21] [22] 。为了预测吸附态有机物的生物可利用性,需要建立可靠的数学模型。理论上,即使建立最简单的模型也需要融入物理参数或变量,例如吸附质在游离相、易解吸相、不可解吸相的比例,各相质量转移动力学,以及吸附质与吸附剂接触的持续时间。若深入考虑,假设解吸是由径向分散主导,还需要有关颗粒尺寸、颗粒内部孔径结构以及其他变量 [23] 。此外,还有生物参数(或变量)影响,比如细菌在吸附剂上的附着情况 [22] 、细菌与有机物接触时间、细菌对有机物的代谢途径等等,也是模型的组成部分。随着参数的增加,模型的复杂性越来越大,实用型模型的建立则越来越困难。鉴于目前有关农药和多环芳烃在土壤/沉积物上的吸附–降解动力学模型已有一些研究成果,而鲜有从实用性角度做更深入的解剖和提炼,本文将介绍五种国内外常用的简化模型,着重从模型建立过程、评价方法、适用范围等方面进行详细的综述,并探讨现有模型在实际应用中的共性问题,以期为后续研究者建立实用性更强的量化模型奠定基础,为土壤污染的控制和修复提供思路。
2. 吸附–降解耦合模型
无土体系中,对于初始浓度为C0 (μg∙L−1)的有机物溶液,当细菌细胞密度相对于目标物浓度较高时,即非生长条件下,降解可通过米氏方程描述 [12] 。当目标物初始浓度低于米氏常数Km时,矿化反应为一级反应 [23] [24] [25] ,反应速率与目标物液相浓度C (μg∙L−1)成正比,即
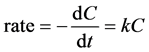 (1)
(1)
上式积分,可获得一级初始降解动力学方程:
 (2)
(2)
相应的一级矿化动力学方程为
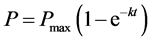 (3)
(3)
其中P (%)是t (min)时刻转化为14CO2的百分率,Pmax (%)是最大矿化百分率 [13] [26] ,k (min−1)是一级反应速率常数。
若游离菌和附着菌对目标物的降解速率相同,游离态目标物在无土体系和土壤–水体系中的反应速率常数也相同,则无土体系初始降解/矿化动力学数据拟合得到的k,也可用于土壤–水降解体系。
基于这种共识,文献中已经建立了评价吸附对生物可利用性影响的方法。但出于对解吸速率和程度的影响的不同考虑,近二十多年来研究者们陆续提出了不同的吸附–降解耦合模型。常见的主要有三参数–半经验模型、瞬时解吸和无解吸矿化模型、三位点解吸–降解模型、二元平衡解吸–降解模型、快慢双位点解吸–降解模型。这五种模型适用范围不同,各有千秋,下面将做具体的介绍。
2.1. 三参数–半经验模型
1992年Guerin和Boyd [23] 在探究土壤吸附态萘的微生物矿化时,发现土–水比较高的条件下,降解菌P. putida 17484对萘的矿化曲线远远偏离了一级矿化动力学方程。结合酶促反应理论和实测数据,假设只有游离态目标物可被降解,他们提出了拟合度更高的三参数–半经验模型。
2.1.1. 理论部分
由上文可知,无土体系中,当降解为一级反应,初始浓度为C0时,相应的一级矿化动力学方程为
 (4)
(4)
对时间求导,得到矿化速率:
 (5)
(5)
令t = 0,得到初始矿化速率:
 (6)
(6)
因此根据实测的无土体系矿化数据拟合,即可得到Pmax和k,进而求得C0对应的初始矿化速率IMR,用于后续的比较。
而土壤–水体系中,三参数–半经验方程的建立过程如下:加有缓慢结合抑制剂的酶促反应,其反应速率v随时间t的变化方程为
 (7)
(7)
其中,v0是初始反应速率,vs是慢结合抑制作用达到最终稳定状态的反应速率,k0是没有物理意义的常数 [27] [28] 。
对上式积分,可得到反应程度p随时间t变化的关系式 [29] :
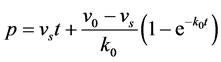 (8)
(8)
该式子包括一个线性部分和一个指数部分,恰好与土水比率较高的条件下降解菌P. putida 17484对萘的矿化曲线(表现出对一级矿化动力学方程的偏离,更像是指数项与线性项的加和)在形式上基本一致。将其应用到土壤中萘的微生物矿化时,Guerin和Boyd [23] 发现与实测矿化数据拟合性较好,仅指数部分因为代数式(v0 − vs)的存在而低估了游离态目标物的矿化。考虑到解吸过程对游离态的矿化做出了积极贡献,故将以上关系式简单地修正,获得土壤–水体系中矿化百分率PS (%):
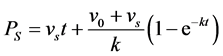 (9)
(9)
该三参数–半经验方程中,参数v0 (%∙min−1)是初始反应速率。用液相平衡浓度C (μg∙L−1)标化后,得到土壤–水体系中的初始矿化速率IMRS (μg∙L−1∙min−1)。由于矿化速率与底物浓度成正比,假设吸附态不能被微生物利用,降低液相平衡浓度(C)会使IMRS成比例降低,且点(C, IMRS)落在一条连接无土体系(C0, IMR)与原点的标准直线上。偏离标准直线预示着细胞接触到比目前水相浓度更高(偏上)或更低(偏下)的目标物浓度,进而反映出矿化对液相浓度的依赖程度。参数vs表示由解吸引起的矿化速率(%∙min−1),与解吸动力学相关,vs相对v0越低说明解吸对降解的影响越小。这里的参数k也是一级反应速率常数(min−1)。指数项的渐近线由v0/k决定,相当于Pmax,反映有机物可被直接利用的最大量,即生物可及度。若吸附态有机物不可利用,且解吸比降解速率低得多,则处于准平衡状态,v0/k数值与C成正比,落在连接无土体系(C0, Pmax)与原点的标准直线上。若高于标准直线,则说明部分吸附态被直接利用。
修正后的模型能很好拟合非平衡条件下的实验数据,其残差平方和远小于一级矿化动力学方程的拟合结果。因此在探究吸附态物质的生物可利用性时,可用三参数–半经验模型拟合矿化数据,获得v0、vs和k,进而求得初始矿化速率IMRS、生物可及度v0/k,再与无土体系的数据比较,评估吸附–解吸对生物可利用性的影响。
该模型应用条件:液相矿化反应为一级反应,吸附作用以分配机理为主的体系。
2.1.2. 应用与评价
基于上述理论,Guerin和Boyd [23] 发现,土壤–水体系中降解菌P. putida 17484对萘的多个初始浓度对应的初始矿化速率(IMRS)均在标准直线上方,表明矿化没有受到液相浓度的限制,同时生物可及度 v0/k也显著大于经无土体系标准曲线推出的理论值,说明该降解菌在降解游离态萘的同时,也在利用吸附态萘。此外,由解吸引起的矿化速率vs虽比初始矿化速率v0小,但当保持萘的总量一定、增大土水比率时,在液相平衡浓度、固相平衡浓度、v0、v0/k均降低的情况下,vs的值反而增大,表明该降解体系中随着吸附态萘的分散度增加,解吸越来越容易发生,解吸对矿化的贡献值越来越大。Lahlou和Ortega-calvo [30] 用该模型拟合蒙脱石中菲的矿化数据后,通过与无土体系数据对比,发现黏土对菲的表面吸附(labile)不影响甚至可增强菲的矿化速率和程度,但强吸附(desorption-resistant)因解吸极其缓慢致使1020 h后仍有95%以上的强吸附态菲不可降解,由此认为黏土对菲的吸附作用对生物可利用性的影响主要体现在解吸行为上,而非水土体系平衡时的液相浓度,吸附机制的不同将导致不同的解吸行为,进而造成不同的生物可利用性。同时他们指出,由于考虑了慢解吸对矿化的贡献,该三参数–半经验模型相较于一级反应动力学方程,与实验数据的偏差更小,更适于吸附剂存在时初始矿化速率的测定。基于此,Cui等 [31] 直接用该模型拟合了沉积物中芘的矿化动力学数据,发现由慢解吸引起的矿化速率vs值均显著大于零,占初始反应速率v0的0.77%~8.6%,在慢解吸态通常比快解吸态比率高的情况下,慢解吸对降解有显著贡献。
但Guerin和Boyd [26] 又指出,若vs远小于v0,解吸对降解无显著影响,三参数–半经验方程与一级矿化动力学方程对实验数据的拟合结果会非常接近,二者无显著性差异。Lee等 [32] 在研究湿地土壤中吸附对氯苯的生物降解影响时,也有类似的报道,建议对于准平衡(无解吸或解吸速率远小于矿化速率)的体系,直接用一级矿化动力学方程处理数据。此外,当用该模型拟合无土体系(相当于瞬时平衡体系)的矿化数据时,解吸造成的矿化速率vs显著大于零,揭示出模型在辨别慢解吸速率与实验干扰时的局限性。可见,该模型主要适用于模拟非平衡解吸态体系中的生物可利用性,对瞬时平衡或准平衡体系则不太适用。
需要特别指出,即使在非平衡体系中,模型也有不合理的情况。例如,在探究蒙脱石吸附态菲的生物可利用性实验中,模型给出的生物可及性v0/k数值与实验测定的最终矿化程度存在较大偏差 [30] ,前者只占后者的48%~77%。可见,该模型对vs和v0/k的解释还比较牵强,理论依据不够充足。
值得肯定的是,对于模型的建立,这种触类旁通、理论与实践相结合的方式是一次大胆的尝试。尽管它存在一些局限性,不适用于瞬时解吸与准平衡体系,但与一级反应矿化动力学方程比较起来,它考虑到了慢解吸对矿化的影响,提供了更精确的数据拟合方式,更适于计算土壤–水体系中的初始矿化速率。
2.2. 瞬时解吸和无解吸矿化模型
2000年Feng等 [20] 在研究吸附对联苯微生物可利用性的影响时,首次将完全可逆和完全不可逆吸附作用直接结合进一级矿化动力学方程。在假定只有游离态分子才能被降解的同时,进一步假定两种解吸状态——瞬时解吸和无解吸,由此导出了瞬时解吸和无解吸矿化模型。
2.2.1. 理论部分
由上文可知,无土体系中,当降解为一级反应,初始浓度为C0 (μg∙L−1)时,矿化百分率P (%)随时间t (min)的变化关系式为:
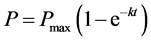 (10)
(10)
土壤–水体系中,对疏水性中性有机物来说,分配是其主要吸附机理 [33] ,吸附等温线为直线,固相浓度S (μg∙kg−1)可以简单地应用分配系数Kd (L∙kg−1)定量地与液相浓度C (μg∙L−1)联系起来,即:
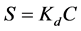 (11)
(11)
假设瞬时解吸,则解吸速率可表示为:
 (12)
(12)
根据吸附前后目标物总质量守恒,得到降解前液相的初始浓度C0:
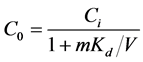 (13)
(13)
其中,Ci (μg∙L−1)为吸附前的液相浓度,V (L)为液体体积,m (kg)为土壤质量。
假设仅液相有机物能被降解,固相需要先解吸后降解且解吸与降解之间无时间间隔。当反应速率与目标物液相浓度C成正比时,降解体系的质量平衡公式为
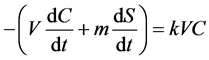 (14)
(14)
设生物可利用性因子 [34] 为:
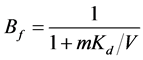 (15)
(15)
整理后得到:
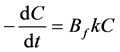 (16)
(16)
上式积分后,得到液相浓度随时间变化的关系式:
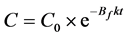 (17)
(17)
实验中用CO2的产生速率表示矿化速率,则
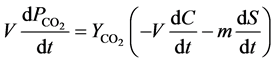 (18)
(18)
其中,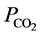 (μg∙L−1)是CO2的产生量,
(μg∙L−1)是CO2的产生量,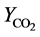 (μg∙μg−1)是单位质量目标物产生CO2的量。整理后得到CO2的产生速率随时间变化的关系式:
(μg∙μg−1)是单位质量目标物产生CO2的量。整理后得到CO2的产生速率随时间变化的关系式:
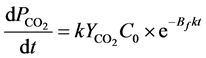 (19)
(19)
上式积分后,得到瞬时解吸时目标物的矿化百分率Pd (%):
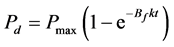 (20)
(20)
假设无解吸,即解吸速率为零,可同理推得目标物的矿化百分率Pnd (%):
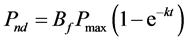 (21)
(21)
实验中应该先测定无土体系的降解动力学,拟合后获得Pmax和k,进而获得瞬时解吸和无解吸的模型曲线,再将实测值与模型进行比较。若实测的土壤体系中目标物的矿化百分率比高于Pd,则说明吸附态有机物可部分或全部被降解;若低于Pnd,则说明土壤体系环境限制了污染物的矿化活性 [23] 。另外,若实测的土壤体系中矿化曲线与无土体系完全重合,则说明吸附对降解几乎无影响,微生物可完全降解吸附态有机物。
该模型应用条件:液相矿化反应为一级反应,吸附作用以分配机理为主的体系。
2.2.2. 应用与评价
采用上述评价方法,Feng等人 [20] 发现,用两种降解菌(Pseudomonas putida P106和Rhodococcus erythropolis NY05)分别测得的土壤–水体系中联苯的矿化百分率,要高于用上述吸附/降解耦合模型所预测的对应值Pd,证明土壤吸附态联苯能够不经解吸直接被微生物利用。其中,用NY05测得的土壤–水体系中联苯的矿化曲线与不含土壤体系对应的矿化曲线完全重合,说明吸附态联苯能够被该细菌完全降解。张静等 [35] 也得到类似的结论,发现土壤线性吸附态的阿特拉津可部分被藤黄微球菌AD3直接利用。Lee等 [32] 研究结果显示,当氯苯吸附于两种湿地土壤,其矿化速率和程度都远高于瞬时解吸的理想矿化曲线,在验证吸附态氯苯具有生物可利用性的同时,也揭示了该模型对模拟实际土壤环境中有机物矿化的不适用性。
此外,还应注意的是,当实测值高于Pd或低于Pnd时,可以判断吸附态是否具有生物可利用性。但若实测值介于Pd与Pnd之间,则不能肯定吸附态不具有生物可利用性,因为有机污染物在土壤环境中存在多个解吸位点,其全部浓度范围内的瞬时解吸几乎不可能发生,若某浓度范围内解吸速率小于矿化速率而微生物矿化结合态的速率比游离态低,实测值也会介于Pd与Pnd之间。因而要获得其生物可利用性,还需比较解吸速率和降解速率的大小关,这涉及到解吸动力学的测定与模拟。
可见,由于采用线性吸附–瞬时解吸或无解吸,模拟平衡状态(瞬时吸附、瞬时解吸)和准平衡状态(无解吸或解吸速率远小于矿化速率)解吸动力学,未能考虑到解吸滞后现象的干扰,该模型仅能用于初步判断分配占主导地位的吸附态有机物是否具有生物可利用性,不能精确模拟解吸对降解的影响,对于某些土壤吸附态有机物的生物可利用度的预测也不够准确。
尽管如此,该模型首次采用质量平衡公式与解吸速率和降解速率联系起来,将吸附作用有理有据地结合到微生物矿化动力学中,打破了吸附与降解的隔阂。目前这种方式还一直被推崇和借鉴。
2.3. 三位点解吸–降解模型
考虑到解吸在大多数情况下会出现滞后现象,吸附态分子可能随时间变得愈来愈难解吸,也可能成为完全不可解吸,Park等 [21] [36] [37] [38] 提出了三位点解吸模型,认为吸附位点包括平衡位点、非平衡位点和不可解吸位点,三位点遵循不同的解吸方程,并在Feng等 [20] 研究基础上建立了线性吸附–三位点解吸–降解模型和非线性吸附–三位点解吸–降解模型,探究土壤吸附态多环芳烃和农药的生物可利用性。
2.3.1. 理论部分
1) 线性吸附–三位点解吸–降解模型
对于吸附等温线为线性的有机物,假设土壤有三个解吸位点 [39] [40] ,即平衡态,非平衡态和不可解吸态:
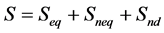 (22)
(22)
平衡态的解吸由线性分配模型描述:
 (23)
(23)
非平衡位点的解吸速率与非平衡位点及液相中的浓度梯度成正比:
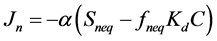 (24)
(24)
不可解吸位点上的有机物在实验期间内不可解吸至水相,但可被甲醇完全萃取,其值为:
 (25)
(25)
式中S (μg∙kg−1)是吸附质的总吸附浓度,Seq (μg∙kg−1)、Sneq (μg∙kg−1)和Snd (μg∙kg−1)分别为平衡位点、非平衡位点及不可解吸位点上的吸附质浓度,C (μg∙kg−1)为液相浓度,Ce (μg∙kg−1)为吸附平衡时的液相浓度,Kd (L∙kg−1)为吸附分配系数,Jn (μg∙kg−1∙min−1)为非平衡位点上的解吸速率,α (min−1)为非平衡位点上的一级解吸速率常数,feq (%)、fneq (%)和fnd (%)分别为平衡、非平衡、不可解吸三种位点所占比例因子,其和为1:
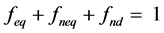 (26)
(26)
上述解吸模型中,Kd根据吸附等温线数据计算,fnd由解吸达稳定状态的连续稀释解吸曲线得到,feq、fneq、α通过解吸数据的非线性回归获得。
假定解吸与降解之间没有时间间隔,非生物解吸实验中获得的解吸参数在土壤–水–微生物降解体系中仍然有效;游离菌和附着菌对目标物的降解速率一致,且游离态目标物在无土体系和土壤–水体系中的降解速率参数均一致。下面5个模型用于评价实验结果 [36] [37] [38] ,各模型对不同位点的生物可降解性的基本假设不同。
模型1:三种位点上的污染物均可被降解,且各位点降解独立、均为一级反应,则土壤–水降解体系中的目标物消耗的质量平衡为:
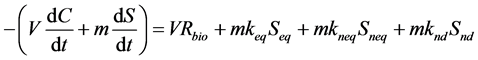 (27)
(27)
其中,m (kg)是土壤质量,V (L)是液体体积,t (min)是时间,keq (min−1),kneq (min−1)和knd (min−1)分别是吸附态污染物在平衡、非平衡和不可解吸位点上的一级降解速率常数,Rbio (μg∙L−1∙min−1)是液相中生物降解速率,不同微生物降解体系的Rbio值不同,采用不同的关系式求解:
对于零级动力学:
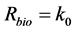 (28)
(28)
对于一级动力学:
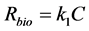 (29)
(29)
对于米氏动力学:
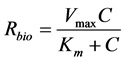 (30)
(30)
其中k0 (μg∙L−1∙min−1)和k1 (min−1)分别是游离态污染物的零级、一级降解速率常数,Vmax (μg∙L−1∙min−1)是降解酶促反应的最大速率,Km (μg∙L−1)是米氏常数,即反应速度为最大反应速度一半时的液相浓度。
非平衡位点和不可解吸位点上的质量平衡如下:
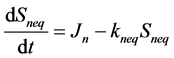 (31)
(31)
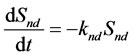 (32)
(32)
上述降解体系中,k1、Vmax、Km通过土壤提取液的生物降解实验的回归分析获得,keq、kneq、knd通过生物可利用性数据的非线性回归分析获得。
模型1所假设的降解过程如图1所示。模型2~5都是1的简化,将合适的参数调为零即可得到,具体如下。
模型2:微生物不能利用不可解吸位点上的吸附态目标物,但其它部分的均可直接利用,故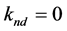 ;
;
模型3:微生物不能利用不可解吸和非平衡位点上的吸附态目标物,但平衡位点和液相的均可直接利用,故 ;
;
模型4:微生物只能利用液相目标物,故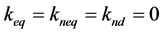 ;
;
模型5:微生物只能利用液相目标物,且降解过程中的解吸是瞬时解吸,故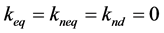 且
且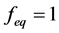 ,
,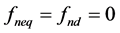 。
。
2) 非线性吸附–三位点解吸–降解模型
对于吸附等温线呈非线性(遵循Freundlich非线性方程)的有机物,其解吸–降解模型与线性吸附物质的大体相同 [41] [42] ,主要有以下差别:
平衡位点上的吸附态有机物解吸遵循Freundlich非线性方程
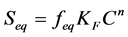 (33)
(33)
非平衡位点上的解吸速率与非平衡位点及液相中的浓度梯度成正比,表达式为
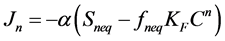 (34)
(34)
不可解吸位点上吸附质的吸附分配则变为
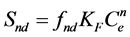 (35)
(35)
式中,KF (mg∙kg−1∙ (mg∙L−1)−n)为Freundlich分配系数,n为描述等温线曲率的常数,KF和n的值由吸附等
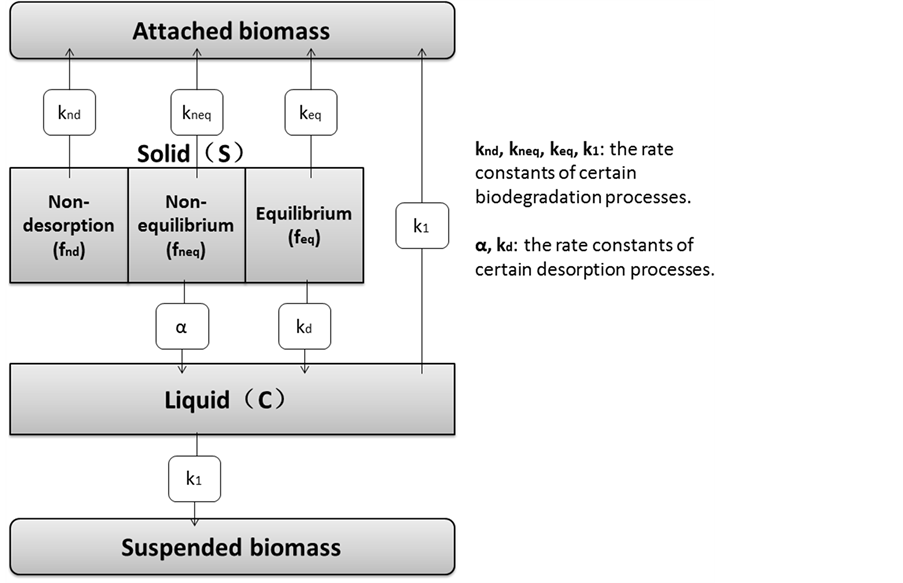
Figure 1. Model 1 description
图1. 模型1的降解过程描述
温线拟合得到。注意:实验中应先区分有机物的吸附特性,再选择合适的模型评价体系中污染物的生物可利用性。
该模型应用条件:液相矿化反应为零级反应,一级反应或米氏反应;吸附为线性或非线性(遵循Freundlich非线性方程)的体系。
2.3.2. 应用与评价
Park等 [36] 测定了四种类型土壤中吸附等温线为线性的萘解吸动力学,发现虽然吸附分配系数大有不同(4.3~25.6 L∙kg−1),但解吸曲线都有一个快速释放和限速解吸阶段,而最终的解吸并未达到吸附预测线,表明土壤中确实存在三种不同的解吸位点。连续解吸实验则显示解吸等温线显著高于吸附等温线,但二者的斜率基本一致,证实了解吸模型中分配系数Kd使用的正确性。解吸模型对四种土壤中解吸数据拟合的相关系数在0.91到0.97之间,拟合获得的不可解吸位点比率fnd与由解吸等温线纵截距和吸附平衡时的固相浓度计算的结果非常接近,进一步证实了三位点解吸模型预测的正确性。
在降解方面,对于一级和米氏动力学降解体系,实验观测到400 min后液相萘已消耗完,而固相总浓度却持续下降,甚至降至不可解吸位点浓度Snd之下,表明不可解吸位点上的萘也被微生物利用了,与模型2~5的假设和预测结果相悖,而模型1却能很好地拟合和解释整个降解体系中液相和固相浓度的变化规律,证实了模型1对土壤中萘的生物可利用性预测的准确性。Park等 [37] 还比较了模型3和4对液相降解为零级反应的土壤–水体系中萘的降解动力学数据的拟合结果,发现二者拟合的相关系数均在0.97以上,且在95%置信区间内无显著性差异,与浓度不控制降解速率的体系中微生物更倾向于只利用液相中有机物的事实相符,又一次证明了该三解吸–降解模型预测的准确性。
此外,对于土壤非线性吸附的阿特拉津和黑碳非线性吸附的苯酚的生物有效性以及老化对生物可利用性的影响,该模型也表现出较好的预测效果 [21] [41] [42] 。
由此可见,该模型考虑周全、设计较为合理,同时涉及线性和非线性吸附,既定义了各解吸位点又考虑到瞬时解吸,既包括了液相降解又假定了各个解吸位点的生物降解,甚至在液相降解中还区分了不同的降解动力学系统对生物可利用性的影响,因此适用范围较为广泛,可以解释降解体系中浓度变化规律,可以预测特定体系中吸附态污染物的微生物可利用性,还可以评价土壤类型、微生物种类、老化等因素对微生物可利用性的影响,是目前较为成熟的模型体系。
不可忽视的是,模型的假设越多,对实际机理的探讨则越少。若土壤–水体系中降解相对于模型4(假定只有液相能降解)有增强,模型1~3只反映了降解速率的增加,模型5只反映了解吸速率的增加,至于是否描述了增强生物可利用性的实际机制,还有待商榷和证明。比如,各位点的解吸及降解过程是否独立,非生物解吸体系中的解吸参数在降解体系中是否会变化,各位点的直接降解是否都符合一级反应等等,目前还没有明确的定论。此外,相较于其他模型,该模型需要测定的参数较多,实验操作方面不及其他几个模型方便。
2.4. 二元平衡解吸–降解模型
对于解吸滞后现象,Park等 [21] [36] [37] [38] 提出了三位点解吸模型,但也有研究者认为,吸附和解吸都是两相,包括两部分,每部分有独特的平衡和动力学特征 [43] [44] [45] 。第一部分的吸附通常在很大范围内(从微量水平到溶解度)呈线性,其土壤/水分配系数与有机碳质量分数成比例,可使用常规的动力学表达式描述。第二部分的动力学通常比第一部分慢 [46] ,不管是高浓度单次暴露还是低浓度持续暴露,其最大吸附容量相同 [47] ;吸附于第二部分的物质不参加反应 [48] ,但一旦解吸则能进行生物化学反应。结合前人研究成果和场地数据分析,2002年Chen等 [49] 建立了二元平衡解吸模型,2007年经Beckles等 [50] 发展为二元平衡解吸–降解模型,用于评价沉积物中结合态多环芳烃的生物可利用性。
2.4.1. 理论部分
该模型假设,吸附q (mg∙kg−1)是q1st (mg∙kg−1)和q2nd (mg∙kg−1)这两部分的线性加和:
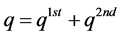 (36)
(36)
第一部分是线性吸附:
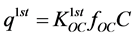 (37)
(37)
其中,C (mg∙L−1)表示液相浓度,fOC (%)为土壤有机碳质量分数,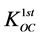 (L∙kg−1)为第一部分有机碳标化分配系数,可通过经验表格数据、特殊的相关性和外显测量获得。以下两个方程可用于疏水性有机物质的
(L∙kg−1)为第一部分有机碳标化分配系数,可通过经验表格数据、特殊的相关性和外显测量获得。以下两个方程可用于疏水性有机物质的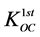 求解:
求解:
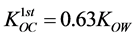 (38)
(38)
 (39)
(39)
其中,KOW为辛醇/水分配系数,即目标物在正辛醇中的溶解度与其在水中的溶解度之比。第二部分近似于Langmuir型吸附:
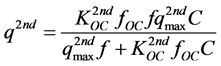 (40)
(40)
式中,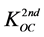 (L∙kg−1)为第二部分的有机碳标化分配系数。对于KOW在102.3至106.4之间的化合物,其
(L∙kg−1)为第二部分的有机碳标化分配系数。对于KOW在102.3至106.4之间的化合物,其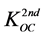 近似为常数:
近似为常数:
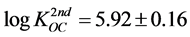 (41)
(41)
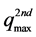 (mg∙kg−1)表示第二部分的最大吸附容量,即单位质量土壤中吸附的第二部分的目标物的最大量,可通过实验拟合得到,也可通过fOC (%)、KOW和物质在水中的溶解度Csat (mg∙L−1)综合评估 [51] :
(mg∙kg−1)表示第二部分的最大吸附容量,即单位质量土壤中吸附的第二部分的目标物的最大量,可通过实验拟合得到,也可通过fOC (%)、KOW和物质在水中的溶解度Csat (mg∙L−1)综合评估 [51] :
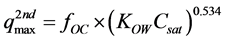 (42)
(42)
式中,f(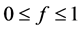 )为吸附过程中第二部分被吸附质填充的程度,f越接近1表示填充程度越大,田地试验体系中f通常接近于1 [52] ,具体数值可根据实验数据拟合得到。若保守计算,假设f = 1,则二元平衡等温线模型的一般式为:
)为吸附过程中第二部分被吸附质填充的程度,f越接近1表示填充程度越大,田地试验体系中f通常接近于1 [52] ,具体数值可根据实验数据拟合得到。若保守计算,假设f = 1,则二元平衡等温线模型的一般式为:
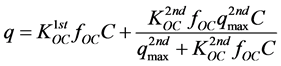 (43)
(43)
q对C求导,可得:
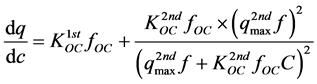 (44)
(44)
假设吸附态有机物先解吸到水相,再被微生物降解,水相的降解反应遵循一级动力学,且反应速率常数不随反应时间而改变,则
 (45)
(45)
其中,V (L)为液体体积,m (kg)为土壤质量,μ (h−1)为一级反应速率常数,t (h)为反应时间。
假设目标物在固–液间的分配为瞬时平衡,且遵循二元平衡解吸模型,结合前两式得到二元平衡解吸–降解模型:
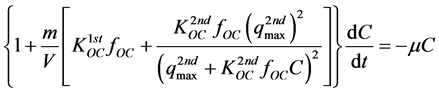 (46)
(46)
积分或者数值求解后(例如有限差分方法),可获得液相浓度C(或者固相浓度q)随时间t变化的的模型曲线 [50] ,用于评估疏水性有机污染物在土壤和沉积物中的生物可利用性。
该模型应用条件:液相矿化反应为一级反应,吸附和解吸为两相反应的体系。
2.4.2. 应用与评价
Chen等 [52] ,Kan等 [48] 和Beckles等 [46] [50] [51] 用二元平衡解吸模型拟合土壤中多环芳烃(萘、菲、荧蒽、芘等)、多氯联苯(Cl5PCB、Cl6PCB等)和氯苯(1,2-DCB、1,2,3-TCB、1,2,3,4-TeCB等)以及氯烯的解吸等温线后均指出,相较于传统的线性模型、Langmuir 模型、Freundlich 模型等,该模型整体上能更准确地量化疏水性有机污染物的解吸滞后规律,通过恰当地修改模型变量还可用来量化表面活性剂、共溶剂或胶体等对吸附–解吸行为的影响。而在生物降解方面,如图2所示,二元平衡解吸–降解模型对生物降解的预测与实测数据也达到很高的吻合度,对目标物半衰期的预测比线性吸附–解吸理论更合理。张静 [35] 则指出,二元平衡解吸–降解模型的预测效果因目标物浓度的不同而略有差异,对于土壤中吸附以疏水性分配为主的阿特拉津,吸附态浓度较低(q0 = 3.11 mg∙kg−1)时,模型能很好地拟合固相浓度和液相浓度随时间的变化,说明在低浓度降解体系中,阿特拉津的降解符合模型预设,即吸附态先解吸至液相再被微生物降解;吸附态浓度较高(q0 = 8.67 mg∙kg−1)时,模型与实验数据有偏差,液相浓度下降速率远慢于模型的预测结果,而固相的浓度变化速率则明显大于解吸速率,说明高浓度的吸附态阿特拉津一
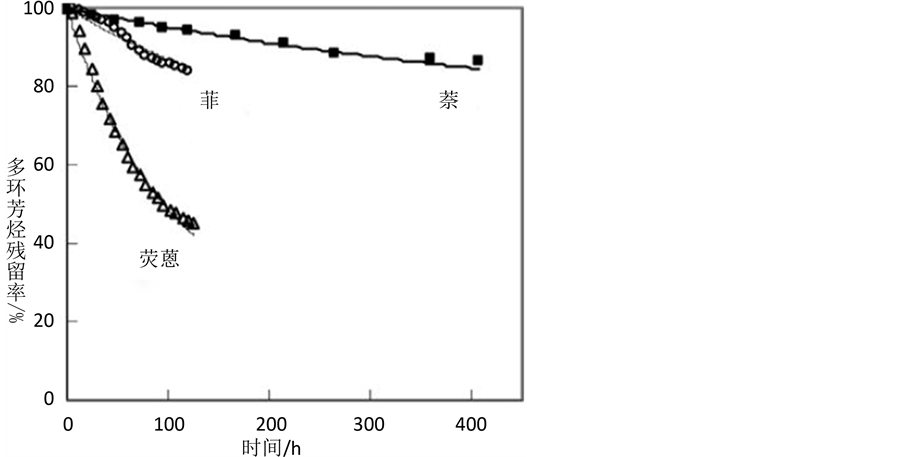
Figure 2. Biodegradation of naphthalene, phenanthrene and fluoranthene versus model predictions (solid lines) [50]
图2. 沉积物中多环芳烃的生物降解及模型预测结果 [50]
部分可不经解吸直接被细菌利用,其生物可利用率大于可解吸率。
由于二元平衡解吸模型是在系统地研究了六十多种吸附剂–吸附质体系的吸附–解吸行为后提出的,所涉及的有机物范围广泛,包括多环芳烃、多氯联苯、氯代苯类、氯代烷烃及烯烃、DDT及其降解产物等 [53] ,且吸附剂性质多样,包括多种天然土壤、沉积物以及人工合成吸附剂,其中的理化参数获取也相当方便,因而在实验室和田间试验中的适用性高,特别适合于低浓度污染物吸附–解吸行为的预测。相较于其他模型,二元平衡解吸模型能够以简单参数较准确地量化疏水性有机污染物在土壤、沉积物以及更复杂条件下的解吸规律,故在液相降解速率常数已知的情况下,由此发展的二元平衡解吸–降解模型也具有相当的实用性,可作为疏水性有机污染物(主要是KOW在102.3至106.4之间的化合物)生物有效性指标的定量检测工具。
尽管如此,该降解模型仍是基于先解吸后降解的假设,降解动力学采用的还是一级反应,未能考虑到微生物对结合态的直接利用速率和程度以及微生物不同种类的影响。此外,二元平衡解吸和二元平衡解吸–降解模型研究对象主要以氯代有机物为主,对结构更为复杂的分子如硝基取代苯类农药等,在其他吸附剂如黏土矿物 [54] [55] 或生物质碳上不可忽略的吸附作用 [56] [57] 而言,模型中的参数是否可做同样处理,还有待进一步进行检验。
2.5. 快慢两位点解吸–降解模型
1997年Cornelissen等 [58] 提出了遵循一级动力学方程的快速及慢速双位点解吸模型,2011年经Cui等 [31] 发展为快慢双位点解吸–降解模型,用于评价沉积物中沙土、淤泥、黏土各组分吸附态芘的生物可利用性。
2.5.1. 理论部分
对以分配机制为主的吸附作用,其各部分的解吸动力学可简化为一级反应 [59] [60] [61] 。用Tenax树脂持续提取沉积物中目标物时,目标物的解吸主要包括快解吸和慢解吸两部分 [58] [62] ,且两部分之间的物质转移可忽略不计 [63] 。当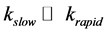 时,解吸动力学可用以下一阶两相方程描述:
时,解吸动力学可用以下一阶两相方程描述:
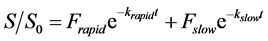 (47)
(47)
其中,S (ng∙g−1)和S0 (ng∙g−1)分别表示t(h)时刻的固相浓度和解吸前的固相浓度,Frapid (%)和Fslow (%)分别表示解吸开始前快解吸态和慢解吸态所占的百分比,krapid (h−1)和kslow (h−1)则对应于两组分的解吸速率常数,可根据解吸动力学曲线拟合得到。对上式求导,得到解吸速率:
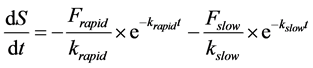 (48)
(48)
假设固相中的目标物只有解吸后才能被降解,而液相中的降解为一级反应,反应速率与目标物液相浓度C (μg∙L−1)成正比,则:
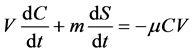 (49)
(49)
其中V (L)为液体体积,m (g)为土壤质量,μ (h−1)表示液相中的一级反应速率常数,可通过无土体系中的矿化数据获得。整合以上两式,得到
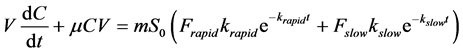 (50)
(50)
通过通解公式可求得此一阶非齐次微分方程的解,获得液相液相浓度C随时间t的变化方程(模型1):
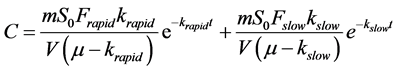 (51)
(51)
培养时间内目标物的矿化量可通过C的变化量之和计算,通过模型1得到的矿化速率可用于目标物在沉积物样品中的生物可利用性的评估。假设只有游离态降解,快慢两部分均是解吸后才被降解,那么实测的目标物矿化量应该与模型预测的一致。相反地,如果实测矿化速率高于预测值,则说明生物可利用性有所增强。
模型评估的上限是瞬时解吸,Fslow = 0且Frapid = 1,模型1可简化为(模型2):
 (52)
(52)
该模型应用条件:液相矿化反应为一级反应,吸附作用以分配机制为主的体系。
2.5.2. 应用与评价
运用上述方法,Cui等 [31] 发现,一阶两相解吸方程对于芘在沉积物沙土、淤泥和黏土三组分中的解吸动力学的拟合效果均很好(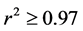 ),但实测的矿化曲线却在模型1的预测线之上,表明细菌不仅可以利用液相中的芘,还可以促进芘的解吸或者直接降解吸附态。其中沙土颗粒中的矿化曲线在模型1和2的预测线中间,淤泥成分中的矿化线与模型2非常接近,而黏土在矿化后期甚至超过了模型2的预测。这种高于瞬时解吸预测线的现象表明,淤泥和黏土组分对芘的吸附更可能直接被细菌降解,即不需要先解吸至液相才可被利用。然而,目前并未见到其他文献采用该模型判断吸附态有机物的生物有效性。
),但实测的矿化曲线却在模型1的预测线之上,表明细菌不仅可以利用液相中的芘,还可以促进芘的解吸或者直接降解吸附态。其中沙土颗粒中的矿化曲线在模型1和2的预测线中间,淤泥成分中的矿化线与模型2非常接近,而黏土在矿化后期甚至超过了模型2的预测。这种高于瞬时解吸预测线的现象表明,淤泥和黏土组分对芘的吸附更可能直接被细菌降解,即不需要先解吸至液相才可被利用。然而,目前并未见到其他文献采用该模型判断吸附态有机物的生物有效性。
值得肯定的是,该模型与Feng等提出的无解吸和瞬时解吸模型相比,考虑到了吸附态有机物不同组分的解吸速率对降解的影响,可用于判断吸附态有机物是否可被微生物直接利用。但遗憾的是,和后者一样,对实际矿化速率和矿化量的预测不够准确。这可能是因为一阶两相解吸动力学方程不一定具有机理上的意义,不一定与真实的物理化学变化相符 [63] 。其次,降解过程中微生物的某些作用,例如粘附或分泌作用 [12] [64] [65] ,可能促进了有机物的解吸 [66] [67] [68] ,改变了总体解吸速率,导致生物降解过程中的解吸不同于非生物过程。另外,该耦合模型中忽略了一些重要变量的影响,也可能是模型预测脱离实际的原因之一。
3. 总结
近几十年来,土壤中有机污染物生物可利用性的理论研究已经有了长足的发展,国内外研究者已将吸附的影响与微生物降解结合起来,建立了较为可靠的吸附–降解动力学模型,用于评价和预测农药和多环芳烃在土壤/沉积物中的微生物可利用性。
然而,迄今为止的研究仍存在相当多的缺陷。首先,除了Park等人提出的三位点解吸–降解模型之外,现有微生物降解模型都基于先解吸后降解的假设建立,降解动力学方面多采用一级反应,未能考虑到微生物对结合态直接利用的速率和程度以及微生物不同种类的影响。其次,现有降解模型中的吸附问题多采用最简单的土壤分配理论以及吸附等温线为直线来处理。实际上,土壤生态系统是一个复杂的体系,有机物分子(特别是农药)在土壤中的吸附行为不仅受土壤有机质(SOM)支配 [33] [69] ,还受到包括黏土矿物、生物质碳等在内的土壤各组分的不可忽视的影响 [54] [55] [56] [57] [70] [71] 。研究证明,即使土壤仅含0.1%的生物质碳,就能大大提高土壤的吸附能力,且生物质碳的吸附能力持续有效,不随时间而明显降低 [72] ,会显著影响有机物分子的生物可利用性 [73] 。因此土壤各组分的吸附机理不同,吸附等温线和解吸特性也相异,需采用不同的吸附、解吸系数来综合处理。此外,自然土壤生态系统以及污染修复系统有机物种类丰富,也并非单一微生物体系,其中存在协同、拮抗、竞争等作用关系,环境因素如pH、温度、湿度条件以及离子强度的影响也不容忽视 [74] [75] [76] [77] 。因此上述单一有机污染物单一有机体的研究模式对于实际环境的把控不一定到位,还需要更全面的理论研究,修正现有模型或另辟蹊径建立实用性更强、适用范围更广的量化方式,发展和建立更完善的模型评价系统。
基金项目
本课题获国家自然科学重点基金资助:土壤结合态农药的生物可利用性与潜在毒性21437004。
文章引用
胡 姣,郁 祁,盛光遥. 土壤有机污染物的吸附–生物降解耦合模型研究进展
Advances in Coupled Sorption Biodegradation Models for Organic Pollutants in Soil[J]. 微生物前沿, 2016, 05(04): 37-54. http://dx.doi.org/10.12677/AMB.2016.54005
参考文献 (References)
- 1. Song, Q., Wang, Z. and Li, J. (2013) Sustainability Evaluation of E-Waste Treatment Based on Emergy Analysis and the LCA Method: A Case Study of a Trial Project in Macau. Ecological Indicators, 30, 138-147. https://doi.org/10.1016/j.ecolind.2013.02.016
- 2. 邹威, 罗义, 周启星. 畜禽粪便中抗生素抗性基因(ARGs)污染问题及环境调控[J]. 农业环境科学学报, 2014, 33(12): 2281-2287.
- 3. Mitton, F.M., Gonzalez, M., Pena, A.v Miglioranza, K.S. (2012) Effects of Amendments on Soil Availability and Phytoremediation Potential of Aged p,p’-DDT, p,p’-DDE and p,p’-DDD Residues by Willow Plants (Salix sp.). Journal of Hazardous Materials, 203-204, 62-68. https://doi.org/10.1016/j.jhazmat.2011.11.080
- 4. Jayanthy, V., Geetha, R., Rajendran, R., Prabhavathi, P., Karthik Sundaram, S., Dinesh Kumar, S. and Santhanam, P. (2014) Phytoremediation of Dye Contaminated Soil by Leucaena leucocephala (Subabul) Seed and Growth Assessment of Vigna radiata in the Remediated Soil. Saudi Journal of Biological Sciences, 21, 324-333. https://doi.org/10.1016/j.sjbs.2013.12.001
- 5. 杨勇, 何艳明, 栾景丽, 刘景洋, 郭玉文. 国际污染场地土壤修复技术综合分析[J]. 环境科学与技术, 2012, 35(10): 92-98.
- 6. 周际海, 袁颖红, 朱志保, 姚春阳, 张谷雨, 高琪. 土壤有机污染物生物修复技术研究进展[J]. 生态环境学报, 2015, 24(2): 343-351.
- 7. Head, I.M. (1998) Bioremediation: Towards a Credible Technology. Microbiology, 144, 599-608. https://doi.org/10.1099/00221287-144-3-599
- 8. Haws, N.W., Ball, W.P. and Bouwer, E.J. (2006) Modeling and Interpreting Bioavailability of Organic Contaminant Mixtures in Subsurface Environments. Journal of Contaminant Hydrology, 82, 255-292. https://doi.org/10.1016/j.jconhyd.2005.10.005
- 9. 李克斌, 许中坚, 刘维屏农药在土壤上吸着/解吸及其对生物利用率影响的研究进展[J]. 环境污染治理技术与设备, 2002, 3(4): 18-24.
- 10. Ogram, A.V., Jessup, R.E., Ou, L.T. and Rao, P.S. (1985) Effects of Sorption on Biological Degradation Rates of (2,4-Dichlorophenoxy) Acetic Acid in Soils. Applied and Environmental Microbiology, 49, 582-587.
- 11. Calvillo, Y.M. and Alexander, M. (1996) Mechanism of Microbial Utilization of Biphenyl Sorbed to Polyacrylic Beads. Applied Microbiology and Biotechnology, 45, 383-390. https://doi.org/10.1007/s002530050700
- 12. Tang, W.C., White, J.C. and Alexander, M. (1998) Utilization of Sorbed Compounds by Microorganisms Specifically Isolated for That Purpose. Applied Microbiology and Biotechnology, 49, 117-121. https://doi.org/10.1007/s002530051147
- 13. Laor, Y., Strom, P.F. and Farmer, W.J. (1999) Bioavailability of Phenanthrene Sorbed to Mineral-Associated Humic Acid. Water Research, 33, 1719-1729. https://doi.org/10.1016/S0043-1354(98)00378-9
- 14. Huesemann, M.H., Hausmann, T.S. and Fortman, T.J. (2004) Does Bioavailability Limit Biodegradation? A Comparison of Hydrocarbon Biodegradation and Desorption Rates in Aged Soils. Biodegradation, 15, 261-274. https://doi.org/10.1023/B:BIOD.0000042996.03551.f4
- 15. Poeton, T.S., Stensel, H.D. and Strand, S.E. (1999) Biodegradation of Polyaromatic Hydrocarbons by Marine Bacteria: Effect of Solid Phase on Degradation Kinetics. Water Research, 33, 868-880. https://doi.org/10.1016/S0043-1354(98)00232-2
- 16. Yang, Y., Hunter, W., Tao, S. and Gan, J. (2009) Microbial Availability of Different Forms of Phenanthrene in Soils. Environmental Science and Technology, 43, 1852-1857. https://doi.org/10.1021/es802966z
- 17. Smith, K.E.C., Thullner, M., Wick, L.Y. and Harms, H. (2009) Sorption to Humic Acids Enhances Polycyclic Aromatic Hydrocarbon Biodegradation. Environmental Science and Technology, 43, 7205-7211. https://doi.org/10.1021/es803661s
- 18. Xia, X., Li, Y., Zhou, Z. and Feng, C. (2010) Bioavailability of Adsorbed Phenanthrene by Black Carbon and Multi- Walled Carbon Nanotubes to Agrobacterium. Chemosphere, 78, 1329-1336. https://doi.org/10.1016/j.chemosphere.2010.01.007
- 19. Zhang, C., Li, M., Xu, X. and Na, L. (2015) Effects of Carbon Nanotubes on Atrazine Biodegradation by Arthrobacter sp. Journal of Hazardous Materials, 287, 1-6. https://doi.org/10.1016/j.jhazmat.2015.01.039
- 20. Feng, Y., Park, J.H., Voice, T.C. and Boyd, S.A. (2000) Bioavailability of Soil-Sorbed Biphenyl to Bacteria. Environmental Science and Technology, 34, 1977-1984. https://doi.org/10.1021/es991165e
- 21. Park, J.H., Feng, Y., Ji, P., Voice, T.C. and Boyd, S.A. (2003) Assessment of Bioavailability of Soil-Sorbed Atrazine. Applied and Environmental Microbiology, 69, 3288-3298. https://doi.org/10.1128/AEM.69.6.3288-3298.2003
- 22. Alekseeva, T., Prevot, V., Sancelme, M., Forano, C. and Besse-Hoggan, P. (2011) Enhancing Atrazine Biodegradation by Pseudomonas sp. Strain ADP Adsorption to Layered Double Hydroxide Bionanocomposites. Journal of Hazardous Materials, 191, 126-135. https://doi.org/10.1016/j.jhazmat.2011.04.050
- 23. Guerin, W.F. and Boyd, S.A. (1992) Differential Bioavailability of Soil-Sorbed Naphthalene to Two Bacterial Species. Applied and Environmental Microbiology, 58, 1142-1152.
- 24. Simkins, S. and Alexander, M. (1984) Models for Mineralization Kinetics with the Variables of Substrate Concentration and Population Density. Applied and Environmental Microbiology, 47, 1299-1306.
- 25. Scow, K.M., Schmidt, S.K. and Alexander, M. (1989) Kinetics of Biodegradation of Mixtures of Substrates in Soil. Soil Biology and Biochemistry, 21, 703-708. https://doi.org/10.1016/0038-0717(89)90067-9
- 26. Guerin, W.F. and Boyd, S.A. (1997) Bioavailability of Naphthalene Associated with Natural and Synthetic Sorbents. Water Research, 31, 1504-1512. https://doi.org/10.1016/S0043-1354(96)00402-2
- 27. Williams, J.W. and Morrison, J.F. (1979) The Kinetics of Reversible Tight-Binding Inhibition. Methods in Enzymology, 63, 437-467. https://doi.org/10.1016/0076-6879(79)63019-7
- 28. Tagaya, M., Yamano, K. and Fukui, T. (1989) Kinetic Studies of the Pyridoxal Kinase from Pig Liver: Slow-Binding Inhibition by Adenosine Tetraphosphopyridoxal. Biochemistry, 28, 4670-4675. https://doi.org/10.1021/bi00437a024
- 29. Leatherbarrow, R.J. (1990) Using Linear and Non-Linear Regression to Fit Biochemical Data. Trends in Biochemical Sciences, 15, 455-458. https://doi.org/10.1016/0968-0004(90)90295-M
- 30. Mohammed, L. and Julio, O.C.J. (1999) Bioavailability of Labile and Desorption-Resistant Phenanthrene Sorbed to Montmorillonite Clay Containing Humic Fractions. Environmental Toxicology and Chemistry, 18, 2729-2735. https://doi.org/10.1002/etc.5620181212
- 31. Cui, X., Hunter, W., Yang, Y., Chen, Y. and Gan, J. (2011) Biodegradation of Pyrene in Sand, Silt and Clay Fractions of Sediment. Biodegradation, 22, 297-307. https://doi.org/10.1007/s10532-010-9399-z
- 32. Lee, S., Pardue, J.H., Moe, W.M. and Kim, D.J. (2009) Effect of Sorption and Desorption-Resistance on Biodegradation of Chlorobenzene in Two Wetland Soils. Journal of Hazardous Materials, 161, 492-498. https://doi.org/10.1016/j.jhazmat.2008.03.129
- 33. Chiou, C.T. (2002) Partition and Adsorption of Organic Contaminants in Environmental Systems. John Wiley & Sons, Hoboken, 106-213. https://doi.org/10.1002/0471264326
- 34. Zhang, W.X., Bouwer, E.J. and Ball, W.P. (1998) Bioavailability of Hydrophobic Organic Contaminants: Effects and Implications of Sorp-tion-Related Mass Transfer on Bioremediation. Groundwater Monitoring and Remediation, 18, 126-138. https://doi.org/10.1111/j.1745-6592.1998.tb00609.x
- 35. 张静, 庞然, 段林, 张承东. 土壤吸附态阿特拉津的生物可利用性研究[J]. 环境污染与防治, 2013, 35(10): 12-16.
- 36. Park, J.H., Zhao, X. and Voice, T.C. (2001) Biodegradation of Non-Desorbable Naphthalene in Soils. Environmental Science and Technology, 35, 2734-2740. https://doi.org/10.1021/es0019326
- 37. Park, J.H., Zhao, X. and Voice, T.C. (2002) Development of a Kinetic Basis for Bioavailability of Sorbed Naphthalene in Soil Slurries. Water Research, 36, 1620-1628. https://doi.org/10.1016/S0043-1354(01)00360-8
- 38. Park, J.H., Sharer, M., Feng, Y., Chung, S.Y., Voice, T.C. and Boyd, S.A. (2005) Effects of Aging on the Bioavailability and Sorption/Desorption Behavior of Biphenyl in Soils. Water Science and Technology, 52, 95-105.
- 39. Sharer, M., Park, J.H., Voice, T.C. and Boyd, S.A. (2003) Time Dependence of Chlorobenzene Sorption/Desorption by Soils. Soil Science Society of America Journal, 67, 1740-1745. https://doi.org/10.2136/sssaj2003.1740
- 40. Sharer, M., Park, J.H., Voice, T.C. and Boyd, S.A. (2003) Aging Effects on the Sorption-Desorption Characteristics of Anthropogenic Organic Compounds in Soil. Journal of Environmental Quality, 32, 1385-1392. https://doi.org/10.2134/jeq2003.1385
- 41. Park, J.H., Feng, Y., Cho, S.Y., Voice, T.C. and Boyd, S.A. (2004) Sorbed Atrazine Shifts into Non-Desorbable Sites of Soil Organic Matter during Aging. Water Research, 38, 3881-3892. https://doi.org/10.1016/j.watres.2004.06.026
- 42. 黄杰勋, 周冰冰, 李非里, 盛光遥. 老化对黑碳中吸附态苯酚的脱附及微生物降解的影响[J]. 环境科学学报, 2014, 34(10):2469-2476.
- 43. Carroll, K.M., Harkness, M.R., Bracco, A.A. and Balcarcel, R.R. (1994) Application of a Permeantpolymer Diffusional Model to the Desorption of Polychlorinated Biphenyls from Hudson River Sediments. Environmental Science and Technology, 28, 253-258. https://doi.org/10.1021/es00051a011
- 44. Pignatello, J.J. and Xing, B. (1996) Mechanisms of Slow Sorption of Organic Chemicals to Natural Particles. Environmental Science and Technology, 30, 1-11. https://doi.org/10.1021/es940683g
- 45. Weber, W.J. and Huang, W. (1996) A Distributed Reactivity Model for Sorption by Soils and Sediments. 4. Intraparticle Heterogeneity and Phase Distribution Relationships under Nonequilibrium Conditions. Environmental Science and Technology, 30, 881-888. https://doi.org/10.1021/es950329y
- 46. Kan, A.T., Fu, G., Hunter, M., Chen, W., Ward, C.H. and Tomson, M.B. (1998) Irreversible Sorption of Neutral Hydrocarbons to Sediments: Experimental Observations and Model Predictions. Environmental Science and Technology, 32, 892-902. https://doi.org/10.1021/es9705809
- 47. Kan, A.T., Fu, G., Hunter, M.A. and Tomson, M.B. (1997) Irreversible Adsorption of Naphthalene and Tetrachlorobiphenyl to Lula and Surrogate Sediments. Environmental Science and Technology, 31, 2176-2185. https://doi.org/10.1021/es9601954
- 48. Alexander, M. (2000) Aging, Bioavailability, and Overestimation of Risk from Environmental Pollutants. Environmental Science and Technology, 34, 4259-4265. https://doi.org/10.1021/es001069+
- 49. Chen, W., Kan, A.T., Newell, C.J., Moore, E. and Tomson, M.B. (2002) More realistic Soil Cleanup Standards with Dual-Equilibrium Desorption. Ground Water, 40, 153-164. https://doi.org/10.1111/j.1745-6584.2002.tb02500.x
- 50. Beckles, D.M., Wei, C. and Hughes, J.B. (2007) Bioavailability of Polycyclic Aromatic Hydrocarbons Sequestered in Sediment: Microbial Study and Model Prediction. Environmental Toxicology and Chemistry, 26, 878-883. https://doi.org/10.1897/06-410R.1
- 51. Chen, W. (1999) Impact of Irreversible Sorption on Sediment Quality. PhD Thesis, Rice University, Houston.
- 52. Chen, W., Kan, A.T. and Tomson, M.B. (2000) Impact of Irreversible Sorption on Bioavailability, Risk Assessment, and Site Remediation. Proceedings of the Water Environment Federation, Anaheim, 14-18 October 2000, 598-615. https://doi.org/10.2175/193864700784608423
- 53. 段林, 张承东, 陈威. 土壤和沉积物中疏水性有机污染物的锁定及其环境效应[J]. 环境化学, 2011, 30(1): 242- 251.
- 54. Sheng, G., Johnston, C.T., Teppen, B.J. and Boyd, S.A. (2001) Potential Contributions of Smectite Clays and Organic Matter to Pesticide Retention in Soils. Journal of Agricultural and Food Chemistry, 49, 2899-2907. https://doi.org/10.1021/jf001485d
- 55. Boyd, S.A., Sheng, G., Teppen, B.J. and Johnston, C.T. (2001) Mechanisms for the Adsorption of Substituted Nitrobenzenes by Smectite Clays. Environmental Science and Technology, 35, 4227-4234. https://doi.org/10.1021/es010663w
- 56. Yang, Y. and Sheng, G. (2003) Enhanced Pesticide Sorption by Soils Containing Particulate Matter from Crop Residue Burns. Environmental Science and Technology, 37, 3635-3639. https://doi.org/10.1021/es034006a
- 57. Chun, Y., Sheng, G., Chiou, C.T. and Xing, B. (2004) Compositions and Sorptive Properties of Crop Residue-Derived Chars. Environmental Science and Technology, 38, 4649-4655. https://doi.org/10.1021/es035034w
- 58. Cornelissen, G., Noort, P.C.M.V., Parsons, J.R. and Govers, H.A.J. (1997) Temperature Dependence of Slow Adsorption and Desorption Kinetics of Organic Compounds in Sediments. Environmental Science and Technology, 31, 454- 460. https://doi.org/10.1021/es960300+
- 59. Connaughton, D.F., Stedinger, J.R., Lion, L.W. and Shuler, M.L. (1993) Description of Time-Varying Desorption Kinetics: Release of Naphthalene from Contaminated Soils. Environmental Science and Technology, 27, 2397-2403. https://doi.org/10.1021/es00048a013
- 60. Schrap, S.M., Sleijpen, G.L., Seinen, W. and Opperhuizen, A. (1994) Sorption Kinetics of Chlorinated Hydrophobic Organic Chemicals, Part II: Desorption Experiments. Environmental Science and Pollution Research, 1, 81-92. https://doi.org/10.1007/BF02986511
- 61. Langenfeld, J.J., Hawthorne, S.B., Miller, D.J. and Pawliszyn, J. (1995) Kinetic Study of Supercritical Fluid Extraction of Organic Contaminants from Heterogeneous Environmental Samples with Carbon Dioxide and Elevated Temperatures. Analytical Chemistry, 67, 1727-1736. https://doi.org/10.1021/ac00106a013
- 62. Gerard, C., Van, N.P.C.M. and Govers, H.A.J. (1997) Desorption Kinetics of Chlorobenzenes, Polycyclic Aromatic Hydrocarbons, and Polychlorinated Biphenyls: Sediment Extraction with Tenax and Effects of Contact Time and Solute Hydrophobicity. Environmental Toxicology and Chemistry, 16, 1351-1357. https://doi.org/10.1002/etc.5620160703
- 63. Cornelissen, G., Rigterink, H., Ferdinandy, M.M.A. and Noort, P.C.M.V. (1998) Rapidly Desorbing Fractions of Pahs in Contaminated Sediments as a Predictor of the Extent of Bioremediation. Environmental Science and Technology, 32, 966-970. https://doi.org/10.1021/es9704038
- 64. Scheibenbogen, K., Zytner, R.G., Lee, H. and Trevors, J.T. (1994) Enhanced Removal of Selected Hyrocarbons from Soil by Pseudomonas aeruginosa UG2 Biosurfactants and Some Chemical Surfactants. Journal of Chemical Technology and Biotechnology, 59, 53-59. https://doi.org/10.1002/jctb.280590109
- 65. Leglize, P., Alain, S., Jacques, B. and Corinne, L. (2008) Adsorption of Phenanthrene on Activated Carbon Increases Mineralization Rate by Specific Bacteria. Journal of Hazardous Materials, 151, 339-347. https://doi.org/10.1016/j.jhazmat.2007.05.089
- 66. Oberbremer, A., Muller-Hurtig, R. and Wagner, F. (1990) Effect of the Addition of Microbial Surfactants on Hydrocarbon Degradation in a Soil Population in a Stirred Reactor. Applied Microbiology and Biotechnology, 32, 485-489. https://doi.org/10.1007/BF00903788
- 67. Uyttebroek, M., Ortega-Calvo, J.J., Breugelmans, P. and Springael, D. (2006) Comparison of Mineralization of Solid- Sorbed Phenanthrene by Polycyclic Aromatic Hydrocarbon (PAH)-Degrading Mycobacterium spp. and Sphingomonas spp. Applied Microbiology and Biotechnology, 72, 829-836. https://doi.org/10.1007/s00253-006-0337-2
- 68. Zhang, Y., Wang, F., Bian, Y., Kengara, F.O., Gu, C., Zhao, Q. and Jiang, X. (2012) Enhanced Desorption of Humin- Bound Phenanthrene by Attached Phenanthrene-Degrading Bacteria. Bioresource Technology, 123, 92-97. https://doi.org/10.1016/j.biortech.2012.07.093
- 69. Chiou, C.T., Peters, L.J. and Freed, V.H. (1979) A Physical Concept of Soil-Water Equilibria for Nonionic Organic Compounds. Science, 206, 831-832. https://doi.org/10.1126/science.206.4420.831
- 70. Johnston, C.T., de Oliveira, M.F., Teppen, B.J., Sheng, G. and Boyd, S.A. (2001) Spectroscopic Study of Nitroaromatic-Smectite Sorption Mechanisms. Environmental Science and Technology, 35, 4767-4772. https://doi.org/10.1021/es010909x
- 71. Zhou, Z., Shi, D., Qiu, Y. and Sheng, G.D. (2010) Sorptive Domains of Pine Chars as Probed by Benzene and Nitrobenzene. Environmental Pollution, 158, 201-206. https://doi.org/10.1016/j.envpol.2009.07.020
- 72. Yang, Y. and Sheng, G. (2003) Pesticide Adsorptivity of Aged Particulate Matter Arising from Crop Residue Burns. Journal of Agricultural and Food Chemistry, 51, 5047-5051. https://doi.org/10.1021/jf0345301
- 73. Loganathan, V.A., Feng, Y., Sheng, G.D. and Clement, T.P. (2009) Crop-Residue-Derived Char Influences Sorption, Desorption and Bioavailability of Atrazine in Soils. Soil Science Society of America Journal, 73, 967-974. https://doi.org/10.2136/sssaj2008.0208
- 74. Qiu, Y., Xiao, X., Cheng, H., Zhou, Z. and Sheng, G.D. (2009) Influence of Environmental Factors on Pesticide Adsorption by Black Carbon: pH and Model Dissolved Organic Matter. Environmental Science and Technology, 43, 4973-4978. https://doi.org/10.1021/es900573d
- 75. Tong, F., Gu, X., Gu, C., Ji, R., Tan, Y. and Xie, J. (2015) Insights into Tetrabromobisphenol A adsorption onto Soils: Effects of Soil Components and Environmental Factors. The Science of the Total Environment, 536, 582-588. https://doi.org/10.1016/j.scitotenv.2015.07.063
- 76. Chang, P.H., Li, Z., Jiang, W.T., Kuo, C.Y. and Jean, J.S. (2014) Adsorption of Tetracycline on Montmorillonite: Influence of Solution pH, Temperature, and Ionic Strength. Desalination and Water Treatment, 55, 1380-1392. https://doi.org/10.1080/19443994.2014.924881
- 77. Ngigi, A., Dorfler, U., Scherb, H., Getenga, Z., Boga, H. and Schroll, R. (2011) Effect of Fluctuating Soil Humidity on in Situ Bioavailability and Degradation of Atrazine. Chemosphere, 84, 369-375. https://doi.org/10.1016/j.chemosphere.2011.03.068