Immunology Studies
Vol.02 No.04(2014), Article ID:15157,14
pages
10.12677/IS.2014.24006
Silver Nanoparticles Induced Immunotoxicity-Based Early Systemic Toxicity
Anliang Shao1*, Zhijie Wang1,2, Liang Chen1, Liming Xu1#
1National Institutes for Food and Drug Control, Beijing
2Guanhao Biotech Co., Ltd., Guangzhou Guangdong
*第一作者。
#通讯作者。
Email: shaoanliang@nifdc.org.cn, #xuliming@nifdc.org.cn
Received: Apr. 15th, 2015; accepted: Apr. 26th, 2015; published: Apr. 30th, 2015
Copyright © 2014 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: To investigate the effects on immune system and other systemic toxicity of silver nanoparticles (SNPs) in rats by oral exposure, and combined an in vitro study of SNPs on the release of inflammatory cytokines and immune factors in lymphocytes, to get a better understanding about potential immunotoxicity of silver nanoparticles. Methods: SD rats were orally administrated with low-dose (1 mg/kg) and high-dose (10 mg/kg) of SNPs and saline (control) respectively, and the organ and blood samples were harvested after 2 hrs (n = 9), 7 days (n = 18), 14 days (n = 18) exposure and14 days of post-exposure (n = 9) for determination of silver content, hematology, blood biochemistry, and immune factor assessment. Lymphocytes were incubated with or without lipopolysaccharide in the presence or absence of silver nanoparticles for 24 hours in vitro. And IL-6, IL-4, IgG and IgE of cell culture supernatants were analyzed by ELISA. Results and Discussion: SNPs exposure group showed SNPs accumulated time-dose dependently in blood and organs of rats. The IgG (14 days), IgE (14 days) and IL-4 (7 days) of rats after 10 mg/kg SNPs exposure were significantly increased, and IL-6 and CD45RA+ (B cells) at 14 days post-exposure of SNPs were obviously increased, compared with that in control. But we did not find significant pathological changes. The rise of glucose and ALP suggested damage of pancreas and liver of rats after SNPs oral administration. Low concentration silver in blood increased inflammatory cells in response to the stimuli by blood examination, while high concentration induced cytotoxicity which inhibited the normal growth of lymphocyte. Secretion of IgG and IL-6 induced by LPS of lymphocytes in low-dose and high-dose (0.5 μg/ml, 5 μg/ml) SNPs exposure was inhibited in vitro. In conclusion, our study showed that silver nanoparticles mainly caused a Th2-type immune toxicity-based early systemic toxicity.
Keywords:Silver Nanoparticles, Oral Administration, Immunotoxicity, Systemic Toxicity

纳米银诱导的以免疫毒性为主的 早期全身毒性研究
邵安良1*,王志杰1,2,陈亮1,徐丽明1#
1中国食品药品检定研究院,北京
2冠昊生物科技股份有限公司,广东 广州
Email: shaoanliang@nifdc.org.cn, #xuliming@nifdc.org.cn
收稿日期:2015年4月15日;录用日期:2015年4月26日;发布日期:2015年4月30日

摘 要
目的:考察纳米银对大鼠免疫系统的影响以及其他早期全身毒性反应;同时考察纳米银在体外对淋巴细胞炎性因子和免疫因子释放的影响。通过体内外试验的综合研究考察纳米银的潜在免疫系统毒性。方法:SD大鼠经连续灌胃给入低剂量(1 mg/kg)和高剂量(10 mg/kg)纳米银溶液,生理盐水溶液(对照组)。于首次给入后2小时、连续给入7天、14天及停止给入14天后分别处死大鼠,然后进行大鼠体内各脏器银元素定量测定和病理学分析、血液学及血液生化检测、相关免疫因子的检测。体外试验中,在纳米银暴露或非暴露条件下,将淋巴细胞于含或不含脂多糖的培养液中培养24小时,分析IL-6、IL-4、IgG、IgE等的含量,以考察纳米银引起的免疫系统毒性。结果和讨论:纳米银暴露组显示纳米银剂量、时间依存性的在大鼠血液及脏器组织内蓄积。与对照组相比,经口给入高剂量纳米银(10 mg/Kg)引起了大鼠淋巴细胞IgE、IgG与IL-4的显著增加;高、低剂量组给入纳米银14天停止给入14天后,血清IL-6水平与B细胞CD45RA+水平均显著增加。虽然经纳米银灌胃后大鼠组织病理学检查未发现显著的病理改变,但血糖和碱性磷酸酶的升高提示有胰脏和肝脏的损伤。血常规显示血液内银在低浓度时刺激炎性细胞反应性增加;而高浓度时则诱导细胞毒性,抑制了淋巴细胞的正常生长。在体外不同浓度纳米银(0.5 μg/mL,5 μg/mL)作用下,LPS诱导的淋巴细胞分泌IgG和IL-6显著减少。综合体内外实验结果表明,本研究所用的纳米银主要引起了大鼠以Th2型免疫毒性为主的早期全身毒性。
关键词 :纳米银,灌胃,免疫系统毒性,全身毒性

1. 引言
纳米银因具有抗菌杀菌作用而被应用于医疗领域,如:含纳米银敷料、纳米银涂层导管等。然而,具有粒径小、比表面积大、活性强等特点的纳米银在发挥抗菌杀菌作用的同时也会对人体正常组织或细胞产生负作用。大量的体外实验研究提示一定剂量的纳米银具有明显的细胞毒性[1] -[6] 。纳米银的毒性强度不仅与剂量有关,还与粒径的大小、形状、聚散状态,尤其与颗粒表面的化学修饰及电荷有着重要的关联性 [7] 。更多的学者认为目前的资料还不足以充分全面的对纳米银进行风险评估 [8] - [10] 。
大量体内实验研究证实纳米银能够从各种途经(吸入、口服、皮肤)吸收进入体内,在体内迁移,于不同脏器引起蓄积及大剂量时伴有主要靶脏器(如肝、肺、肾)的损伤 [11] - [18] 。汤京龙等曾报告在皮下植入实验中发现纳米银不仅分布于肝脏、脾脏、肾脏、心脏等,而且能够透过血脑屏障引起脑神经的损伤 [19] 。以上实验研究所得到的无毒性剂量水平或最低毒性剂量水平似乎远远高于人体可能被暴露的水平。然而,存在的疑问:1) 研究中缺乏对生物利用度的考察。即虽然暴露的剂量很高,但动物并非剂量依存性地吸收利用了所暴露的剂量;2) 所采用的评价方法大多是对非纳米级材料的评价指标、方法和技术,没有充分考虑纳米材料可能诱导的特殊生物学反应。因此,仅依据目前的体内实验研究结果还不能全面合理地推测人体暴露的风险。
当纳米材料穿透人体的自然屏障后发生体内迁移,接触最多的是血液和淋巴系统。有研究报道利用碳纳米管进入血液系统后的免疫刺激作用靶向性治疗肿瘤细胞 [20] 。在I125标示的纳米银体内分布的研究结果表明,脾脏占41.5%、肝脏占24.5%、肺脏占1.5%,其他脏器分布均在1%以下,由此可见纳米银在脾脏分布最多 [21] 。许海燕课题组的研究发现碳纳米管可以引起动物体内淋巴细胞数量的变化、细胞因子分泌谱的改变以及补体系统活化等一系列免疫反应,而且具有一定的剂量依赖性 [22] [23] 。刘焕亮等的研究显示纳米银、纳米氧化锌、纳米二氧化钛可以引起大鼠脾脏和胸腺的免疫损伤,刺激机体免疫系统产生免疫应答,引起免疫系统毒性 [24] 。也有研究报告小鼠经口给入纳米银(1 mg/Kg)连续暴露14天引起了血浆TGF-β的升高和B细胞的增加;而连续28天暴露后发现淋巴细胞中B细胞和IgE增加 [25] 。然而,以上研究缺乏详细的体内外对比研究。
为考察纳米银引起免疫反应的特征和类型,本研究设计经灌胃给入纳米银溶液,重点考察SD大鼠的免疫系统变化以及其他早期全身毒性反应。同时,设计在体外条件下,考察纳米银对淋巴细胞炎性因子和免疫因子释放的影响,考察纳米银对淋巴细胞的刺激作用或者毒性反应类型。通过体内外试验综合分析纳米银诱导的免疫毒性反应特征和类型,为低剂量纳米银暴露时引起的早期全身毒性风险评价供技术支持。
2. 材料与仪器
2.1. 材料
纳米银溶液(Nanux, Korea);细胞培养液:含10% FBS (Gibco)、2 mM L-谷氨酰胺Sigma)、50 μM beta-巯基乙醇Sigma)、100 U青霉素及100 μg/mL硫酸链霉素(Sigma);RPMI-1640培养基(Hyclone);脂多糖(sigma);聚苯乙烯纳米颗粒:(PS-NP,天津市倍思乐色谱技术开发中心,粒径:50~100 nm)。
2.2. 仪器
血细胞分析仪(Sysmex xt-1800i);低温离心机(Himac CR21G);生化分析仪(Hitachi7080);电感耦合等离子体质谱仪(ICP-MS, Agilent 7500);酶标仪(Thermo 1500);透射电镜(JEM-2100F);粒径电位仪(Malvern, nano ZS)。
3. 方法
3.1. 动物实验
选取240~260 g的健康成年雌性SD大鼠(由中国食品药品检定研究院实验动物中心提供) 54只,按照取样时间点随机分成四大组,每大组再均分成对照、低剂量、高剂量3组。对照组灌胃给入1 mL/kg生理盐水;低剂量组灌胃给入1 mg/kg纳米银溶液;高剂量组灌胃给入10 mg/kg纳米银溶液。四组SD大鼠经单次灌胃给入溶液后2小时取样为第1天(n = 9,每组3只)、连续7天灌胃给入溶液后为第7天取样(n = 18,每组6只)、连续灌胃给入溶液14天后为第14天取样(n = 18,每组6只)、连续灌胃给入溶液14天后停止给样,再正常饲养14天后为第28天取样(n = 9,每组3只)。在上述不同时间点将大鼠人道处死,取血及脏器组织,进行血液学、血液生化、炎症因子、免疫因子、淋巴细胞型、免疫器官及其他各器官的重量及组织病理、动物体内银元素定量测定等分析。
3.2. 器官病理观察(HE染色)
将动物处死后取脏器,经生理盐水充分冲洗后每种组织各取1/3分别放入10%福尔马林固定液,用于HE 染色;其余用于银含量检测。
3.3. 血液及脏器组织内银含量检测
将样本放入消解瓶中,添加3 mL HNO3后放置24 h进行消解;消解后将样本放在通风厨内,加盖密封后低温加热,直至溶液变澄清;再加热接近干燥时停止加热,使其冷却;用超纯净水溶解消解瓶中残余物,并定容至25 mL。利用等离子体质谱仪测定每份定量容液中的银含量,即为每份样本中的银含量,并计算出单位质量(mg)脏器组织的银含量。
3.4. 血常规及血液生化检测
取血液每管300 μL,用1.5% EDTA 1:10抗凝,然后采用血细胞分析仪检测。取血液每管700 μL,在常温下2000 g离心15 min,取上清,然后采用生化分析仪进行检测。
3.5. 免疫学检测
先在96孔培养板上包被抗体4℃过夜,然后在室温下洗板及封闭1 h,添加血清及标准品至96孔培养板在室温下反应1 h。然后洗板,加入二抗,在室温下孵育1 h。洗板后,加入染色液进一步反应。最后用2 M H2SO4终止反应。分别对IgG,IgE,IL-4,IL-6,IL-1β,IL-12p40,IL-10进行上机分析。
3.6. 大鼠全血淋巴细胞亚群流式检测
对大鼠全血进行裂解红细胞后通过特异荧光标记单克隆抗体对淋巴细胞进行染色,运用流式细胞仪对细胞进行亚群分析。组合如下:CD3 FITC/CD80 PE/CD8a PerCP/CD4 APC,AlexaFluor488 CD45RA/ CD80 PE/AlexaFluor647 CD161。按照说明书操作待上机分析。
3.7. 体外细胞因子释放试验
参考美国癌症研究院纳米材料表征实验室建立的方法(NCL Method ITA-10)。选取5 μg/ml纳米银作为高浓度;0.5 μg/ml纳米银作为低浓度;5 μg/ml聚苯乙烯纳米颗粒(PS-NP)作为对照组;培养液组作为空白组。按照说明书中检测步骤进行,用ELISA方法分析IL-1β、IL-12p40、IL-10、IL-6、IL-4、IgG、IgE的含量。
4. 结果
4.1. 材料表征
利用透射电子显微镜(TEM)和动态光散射(DLS)表征纳米银的颗粒形态及粒径分布。如图1(a),图1(b)所示,纳米银颗粒呈圆形,分散状态良好。图1(c)~(e)结果表明纳米银溶液在水中分散良好,粒径分布在7~45 nm,以10 nm左右为主;而在模拟胃液中粒径分布以10~25 nm为主,发生了部分团聚现象。
 (a) (b)
(a) (b)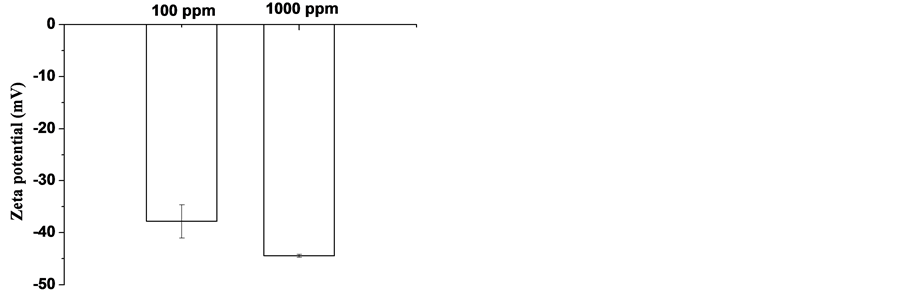
 (c) (d)
(c) (d) (e)
(e)
Figure 1. Surface character of silver nanoparticles. (a) (b) TEM figures; (c) Z-potential in water, n = 3; (d) DLS of 1000 ppm silver-NPs in water; (e) DLS of 1000ppm silver-NPs in simulated gastric juice
图1. 纳米银颗粒的表征。(a) (b)透射电镜图像;(c)在水中的Z电位,n = 3;(d) 1000 ppm纳米银溶液在水中的DLS图;(e) 1000 ppm纳米银溶液在模拟胃液中的DLS图
4.2. 动物实验
4.2.1. 一般状况、脏器系数和大体病理
整个实验过程中无大鼠死亡,活动情况、肤色、粪便排泄正常。所有实验动物组均未见明显的脏器系数改变。心脏、肝脏、胃、十二指肠、肺脏、脾脏、胸腺等脏器未见明显病变。
4.2.2. 血液及脏器组织内银含量
不同取样点的血液及脏器组织内银含量经ICP-MS方法测定,其结果如图2所示。图2(a)显示纳米银
 (a)
(a)
 (b)
(b)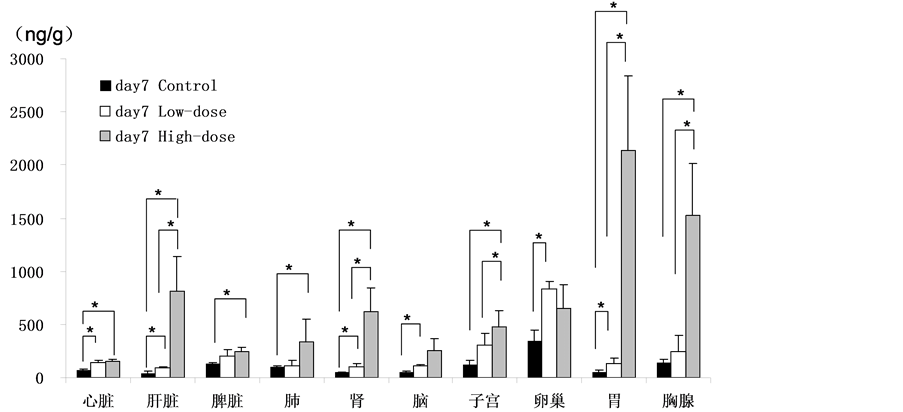 (c)
(c) (d)
(d)
Figure 2. Silver content of rats after SNPs exposure. (a) Blood (n = 3 at 1st day ; n = 6 at other timepoints); (b) Organs at 1st day (n = 3); (c) Organs at 7th day (n = 6); (d) Organs at 14th day (n = 6) (*p < 0.05)
图2. 纳米银灌胃给入后大鼠的银含量(ng/g)。(a) 血液(第一天,n = 3,其余时间点,n = 6);(b) 第一天的脏器(n = 3);(c) 第七天的脏器(n = 6);(d) 第14天的脏器(n = 6) (*p < 0.05)
灌胃单次给入和连续给入七天均可见血液中银浓度的剂量依存性显著增高。纳米银灌胃连续给入十四天的血液银浓度较空白对照组相比显著增高;而且显著高于连续给入七天血液银浓度的增高量,提示连续灌胃给入十四天出现了血液中银的蓄积。低剂量组(1 mg/kg)在纳米银经灌胃给入连续给入十四天,继而停止给入十四天后,增高了的血液银水平基本恢复到了正常水平。
纳米银灌胃单次给入(2小时)与给入第七天后脏器中银含量结果见图2(b),图2(c)。在低剂量组(1 mg/Kg),心脏、脑、胃及胸腺组织内检测到了有显著性差异的银含量,提示在本实验条件下,这些组织在低剂量经胃暴露时就会被累及。
纳米银灌胃连续给入第十四天脏器中银含量见图2(d)。在低剂量组(1 mg/Kg)和高剂量组(10 mg/Kg),所有脏器组织均检测到了显著性增加的银,提示持续暴露两周后银分布蓄积在所有脏器。
在肾、脑、子宫、卵巢及胃组织内,连续灌胃给入七天组较单次给入时银含量显著增加,提示在这些组织内可能有一定的蓄积。在高剂量组(10 mg/Kg),除脑及卵巢组织之外,其他组织内均检测到了有显著性差异的银含量,提示在本实验条件下,经灌胃给入连续七天后纳米银能够被迅速吸收,分布到大多数的脏器组织内。脾脏和胸腺组织内均显示银含量的显著性增高,而且呈现时间依存性蓄积,高度提示脾脏和胸腺组织是本研究所用纳米银的重要靶器官。在低剂量组(1 mg/Kg),连续给入第十四天和连续给入七天相比,在心脏、肺、肾、胃及胸腺组织内银含量显著性增加,提示在这些组织内引起了明显的蓄积。
4.2.3. 血常规及血液生化检测结果
血常规异常检测结果见表1。在纳米银单次灌胃给入时,高剂量组(10 mg/Kg)与对照组相比出现了明显的白细胞、淋巴细胞、单核细胞、嗜酸细胞增高和红细胞容积的减少。纳米银连续灌胃给入十四天时检测到了淋巴细胞的显著性减少和红细胞平均血红蛋白浓度的异常增高,提示纳米银持续作用于血液细胞可能引起了一定的细胞毒性,抑制了淋巴细胞的正常生长,从而使淋巴细胞显著降低。然而,纳米银连续灌胃给入七天时并未检测到上述指标的异常。而连续灌胃给入十四天时血液内银含量和单次给入相
Table 1. Abnormal hematology results for rats after oral administration (v.s control)
表1. 灌胃后大鼠血常规异常检测结果(与对照组比较)
比血液内银含量呈现蓄积性增加,因此血液内的银在低浓度时刺激炎性细胞反应性增加;而高浓度时则诱导细胞毒性,抑制了淋巴细胞的正常生长。这一结果提示,机体摄入纳米银的量不同可能会引起完全不同的毒性风险。
血液生化异常检测结果见表2。在纳米银单次灌胃给入的高剂量组和连续灌胃给入七天时的低剂量组均检测到了血糖的升高,提示胰脏可能受到了一定的影响。在纳米银单次灌胃给入和连续灌胃给入七天时的高剂量组分别检测到了磷酸酶的增高和谷草转氨酶的显著降低,提示肝脏可能受到了一定的影响。
4.2.4. 免疫学检测结果
大鼠血清免疫因子检测结果见图3,结果表明纳米银连续灌胃给入十四天时,高剂量组(与对照组相比)血清总IgG、IgE水平显著增高。纳米银连续灌胃给入七天时,高剂量组(与对照组相比)血清IL-4水平显著增高。在纳米银连续灌胃给入十四天后停止给入十四天时,高剂量组(与对照组相比)血清IL-6显著性增高,但在纳米银连续灌胃给入十四天时并没有检测到显著性增高。其在停止给入十四天后在高剂量组的高表达的原因未见相关报道。
大鼠血清IL-12p40,IL-1β检测结果在各组间没有显著性差异。所有大鼠的血清样本IL-10均在检测限以下。
4.2.5. 大鼠全血淋巴细胞亚群流式检测
如图4所示,纳米银经灌胃连续7天暴露后各淋巴细胞分型检测与对照组相比未见明显异常。纳米银连续14天暴露后高剂量组的Th细胞(CD3+CD4+) (与对照组相比)有明显的增加,但未达到显著性差异(p = 0.052)。低剂量组的B细胞(CD45RA+) (与对照组相比)有增高趋势;其它各淋巴细胞分型检测与对照组相比未见明显异常。连续14天暴露后停止暴露,继续饲养14天后,高剂量组、低剂量的组B细胞(CD45RA+) (与对照组相比)均显著增加(高剂量组p = 0.001:低剂量组p = 0.032),其它各淋巴细胞分型检测与对照组相比未见明显异常。
4.3. 体外炎症因子诱导实验结果
如图5所示,在LPS诱导条件下,低剂量和高剂量纳米银(0.5 μg/ml,5 μg/ml)均抑制了LPS诱导的IgG和IL-6的分泌;但聚苯乙烯纳米颗粒没有引起显著性的减少。这一结果提示,纳米银引起淋巴细胞在LPS诱导下的IgG分泌的抑制主要由纳米银释放的银离子的毒性引起,银纳米级颗粒可能起到了协同作用。单纯的纳米级颗粒并不会引起淋巴细胞的毒性和刺激作用。
在LPS诱导条件下,聚苯乙烯纳米颗粒显著抑制了IL-12p40的释放,而纳米银高低剂量组均未见显著性变化。这一现象可能与纳米颗粒的粒径不同有关,聚苯乙烯纳米颗粒的粒径是50~100 nm,而纳米银的
Table 2. Abnormal results of blood biochemical assessment in rats after SNPs exposure (v.s control)
表2. 纳米银暴露后大鼠血液生化异常检测结果(与对照组比较)
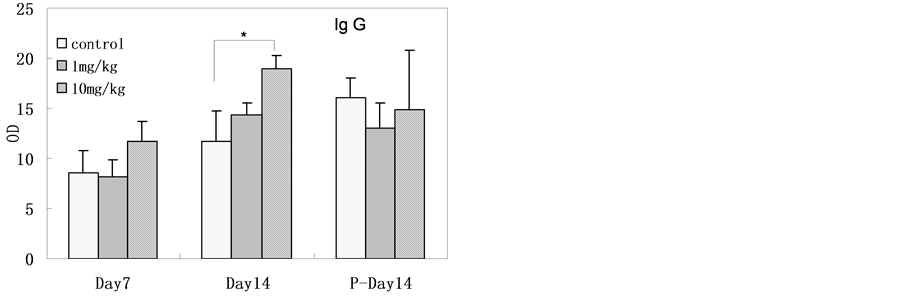
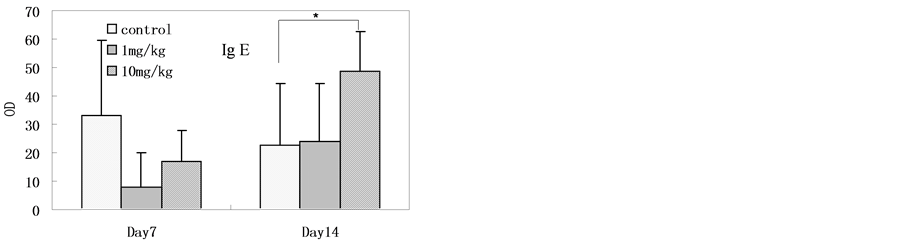
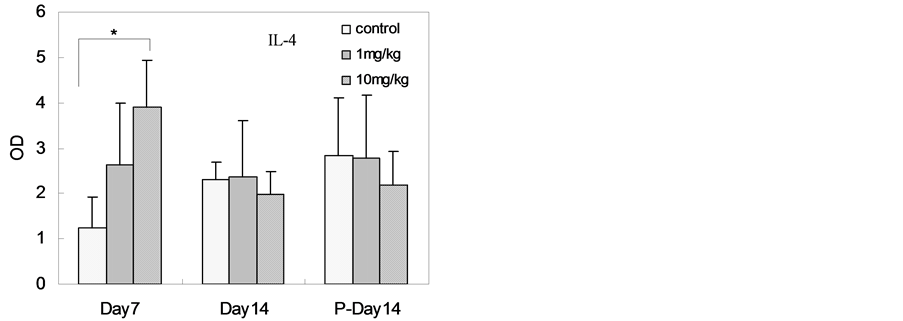

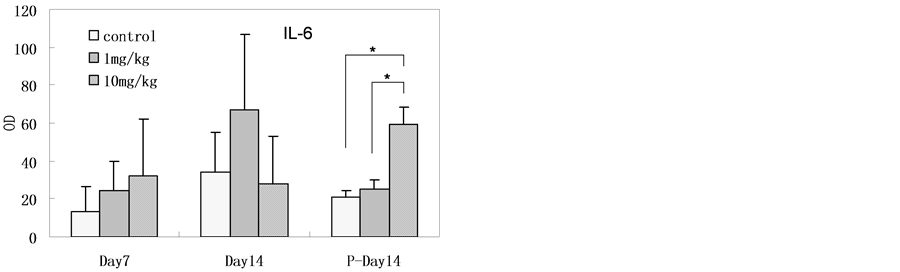
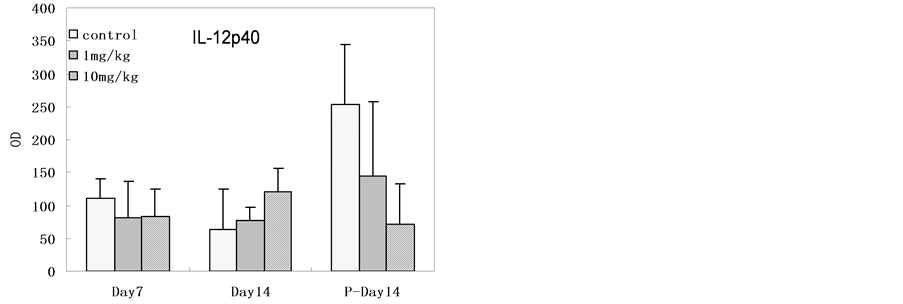
Figure 3. The serum level of immune factors in rats after SNPs exposure (The level of IL-10 was below detection limit, n = 6, *p < 0.05)
图3. 灌胃后大鼠血清样本的免疫因子测试结果(IL-10水平在检测限以下,n = 6,*p < 0.05)


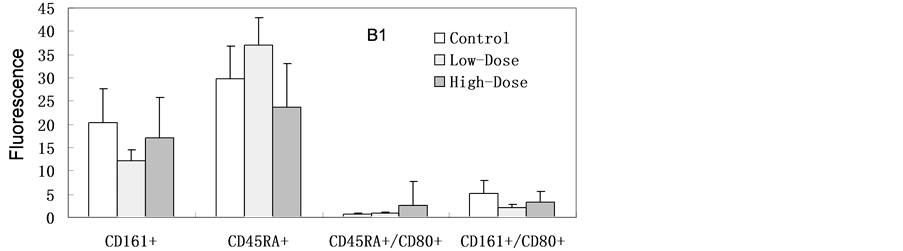
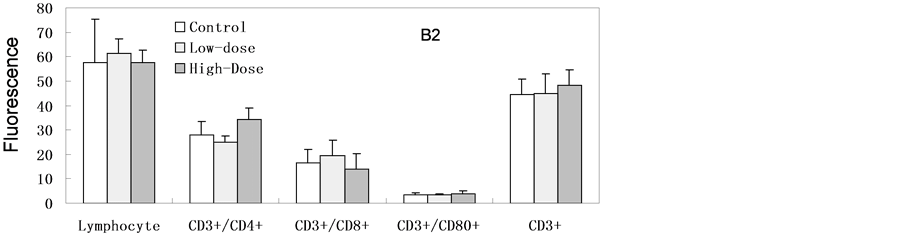
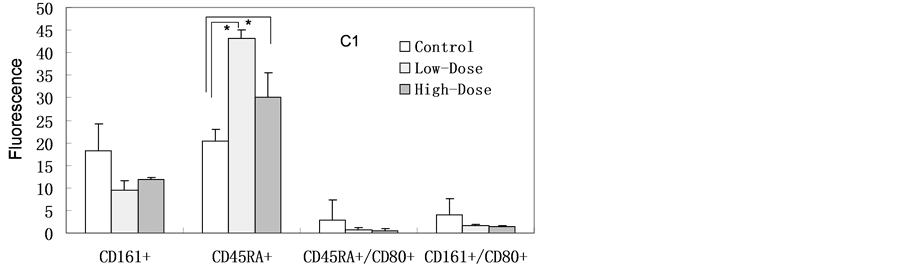

Figure 4. Lymphocyte phenotype. Blood samples harvested from experimental rats after SNPs exposure. (A1, A2) Continuous exposed for 7 days; (B1, B2) Continuous exposed for 14 days; (C1, C2) Continuous exposed for 14 days and then normally raised for 14 days (n = 6, *p < 0.05)
图4. 血液淋巴细胞分型。样本来源于灌胃后实验组大鼠。(A1, A2)连续暴露7天;(B1, B2)连续暴露14天;(C1, C2)连续暴露14天后停止暴露14天(n = 6,*p < 0.05)



Figure 5. IgG, IL-6 and IL-12p40 of lymphocytes incubated with or without lipopolysaccharide with or without SNPs exposure for 24 hours (n = 5, *p < 0.05)
图5. 在LPS (有/无)刺激下,淋巴细胞在纳米银(有/无)暴露24 h后IgG,IL-6,IL-12p40的含量(n = 5, *p < 0.05)
平均粒径为10 nm左右。IL-12p40与纳米颗粒的纳米效应是否与纳米颗粒粒径越大,越容易引起细胞的吞噬反应,从而导致IL-12p40的释放降低等有关,目前未见文献报道。其他免疫因子,如:IgE,IL-4,IL-10,IL-1β在纳米银组和对照组之间未见显著性差异。
5. 讨论
本研究除了一般的全身毒性研究之外,重点考察了动物接触纳米银后可能引起的免疫系统变化。为了选择最大给入剂量和最佳采样时间点,在预实验中考察了生物利用度和最佳采样点。预实验结果表明采用大鼠经灌胃单次纳米银溶液(10 mL/kg)作为最大暴露剂量,1 mL/kg为最小暴露剂量,选择暴露2 h为采样点进行后续研究是能够采集到最大的血液及组织中银的蓄积量(数据未显示)。
研究结果显示血液及脏器中银的含量呈现时间及剂量依存性升高,证实了纳米银经口给入后,吸收入血并分布于全身各脏器,且引起了一定的蓄积。脾脏和胸腺组织内均显示银含量的显著性增高,而且呈现时间依存性蓄积,高度提示脾脏和胸腺组织是本研究所用纳米银作用的重要靶器官。血液学检测发现高剂量组在早期引起了白细胞、淋巴细胞、单核细胞、嗜酸细胞增高,持续应用十四天后则引起了淋巴细胞的显著减少,提示了纳米银早期引起了血液细胞炎症性刺激,持续应用后则诱导血液细胞的细胞毒性,造成炎性细胞减少。血液生化检测提示有一定的胰脏和肝脏损伤。免疫学检测发现高剂量组血清总IgG、IgE水平显著增高;血清IL-4、血清IL-6水平显著增高;B细胞(CD45RA+)增加。这些结果提示在本研究的实验条件下,10 mg/kg的纳米银(平均粒径10 nm左右,血液银浓度最高达1 μg/mL)引起了以免疫毒性为主的全身毒性。然而组织病理却未显示出显著性的变化,说明单纯的大体病理学评价是不能全面有效地评价其潜在毒性风险的。
大多数有关纳米银毒理学研究的动物实验只限于以大体病理为主的一般毒性研究,较少关注免疫系统变化。我们分析纳米银无论从任何途径吸收进入体内,首先进入血液循环系统,然后分布或蓄积在各个组织。因此,血液将是纳米银进入体内接触的第一个靶器官(暴露的局部组织除外),而血液中的吞噬细胞、单核细胞、淋巴细胞将是主要的靶细胞。本课题设计时曾假定纳米银在低剂量时可能会有刺激性免疫反应,包括刺激炎症因子释放等纳米效应;而高剂量时将会引起细胞毒性,抑制细胞的生长和功能,从而抑制炎症和免疫因子的释放。然而,由于受暴露方式和生物利用度的影响,本实验设计的高剂量组对于实验动物仅引起了低度毒性作用,呈现了刺激性免疫反应。但是,这样的暴露水平(血液银浓度1 μg/mL)可能更接近人体可能遇到的暴露水平,反映了可能的风险。有文献 [25] 报告小鼠经口给入纳米银(1 mg/Kg)连续暴露14天引起了血浆TGF-β的升高和B细胞的增加;而连续28天暴露后发现淋巴细胞中B细胞和IgE增加;同时诱导了Th1型细胞因子IL-12、IFN-γ和Th2型细胞因子IL-4、IL-5、IL-10的增加,而以Th2型细胞因子增加为主,提示纳米银低剂量(1 mg/Kg)长期暴露(28天)主要引起了Th2型免疫毒性。本研究中经口给入纳米银(10 mg/Kg)连续暴露14天观察到了淋巴细胞中Th细胞、B细胞增加,IgE、IgG和IL-4显著增加,提示本研究所用的纳米银也主要引起了Th2型免疫毒性,与文献报道的毒性特点非常相近。
为了证实纳米银的毒性特征,我们进行了体外淋巴细胞刺激试验。体外试验结果显示不同浓度的纳米银均对淋巴细胞产生了毒性抑制作用,从而导致细胞因子释放减少。这个结果与Hackenberg S等人的研究 [26] 有相似之处,但也有不同点。Hackenberg S等人在研究中将不同浓度的纳米银溶液(1, 10 μg/mL)作用于骨髓间充质干细胞24 h后,发现IL-6,IL-8,VEGF等细胞因子在低浓度(1 μg /mL)时释放增加,而在高浓度(10 μg /mL)时释放减少。其结果反映了纳米银在低浓度时引起细胞炎性因子刺激性增加,而高浓度时抑制炎症因子的释放。然而,纳米颗粒的毒性强弱不但与剂量和暴露时间有关,还与粒径的大小、表面的修饰状态、表面电荷、聚散状态、材料自身的性质等密切相关。在本课题组的既往研究中发现本研究中所使用的纳米银(平均粒径10 nm左右)比购自Sigma的纳米银粉剂(粒径小于100 nm)所引起的细胞毒性强 [27] - [29] 。许多研究也认为,在相同浓度时粒径越小的颗粒可能对细胞的毒性越大 [25] [30] ,其可能的原因是较小的颗粒具有较大的比表面积,产生的ROS数量较多 [31] [32] 。本研究中所使用的纳米银颗粒平均粒径在10 nm左右,而Hackenberg S等人的研究中的纳米颗粒在46 nm左右。因此,本研究中低浓度的纳米银(0.5 μg/mL)引起了细胞毒性作用,从而引起了细胞因子释放的抑制效应,而没有呈现出对细胞释放细胞因子的刺激作用。然而,与高剂量组(5 μg/mL)之间没有呈现出剂量依存性的抑制作用,在这两个剂量组之间的量效关系尚有待于进一步研究。
本研究中在不同浓度纳米银(0.5、5 μg /mL)作用下,在LPS诱导后淋巴细胞分泌IgG和IL-6减少,提示本研究所用的纳米银在体外外周血细胞因子诱导实验中主要引起了Th2型免疫毒性。这一结果与本研究的体内试验结果以及文献报告 [26] 的体内实验结果一致。体外细胞因子诱导实验在低、高剂量组均引起了抑制性Th2型免疫毒性,这可能与本研究中所用纳米颗粒粒径较小有关 [33] ;这一点可以解释为体外实验中粒径较小的纳米银导致的细胞毒性抑制了细胞免疫因子的释放。而体内研究显示的刺激性Th2型免疫毒性则反映出消化道暴露的纳米银溶液因生物利用度低,体内低水平暴露引起了刺激性Th2型免疫毒性。据文献报道 [34] ,SiO2纳米颗粒经连续口服给入小鼠14天后引起了实验小鼠的Th1型免疫毒性;而TiO2纳米颗粒经连续口服给入小鼠6个月后,主要引起了小鼠的Th2型免疫毒性 [35] 。目前,关于不同纳米颗粒(包括元素,粒径,表面电荷,修饰等)与所引起的免疫毒性类型间的关系尚不清楚,有待积累信息,进行更系统的研究。
6. 小结
经口给入高剂量纳米银(10 mg/Kg)引起了大鼠淋巴细胞IgE、IgG与IL-4的显著增加;高、低剂量组给入纳米银14天停止给入14天后,血清IL-6水平与B细胞CD45RA+水平均显著增加。在体外不同浓度纳米银(0.5 μg/mL,5 μg/mL)作用下,LPS诱导的淋巴细胞分泌IgG和IL-6显著减少。综合体内外实验结果,表明本研究所用的纳米银主要引起了实验大鼠以Th2型免疫毒性为主的早期全身毒性。
基金项目
本课题由“东南大学生物电子学国家重点实验室开放研究基金:纳米医疗器械的免疫学研究” (2011E4)和中国食品药品检定研究院学科带头人培养基金(2012X2)资助。
文章引用
邵安良,王志杰,陈 亮,徐丽明, (2014) 纳米银诱导的以免疫毒性为主的早期全身毒性研究
Silver Nanoparticles Induced Immunotoxicity-Based Early Systemic Toxicity. 免疫学研究,04,33-47. doi: 10.12677/IS.2014.24006
参考文献 (References)
- 1. Xu, L., Shi, C., Shao, A., et al. (2014) Toxic responses in rat embryonic cells to silver nanoparticles and released silver ions as analyzed via gene expression profiles and transmission electron microscopy. Nanotoxicology, 1-10.
- 2. Xu, L., Shao, A., Zhao, Y., et al. (2014) Neurotoxicity of silver nanoparticles in rat brain after intragastric exposure. Journal of Nanoscience and Nanotechnology, 14, 1-9.
- 3. Bouwmeester, H., Poortman, J., Peters, R.J., et al. (2011) Characteri-zation of translocation of silver nanoparticles and effects on whole-genome gene expression using an in vitro intestinal epithelium coculture model. ACS Nano, 5, 4091- 5103.
- 4. Shavandi, Z., Ghazanfari, T. and Moghaddam, K.N. (2011) In vitro toxicity of silver nanoparticles on murine peritoneal macrophages. Immunopharmacology Immunotoxicology, 33, 135-140.
- 5. Beer, C., Foldbjerg, R., Hayashi, Y., et al. (2012) Toxicity of silver nanoparticles—Nanoparticle or silver ion? Toxicology Letters, 208, 286-292.
- 6. Mukherjee, S.G., O’Claonadh, N., Casey, A., et al. (2012) Comparative in vitro cytotoxicity study of silver nanoparticle on two mammalian cell lines. Toxicology in Vitro, 26, 238-251.
- 7. El Badawy, A.M., Silva, R.G., Morris, B., et al. (2011) Surface charge-dependent toxicity of silver nanoparticles. En-vironmental Science Technology, 45, 283-287.
- 8. Schäfer, B., Tentschert, J. and Luch, A. (2011) Nanosilver in consumer products and human health: More information required! Environmental Science Technology, 45, 7589-7590.
- 9. Ahamed, M., Alsalhi, M.S. and Siddiqui, M.K. (2010) Silver nanoparticle applications and human health. Clinica Chimica Acta, 411, 1841-1848.
- 10. Johnston, H.J., Hutchison, G., Christensen, F.M., et al. (2011) A review of the in vivo and in vitro toxicity of silver and gold particulates: Particle attributes and biological mechanisms responsible for the observed toxicity. Critical Reviews in Toxicology, 40, 328-346.
- 11. Sung, J.H., Ji, J.H., Song, K.S., Lee, J.H., Choi, K.H., Lee, S.H. and Yu, I.J. (2011) Acute inhalation toxicity of silver nanoparticles. Toxicology and Industrial Health, 27, 149-154.
- 12. Sung, J.H., Ji, J.H., Park, J.D., Song, M.Y., Song, K.S., Ryu, H.R., et al. (2011) Subchronic inhalation toxicity of gold nanoparticles. Particle and Fibre Toxicology, 8, 1-16.
- 13. Stebounova, L.V., Adamcakova-Dodd, A., Kim, J.S., Park, H., O’Shaughnessy, P.T., Grassian, V.H. and Thorne, P.S. (2011) Nanosilver induces minimal lung toxicity or inflammation in a subacute murine inhalation model. Particle and Fibre Toxicology, 8, 1-5.
- 14. Korani, M., Rezayat, S.M., Gilani, K., Arbabi Bidgoli, S. and Adeli, S. (2011) Acute and subchronic dermal toxicity of nanosilver in guinea pig. International Journal of Nanomedicine, 6, 855-862.
- 15. Kim, Y.S., Song, M.Y., Park, J.D., Song, K.S., Ryu, H.R., Chung, Y.H., et al. (2010) Subchronic oral toxicity of silver nanoparticles. Particle and Fibre Toxicology, 7, 1-20.
- 16. Sung, J.H., Ji, J.H., Park, J.D., Yoon, J.U., Kim, D.S., Jeon, K.S., et al. (2009) Subchronic inhalation toxicity of silver nanoparticles. Toxicolology Science, 108, 452-461.
- 17. Sung, J.H., Ji, J.H., Yoon, J.U., Kim, D.S., Song, M.Y., Jeong, J., et al. (2008) Lung function changes in Sprague-Dawley rats after prolonged inhalation exposure to silver nanoparticles. Inhalation Toxicology, 20, 567-574.
- 18. Ji, J.U., Jung, J.H., Kim, S.S., Yoon, J.U., Park, J.D., Choi, B.S., et al. (2007) Twenty-eight-day inhalation toxicity study of silver nanoparticles in Sprague-Dawley rats. Inhalation Toxicology, 19, 857-871.
- 19. Tang, J., Xiong, L., Wang, S., Wang, J., Liu, L., Li, J., et al. (2009) Distribution, translocation and accumulation of silver nanoparticles in rats. Journal of Nanoscience and Nanotechnology, 9, 4924-4932.
- 20. Fadel, T.R., Look, M., Staffier, P.A., Haller, G.L., Pfefferle, L.D., Fahmy, T.M., et al. (2010) Clustering of stimuli on single-walled carbon nanotube bundles enhances cellular activation. Langmuir, 26, 5645-5654.
- 21. Chrastina, A. and Schnitzer, J.E. (2010) Iodine-125 radiolabeling of silver nanoaprticles for in vivo SPECT imaging. International Journal of Nanomedicine, 5, 653-659.
- 22. Meng, J., Yang, M., Jia, F., Xu, Z., Kong, H., Xu, H., et al. (2011) Immune responses of BALB/c mice to subcutaneously injected multi-walled carbon nanotubes. Nanotoxicology, 5, 583-591.
- 23. Meng, J., Yang, M., Jia, F., Kong, H., Zhang, W., Wang, C., et al. (2010) Subcutaneous injection of water-soluble multi-walled carbon nanotubes in tumor-bearing mice boosts the host immune activity. Nanotechnology, 21, Article ID: 145104.
- 24. 刘焕亮, 杨丹凤, 张华山, 杨红莲, 张伟, 刘丽华, 等 (2010) 3种典型纳米材料致大鼠免疫毒性的作用. 解放军预防医学杂志, 3, 163-166.
- 25. Park, E.J., Bae, E., Yi, J., Kim, Y., Choi, K., Lee, S.H., et al. (2010) Repeated-dose toxicity and inflammatory responses in mice by oral administration of silver nanoparticle. Environmental Toxicology and Pharmacology, 30, 162- 168.
- 26. Hackenberg, S., Scherzed, A., Kessler, M., Hummel, S., Technau, A., Froelich, K., et al. (2011) Silver nanoparticles: Evaluation of DNA damage, toxicity and functional impairment in human mesenchymal stem cells. Toxicology Letters, 201, 27-33.
- 27. Xu, L.M., Takemura, T., Xu, M.S., Hanagata, N. (2011) Toxicity of silver nanoparticles as assessed by global gene expression analysis. Materials Express, 1, 74-79.
- 28. Xu, L., Li, X., Takemura, T., Hanagata, N., Wu, G. and Chou, L.L. (2012) Genotoxicity and molecular response of silver nanoparticle (NP)-based hydrogel. Journal of Nanobiotechnology, 10, 16.
- 29. Li, X., Xu, L., Shao, A., Wu, G. and Hanagata, N. (2013) Cytotoxic and genotoxic effects of silver nanoparticles on primary Syrian hamster embryo (SHE) cells. Journal of Nanoscience and Nanotechnology, 13, 161-170.
- 30. Park, M.V., Neigh, A.M., Vermeulen, J.P., de la Fonteyne, L.J., Verharen, H.W., Briedé, J.J., et al. (2011) The effect of particle size on the cytotoxicity, inflammation, developmental toxicity and genotoxicity of silver nanoparticles. Biomaterials, 32, 9810-9817.
- 31. Carlson, C., Hussain, S.M., Schrand, A.M., Braydich-Stolle, L.K., Hess, K.L., Jones, R.L. and Schlager, J.J. (2008) Unique cellular interaction of silver nanoparticles: Size-dependent generation of reactive oxygen species. The Journal of Physical Chemistry B, 112, 13608-13619.
- 32. Liu, W., Wu, Y., Wang, C., Li, H.C., Wang, T., Liao, C.Y., et al. (2010) Impact of silver nanoparticles on human cells: Effect of particle size. Nanotoxicology, 4, 319-330.
- 33. De Jong, W.H. and Borm, P.J. (2008) Drug delivery and nanoparticles: Applications and hazards. International Journal of Nanomedicine, 3, 133-149.
- 34. Kim, J.H., Kim, C.S., Ignacio, R.M., Kim, D.H., Sajo, M.E., Maeng, E.H., et al. (2014) Immunotoxicity of silicon dioxide nanoparticles with different sizes and electrostatic charge. International Journal of Nanomedicine, 9, 183-193.
- 35. Hong, J., Wang, L., Zhao, X., Yu, X., Sheng, L., Xu, B., et al. (2014) Th2 factors may be involved in TiO2 NP-induced hepatic inflammation. Journal of Agricultural and Food Chemistry, 62, 6871-6878.
