Open Journal of Natural Science
Vol.
10
No.
05
(
2022
), Article ID:
55437
,
12
pages
10.12677/OJNS.2022.105071
海藻来源的真菌天然产物研究进展
毛芬琴1,尹冰洁2,嵇艳兰1,沈小童1,刘文2,孙坤来2*
1德清县人民医院,浙江 德清
2浙江海洋大学食品与药学学院,浙江 舟山
收稿日期:2022年7月21日;录用日期:2022年8月23日;发布日期:2022年9月1日

摘要
海洋蕴含丰富的动植物和微生物资源,由于其特殊的环境(高压、高盐度、低温、低氧和寡营养等),使得生存在海洋中的动植物和微生物的代谢产物具有特异性。海洋微生物往往共附生于海洋动植物,它们之间存在着相互依赖和营养竞争等关系。因此,海洋动植物内生微生物可能会产生某些化合物去竞争营养物质,这些产物是获得先导化合物和新药前体的重要资源。本文综述了近年来,从海洋褐藻、红藻和绿藻来源真菌天然产物研究进展,以期为海洋微生物活性先导化合物的发现提供借鉴。
关键词
海洋微生物,海藻,代谢产物,先导化合物,生物活性

Research Progress on Fungalnatural Products Derived from Seaweed
Fenqin Mao1, Bingjie Yin2, Yanlan Ji1, Xiaotong Shen1, Wen Liu2, Kunlai Sun2*
1Deqing County People’s Hospital, Deqing Zhejiang
2School of Food and Pharmacy, Zhejiang Ocean University, Zhoushan Zhejiang
Received: Jul. 21st, 2022; accepted: Aug. 23rd, 2022; published: Sep. 1st, 2022

ABSTRACT
The ocean is rich in animal, plant and microorganism resources. Due to its special environment (high pressure, high salinity, low temperature, low oxygen and oligotrophic, etc.), the metabolites of animals, plants and microorganisms living in the ocean are specific. Marine microorganisms are often co-exist with marine animals and plants, and there are relationships between them, such as interdependence and nutrient competition. Therefore, endophytic microorganisms of marine plants and animals may produce compounds to compete for nutrients, and these products are important resources for obtaining lead compounds and precursors for new drugs. In this paper, the research progress on natural products of fungi derived from brown algae, red algae and green algae was reviewed in order to provide reference for the discovery of active lead compounds of marine microorganisms.
Keywords:Marine Microorganism, Algae, Metabolites, Lead Compounds, Bioactivity

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
从二十世纪六十年代以来,科研工作者们从陆地生物获得的结构新奇、活性显著天然产物的几率不断在下降,科学家们慢慢把目光投向尚未充分开发并且蕴含丰富生物资源的海洋。由于海洋具有特殊的环境(高压、高盐度、低温、低氧和寡营养等),使得海洋生物代谢出一些结构新奇的生物活性产物去竞争营养物质 [1]。从目前获得的海洋天然产物,按照化学结构分类简单分为大环内酯类、聚醚类化合物、萜类、生物碱类、肽类、甾体类和含硫大环类化合物等;按照生物活性分类简单分为抗菌素、抗肿瘤化合物、抗病毒化合物、生物毒素、酶抑制剂、免疫抑制剂等 [2]。
在1945年,Giuseppe Brotzu等人从地中海撒丁岛沿岸的污水排放口附近海水样本中分离得到一株产头孢菌素的真菌头孢霉Cephalosporium acremonium。1961年,Edward Abraham和Guy Newton从头孢霉Cephalosporium acremonium代谢产物中分离到抗菌谱广的头孢霉素C (Cephalosporin C),并确定其结构 [3]。
到1969年,瑞士科学家Borel从海洋丝状真菌Tolypocladium inflatum的培养液中分离得到环孢霉素A (cyclosporin A),1978年被FDA批准为免疫抑制药物并进行临床应用 [4]。瑞士诺华公司于1984年成功上市了环孢菌素A产品山地明,并于1995年对山地明进行剂型改造,形成了现在临床中广泛应用的新山地明 [5]。
1996年Fukumoto等人从海洋真菌焦曲霉Aspergillus ustus NSC-F038分离到的天然产物Phenylahistin,下一年Kaneo Kanoh等人阐述了Phenylahistin为对映异构体(R:S = 3:1),并确定了绝对构型,在活性测试中发现只有(−)-(S)-Phenylahistin显示出细胞毒活性和制微管聚合使细胞周期停止在G2/M期 [6]。 后续深入活性研究中,Kaneo Kanoh等人发现对以下八种肿瘤细胞系A431 (人皮肤鳞癌细胞)、A549 (人肺癌细胞)、Hela (人卵巢癌细胞)、K562 (人慢性髓系白血病细胞)、MCF7 (人乳腺癌细胞)、WiDr (人大肠癌细胞)、TE-671 (人横纹肌瘤细胞)和P388 (鼠白血病细胞)有很强的抑制作用,IC50值范围为1.8 × 10−7~3.7 × 10−6 M [7]。Yoshio Hayashi等人进一步优化Phenylahistin的生物活性以及消除手性,合成了一系列Phenylahistin的类似物,其中普那布林(Plinabulin NPI-2358)表现出很好的药物开发价值 [8]。普那布林作为抗肿瘤候选药物,目前已进入临床III期研究 [9]。
海洋真菌具有很大研究价值和产生药物先导化合物的潜力,近年来,科研工作者们不断的从海洋藻类中分离到活性真菌菌株,并产生了很多结构新奇的生物活性天然产物。以下简单综述近年来,从海洋褐藻、红藻和绿藻来源真菌天然产物研究进展。
1.1. 海洋褐藻来源真菌天然产物
2012年,Hao-Fen Sun et al.从褐藻Sargassum中分离得到一株文氏曲霉Aspergillus wentii EN-48,并在其发酵产物中分离到三个新的二萜类化合物asperolides A-C (1~3) (见图1),以及五个类似物,其中化合物1和2对各种肿瘤细胞系表现出弱活性 [10]。后续又从该菌发酵产物中得到两个新的secoanthraquinone类化合物wentiquinones A (4)和B (5) (见图1) [11]。2014年,Xin Li从Aspergillus wentii EN-48发酵物中获得一个新的secoanthraquinone类化合物wentiquinones C (6),以及一个新的苯甲酰胺衍生物7 (见图1),其中化合物7对DPPH自由基显示清除活性,IC50值为5.2 ± 0.3 μg/mL [12]。
2014年,Sherif S. Ebada et al.从两株曲霉BM-05和BM-05ML (德国赫尔戈兰岛海域的褐藻Sargassum)的共培养物中,获得了一个新的环三肽psychrophilin E (8) (见图1),化合物8对肿瘤细胞系K562,HCT116 (人结肠癌细胞),A2780 (人卵巢癌细胞)和A2780CisR (耐顺铂的人卵巢癌细胞)均显示出弱的抑制活性,IC50值范围为27.3~67.8 μM [13]。
2014年,Olesya I. Zhuravleva et al.从日本海拉祖尔纳亚湾采集的褐藻海黍子Sargassum miyabei表面分离到两株真菌Penicillium thomii KMM 4645和Penicillium lividum KMM 4663,并从它们发酵的乙酸乙酯萃取物中一共获得了七个新的6,6-spiroketals类化合物sargassopenillines A-G (9~15) (见图1),其中化合物9和10含有与6,6-螺缩酮部分稠合的芳环,这是稀有的天然化合物。化合物11具有抑制致癌核因子AP-1的转录活性,IC50值为15 μM [14]。
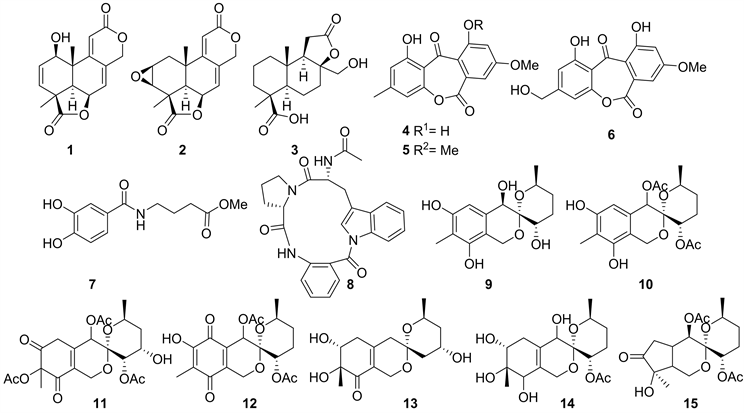
Figure 1. Structures of compound 1~15
图1. 化合物1~15的结构式
2015年,杨海滨从表面灭菌的马尾藻Sargassum sp.新鲜组织中(于2009年7月采自中国山东省烟台市沿海)分离出一株糙刺篮状菌Talaromyces CF-16,并从其发酵产物中获得一对新天然产物,即喹啉酮衍生物对映异构体19和20 (见图2),生物活性显示有弱的卤虫致死活性,LD50值分别为97.8和106.4 μg/mL [15]。
2016年,Maria P. Sobolevskaya et al.对真菌Penicillium thomii KMM 4645继续研究,获得了一个新的萜类化合物21,以及三个新的呋喃-2-羧酸的衍生物22~23 (见图2),并且化合物21对海洋软体动物Pseudocardium sachalinensis结晶茎中的endo-1,3-β-D-葡聚糖酶具有显着的抑制活性,IC50值为2 × 10−7 M [16]。
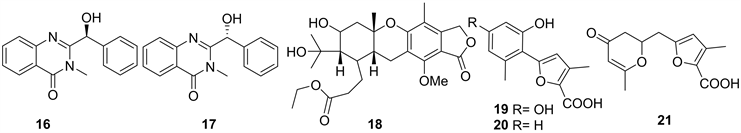
Figure 2. Structures of compound 16~21
图2. 化合物16~21的结构式
2016年,Maria P. Sobolevskaya et al.对一株青霉Penicillium thomii Maire KMM 4675 (日本海俄罗斯岛诺维克湾的褐藻Sargassum pallidum)代谢产物研究,获得了十一个新的聚酮类化合物pallidopenillines (22~32) (见图3),并对以上化合物人前列腺癌细胞系22Rv1,PC-3和LNCaP进行细胞毒活性研究,结果显示Pallidopenilline G (30)对22Rv1细胞系表现出细胞毒性,IC50值为9.8 μM,并且1-acetylpallidopenilline A (23)和30浓度分别为2和1 μM时,能够抑制40%的22Rv1细胞集落生长 [17]。
同年,该研究组从来源于越南南海海域Padina sp.褐藻的青霉KMM 4672的发酵物中,获得了三个新的环二硫代二酮哌嗪类化合物pretrichodermamides D-F (33~35),以及两个已知的环二硫代二酮哌嗪类pretrichodermamide C (36)和N-methylpretrichodermamide B (37) (见图3)。化合物33~35含有稀有的1,2-恶唑烷部分,并且33和34是相关生物碱中恶唑酮结合部分的第一个差向异构体。其中化合物37显示出对雄激素受体靶向治疗具有抗性的22Rv1人前列腺癌细胞的强细胞毒性 [18]。
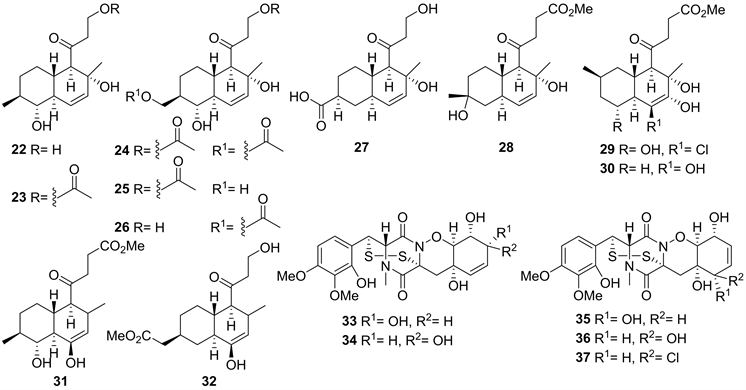
Figure 3. Structures of compound 22~37
图3. 化合物22~37的结构式
2018年,Yin-Ping Song et al.从中分离到一株丛梗饱科真菌Trichoderma asperellum cf44-2 (与2010年采集自中国舟山群岛(N30˚01'20'',E122˚05'14'')的褐藻Sargassum sp.组织),并从菌株发酵产物中获得了三个新的没药烷衍生物trichaspin (38),trichaspsides A (39) 和B (40),以及三个新的cyclonerane sesquiterpenes 9-cycloneren-3,7,11-triol (41),11-cycloneren-3,7,10-triol (42)和7,10-epoxycycloneran-3,11,12-triol (43),以及一个harziane二萜11-hydroxy-9-harzien-3-one (44) (见图4)。其中化合物38是具有乙基化没药烷新骨架,39和40分别代表没药烷和去没药烷倍半萜的第一个氨基糖苷。生物活性显示,化合物39、40、43和44对五种水产致病菌(Vibrio parahaemolyticus, V. anguillarum, V. harveyi, V. splendidus, and Pseudoalteromonas citrea)有弱的抑制活性,39和40能够抑菌可能与其取代的氨基糖苷有关 [19]。
Yin-Ping Song et al.还从T. asperellum cf44-2的发酵物中获得一个高度转化麦角固醇衍生物Tricholumin A (45) (见图4),并发现45能抑制四种浮游植物(Chattonella marina, Heterosigma akashiwo, Karlodinium veneficum和Prorocentrum donghaiense),其IC50值分别为0.56、0.37、0.59和0.27 μg/mL。并且对三株水产致病菌V. harveyi,V. splendidus和Pseudoalteromonas citre有弱的抑菌活性;对农业致病真菌Glomerella cingulata也有抑制作用,其MIC值为12 μg/mL [20]。
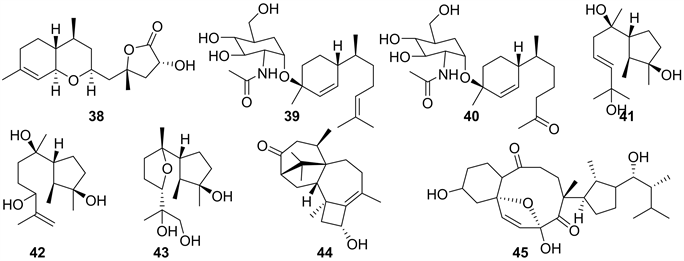
Figure 4. Structures of compound 38~45
图4. 化合物38~45的结构式
1.2. 海洋红藻来源真菌天然产物
2012年,RanRan Sun et al.从真菌菌株Aspergillus wentii pt-1 (于2010年5月从中国平潭岛海岸采集的表面灭菌海洋红藻G. flabelliformis的新鲜组织中分离)的次级代谢产物中获得了三个新的氧杂蒽酮类化合物yicathin A-C (46~48) (见图5)。化合物47显示对大肠杆菌有抑制活性,抑菌圈直径为9 mm (10 μg/disk),48对大肠杆菌,金黄色葡萄球菌,炭疽菌也有抑制作用,抑菌圈直径分别为12、7.5、11 mm (10 μg/disk)。并且,化合物46~48对盐水虾致死有弱的活性,IC50值分别为0.20、0.22和0.30 μM [21]。
2014年,Peng Zhang et al.从真菌菌株Paecilomyces variotii EN-291 (2013年从中国山东省青岛海岸采集的红藻Grateloupia turuturu中分离)代谢产物中,获得了一个新颖的含3H-氧杂环庚烷的生物碱,即varioxepine A (49) (见图5),其结构是前所未有地缩合3,6,8-三氧杂双环[3.2.1]辛烷基,并且49对植物病原真菌禾谷镰刀菌有抑制作用,其MIC值为4 μg/mL [22]。接着在2015年,该研究者从Paecilomyces variotii EN-291的发酵产物中分离到两个新的含氧杂环庚烷的二酮哌嗪类生物碱,varioloids A (50)和B (51) (见图5),并且51和52能够抑制植物病原真菌禾谷镰刀菌,MIC值分别为8和4 μg/mL [23]。
2015年,War War May Zin et al.从真菌Neosartorya takakii KUFC 7898 (采集自泰国Samaesarn岛海洋红藻Amphiroa sp.)代谢产物中获得三个新化合物,meroditerpene sartorenol (52),新天然产物takakiamide (53)和tryptoquivaline U (54) (见图5) [24]。
同年,王佳宁从中国山东省烟台市采集的松节藻中分离到真菌Penicillium crustosum EN-311,并从菌株的PDB培养代谢产物中纯化鉴定了八个混源萜类化合物,包括三个新化合物55~57 (见图5),生物活性结果显示化合物55和56具有显著的卤虫致死活性,LD50值分别为1.98和1.56 μg/mL [25]。
在2016年,Peng Zhang et al.还从Paecilomyces variotii EN-291的发酵产物中分离鉴定了两个新的生物碱,varioloid C (58) 和D (59) (见图5),对58和59进行细胞毒活性研究,结果表明化合物对58和59对A549、HCT116和HepG2细胞系具有细胞毒活性,IC50值范围为2.6~8.2 μg/mL [26] [27]。
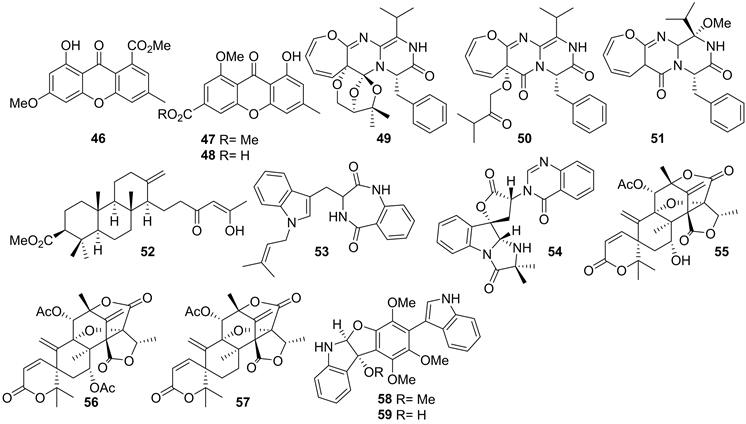
Figure 5. Structures of compound 46~59
图5. 化合物46~59的结构式
2018年,Zhen-Zhen Shi et al.从海洋红藻Gracilaria vermiculophylla组织中分离出一株真菌Trichoderma virens Y13-3,通过发酵后从萃取物中获得三个新骨架的聚酮类化合物trichorenins A-C (60~62) (见图6),活性研究发现化合物60~62分别能够有效地抑制浮游植物Chattonella marina和Karlodinium veneficum,其IC50值分别为0.41、0.56、0.41 μg/mL和1.0、0.87、0.69 μg/mL [28]。同年,Zhen-Zhen Shi et al.还从Trichoderma virens Y13-3发酵物中分离出八个新的胡萝卜烷型倍半萜trichocarotins A-H (63~70)和一个新的杜松烷型倍半萜trichocadinin A (71) (见图6),63~70的发现极大地增加了真菌来源胡萝卜烷型倍半萜分子多样性,并且之前从未在真菌Trichoderma sp.中发现杜松烷型骨架,抗海洋浮游生物活性结果显示,化合物65~67、69对四种海洋浮游植物(Chattonella marina, Heterosigma akashiwo, Karlodinium veneficum, Prorocentrum donghaiense)有明显抑制作用,IC50值范围在0.24~7.6 μg/mL之间,化合物70对Artemia salina有弱抑制作用,半数致死浓度(Median lethal concentration, LC50)值为21 μg/mL [29]。
2018年,Dan Chen et al.从未鉴定的海洋红藻组织(采集自中国山东省青岛)中分离出一株真菌Acremonium vitellinum,并且从真菌的代谢产物中获得了三个氯霉素衍生物72~74 (见图6),其中73被报道为新天然产物,在抗棉铃虫Helicoverpa armigera (Hübner) (Lepidoptera: Noctuidae)上表现出强的杀虫性,LC50分别为0.93 ± 0.05、0.56 ± 0.03和0.91 ± 0.06 mg/mL。研究者还对化合物73的杀虫活性深入了研究73对棉铃虫解毒和保护酶(谷胱甘肽S-转移酶、过氧化氢酶)活性的影响,以及对棉铃虫总抗氧化能力(T-AOC)的影响。并通过筛选棉铃虫基因序列,鉴定了许多与杀虫剂靶标和解毒代谢相关的基因。通过使用GO和KEGG数据库对这些差异表达基因的功能预测,发现73显著影响代谢过程,生物过程和催化活性过程 [30]。

Figure 6. Structures of compound 60~74
图6. 化合物60~74的结构式
2018年Sui-Qun Yang et al.从菌株Aspergillus alabamensis EN-547 (于2016年6月采自青岛二浴礁石区的一株日本仙菜Ceramium japonicum)中分离鉴定了两个新的二酮吗啉类衍生物4-epi-seco-shornephine Amethylester (75)和4-epi-seco-shornephine A carboxylic acid (76),一个新的高度共轭麦角甾酮类化合物(77) (见图7),抑菌结果显示75~77对Escherichia coli、Micrococcus luteus、Edwardsiella ictaluri和Vibrio alginolyticus有弱的抑制作用,MIC值范围为16~64 µg/mL [31]。
同年,Sui-Qun Yang et al.从聚多曲霉Aspergillus sydowii EN-534和桔青霉Penicillium citrinum EN-535 (中国山东省青岛市海域采集的一株凹顶藻Laurencia okamurai样品中分离得到的两株内生真菌)大米固体培养基共培养物中分离鉴定了十个桔霉素类衍生物,其中包括两个新的化合物seco-penicitrinol A (78)和penicitrinol L (79) (见图7),生物活性结果显示化合物78和79对E. ictaluri 和V. alginolyticus有弱的抑制活性;78和79有弱的流感神经氨酸酶抑制活性,IC50值分别为24.7和41.5 nM [32]。

Figure 7. Structures of compound 75~79
图7. 化合物75~79的结构式
1.3. 海洋绿藻来源真菌天然产物
2006年,Ana Kralj et al.从真菌Emericella nidulans var. acristata (来源于地中海撒丁岛采集的海洋绿藻)代谢产物中获得两个新化合物arugosins G (80)和H (81) (见图8) [33]。同年,Anja Krick et al.从来源于西班牙特内里费岛的海洋绿藻内生真菌Monodictys putredinis的代谢产物中,获得了四个新的氧杂蒽酮Monodictysin A-C (82~84),Monodictyxanthone (85),以及一个新的二苯甲酮Monodictyphenone (86) (见图8),活性研究结果显示化合物83具有抑制细胞色素P450 1A活性,IC50值为3.0 μM,化合物83和84作为NAD(P)H:醌还原酶(QR)的诱导物,在小鼠Hepa lclc7细胞中显示出中等活性,CD值(使醌还原酶活性加倍所需的浓度)分别为12.0和12.8 μM [34]。
2007年,Dong-Chan Oh et al.从采集自巴布亚新几内亚的马当湾海藻Halimeda sp.中分离两株菌(海洋真菌Emericella sp.和海洋放线菌Salinispora arenicola),并从两者的共培养发酵物中获得两个新的环状缩酚酸肽emericellamides A (87)和B (88) (见图8)。活性研究表明,化合物87和88对耐甲氧西林金黄色葡萄球菌显示出抗菌活性,MIC值分别为3.8和6.0 μM [35]。
2013年,Nai-Yun Ji et al.从真菌Aspergillus versicolor dl-29 (来源于海洋绿藻Codium fragile)的发酵产物中,获得了一个新颖的含氨基甲酸酯和氰基的生物碱89 (见图8),抗海洋浮藻活性结果显示,化合物89对海洋浮游植物Heterosigma akashiwo有抑制作用,24 h和96 h下的EC50值分别为6.3和3.4 μg/mL [36]。
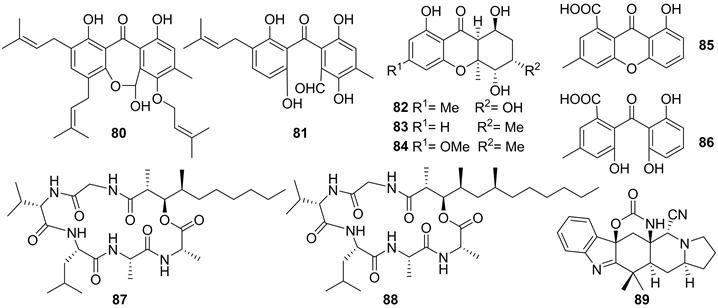
Figure 8. Structures of compound 80~89
图8. 化合物80~89的结构式
2014年,孙坤来对真菌Aspergillus terreus OUCMDZ-2739 (中国山东省青岛市石老人海滩的海洋绿藻Enteromorpha prolifera新鲜组织)次级代谢产物进行表观遗传修饰研究。在相同条件下通过HPLC显示,添加组蛋白去乙酰化酶抑制剂trichostatin A (TSA)的发酵物中化合物变得丰富,生物活性显示抗MCF-7和K562肿瘤细胞系活性增加,并从添加了10 µM的表观遗传修饰剂的菌株发酵产物中获得九个新的化合物90~98,以及两个已知的呋喃二酮类化合物99和100 (见图9) [37]。其中新化合物95显示出较强的α-糖苷酶抑制活性,IC50值为24.8 μM。已知化合物99显示出强的α-糖苷酶抑制活性,进一步研究了酶动力学,结果表明它是一种反竞争性α-葡萄糖苷酶抑制剂,Ki值为1.42 μM。抗肿瘤活性显示96对K562细胞系表现出抑制作用,IC50为9.5 μM。已知化合物100对MCF-7和K562肿瘤细胞系均有抑制作用,IC50值分别为10.1和13.0 μM [38] [39]。
该研究者还对另一株真菌Penicillium sp. OUCMDZ-770 (中国山东省青岛市石汇泉湾的海洋绿藻Enteromorpha prolifera新鲜组织)的次级代谢产物进行表观遗传修饰研究,从不添加修饰剂的发酵物中分离鉴定了两个新化合物101和102 (见图9),以及六个已知的二酮哌嗪类化合物,从添加组蛋白去乙酰化酶抑制剂丙戊酸钠(VPA)调节后的发酵物中分离到一个新的二酮哌嗪衍生物103 (见图9) [37]。
2015年,Xin Li et al.从真菌Penicillium oxalicum EN-290 (中国山东省青岛市海岸采集的海洋绿藻Codium fragile)的次级代谢产物中分离到两个新化合物,一个酚醛酰胺methyl (Z)-3-(3,4-dihydroxyphenyl)-2-formamidoacrylate (104)和一个杂萜15-hydroxydecaturin A (105) (见图9),其中化合物104显示出对金黄色葡萄球菌的有效活性,MIC值为2.0 μg/mL,强于阳性对照(氯霉素,MIC值为4.0 μg/mL) [40]。
2015年,陈正波从未鉴定种属真菌OUCMDZ-3416 (中国山东省青岛市栈桥海水浴场(E120˚18'56.982'', N36˚03'56.42.659'')的浒苔样品的大米发酵产物中,分离鉴定了六个聚酮来源化合物,包括三个新化合物106~108 (见图9),其中两个为二聚体107和108,并且两者的平面结构是一样的,但未确定化合物的绝对构型 [41]。
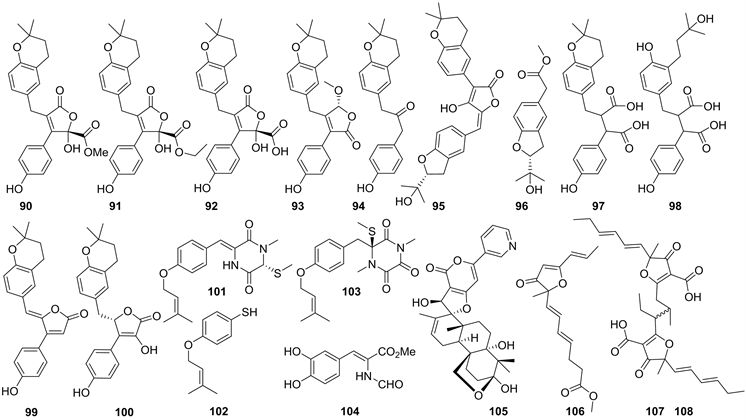
Figure 9. Structures of compound 90~108
图9. 化合物90~108的结构式
2. 总结与展望
近十年来,海洋海藻来源微生物代谢产物的研究依然得到了很多研究学者的关注。国内外众多研究者不断从海藻来源微生物中获得了很多结构新颖和活性良好的化合物,这些化合物具有化学结构和生物活性多样性,它们的发现不仅仅是丰富了天然产物库,还是发现先导化合物重要来源,更是研制新药的不可缺少的一步。以上证实了海藻来源微生物是具有开发新药的潜力,是具有很大地科研价值。
海藻来源微生物可能因环境条件的差异,在现有的常规实验条件下不表达出丰富的产物或者是不表达产物。如何从细胞分子水平去调控这些微生物的生物合成途径,对于现在的科研条件来说是不小的挑战。期望在往后的科学研究中能有所突破,能为人类做出更多贡献。
基金项目
本文由德清县农业与社会发展科技计划项目(No. 2021SK10),浙江省大学生科技创新活动计划(No. 2021R411035)资助。
文章引用
毛芬琴,尹冰洁,嵇艳兰,沈小童,刘 文,孙坤来. 海藻来源的真菌天然产物研究进展
Research Progress on Fungalnatural Products Derived from Seaweed[J]. 自然科学, 2022, 10(05): 593-604. https://doi.org/10.12677/OJNS.2022.105071
参考文献
- 1. 时振振. 五株海藻附生真菌次生代谢产物化学结构与生物活性研究[D]: [博士学位论文]. 烟台: 中国科学院烟台海岸带研究所, 2018.
- 2. 史清文, 李力更, 王于方, 等. 海洋天然产物化学研究新进展[J]. 药学学报, 2010, 45(10): 1212-1223.
- 3. 朱伟明, 王俊锋. 海洋真菌生物活性物质研究之管见[J]. 菌物学报, 2011, 30(2): 218-228.
- 4. Lawen, A., Traber, R., Geyl, D., et al. (1989) Cell-Free Biosynthesis of New Cyclosporins. The Journal of Antibiotics, 42, 1283-1289. https://doi.org/10.7164/antibiotics.42.1283
- 5. 刘阳, 肖庚富. 环孢菌素A的研究进展及应用[J]. 生物技术通报, 2006(2): 21-24.
- 6. Kanoh, K., Kohno, S., Asari, T., et al. (1997) (−)-Phenylahistin: A New Mammalian Cell Cycle Inhibitor Produced by Aspergillus ustus. Bioorganic & Medicinal Chemistry Letter, 7, 2847-2852. https://doi.org/10.1016/S0960-894X(97)10104-4
- 7. Kanoh, K., Kohno, S., Katada, J., et al. (1999) Antitumor Activity of Phenylahistin in Vitro and in Vivo. Bioorganic & Medicinal Chemistry Letter, 63, 1130-1133. https://doi.org/10.1271/bbb.63.1130
- 8. Nicholson, B., Lloyd, K., Miller, B., et al. (2006) NPI-2358 Is a Tubu-lin-Depolymerizing Agent: In-Vitro Evidence for Activity as a Tumor Vascular-Disrupting Agent. Anti-Cancer Drugs, 17, 25-31. https://doi.org/10.1097/01.cad.0000182745.01612.8a
- 9. 孙天文, 丁忠鹏, 王世潇, 等. 海洋抗肿瘤候选药物普那布林(plinabulin)及其类似物的研究进展[J]. 中国海洋药物, 2016, 35(4): 79-86.
- 10. Sun, H.-F., Li, X.-M., Meng, L.-H., et al. (2012) Asperolides A-C, Tetranorlabdane Diterpenoids from the Marine Alga-Derived Endophytic Fungus Aspergillus wentii EN-48. Journal of Natural Products, 75, 148-152. https://doi.org/10.1021/np2006742
- 11. Sun, H.-F., Li, X.-M., Meng, L.-H., et al. (2013) Two New Secoanthra-quinone Derivatives from the Marine-Derived Endophytic Fungus Aspergillus wentii EN-48. Helvetica Chimica Acta, 96, 458-462. https://doi.org/10.1002/hlca.201200201
- 12. Li, X., Li, X.-M., Xu, G.-M., et al. (2014) Antioxidant Metabolites from Marine Alga-Derived Fungus Aspergillus wentii EN-48. Phytochemistry Letters, 7, 120-123. https://doi.org/10.1016/j.phytol.2013.11.008
- 13. Ebada, S., Fischer, T., Hamacher, A., et al. (2014) A New Cy-clotripeptide, from Co-Fermentation of Two Marine Alga-Derived Fungi of the Genus Aspergillus. Natural Product Re-search, 28, 776-781. https://doi.org/10.1080/14786419.2014.880911
- 14. Zhuravleva, O., Sobolevskaya, M., Afiyatullov, S., et al. (2014) Sargassopenillines A-G, 6,6-Spiroketals from the Alga-Derived Fungi Penicillium thomii and Penicillium lividum. Marine Drugs, 12, 5930-5943. https://doi.org/10.3390/md12125930
- 15. 杨海滨. 两株海藻内生真菌次级代谢产物及其生物活性的研究[D]: [硕士学位论文]. 青岛: 青岛科技大学, 2015.
- 16. Sobolevskaya, M., Zhuravleva, O., Leshchenko, E., et al. (2016) New Metabolites from the Alga-Derived Fungi Penicillium thomii Maire and Penicillium lividum Westling. Phytochemis-try Letters, 15, 7-12. https://doi.org/10.1016/j.phytol.2015.10.016
- 17. Sobolevskaya, M., Leshchenko, E., Hoai, T., et al. (2016) Pal-lidopenillines: Polyketides from the Alga-Derived Fungus Penicillium thomii Maire KMM 4675. Journal of Natural Products, 79, 3031-3038. https://doi.org/10.1021/acs.jnatprod.6b00624
- 18. Yurchenko, A., Smetanina, O., Ivanets, E., et al. (2016) Pretrichodermamides D-F from a Marine Algicolous Fungus Penicillium sp. KMM 4672. Marine Drugs, 14, 122-140. https://doi.org/10.3390/md14070122
- 19. Song, Y.-P., Liu, X.-H., Shi, Z.-Z., et al. (2018) Bisabolane, Cy-clonerane, and Harziane Derivatives from the Marine- Alga-Endophytic Fungus Trichoderma asperellum cf44-2. Phyto-chemistry, 152, 45-52. https://doi.org/10.1016/j.phytochem.2018.04.017
- 20. Song, Y.-P., Shi, Z.-Z., Miao, F.-P., et al. (2018) Tricho-lumin A, a Highly Transformed Ergosterol Derivative from the Alga-Endophytic Fungus Trichoderma asperellum. Or-ganic Letters, 20, 6306-6309. https://doi.org/10.1021/acs.orglett.8b02821
- 21. Sun, R.-R., Miao, F.-P., Zhang, J., et al. (2013) Three New Xan-thone Derivatives from an Algicolous Isolate of Aspergillus wentii. Magnetic Resonance in Chemistry, 51, 65-68. https://doi.org/10.1002/mrc.3903
- 22. Zhang, P., Mándi, A., Li, X.M., et al. (2014) Varioxepine A, a 3H-Oxepine-Containing Alkaloid with a New Oxa-Cage from the Marine Algal-Derived Endophytic Fungus Paecilomy-ces variotii. Organic Letters, 16, 4834-4837. https://doi.org/10.1021/ol502329k
- 23. Zhang, P., Li, X.-M., Wang, J.-N., et al. (2015) Oxepine-Containing Diketopiperazine Alkaloids from the Algal-De- rived Endophytic Fungus Paecilomyces variotii EN-291. Helvetica Chimica Acta, 98, 800-804. https://doi.org/10.1002/hlca.201400328
- 24. May Zin, W.-W., Buttachon, S., Buaruang, J., et al. (2015) A New Meroditerpene and a New Tryptoquivaline Analog from the Algicolous Fungus Neosartorya takakii KUFC 7898. Ma-rine Drugs, 13, 3776-3790. https://doi.org/10.3390/md13063776
- 25. 王佳宁. 海藻内生真菌杂色曲霉EN-298和皮落青霉EN-311化学成分研究[D]: [硕士学位论文]. 青岛: 中国科学院海洋研究所, 2015.
- 26. Zhang, P., Li, X.-M., Mao, X.-X., et al. (2016) Varioloid A, a New Indolyl-6,10b-dihydro-5aH-benzo-furo[2,3- b]indole Derivative from the Marine Al-ga-Derived Endophytic Fungus Paecilomyces variotii EN-291. Beilstein Journal of Organic Chemistry, 12, 2012-2018. https://doi.org/10.3762/bjoc.12.188
- 27. Zhang, P., Li, X.-M., Mao, X.-X., et al. (2018) Correction: Varioloid A, a New Indolyl-6,10b-dihydro-5aH-benzo- furo[2,3-b]indole Derivative from the Marine Alga-Derived Endophytic Fungus Paecilomyces variotii EN-291. Beilstein Journal of Organic Chemistry, 14, 2394-2395. https://doi.org/10.3762/bjoc.14.215
- 28. Shi, Z.-Z., Miao, F.-P., Fang, S.-T., et al. (2018) Trichorenins A-C, Algi-cidal Tetracyclic Metabolites from the Marine-Alga-Epiphytic Fungus Trichoderma virens Y13-3. Journal of Natural Products, 81, 1121-1124. https://doi.org/10.1021/acs.jnatprod.8b00164
- 29. Shi, Z.-Z., Miao, F.-P., Fang, S.-T., et al. (2018) Trichocarotins A-H and Trichocadinin A, Nine Sesquiterpenes from the Marine-Alga-Epiphytic Fungus Trichoderma virens. Bioor-ganic Chemistry, 81, 319-325. https://doi.org/10.1016/j.bioorg.2018.08.027
- 30. Chen, D., Zhang, P., Liu, T., et al. (2018) Insecticidal Activities of Chloramphenicol Derivatives Isolated from a Marine Alga-Derived Endophytic Fungus, Acremonium vitellinum, against the Cotton Bollworm, Helicoverpa armigera (Hübner) (Lepidoptera: Noctuidae). Molecules, 23, 2995-3009. https://doi.org/10.3390/molecules23112995
- 31. Yang, S.-Q., Li, X.-M., Li, X., et al. (2018) Two New Diketo-morpholine Derivatives and a New Highly Conjugated Ergostane-Type Steroid from the Marine Algal-Derived Endo-phytic Fungus Aspergillus alabamensis EN-547. Marine Drugs, 16, 114-122. https://doi.org/10.3390/md16040114
- 32. Yang, S.-Q., Li, X.-M., Li, X., et al. (2018) New Citrinin Analogues Produced by Coculture of the Marine Algal-De- rived Endophytic Fungal Strains Aspergillus sydowii EN-534 and Peni-cillium citrinum EN-535. Phytochemistry Letters, 25, 191-195. https://doi.org/10.1016/j.phytol.2018.04.023
- 33. Kralj, A., Kehraus, S., Krick, A., et al. (2006) Arugosins G and H: Prenylated Polyketides from the Marine-Derived Fungus Emericella nidulans var. acristata. Journal of Natural Products, 69, 995-1000. https://doi.org/10.1021/np050454f
- 34. Krick, A., Kehraus, S., Gerhäuser, C., et al. (2007) Potential Cancer Chemopreventive in Vitro Activities of Monomeric Xanthone Derivatives from the Marine Algicolous Fungus Mo-nodictys putredinis. Journal of Natural Products, 70, 353-360. https://doi.org/10.1021/np060505o
- 35. Oh, D.-C., Kauffman, C., Jensen, P., et al. (2007) Induced Production of Emericellamides A and B from the Marine-Derived Fungus Emericella sp. in Competing Co-Culture. Journal of Natural Products, 70, 515-520. https://doi.org/10.1021/np060381f
- 36. Ji, N.-Y., Liu, X.-H., Miao, F.-P., et al. (2013) Aspeverin, a New Alkaloid from an Algicolous Strain of Aspergillus versicolor. Organic Letters, 15, 2327-2329. https://doi.org/10.1021/ol4009624
- 37. 孙坤来. 表观遗传修饰增加两株浒苔真菌的化学多样性研究[D]: [博士学位论文]. 青岛: 中国海洋大学, 2014.
- 38. Sun, K., Zhu, G., Hao, J., et al. (2018) Chemical-Epigenetic Method to Enhance the Chemodiversity of the Marine Algicolous Fungus, Aspergillus terreus OUCMDZ-2739. Tetrahedron, 74, 83-87. https://doi.org/10.1016/j.tet.2017.11.039
- 39. Sun, K., Zhu, G., Hao, J., et al. (2018) Corrigendum to “Chemi-cal-Epigenetic Method to Enhance the Chemodiversity of the Marine Algicolous Fungus, Aspergillus terreus OUCMDZ-2739”. Tetrahedron, 74, 6465-6466. https://doi.org/10.1016/j.tet.2018.09.018
- 40. Li, X., Li, X.-M., Zhang, P., et al. (2015) A New Phenolic Enamide and a New Meroterpenoid from Marine Alga-Derived Endophytic Fungus Penicillium oxalicum EN-290. Journal of Asian Natural Products Research, 17, 1204-1212. https://doi.org/10.1080/10286020.2015.1117454
- 41. 陈正波. 两株浒苔来源微生物的次生代谢产物研究[D]: [硕士学位论文]. 青岛: 中国海洋大学, 2015.
NOTES
*通讯作者。