Journal of Organic Chemistry Research
Vol.
08
No.
04
(
2020
), Article ID:
41189
,
7
pages
10.12677/JOCR.2020.84004
川芎嗪衍生物合成及抗血小板聚集活性研究
江 娟1*#,丁 锐1*,李 杰2,邹远军1,郑一敏3
1成都与康科技有限公司,四川 成都
2西南药业股份有限公司,重庆
3重庆理工大学药学与生物工程学院,重庆
收稿日期:2021年2月17日;录用日期:2021年3月3日;发布日期:2021年3月25日

摘要
本文基于药物设计的生物电子等排和拼合原理,设计、合成了一系列川芎嗪类衍生化合物A~H,以期得到活性较强的抗血小板聚集药物。结果表明,目标化合物对二磷酸腺苷(ADP)和花生四烯酸(AA)诱导的血小板聚集均显示不同程度的抑制;其中化合物H活性最强,对ADP诱导的血小板聚集的抑制作用(IC50 = 8.52 μmol/L)是川芎嗪的5.2倍,对AA诱导的血小板聚集的抑制作用(IC50 = 12.08 μmol/L)是川芎嗪的3.9倍,是具有良好开发前景的候选化合物。
关键词
川芎嗪,衍生物,合成,抗血小板聚集
Synthesis and Anti-Platelet Aggregation Activity Evaluation of Ligustrazine Derivatives
Juan Jiang1*#, Rui Ding1*, Jie Li2, Yuanjun Zou1, Yimin Zheng3
1Chengdu Yukang Science and Technology Co. Ltd., Chengdu Sichuan
2Southwest Pharmaceutical Co. Ltd., Chongqing
3College of Pharmacy and Bioengineering, Chongqing University of Technology, Chongqing
Received: Feb. 17th, 2021; accepted: Mar. 3rd, 2021; published: Mar. 25th, 2021

ABSTRACT
In order to search for new anti-platelet agents with higher potency, a series of Ligustrazine derivatives were synthesized and evaluated based on the principle of bioisostere and hybridization. They exerted inhibitory activity against adenosine diphosphate (ADP)-induced and arachidonic acid (AA)-induced platelet aggregation to varied extent. Among them, compound H was the most potent with IC50 of 8.52 μmol/L on ADP-induced platelet aggregation (5.2 folds of TMP) and 12.08 μmol/L on AA-induced platelet aggregation (3.9 folds of TMP), which may be utilized as lead compound for further investigation.
Keywords:Ligustrazine, Derivative, Synthesis, Anti-Platelet Aggregation Activity

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
随着人们生活水平的不断提高,心脑血管类疾病己成为人类发病和死亡的最主要原因之一 [1]。研究表明,导致心脑血管疾病的重要因素之一是血栓的形成 [2]。因此,防止血栓形成已成为防治心脑血管疾病的有效措施。
我国中医药资源丰富,其有效成分多种多样,是先导化合物的重要来源之一。因此,从传统中药中筛选具有抑制血小板聚集作用的有效成分作为先导物进行药物设计、合成,从中筛选出疗效好、副作用小的治疗血栓栓塞性疾病药物具有重要的理论意义和临床应用价值。传统中药川芎的有效成份川芎嗪(TMP) [3] 具有抑制血小板聚集、抗血栓等作用 [4] - [9],但川芎嗪脂溶性差、代谢快、半衰期短,为保持有效的药物治疗浓度,临床上须频繁给药,故易导致积蓄中毒 [10],使其应用受到一定限制。
现代药物研究中,药物设计具有非常重要的作用,从活性化合物的随机筛选到药物合理设计,发挥了广阔的应用价值。拼合原理(Combination principles)是指将两个化合物通过共价键拼合成一个分子,新形成的分子或兼具两者的性质,强化药理作用,减小各自相应的毒副作用;或使两者取长补短,发挥各自的药理活性,协同地完成治疗过程。前药是一类通过结构修饰将原来药物分子中的活性基团封闭起来而导致本身没有活性,但在体内可代谢成为具有生物活性的药物,具有克服原药稳定性差,提高生物利用度等优点。本文依据药物拼合原理及前药原理,对川芎嗪结构进行了改造,设计、合成了8种川芎嗪衍生物,合成路线见图1,希望能够合成出高活性的抗血小板聚集的化合物,为后期研究做准备。
2. 材料与方法
2.1. 主要仪器
Varian Mercury-400型核磁共振仪(美国Varian公司);UPLC-QTOF型高分辨质谱(美国沃特世公司);ZF-7C型三用紫外分析仪(上海慧鑫科学仪器有限公司)。
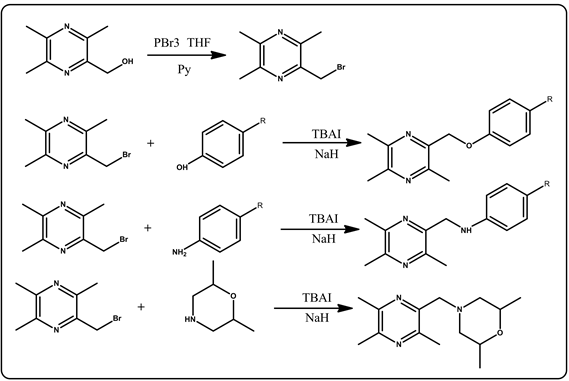
Figure 1. Synthesis of Ligustrazine derivatives
图1. 川芎嗪衍生物合成路线
2.2. 川芎嗪衍生物的合成
本文根据生物电子等排原理和拼合原理,以川芎嗪为先导化合物,筛选了含有酚羟基、氨基、吗啉等基团的化合物,在碱性环境下经威廉姆森醚化反应得到一系列酯类川芎嗪衍生物,再经水解反应得到含有羧基的8个新型川芎嗪衍生物A~H,其结构经1H-NMR、13C-NMR和LC-MS确证。
以化合物D为例:以三溴化磷和(3,5,6-三甲基吡嗪-2-基)甲醇为原料,以四氢呋喃为溶剂反应得到2-溴甲基-3,5,6-三甲基吡嗪,再与化合物对氨基苯甲酸甲酯化合物经过亲核取代反应得到4-((3,5,6-三甲基吡嗪-2-基)甲基)氨基)苯甲酸甲酯川芎嗪氨类衍生物,最后经过水解得到4-((3,5,6-三甲基吡嗪-2-基)甲基)氨基)苯甲酸(化合物D)。白色粉末;1H NMR δ:7.82 (s, 1H, Ar-H),7.81 (s, 1H, Ar-H),6.75 (s, 1H, Ar-H),6.73 (s, 1H, Ar-H),4.46 (s, 2H, CH3),2.56 (s, 3H, CH3),2.55 (s, 3H, CH3),2.52 (s, 3H, CH3);13C NMR δ = 152.53, 151.81, 149.63, 148.66, 148.27, 147.40, 131.31, 118.14, 112.20, 45.47, 19.82, 19.66, 18.69;ESI-MS(m/z) [M+H]+ = 272.41。
用类似的方法合成得到化合物A、B、C、E、F、G、H。
化合物A:4-((3,5,6-三甲基吡嗪-2-基)甲氧基)苯甲酸;白色粉末;1H NMR δ:8.01 (s, 1H),7.12 (s, 1H),7.99 (s, 1H),7.11 (s, 1H),5.27 (s, 2H),2.54 (s, 3H),2.58 (s, 3H);13C NMR δ = 168.27, 162.42, 151.50, 149.73, 149.08, 145.59, 131.45, 123.39, 114.14, 69.19, 19.94, 19.73, 18.88;ESI-MS(m/z) [M-H]− = 271.17。
化合物B:2-(4-((3,5,6-三甲基吡嗪-2-基)甲氧基)苯基)乙酸;白色粉末;1H NMR δ:7.23 (s, 1H, Ar-H),7.21 (s, 1H, Ar-H),7.00 (s, 1H, Ar-H),6.98 (s, 1H, Ar-H),5.17 (s, 2H, CH2),3.55 (s, 2H, CH2),2.57 (s, 3H, CH3),2.53 (s, 3H, CH3);13C NMR δ = 174.45, 157.61, 149.77, 148.11, 146.19, 130.09, 127.47, 114.48, 69.13, 36.39, 19.91, 19.69, 18.92;ESI-MS(m/z) [M+H]+ = 288.44。
化合物C:3-(4-((3,5,6-三甲基吡嗪-2-基)甲氧基)苯基)丙酸;白色粉末;1H NMR δ:7.17 (s, 1H, Ar-H),7.16 (s, 1H, Ar-H),6.96 (s, 1H, Ar-H),6.94 (s, 1H, Ar-H),5.15 (s, 2H, CH2),2.59 (s, 2H, CH2),2.57 (s, 3H, CH3),2.56 (s, 2H, CH2),2.54 (s, 3H, CH3);13C NMR δ = 157.07, 151.22, 149.77, 148.89, 146.27, 133.59, 123.98, 114.51, 69.14, 35.57, 29.79, 19.90, 19.67, 18.92;ESI-MS(m/z) [M+H]+ = 302.45。
化合物E:2-(4-((3,5,6-三甲基吡嗪-2-基)甲基)氨基)苯基)乙酸合物;白色粉末;1H NMR δ:7.08 (s, 1H, Ar-H),7.06 (s, 1H, Ar-H),6.72 (s, 1H, Ar-H),7.06 (s, 1H, Ar-H),6.72 (s, 1H, Ar-H),6.71 (s, 1H, Ar-H),4.37 (s, 2H, CH3),2.55 (s, 3H, CH3),2.54 (s, 3H, CH3),2.51 (s, 3H, CH3);13C NMR δ = 153.89, 149.32, 148.56, 148.22, 148.13, 147.28, 129.57, 123.43, 112.87, 45.27, 40.07, 19.80, 19.62, 18.69;ESI-MS(m/z) [M+H]+ = 286.43。
化合物F:2,6-二甲基-4-((3,5,6-三甲基吡嗪-2-基)甲基)吗啉;淡黄色油状;1H NMR δ:3.66~3.68 (d, 1H, CH, J = 12),3.59 (s, 2H, CH2),2.62~2.66 (t, 2H, CH2, J = 12),2.59 (s, 3H, CH3),2.51 (s, 3H, CH3),1.88~1.91 (t, 2H, CH2, J = 12),1.14~1.15 (d, 3H, CH3, J = 6);13C NMR δ = 149.99, 149.65, 148.01, 147.99, 71.69, 62.01, 21.58, 21.47, 20.95, 19.09;ESI-MS(m/z) [M+H]+ = 251.42。
化合物G:4-((3,5,6-三甲基吡嗪-2-基)甲基)硫代吗啉合物;淡黄色油状;1H NMR δ:3.62 (s, 2H, CH2),2.76 (s, 2H, CH2),2.66 (s, 2H, CH2),2.58 (s, 3H, CH3),2.51 (S, 3H, CH3),2.50 (S, 3H, CH3);13C NMR δ = 150.08, 149.65, 147.94, 147.66, 62.78, 54.96, 29.70, 27.99, 21.57, 21.45, 20.95;ESI-MS(m/z) [M+H]+ = 239.44。
化合物H:(E)-3-(4-(3,5,6-三甲基吡嗪-2-基)甲氧基)苯基)丙烯酸;白色粉末;1H NMR δ:7.64~7.61 (d, 1H, CH, J = 18),7.58~7.56 (d, 1H, Ar-H, J = 12),7.09~7.08 (d, 1H, Ar-H, J = 6),6.38~6.35 (d, 1H, CH, J = 18),5.24 (s, 2H, CH2),2.58 (s, 3H, CH3),2.54 (s, 3H, CH3);ESI-MS(m/z) [M+H]+ = 300.41。
化合物A~H结构式见图2。

Figure 2. Structure of compounds A~H
图2. 化合物A~H结构图
2.3. 抗血小板聚集试验
2.3.1. 富血小板血浆(PRP)与贫血小板血浆(PPP)的制备
取禁食24 h家兔用利多卡因局部麻醉,颈动脉插管取血,注入含1/10容量的3.8%枸橼酸钠溶液的硅化离心管中,将血液与抗凝剂轻轻混匀,以900 rpm/min,离心5 min后,再次800 rpm/min离心5 min,取上层淡黄色液体为富血小板血浆(PRP),将剩余部分以3000 rpm/min离心10 min,取上清液即得贫血小板血浆(PPP)。
2.3.2. 血小板聚集率的测定
将制备好的富血小板血浆(PRP)置37℃摇床温育20 min,用移液器精密移取温育后的PRP 90 μL于96孔板中,再加入5 μL待测化合物,涡旋混匀,然后逐级稀释,制得终浓度为100 μmol/L、50 μmol/L、25 μmol/L、12.5 μmol/L、6.25 μmol/L、3.12 μmol/L的血浆样品,37℃温育振摇5 min,平行制备2组,记为A组和B组。将酶标仪设置震动一次时间为10 s,测定波长为570 nm,将经温育震荡的96孔板置于酶标仪上快速震摇10 s后测定吸光度,每30 s测定一次,连续测3次,记各孔三次吸光度均值为A0。A组加入诱导剂二磷酸腺苷(ADP),使ADP终浓度为5 μmol/L,B组加入诱导剂花生四烯酸(AA),使AA终浓度为0.5 mmol/L,将其放置摇床37℃震荡5 min后,每30 s测定一次吸光度,直至吸光度不再变化,记平行孔的吸光度均值为A。
2.3.3. 统计学处理
实验数据处理使用SPSS进行统计分析,用 表示,P < 0.05为差异具有统计学意义。直线回归方程计算半数有效浓度IC50。按以下公式计算血小板聚集率(aggregation rate, AR)和药物对血小板聚集抑制率(aggregation inhibition rate, AIR):
AR = [(加入ADP前A值 − 加入ADP后A值)/加入ADP前A值] × 100%;
AIR = [1 − (给药管聚集百分率/对照管聚集百分率)] × 100%。
2.3.4. 抗血小板聚集活性
与空白组比较,不同浓度的待测样品能抑制ADP和AA诱导的体外血小板聚集,并呈剂量相关性。化合物H有显著的体外血小板抑制作用,活性明显强于阿司匹林。其中化合物A、D、F、H抗血小板聚集作用优于阿司匹林,其在100 μmol/L时对ADP抑制率分别为72.56%、66.95%、78.48%、88.93%,对AA抑制率分别为68.64%、62.08%、78.48%、84.91%。其抑制ADP诱导血小板聚集的IC50分别为:30.71 μmol/L、37.38 μmol/L、21.85 μmol/L、8.52 μmol/L,阿司匹林IC50为44.66 μmol/L;其抑制AA诱导血小板聚集的IC50分别为:33.42 μmol/L、46.19 μmol/L、24.92 μmol/L、12.08 μmol/L,阿司匹林IC50为46.58 μmol/L,化合物H抗血小板聚集作用最强,结果见表1。
Table 1. IC50 values of target compounds against platelet aggregation in vitro
表1. 体外抗血小板聚集的IC50值
3. 结果与讨论
Liu XY等 [6] 以2-羟甲基-3,5,6-三甲基吡嗪为原料作为先导化合物,设计合成了一系列川芎嗪衍生物,发现其中某些化合物可有效地刺激正常人胎儿脐静脉血管内皮细胞(HUVECs)增殖,并且对过氧化损伤的HUVECs有保护作用。叶云鹏等 [11] 以无水四甲基吡嗪为原料,设计合成了川芎嗪醚类衍生物。其中川芎嗪异丙醚盐酸盐的体外药理活性强于川芎嗪。程先超等 [5] [12] 以TMP为先导物,合成了一系列抗心脑血管疾病疗效更佳的TMP哌嗪衍生物。本文根据生物电子等排原理和拼合原理,以川芎嗪为先导化合物,经氧化、重排、酯化、水解等反应,成功制备8个新型川芎嗪衍生物。部分化合物抗血小板聚集作用高于阿司匹林阳性对照药,化合物A、D、F、H活性较好,其中H的活性最好,IC50是阿司匹林的5.2倍。研究活性构效关系发现:苯环15位碳连接的碳原子的数增加抗血小板聚集作用会降低,15位侧链含有双键抑制作用会增加,氨类衍生物抑制作用弱于醚类衍生物,11位引入吗啉环活性会降低,羧基为抗血小板聚集作用重要基团,11位连接氮原子时川芎嗪醚类衍生物抗血小板聚集作用优于川芎嗪氨类衍生物的活性。鉴于化合物H具有较好的血小板聚集活性,故可作为先导化合物进行后续研究。
基金项目
重庆市科委重点项目涪陵区中药产业科技支撑示范工程协同管理创新与应用研究(CSTC2014zkjccxyyBX0034)。
文章引用
江 娟,丁 锐,李 杰,邹远军,郑一敏. 川芎嗪衍生物合成及抗血小板聚集活性研究
Synthesis and Anti-Platelet Aggregation Activity Evaluation of Ligustrazine Derivatives[J]. 有机化学研究, 2020, 08(04): 35-41. https://doi.org/10.12677/JOCR.2020.84004
参考文献
- 1. Zhang, C.Q. (2013) New Perspectives for Cardiovascular Disease Prevention. World Science, 3, 25-26.
- 2. Lu, W.D. (2013) Analysis on Combination Therapy of Cardiovascular Disease. Chin J Clin Rational Drug Use, 6, 33-35.
- 3. 李秋怡, 干国平, 刘焱文. 川芎的化学成分及药理研究进展[J]. 时珍国医国药, 2006, 17(7): 1298-1299.
- 4. Tan, Z.Q. (2009) Neural Protection by Naturopathic Compounds—An Example of Tetramethylpyrazine from Retina to Brain. Journal of Ocular Biology, Diseases, and Informatics, 2, 137-144. https://doi.org/10.1007/s12177-009-9033-7
- 5. Cheng, X.C., Liu, X.Y., Xu, W.F., et al. (2009) Ligustrazine Derivatives. Part 3: Design, Synthesis and Evaluation of Novel Acylpiperazinyl Derivatives as Potential Cerebrocardiac Vascular Agents. Bioorganic & Medicinal Chemistry, 17, 3018-3024. https://doi.org/10.1016/j.bmc.2009.03.012
- 6. Liu, X.Y., Zhang, R., Xu, W., et al. (2003) Synthesis of the Novel Ligustrazine Derivatives and Their Protective Effect on Injured Vascular Endothelial Cell Damaged by Hydrogen Peroxide. Bioorganic & Medicinal Chemistry Letters, 13, 2123-2126. https://doi.org/10.1016/S0960-894X(03)00359-7
- 7. Song, Y.N., Guo, X.L., Zheng, B.B., et al. (2011) Ligustrazine Derivative DLJ14 Reduces Multidrug Resistance of K562/A02 Cells by Modulating GSTπ Activity. Toxicology in Vitro, 25, 937-943. https://doi.org/10.1016/j.tiv.2011.03.002
- 8. Xue, Y., Tie, C.R., Li, J., et al. (2011) Ligustrazine Inhibits Lipolysaccharide-Induced Proliferation by Affecting P27, Bcl-2 Expression in Rat Mesangial Cells. European Journal of Pharmacology, 665, 8-12. https://doi.org/10.1016/j.ejphar.2011.05.004
- 9. Au, A.L.S., Kwan, Y.W., Kwork, C.C., et al. (2003) Mechanisms Responsible for the in vitro Relaxation of Ligustrazine on Porcine Left Anterior Descending Coronary Artery. European Journal of Pharmacology, 468, 199-207. https://doi.org/10.1016/S0014-2999(03)01691-1
- 10. 徐睿, 李源, 黄熙. 川芎嗪药物代谢动力学研究进展[J]. 安徽中医药大学学报, 2002, 21(1): 58-61.
- 11. 叶云鹏, 王世真, 江骥. 人体尿中川芎嗪代谢产物的研究[J]. 中国医学科学院学报, 1996(4): 288-291.
- 12. 程先超. 川芎嗪衍生物的设计、合成及其心脑血管药理活性研究[D]: [硕士学位论文]. 济南: 山东大学, 2005.
NOTES
*共一作者。
#通讯作者。
