Hans Journal of Medicinal Chemistry
Vol.04 No.03(2016), Article ID:18930,6
pages
10.12677/HJMCe.2016.43003
Liposome—A Novel Drug Delivery System
Jibo Wang1, Jimin Liu2, Hongmei Yuan3
1School of Pharmacy, Medical Department of Qingdao University, Qingdao Shandong
2Division of Microbiology, Medical Department of Qingdao University, Qingdao Shandong
3Pharmacy Department, Qingdao Municipal Hospital, Qingdao Shandong

Received: Oct. 27th, 2016; accepted: Nov. 12th, 2016; published: Nov. 15th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
The study of liposome has become a focus in physical pharmacy recently and showed the prospective value of application in many ways. The summarization of origin, basic concept, types, preparation, in vivo characteristics, quality control and application of liposome was made. The stability and target design of liposome are the fundamentality of its application. The future development of liposome was viewed.
Keywords:Liposome, Drug Delivery System, Stability, Lipid Bilayer, Target

脂质体—神奇的药物递送系统
王继波1,刘继民2,袁红梅3
1青岛大学医学部药学院,山东 青岛
2青岛大学医学部微生物教研室,山东 青岛
3青岛市立医院药剂科,山东 青岛

收稿日期:2016年10月27日;录用日期:2016年11月12日;发布日期:2016年11月15日

摘 要
近年来,脂质体已成为物理药学领域研究的热点,并且已经在许多方面显示出其潜在的应用价值。本文综述了脂质体的起源、基本概念、类型、制备方法、体内特性、质量控制和应用。脂质体的稳定性和靶向化设计是脂质体应用的根本。对脂质体的发展前景作了展望。
关键词 :脂质体,药物递送系统,稳定性,脂双层,靶向

1. 引言
1961年,Alec Douglas. Bangham和R. W. Horne用经过负染的磷脂调试电子显微镜时,他们在电镜下观察到磷脂形成了类似细胞质膜的结构,并于1964年发表了他们拍摄的电镜照片。进一步研究发现,当磷脂分散在水中时会形成多层小囊泡,而且每一层均为脂质双分子层,各层之间被水相隔开。他们将这种内部是一定量水完全由单层或多层同心(或非同心)磷脂双分子层包裹的人工囊泡称为脂质体(Liposome)。由于脂质体的结构类似生物膜,故又称人工生物膜 [1] 。脂质体是作为生物膜模型提出的,近年来,脂质体在给药系统研究领域中已成为研究的热点,非常引人瞩目。
2. 脂质体的结构及构建组件
2.1. 脂质体的结构类型
脂质体的基本结构和类型可分为单层脂质体和多层脂质体。含有单层双分子层磷脂膜的囊泡称为单层脂质体(unilamellar vesicle, ULV)即单室脂质体。单室脂质体又分为小单室脂质体(small unilamellar vesicular,SUV,粒径 < 100 nm)即纳米脂质体(nanoliposomes)、大单室脂质体(1arge unilamellar vesicular,LUV,粒径 > 100 nm )和巨大大单室脂质体(giant unilamellar vesicle,GUV,粒径 > 1000 nm)。含有多层双分子层磷脂膜的囊泡称为多层脂质体(multilamellar vesicle,MLV,粒径100~1000 nm)。含有多个单室脂质体的囊泡称为多室脂质体(multivesicular vesicle,MVV,粒径 > 1000 nm)。见图1 (来源网络)。
2.2. 构建脂质体的膜材
磷脂和胆固醇是制备脂质体的重要脂质载体材料,是生物细胞膜的主要成分,又是机体内源性物质。具有良好的生物相容性和可降解性,无毒无免疫原性。制备脂质体的磷脂分为天然磷脂和合成磷脂。天然磷脂最常用的是中性的磷脂酰胆碱(PC),由于天然磷脂分子中的脂肪酸链均含有不饱键,在空气中容易氧化、水解,使脂质体脂膜的微粘度降低,流动性增大,使装载的药物渗漏,脂球易聚集沉淀 [2] 。合成磷脂常用的是二棕榈酰磷脂酰胆碱(DPPC)、二硬脂酰磷脂酰胆碱(DSPC)、二棕榈酰乙醇胺(DPPE)、二油酰磷脂酰胆碱(DOPC)、二油酰磷脂酰甘油(DOPG)、磷脂酰乙醇胺(PE)及鞘磷脂(SM)。合成磷脂不易氧化水解,制备的脂质体稳定性较高 [3] 。负电磷脂常用的是磷脂酸(PA)、磷脂酰肌醇(PI)、脂酰丝氨酸(PS)和磷脂酰甘油(PG)。正电磷脂常用的是:十八胺(SA)。胆固醇可调节磷脂双层的流动性,降低膜的通透性,减少药物的渗漏。胆固醇能保持脂膜一定的柔韧性,以增加脂质体应对外部条件的变化。胆固醇可保护磷脂被氧化,胆固醇还可增加脂膜的稳定性。在体内,没有胆固醇成分的脂质体容易与血浆中的蛋白质(白蛋白、转铁蛋白、巨噬细胞)作用导致物理不稳定性。
3. 载药脂质体及质量控制
3.1. 载药脂质体及药物装载
1971年Ryman等首次用脂质体作为药物载体做成治疗制剂。脂质体可以在同一系统中提供亲水和亲
脂的环境,其载药方式取决于药物的脂水分配系数。水溶性药物包裹在脂质体的内水相、脂溶性镶嵌在脂质体的脂双层中、两亲性药物作为组分构成脂双层或通过技术处理将表面修饰剂连接在脂质体表面均称为载药脂质体,其ULV模型见图2 (来源网络图片编辑)。
脂质体作为药物递送系统受关注和益处是能有效地包裹各种水溶性的、离解常数不同的大小分子。控制剂量达到在满足疗效的条件下减小给药剂量,降低副作用。通过修饰脂质体的表面和改进功能提高脂质体的靶向性,控制循环时间和作用部位。脂质体作为药物递送系统发展至今已经可以装载化疗药物、抗微生物及病毒(SARS、HIV、AIV、RV等)药物 [4] [5] 、抗寄生虫药物、基因物质、疫苗、治疗蛋白质、抗炎症药物、激素和天然药物等 [6] 。载药脂质体具有被动靶向性和主动靶向性(表面修饰的脂质体)、缓释性,药物经脂质体包覆保护药物、提高药物的稳定性、减少敏感组织对毒性大药物的暴露,降低药物毒性 [7] 。脂质体的研究已经从早期的,普通的普通脂质体向多功能脂质体的方向发展,并且已经在许多方面显示出其潜在的应用价值。但是,由于脂质体理想配方、稳定性及给药的实施等方面的困难,目前上市的脂质体制剂的数量有限。
3.2. 脂质体的制备
经过几十年的发展,脂质体的载药研究已经取得长足的进步。脂质体的制备方法较多,脂质体类型不同,制备方法不同。目前制备SUV多采用超声波分散法、溶剂注入法和冻融出挤法。制备LUV采用反相蒸发法、冻融挤出法和溶剂注入法。制备MLV采用冷冻干燥法。制备MVV(W/O/W)采用二次乳化法。这些方法均属于药物的被动包封法。为提高药物的包封率发展出药物的主动包封法(遥控装载法),主要有硫酸铵梯度法、醋酸钙梯度法、其它离子梯度法、pH诱导囊泡化等开启了脂质体载药的新思路 [8] 。
3.3. 脂质体的剂型
乳剂是脂质体的主要剂型,但是,这种剂型的长期稳定性差,不宜长期储存。采用冷冻干燥法将脂
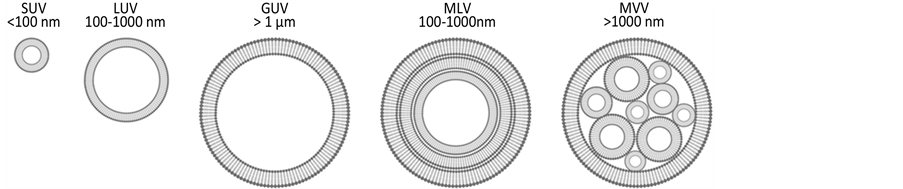
Figure 1. Model of liposome
图1. 脂质体模型
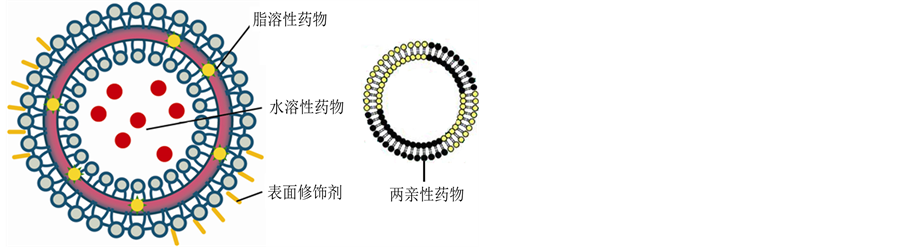
Figure 2. Drug loaded liposome
图2. 载药脂质体
质体制成冻干粉可以提高脂质体的贮存稳定性 [9] [10] 。前体脂质体是只有当脂膜成分和装载药物接触到水环境时才会形成脂质体,是一种独特的系统,可以在使用时制备是该系统的最大优点。此外,脂质体还被制成气雾剂及药膏等剂型外用。
3.4. 脂质体的质量控制
脂质体是粗分散体系,脂质体的脂膜双分子层具有一定流动性,脂质体混悬液在贮存期间易发生聚集、融合、沉淀及药物渗漏造成脂质体的不稳定。脂质体的物理稳定性极易受自身的组成、装载药物及外界环境的影响。在体内,血清中的各种蛋白、酶等都会破坏脂质体。此外,单核巨噬细胞系统的吞噬作用也会影响脂质体的稳定性。
脂质体的质量控制主要从粒度分布及平均粒径、表面形态、包封率、载药量、稳定性、磷脂的氧化程度、相变温度、有机溶剂的残余量和灭菌效果几个方面进行评价。
4. 脂质体的修饰及研究热点
4.1. 脂质体的表面修饰
传统脂质体是用天然磷脂和胆固醇制备,由于天然磷脂容易氧化、水解,所以稳定性较差,难以满足药物制剂稳定性的要求,使应用受到了很大限制。目前,多采用在脂质体表面添加聚乙二醇(PEG200-20000)及其衍生物的方法制备长循环脂质体,提高脂质体的物理稳定性,减小脂质体与血浆蛋白的作用,延长体内循环时间,同时保护脂质体不被网状内皮系统(RES)识别、摄取及吞噬。PEG修饰类型分为双功能PEG修饰(HCOO-PEG-COOH、NH2-PEG-NH2、OH-PEG-COOH、OH-PEG-NH2NH2、PEG-COOH等),直链PEG修饰(mPEG-SC、mPEG-SCM、mPEG-SPA、mPEG-OTS、mPEG-SH、mPEG-SS等)和分岔PEG修饰((mPEG)2-NHS、(mPEG)2-NH2等)。聚乳酸(PLA)、聚丙烯酰胺(PAA)、聚乙烯吡咯烷酮(PVP)、聚羟基乙酸(PLGA)等也可用于脂质体的表面修饰。用保护性聚合物对磷脂进行修饰可以制备特殊功能脂质体。用带碱性基团双功能PEG修饰的磷脂制备的脂质体具有酸敏功能,将药物精确投送到呈弱酸性的肿瘤部位。可以用PEG化的磷脂制备温度敏感脂质体(TSL),将药物定向投送到温度相对较高的炎性部位靶向释药。又如将DPPC和DSPC混合磷脂制备的甲氨喋呤TSL注射于Lewis肺癌小鼠,用微波将肿瘤部位加热至42℃,将甲氨喋呤定向递送至肿瘤部位。将小干扰RNA载于正电脂质体递送,可提高对癌细胞的抑制率 [11] 。将磁性载体材料掺入脂质中制备的磁性脂质体,由于其良好的载药性、磁靶向性以及生物相容性而受到广泛的重视 [12] 。膜融合脂质体是高效的抗肿瘤疫苗载体,可提高免疫小鼠的免疫反应。研究显示,脂质体经过表面修饰、结合一些新的给药方式及技术手段有利于通过血脑屏障(BBB),显著提高药物的治疗效果。
4.2. 脂质体研究的热点领域
目前脂质体研究及运用的热点有六个领域,第一是模拟生物膜的研究。脂质体可作为一种模拟生物膜的简单模型,研究药物及天然产物有效成分与脂质体模拟生物膜的相互作用,研究膜结构与药物释放性能之间的关系。第二是改进脂质体制剂药物的可控释放。脂质体可控药物传输系统可以实现药物在病灶部位的靶向释放,有利于提高药效,降低药物的毒副作用,在疾病治疗方面具有诱人的应用潜力和广阔的应用前景。第三是改进脂质体的体内循环。降低药物的血清清除及网状内皮系统对其的吞噬作用,具有在达到目标病灶部位之前不释放药物分子,到达病灶部位后才以适当的速度释放出药物分子的特性,延长药物作用时间,改变药物的组织分布,降低药物对正常细胞的毒性等。第四是脂质体的靶向化设计及体内靶向给药。研究靶向化脂质体的体内药物动力学、组织分布动力学、靶向化评价、靶向给药机制及治疗效果。抗癌脂质体共递送系统(共载脂质体)对肿瘤的抑制作用和抗药耐药性研究 [13] [14] 等。抗癌脂质体利用EPR效应 [15] 、免疫脂质体在肿瘤的靶向治疗中可显著提高治疗效果,减轻药物的副作用 [16] [17] 。近几年,一批具有靶向性的抗肿瘤脂质体相继问世。如多柔比星脂质体、两性霉素B脂质体、阿糖胞苷脂质体、长春新碱脂质体 [18] 。第五是在体外培养中将核酸和其它生物活性物质导向细胞内,近年来,脂质体作为DNA载体可将DNA有效地传送到靶细胞,提高了基因治疗研究中的安全性和有效性。运用IRIV疫苗脂质体治疗甲型肝炎和流感,用SP-B和SP-C蛋白脂质体治疗呼吸窘迫综合症(RDS)。第六是复合脂质体的研究运用。如雌二醇脂质体用于更年期治疗、吗啡脂质体手术后的镇痛、维替泊芬脂质体治疗老年性黄斑、退化及病理性近视,眼组织胞浆菌病等。
4.3. 脂质体的未来发展
正在研发的下一代脂质体递送系统更多地考虑改变给药途径,更多的普通非胃肠道的给药模式,如吸入给药技术、可植入给药技术、口腔给药技术和长效给药技术。如柔性脂质体(变形脂质体)具有高度的变形力,当脂质体受到足够大的应力时,可发生高效渗透将药物运载穿过角质层进入人体。脂质体递送系统的最新进展、新的给药理念和研发渠道备受关注。
靶向给药的时代已经来临,随着以脂质体为基础给药系统的广泛运用、研究机构及企业科研人员持续不断的努力,未来十年脂质体给药系统产品的数量一定会持续增长,有理由相信,脂质体的研发投入也会持续增长。
文章引用
王继波,刘继民,袁红梅. 脂质体—神奇的药物递送系统
Liposome—A Novel Drug Delivery System[J]. 药物化学, 2016, 04(03): 19-24. http://dx.doi.org/10.12677/HJMCe.2016.43003
参考文献 (References)
- 1. Wang, X.M., Tang, X. and He, H.B. (2006) Research Overview of Multivesicular Liposomes. Chinese Journal of New Drugs, 15, 1243-1244.
- 2. Crommelin, J.A., Grit, M., Talsma, H., et al. (1994) Liposomes as Carries for Durgs and Antigens: Approaches to Preserve Their Long Term Stability. Drug Development and Industrial Pharmacy, 20, 547-550. http://dx.doi.org/10.3109/03639049409038317
- 3. Grit, M., Smidt, J.H., Tur, A., et al. (1989) Hydmlysis of Saturated Soybean Phosphatiylcholine in Aqueous Liposome Dispersions. International Journal of Pharmaceutics, 50, 1-5. http://dx.doi.org/10.1016/0378-5173(89)90173-7
- 4. Yang, G., Cao, G.J., Li, J., Ji, X.G., Zhao, Y.H., Wang, J.Y., Liu, C., Fan, M., Shen, B.F. and Shao, H.N.S. (2004) Inhibition of SARS-CoV Infection in Vero-E6 Cells by siRNAs. Journal of Medical Molecular Biology, 1, 270-273.
- 5. Gao, S., Rong, L.F., Shi, J.Y., Guo, L. and Li, J. (2003) The Preparation of Azidothymidine Liposomes Containing Galactosylceramide and the Observation of Its Physical Chemical Properties. Anhui Medical and Pharmaceutical Journal, 7, 420-422.
- 6. 于波涛, 曾人杰, 张志荣, 邓黎. 脂质体稳定性的研究进展[J]. 西南国防医药, 2005, 15(6): 686-689.
- 7. 蔡明志, 王昆. 载药脂质体的物理化学稳定性的研究进展[J]. 国际药学研究杂志, 2005, 32(6): 404-408.
- 8. Ellens, H., Rustum, Y. and Mayhew, E. (1982) Distribution and Metabolism of Lipsome-Encapsulatnd and Free, Ara-C in Dog and Mouse Tissues. Journal of Pharmacology and Experimental Therapeutics, 222, 324-328.
- 9. Matsumura, Y. and Maeda, A. (1986) A New Concept for Macromolecular Therapies in Cancer Chemotherapy: Mechanisms of Tumor Tropic Accumulation of Proteins and the Antitumor Agents Smancs. Cancer Research, 46, 6387-6392.
- 10. 王健, 李明轩. 冷冻干燥对提高脂质体稳定性的研究概况[J]. 中国医药工业杂志, 2005, 36(9): 576-579.
- 11. Taruttis, A., Lozano, N., Nunes, A., et al. (2014) siRNA Liposome-Gold Nanorod Vectors for Multispectral Optoacoustic Tomography Theranostics. Nanoscale, 6, 13451-13456. http://dx.doi.org/10.1039/C4NR04164J
- 12. 刘信, 李曦, 张志军, 黄坤, 邓方豪, 许雯靓, 刘鹏, 张超灿. 磁性脂质体的制备及应用[J]. 材料导报, 2012, 30(9): 53-56.
- 13. Roy, I., Ohulchanskyy, T.Y. and Pudavar, H.E. (2003) Ceramic-Based Nanopanicles Entrapping Water-Insoluble Photosensitizing an Ticancerdrugs: A Novel Drug-Carrier System for Photodynamic Therapy. Journal of the American Chemical Society, 125, 7860-7865. http://dx.doi.org/10.1021/ja0343095
- 14. Li, X., Ruan, G.R., Lu, W.L., et al. (2006) A Novel Stealth Liposomal to Petecan with Amlodipine: Apoptotic Effect Is Associated with Deletion of Intracellular Ca by Amlodipine thus Leading to an Enhanced Antitumor Activity in Leukemim. Journal of Controlled Release, 112, 186-198. http://dx.doi.org/10.1016/j.jconrel.2006.01.007
- 15. 刘扬, 吕万良, 张强. 脂质体及纳米粒药物递送系统的研究进展[J]. 中国医学科学院学报, 2006, 28(4): 583-589.
- 16. Coifier, B., Lepage, E., Briere, J., et al. (2002) CHOP Chemotherapy Plus Rituximab Compared with CHOP Alone in Elderly Patients with Difuse Large-B-Cell Lymphoma. The New England Journal of Medicine, 346, 235-242. http://dx.doi.org/10.1056/NEJMoa011795
- 17. Slamon, D.J., Leyland, J.B., Shak, S., et al. (2001) Use of Chemotherapy Plus a Monoclonal Antibody against HER2 for Metastatic Breast Cancer That Overexpresses HER2. The New England Journal of Medicine, 344, 783-792. http://dx.doi.org/10.1056/NEJM200103153441101
- 18. 李文静, 杨志强, 王杏林. 硫酸长春新碱脂质体研究进展[J]. 中国新药杂志, 2012, 21(13): 1479-1483.