Advances in Marine Sciences
Vol.05 No.02(2018), Article ID:25294,9
pages
10.12677/AMS.2018.52011
Effects of Replacing Algae Powder by Fermented Soybean Meal on Growth and Digestive Physiology of Juvenile Sea Cucumber Apostichopus japonicus Selenka
Baoshan Li, Jiying Wang, Limin Zhang, Xiaoyan Wang, Chengqiang Wang, Tiantian Hao, Yongzhi Sun
Key laboratory of Marine Ecological Restoration, Shandong Marine Resources and Envionment Research Institute, Yantai Shandong
Received: May 10th, 2018; accepted: May 30th, 2018; published: Jun. 6th, 2018

ABSTRACT
Sea cucumber, Apostichopus japonicus Selenka, is one of most valuable cultured species in China. With its rapid development, algae powder which is the main components in feed was deficient. Fermented soybean meal (FSBM) was regularly used for replacing fish meal in fish diet. It also seemed to be one of high quality raw materials for A. japonicus. In order to investigate the effects of replacing algae powder by FSBM on growth and digestive physiology of juvenile sea cucumber, nine kinds of isoprotein experimental diets were formulated by replacing algae powder or mixture of fish meal and algae powder (2:15) and fed sea cucumber juveniles with initial body weight 17.7 g for 70 d. The results showed that with the decreasing of dietary algae powder, the weight gain rates were increased and then decreased, meanwhile, both protease and lipase activities were not affected, and amylase activities were increased. Both glutamic-pyruvic transaminase (ALT) and glutamic-oxalacetic transaminase (AST) activities deceased firstly and then increased afterwards, and both pyruvate kinase (PK) and hexokinase (GK) activities were stable firstly and then decreasing. Intestinal wall thicknesses were not affected by the diets, but the heights of villus were decreased significantly. With the decreasing of dietary mixture, weight gain rates were decreased significantly, meanwhile, protease decreased and amylase increased. Both ALT and AST activities increased firstly and then kept stable, and both PK and HK activities were decreased significantly. The thicknesses of intestinal walls and the heights of villus tent to raise then fall. When FSBM substitute more than 51.66% algae powder or 24.28% mixture, the height of villus became shorter, width became narrow, and quantity became fewer, meanwhile centrallacteal was broaden, and microvillus appeared absence. Submucous layers of maximum substitute groups were obviously abnormal. It can be concluded from the results that adding amount of FSBM in sea cucumber diet should not exceed 10%, or it may cause the damage of intestinal structure and affected the activities of digestion and metabolism enzymes.
Keywords:Sea Cucumber (Apostichopus japonicus Selenka), Fermented Soybean Meal, Digestive Physiology, Intestinal Structure
发酵豆粕替代藻粉对仿刺参生长及消化生理的影响
李宝山,王际英,张利民,王晓艳,王成强,郝甜甜,孙永智
山东省海洋资源与环境研究院,山东省海洋生态修复重点实验室,山东 烟台
收稿日期:2018年5月10日;录用日期:2018年5月30日;发布日期:2018年6月6日

摘 要
为研究发酵豆粕替代藻粉对仿刺参生长及消化生理的影响,以发酵豆粕分别替代基础饲料中的藻粉及鱼粉藻粉混合物(2:15),配制9种等氮实验饲料,饲喂初始体重17.7 g的仿刺参幼参70 d。结果显示:1) 替代藻粉后,实验仿刺参的增重率先升后降(P < 0.05);肠道蛋白酶和脂肪酶活力变化不显著(P > 0.05),淀粉酶活力先升高后平稳(P < 0.05);肠道谷丙转氨酶(ALT)及谷草转氨酶(AST)活力呈先下降后上升的趋势,丙酮酸激酶(PK)及己糖激酶(GK)活力呈先平稳后下降的趋势;肠壁厚度无显著变化(P > 0.05),但显著降低了绒毛长度(P < 0.05)。2) 替代混合物后,增重率显著降低(P < 0.05);蛋白酶活力显著降低,淀粉酶活力显著升高(P < 0.05);ALT及AST活力呈先上升后平稳的趋势,PK及HK活力显著下降(P < 0.05);肠壁厚度和绒毛长度均先上升后降低。3) 发酵豆粕替代51.66%以上的藻粉或24.28%的混合物时,肠道绒毛长度变短、宽度变窄、数量变少,中央乳糜管变宽,微绒毛出现缺失;最高替代组粘膜下层出现明显异常。综上:本实验条件下,仿刺参配合饲料中发酵豆粕的添加量不宜超过10%,过量添加会损伤肠道结构,影响肠道消化及代谢酶活力。
关键词 :仿刺参,发酵豆粕,消化生理,肠道结构

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
发酵豆粕(fermented soybean meal, FSBM),又名生物豆粕、大豆肽,是以豆粕为主要原料,利用微生物发酵制成的。与豆粕相比,FSBM中抗营养因子含量有了显著降低 [1] ,小分子肽、微量元素及维生素含量有了显著提高 [2] [3] 。研究表明:FSBM可以替代仿刺参(Apostichopus japonicus Selenka) [4] 、牙鲆(Paralichthys olivaceus) [5] 、石斑鱼(Epinephelus coioides) [6] 等饲料中部分鱼粉,提高黑鲷(Acanthopagrus schlegelii)的抗氧化能力 [7] ,改善虹鳟的(Oncorhynchus mykiss)的组织结构形态 [8] 。
仿刺参,属棘皮动物门(Echinodermata),海参纲(Holothroidea),是我国主要的海水养殖品种之一。目前海参配合饲料中主要原料为海洋藻类 [9] [10] [11] [12] ,而藻类是海洋环境中的初级生产力,大量采捕必然会导致海洋生态失衡。FSBM属于陆生植物蛋白原料,来源稳定,对环境影响较小。李宝山等(2017)报道了FSBM可以替代仿刺参饲料中的部分藻粉,但未对替代后仿刺参消化生理的变化进行探讨 [4] 。因此,本实验以FSBM分别替代配合饲料中的藻粉及藻粉鱼粉混合物,研究对其仿刺参生长及消化生理的影响,以期为发酵豆粕在刺参配合饲料中的应用提供参考。
2. 材料与方法
2.1. 实验饲料配方及制作
以鱼粉和藻粉为蛋白源,设计粗蛋白含量为22%左右的基础饲料配方,分别以0%、5%、10%、15%、18%的FSBM等蛋白替代基础饲料中藻粉,以7.6%、15.2%、22.8%、30.4%的FSBM等蛋白替代基础饲料中鱼粉藻粉混合物(2:15),配制9组等氮实验饲料,分别记为D1、D2、D3、D4、D5、D6、D7、D8、D9组,D1为对照组。实验饲料配方及基本成分见表1。各原料(鱼油除外)按比例称重后粉碎过200目筛,加入鱼油及适量的蒸馏水混匀,用饲料制粒机制成颗粒后60℃烘干,用小型粉碎机粉碎,筛选60~80目之间的颗粒备用。
2.2. 养殖实验管理
养殖实验在山东省海洋与渔业厅黄河三角洲渔业科研推广中心循环水养殖系统内进行,实验用海参购自蓬莱安源水产有限公司。实验条件及养殖管理见李宝山等(2017) [4] 。
Table 1. Formulation and proximate composition of the experimental diets (%)
表1. 实验饲料配方及其基本成分(%)
注:a,鼠尾藻,大叶藻,海带1:1:1混合b, 其它包含10%小麦粉,8.94%虾粉,1%磷脂,1%磷酸二氢钙,1.5%维生素预混料,1.5%矿物质预混料,0.06%粘合剂,维生素预混料及矿物质预混料组成见王际英等(2014) [13] 。 Note: a, mixture of Sargassum thunbergii, Zostera marina Linn. and Laminaria japonica at equal proportion. b, others contains 10% wheat flour, 8.94% shrimp powder, 1% phospholipids, 1% Ca(H2PO4)2, 1.5% vitamins premix, 1.5% minerals premix, and 0.06% binder, the compositions of vitamin and mineral premixes are the same as reference Wang’s (2014).
2.3. 样品采集与计算
养殖实验结束后,禁食48 h,放掉桶内水后收集实验仿刺参,计数,在空气中放置30 S后称重。每桶随机挑选15头刺参,置于洁净的白瓷盘中,待其恢复自然体长,分离肠道并置于−20℃保存待测。在仿刺参肠道前1/3处截取0.3 cm,用波恩试液(Bone’s)固定24 h,用于肠道组织切片的制作。
增重率(weight gain rate, WGR, %) = (Wf − Wi)/Wi × 100;
存活率(survival rate, SR, %) = Nf/Ni × 100;
式中,Wf为末体质重(g),Wi为初始体质重(g),Nf为存活仿刺参数量,Ni为实验初始仿刺参数量。
2.4. 样品测定
肠道粗酶液采用吴永恒等(2012)的方法制备 [14] ;蛋白酶(Protease)、脂肪酶(Lipase)及淀粉酶(Amylase)含量采用南京建成生物工程研究所试剂盒测定;谷丙转氨酶(ALT)及谷草转氨酶(AST)采用生化分析仪测定(Hitachi, 7020, Japan),试剂购自北京利德曼生化股份有限公司,酶液中粗蛋白含量采用考马斯亮蓝法测定;丙酮酸激酶(PK)及己糖激酶(HK)采用Elisa试剂盒测定(上海纪宁实业有限公司),酶活力单位设定及测定方法见说明书。
2.5. 肠道组织切片的制作与观察
固定后的样品经梯度酒精脱水、透明、进蜡(Leica TP1020)后包埋,在室温下切成7 um厚的切片,苏木精-伊红(HE)染色后,中性树脂封片。在×20物镜下观测切片,选择典型视野,采用Leica DM500图像采集系统统计肠壁厚度及绒毛长度,每个样品观察10个非连续性的纵切片,其中肠壁厚度为肠外部至肌层与粘膜下层交接处的距离,绒毛长度为所有绒毛长度的平均值。
2.6. 数据处理
实验所得数据采用Microsoft office Excel 2007及SPSS®(SPSS, Inc, Chicago, IL)11.0 One-Way ANOVA处理,结果以平均值±标准偏差(X ± SD)表示,差异显著(P < 0.05)时用Duncan’s检验进行多重比较分析。
3. 结果
3.1. 发酵豆粕对仿刺参生长性能的影响
发酵豆粕替代藻粉或混合物对仿刺参的成活率无显著影响(P > 0.05) (表2)。发酵豆粕替代藻粉后,实验仿刺参的增重率呈先升后降的趋势,在D2组达到最高,显著高于D4及D5组(P < 0.05);随替代混合物比例的升高,D8、D9组增重率及特定生长率显著低于前三组(P < 0.05),前三组之间无显著差异(P > 0.05)。
3.2. FSBM对仿刺参肠道消化酶活力的影响
FSBM对仿刺参肠道消化酶活力的影响见表3。FSBM替代藻粉后,仿刺参肠道蛋白酶活力先平稳后下降,D5组显著低于D2-D4组,其它各组之间差异不显著(P > 0.05),淀粉酶活力先升高后平稳(P < 0.05);FSBM替代鱼粉藻粉混合物后,蛋白酶活力有了显著降低,D9组显著低于其它各组,淀粉酶活力有了显著升高(P < 0.05)。FSBM对脂肪酶活力无显著影响(P > 0.05)。
3.3. FSBM对仿刺参肠道代谢酶活力的影响
FSBM对仿刺参肠道代谢酶活力的影响见表4。由表可见,FSBM替代藻粉后,仿刺参肠道谷丙转氨
Table 2. Effects of dietary FSBM on growth performance and figure indices of sea cucumber A. japonicas Selenka (n = 15 x ¯ ± SD)
表2. 发酵豆粕对刺参生长性能的影响
Table 3. Effects of dietary FSBM on digestive enzyme activities of intestine of sea cucumber A. japonicus juveniles (n = 6 x ¯ ± SD)
表3. FSBM对刺参肠道消化酶活力的影响(U/mg prot)
注:同列上标小写字母不同表示二者差异显著,下同。 Note: Data within the same column with different superscripts were significantly different (P < 0.05), the same as below.
Table 4. Effects of dietary FSBM on metabolism enzyme activities of intestine of sea cucumber A. japonicus juvenile (n = 6 x ¯ ± SD)
表4. FSBM对刺参肠道代谢酶活力的影响
酶(ALT)及和谷草转氨酶(AST)活力呈先下降后上升的趋势,均在D3组达到最低值;丙酮酸激酶(PK)及己糖激酶(HK)活力呈先平稳后下降的趋势。FSBM替代鱼粉藻粉混合物后,ALT呈先升后降的趋势,D7组显著高于其它各组;AST活力先上升后平稳,D8、D9组显著高于其它组;PK及HK活力显著下降(P < 0.05)。
3.4. FSBM对仿刺参肠道结构的影响
FSBM对仿刺参肠道结构的影响见表5及图1。由表可见,FSBM替代藻粉后,对仿刺参肠道肠壁厚度无显著影响(P > 0.05),但显著降低肠道绒毛长度(P < 0.05)。FSBM替代鱼粉藻粉混合物后,仿刺参肠道肠壁厚度和绒毛长度均呈先上升后降低的趋势,D7组肠道肠壁厚度显著高于其它组,D6组肠道厚度和绒毛长度显著高于D1组,D9组肠道肠壁厚度和肠道绒毛长度均显著低于其它各组。
由图1可见,随着FSBM替代藻粉量的增加,仿刺参肠道绒毛长度变短、宽度变窄、数量变少,微绒毛出现缺失,D3组变化已较为显著,D5组肠道微绒毛萎缩、粘膜层出现异常;D3组中央乳糜管明显扩大。FSBM替代鱼粉藻粉混合物后,D6组即出现肠道绒毛变窄,D7组出现肠道微绒毛缺失,D8组出现微绒毛萎缩;D9组肠道粘膜下层出现明显异常;D6-D9组中央乳糜管显著宽于对照组。
4. 讨论
4.1. FSBM对仿刺参生长性能的影响
本实验中,FSBM替代部分藻粉后,饲料中氨基酸模式得到改善 [5] ,促进了仿刺参的生长;但随着替代量的升高,氨基酸平衡被破坏(尤其是蛋氨酸的缺乏) [15] ,且可能由于发酵豆粕中抗营养因子去除的不彻底 [16] ,导致了实验仿刺参生长性能的下降,这与在其它水生动物上的研究较为一致 [6] [7] [17] 。此外,饲料粗灰分含量随发酵豆粕含量的升高而升高,这可能是造成仿刺参生长性能下降的另一个原因,但需要进一步的研究。
4.2. FSBM对仿刺参肠道消化酶活力的影响
仿刺参肠道消化酶活力受温度、光照等环境因子或生长阶段影响较大 [18] [20] ,且由于测定方法和酶
Table 5. Effects of dietary FSM on histological structure of intestine of sea cucumber A. japonicus juveniles (n = 10 x ¯ ± SD)
表5. 发酵豆粕对刺参肠道组织结构的影响(um)
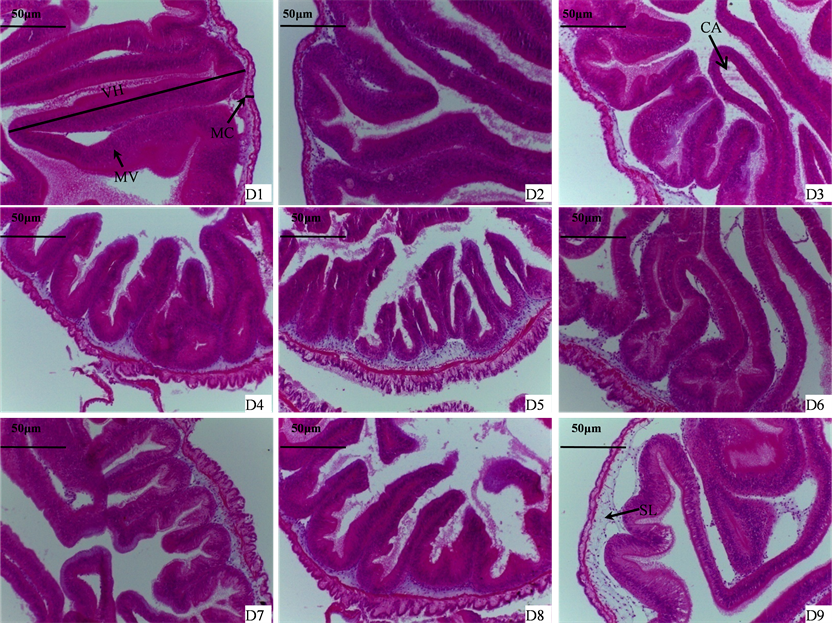
Figure 1. Effects of dietary FBSM on intestinal morphology of sea cucumber A. japonicus juveniles (×200) VH: the height of villus; MC: the thickness of muscularis; MV: microvillus (entrcytes); CA: centrallacteal; ML: submucous layer
图1. FSBM对仿刺参肠道组织形态的影响(×200) VH:肠绒毛长度;MC:肠壁厚度;MV:微绒毛(肠上皮细胞);CA:中央乳糜管;SL:粘膜下层
活力单位定义不一致,导致不同研究者报道的酶活力数值差异较大。但较为一致的是,在同一实验条件下,消化酶活力受饲料成分影响 [21] [22] [23] 。本实验中,FBSM替代藻粉后,蛋白酶活力呈先平稳后降低的趋势,但降低不显著;淀粉酶活力有了显著的提高,这与在穗花狐尾藻 [24] 上的研究较为一致,表明FSBM提高了仿刺参的消化能力。在黑鲷 [25] 和罗非鱼 [26] 上的研究表明FSBM替代鱼粉后,蛋白酶活力有了显著升高;而本实验中FSBM替代鱼粉藻粉混合物后,蛋白酶活力先平稳后显著下降,这可能与实验动物的种类、食性或蛋白源的性质 [27] 有关,也有可能与FSBM替代比例有关。本实验中蛋白酶活力结果与生长结果较为对应,表明FSBM可以通过改善消化功能促进仿刺参的生长。
4.3. FSBM对仿刺参肠道代谢酶活力的影响
转氨酶(aminotransferase)是催化氨基酸和酮酸之间氨基转移的一类酶,也是平衡机体糖和氨基酸代谢的酶之一。激酶是一类从高能供体分子(如ATP)转移磷酸基团到特定靶分子(底物)的酶,HK和PK是糖酵解途径主要限速酶。在脊椎动物上的研究表明:转氨酶主要分布于脑、肝脏等组织,是评价肝功能的重要指标之一;而HK和PK主要分布于以糖为能源的细胞,在肝脏、肌肉、脑等组织中分布较多。不同于脊椎动物,仿刺参不具备高度分化的细胞组织。目前尚无关于仿刺参肠道转氨酶及糖代谢激酶活力的报道,但Wang et al. (2017)等从仿刺参肠道中克隆出ALT、HK、PK基因 [28] ,证明仿刺参肠道中存在上述酶,并且其表达量受环境因素影响较大。本实验中FBSM替代藻粉后,四种代谢酶活力均发生了显著变化,表明肠道是仿刺参重要的营养代谢组织;转氨酶活力上升,HK和PK活力下降,表明FBSM替代藻粉后,加强了刺参肠道氨基酸代谢,抑制了糖酵解过程,换而言之,替代提高了蛋白质的利用效率。
4.4. FSBM对仿刺参肠道结构的影响
与奥尼罗非鱼(Oreochromis niloticus × O. auresu) [29] 、大菱鲆(Scophthalmus maximus L.) [30] 等相比,仿刺参肠道绒毛长度相当(×100 μm),但肠壁厚度显著降低(×10 μm→×1 μm),与吴永恒等 [14] 、樊英 [22] 等研究较为相似。肠壁薄可能与仿刺参肠道具有“再生”能力有关,也可能与仿刺参缺乏高度分化的转运系统有关,肠壁薄利于物质交换。
目前,关于仿刺参肠道结构的报道相对较少,吴永恒等研究表明饲料蛋白质含量可显著影响仿刺参前肠结构 [14] 。本实验中,仿刺参肠道绒毛长度及中央乳糜管宽度受饲料因素影响极为显著,表明仿刺参肠道结构不仅受饲料蛋白质含量的影响,也受饲料蛋白质质量的影响。由于仿刺参缺乏高度分化的组织细胞,因此肠道在其消化代谢生理中的作用非常重要,肠道结构破坏势必会对其生理造成影响。本实验中,生长最优组出现在D2、D3组之间,与肠道结构变化较为一致;替代鱼粉藻粉混合物后,D7组生长略低于D1、D6组,与肠道结构的变化也较为一致;均表明肠道结构的状态与仿刺参生长存在正相关关系。此外,FSBM替代藻粉后,对肠壁厚度无显著影响,但显著降低绒毛长度;发酵豆粕替代鱼粉藻粉混合物后,肠壁厚度和绒毛长度均呈先上升后降低的趋势,表明适当降低饲料中鱼粉含量,可能会促进仿刺参肠道发育。FSBM替代鱼粉后会对破坏黑鲷幼鱼的肠道结构 [25] ,这可能反映了种属和食性的差异。
5. 结论
FSBM替代藻粉或鱼粉藻粉混合物后,显著破坏了仿刺参肠道结构、影响了肠道消化及代谢酶活力。以消化生理变化为评价指标,仿刺参配合饲料中FSBM的添加量不宜超过10%。
基金项目
山东省现代农业产业技术体系–刺参创新团队建设项目(SDAIT-22-06)。山东省重点研发计划(2016GSF116006)。
文章引用
李宝山,王际英,张利民,王晓艳,王成强,郝甜甜,孙永智. 发酵豆粕替代藻粉对仿刺参生长及消化生理的影响
Effects of Replacing Algae Powder by Fermented Soybean Meal on Growth and Digestive Physiology of Juvenile Sea Cucumber Apostichopus japonicus Selenka[J]. 海洋科学前沿, 2018, 05(02): 89-97. https://doi.org/10.12677/AMS.2018.52011
参考文献
- 1. 张丽靖, 齐莉莉, 杨郁. 纳豆菌对豆粕脲酶活性的影响[J]. 大豆科学, 2008, 27(4): 670-672.
- 2. Hong, K.J., Lee, C.H. and Kim, S.W. (2004) Aspergillus oryzae GB-107 Fermentation Improve Nutritional Quality of Soybeans and Feed Soybean Meal. Journal of Medicinal Food, 7, 430-434.
https://doi.org/10.1089/jmf.2004.7.430 - 3. Kim, B.N., Yang, J.L. and Song, Y.S. (1999) Physi-ological Functions of Chongkukjang. Food Industry and Nutrition, 4, 40-46.
- 4. 李宝山, 张利民, 张德瑞, 等. 发酵豆粕替代藻粉对刺参(Apostichopus japonicus)生长及体组成的影响[J]. 渔业科学进展, 2017, 38(5): 130-139.
- 5. Kader, M.A., Koshio, S., Ishikawa, M., et al. (2012) Can Fermented Soybean Meal and Squid By-Product Blend Be Used as Fishmeal Replacements for Japa-nese Flounder (Paralichthys olivaceus)? Aquaculture Research, 43, 1427-1438.
https://doi.org/10.1111/j.1365-2109.2011.02945.x - 6. Luo, Z., Liu, Y.J., Mai, K.S., et al. (2004) Partial Replacement of Fish Meal by Soybean Protein in Diets for Grouper Epinephelus coioides Juveniles. Journal of Fisheries of China, 28, 175-181.
- 7. Azarm, H.M. and Lee, S.M. (2014) Effects of Partial Substitution of Dietary Fish Meal by Fermented Soybean Meal on Growth Performance, Amino Acid and Biochemical Parameters of Juvenile Black Sea Bream Acanthopagrus schlegeli. Aquaculture Research, 45, 994-1003.
https://doi.org/10.1111/are.12040 - 8. Yamamoto, T., Iwashita, Y., Matsunari, H., Sugita, T., Furuita, H., Akimoto, A., Okamatsu, K. and Suzuki, N. (2010) Influence of Fermentation Conditions for Soybean Meal in a Non-Fish Meal Diet on the Growth Performance and Physiological Condition of Rainbow trout Oncorhynchus mykiss. Aquaculture, 309, 173-180.
https://doi.org/10.1016/j.aquaculture.2010.09.021 - 9. Xia, S.D., Zhao, P., Chen, K., et al. (2012) Feeding Preferences of the Sea Cucumber Apostichopus japonicus (Selenka) on Various Seaweed Diets. Aquaculture, 344-349, 205-209.
- 10. Xia, S.D., Yang, H.S., Li, Y., et al. (2012) Effects of Different Seaweed Diets on Growth, Digestibility, and Ammonia-Nitrogen Production of the Sea Cucumber Apostichopus japonicus (Selenka). Aquaculture, 338-341, 304-308.
https://doi.org/10.1016/j.aquaculture.2012.01.010 - 11. Shi, C., Dong, S.L., Wang, F., et al. (2013) Effects of Four Fresh Mi-croalgae in Diet on Growth and Energy Budget of Juvenile Sea Cucumber Apostichopus japonicus (Selenka). Aquaculture, 416-417, 296-301.
- 12. 黄亮华, 李浩洋, 李彬, 等. 裂壶藻对刺参生长、免疫及消化酶的影响[J]. 渔业科学进展, 2014, 35(3): 91-97.
- 13. 王际英, 宋志东, 李培玉, 等. 饲料添加半乳甘露寡糖对刺参幼参生长、体壁营养组成及免疫力的影响[J]. 中国水产科学, 2014, 21(2): 310-319.
- 14. 吴永恒, 王秋月, 冯政夫, 等. 饲料粗蛋白含量对刺参消化酶及消化道结构的影响[J]. 海洋科学, 2012, 36(1): 36-41.
- 15. Deng, J.M., Mai, K.S., Ai, Q.H., et al. (2006) Effects of Replacing Fish Meal with Soy Protein Concentrate on Feed Intake and Growth of Juvenile Japanese Flounder, Paralichthys olivaceus. Aquaculture, 258, 503-513.
- 16. Uyan, O., Koshio, S., Teshima, S., et al. (2006) Growth and Phosphorus Loading by Partially Replacing Fishmeal with Tuna Muscle By-Product Powder in the Diet of Juvenile Japanese Flounder, Paralichthys olivaceus. Aquaculture, 257, 437-445.
- 17. Yuan, Y.C., Lin, Y.C., Yang, H.J., et al. (2013) Evaluation of Fermented Soybean Meal in the Practical Diets for Juvenile Chinese Sucker, Myxocyprinus asiaticus. Aquaculture Nutrition, 19, 74-83.
https://doi.org/10.1111/j.1365-2095.2012.00939.x - 18. Gao, F., Yang, H.S., Xu, Q., et al. (2009) Effect of Water Temperature on Digestive Enzyme Activity and Gut Mass in Sea Cucumber Apostichopus japonicus (Selenka), with Special Reference to Aestivation. Chinese Journal of Oceanology and Limnology, 27, 714-722.
https://doi.org/10.1007/s00343-009-9202-3 - 19. 魏子仲, 赵文. 光照强度对不同养殖方式下刺参幼参生长及消化酶活性的影响[J]. 应用生态学报, 2014, 25(1): 237-242.
- 20. 周玮, 田甲申, 黄俊鹏, 等. 不同生长阶段仿刺参肠道内含物及消化酶活性的变化[J]. 大连海洋大学学报, 2010, 25(5): 460-464.
- 21. Wen, B., Gao, Q.F., Dong, S.L., et al. (2016) Effects of Dietary Inclusion of Benthic Matter on Feed Utilization, Digestive and Immune Enzyme Activities of Sea Cucumber Apostichopus japonicus (Selenka). Aquaculture, 458, 1-7.
- 22. 樊英, 于晓清, 李乐, 等. 不同免疫增强剂对仿刺参肠道消化酶活性及组织结构的影响[J]. 水产学杂志, 2014, 27(4): 46-51, 59.
- 23. 郭娜. 不同饲料对刺参(Apostichopus japonicus)生长、消化生理和能量收支的影响[D]: [博士学位论文]. 青岛: 中国海洋大学, 2011.
- 24. 何舟. 不同饲料对刺参生长、体成分、免疫相关酶和消化酶活性的影响[D]: [硕士学位论文]. 大连: 大连海洋大学, 2014.
- 25. 彭翔, 宋文新, 周凡, 等. 发酵豆粕替代鱼粉对黑鲷胃肠道和血清指标的影响[J]. 江苏农业学报, 2012, 28(5): 1096-1103.
- 26. Lin, S.M., Mai, K.S., Tan, B.P., et al. (2010) Effects of Four Vegetable Protein Supplementation on Growth, Digestive Enzyme Activities, and Liver Functions of Juvenile Tilapia, Oreochromis niloticus × Oreochromis aureus. Journal of World Aquaculture Society, 41, 583-593.
https://doi.org/10.1111/j.1749-7345.2010.00398.x - 27. 樊月居, 李晓东, 罗智, 等. 饲料中用豆粕替代鱼粉对仿刺参幼参生长、体成分及消化酶活性的影响[J]. 大连水产学院学报, 2010, 25(1): 71-75.
- 28. Wang, J.H., Guo, H., Zhang, T.R., et al. (2017) Growth Performance and Digestion Improvement of Juvenile Sea Cucumber Apostichopus japonicus Fed by Solid-State Fermentation Diet. Aquaculture Nutrition, 23, 1312-1318.
https://doi.org/10.1111/anu.12506 - 29. 刘爱君, 冷向军, 李小勤, 等. 甘露寡糖对奥尼罗非鱼(Oreochromis niloticus × O. auresu)生长、肠道结构和非特异性免疫的影响[J]. 浙江大学学报(农业与生命科学版), 2009, 35(3): 329-336.
- 30. 胡海滨, 刘金桃, 李彦先, 等. 饲料中大豆黄酮对大菱鲆生长、消化酶活力、抗氧化力及肠道结构的影响[J]. 水产学报, 2014, 38(9): 1503-1513.
