Advances in Clinical Medicine
Vol.
12
No.
12
(
2022
), Article ID:
59578
,
12
pages
10.12677/ACM.2022.12121676
一种新型仿生材料用于硬脑膜缺损修复研究
邓坤学1*,代兴亮2,林丽敏3,李宗奕1,袁玉宇1,徐弢4#
1广州迈普再生医学科技股份有限公司,广东 广州
2安徽医科大学第一附属医院神经外科,安徽 合肥
3深圳迈普再生医学科技有限公司,广东 深圳
4深圳清华大学研究院,生物智能制造中心,广东 深圳
收稿日期:2022年11月21日;录用日期:2022年12月15日;发布日期:2022年12月27日

摘要
目的:评价一种新型仿生材料用于硬脑膜缺损修复的安全性及有效性。方法:采用增材制造技术制备的聚乳酸新型仿生材料,分别开展了体外和体内研究,研究材料的微观结构、细胞增殖活性、力学特性,以及原位植入硬脑膜缺损后,与周边组织相容性和缺损硬脑膜修复情况等。结果:新型仿生材料微观结构为三维网络结构,对细胞增值活性无影响,其拉伸强度和断裂伸长率均明显高于对照品EthisorbTM。动物实验研究显示材料组织相容性良好,可实现硬脑膜缺损修复。结论:新型仿生材料具有较好的力学性能,组织相容性良好,可诱导周边组织细胞爬行到支架,诱导新生毛细血管生成促进新生组织形成,可作为硬膜缺损修复的新材料,实现硬脑膜再生修复。
关键词
新型仿生材料,力学性能,修复硬脑膜

The Novel Biomimetic Material Study for Repairing the Defect Dura Mater
Kunxue Deng1*, Xingliang Dai2, Limin Lin3, Zongyi Li1, Yuyu Yuan1, Tao Xu4#
1Guangzhou Medprin Regenerative Medical Technologies Co., Ltd., Guangzhou Guangdong
2Department of Neurosurgery, The First Affiliated Hospital of Anhui Medical University, Hefei Anhui
3Shenzhen Medprin Regenerative Medical Technologies Co., Ltd., Shenzhen Guangdong
4Biological Intelligent Manufacturing Center, Research Institute of Tsinghua University in Shenzhen, Shenzhen Guangdong
Received: Nov. 21st, 2022; accepted: Dec. 15th, 2022; published: Dec. 27th, 2022

ABSTRACT
Objective: To evaluate the safety and efficacy of the novel biomimetic material in dura mater defect repair. Methods: The novel biomimetic material were fabricated by the additive manufacturing technology, and the in-vitro and vitro studies were performed for the novel biomimetic material, to study the microstructure, cell proliferation activity, mechanical properties of the materials, as well as after the novel biomimetic material were implanted in situ, the compatibility with the surrounding tissue and repair effect of the defect dura mater and so on. Results: The microstructure of the new biomimetic material was three-dimensional network structure, which had no effect on the proliferation activity of cells. The tensile strength and elongation at break of the novel biomimetic material were significantly higher than that of the control group EthisorbTM. Animal study showed that the novel biomimetic material has good biocompatibility with the tissue and can repair defect dura mater. Conclusion: The novel biomimetic material has good mechanical properties and good biocompatibility, and it can induce the surrounding tissue cells to migrate to the scaffold, and induce the new capillary angiogenesis to promote the new tissue formation. Thus, it can be used as a new material for dura defect repair to achieve dura mater.
Keywords:Novel Biomimetic Material, Mechanical Properties, Repair the Dura Mater

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
硬脑膜是脑组织表面一层重要的组织结构,是保护脑组织的一道重要屏障,对于维护神经系统的结构及功能活动意义重大 [1] [2] [3]。开放性损伤、脑肿胀、炎性反应、过分电灼脑膜等因素均可导致硬脑膜无法关闭而形成缺损,进而可导致脑脊液漏、颅内感染、切口迁延不愈、癫痫发作、脑膜炎等并发症 [1] [4] [5] [6] [7] [8]。为了降低并发症对患者的影响,约10%~30%的脑部手术需要行硬膜修补术修补缺损的硬脑膜 [9]。
为了寻找合适的硬脑膜修补材料,各国学者在过去一百多年中不断尝试新的修补材料 [10] [11] [12]。在1895年,橡胶薄片被作为第一个硬脑膜支架用于硬脑膜缺损修补。两年后,金箔被报道用于硬脑膜替代物。在1898年,鸡蛋膜被尝试用于硬脑膜替代物。随后,聚乙烯膜、合成纤维等合成材料被报道用于作为硬脑膜替代物。但是这些材料大部分被报道存在异物反应、形成疤痕、大量粘连脑组织表面等临床严重不良反应 [13]。在1958年后,随着冻干技术和溶剂干燥技术的发展,冻干同源尸体硬脑膜因良好的生物相容性在过去被广泛用于临床上作为硬脑膜替代物。但随着近些年报道了患者使用冻干同源尸体硬脑膜被感染了病毒(如:克雅氏疾病)后,为了解决临床需求,膨胀聚四氟乙烯和动物来源的胶原组织支架等目前被广泛用于临床作为硬脑膜替代物 [13] - [23]。但是膨胀聚四氟乙烯不可降解,在人体内长期存在,而胶原组织支架作为动物来源,存在病毒传染的风险。
根据文献报道,一种理想的硬脑膜替代物应有以下特点:① 具有稳定的生物惰性,不引起急慢性炎症反应;② 安全性好,无毒性,无致癌作用,不传播疾病;③ 组织相容性好,不产生免疫反应;④ 具有一定的致密性,能防止脑脊液渗漏;⑤ 良好的韧性和强度,能承受缝合;⑥ 能起到支架作用,促使新生硬脑膜的形成,与脑组织不发生黏连;⑦ 可吸收性,新生硬脑膜形成的同时,人工硬脑膜应逐渐被吸收;⑧ 操作简便,来源广泛,价格低廉,易于保存 [24] [25]。
结合上述理想的硬脑膜替代物的特点可知,目前临床上广泛使用的脑膜替代物依然存在不可避免的缺点,硬脑膜修复材料仍需进一步开发。
因此,本研究的目的是关于一种新型仿生材料用于硬脑膜修补的研究。在本研究中,通过开展体外和体内研究,评价新型仿生材料的力学性能、生物相容性能和硬脑膜缺损修复效果,评价新型仿生材料用于硬脑膜修复的安全性和有效性。
2. 材料和方法
2.1. 材料
试验样品为可吸收硬脑(脊)膜补片由广州迈普再生医学科技股份有限公司提供,该产品以聚乳酸(PLA)为原材料,采用增材制造技术制备而成。产品为无菌包装,经辐照灭菌后一次性使用。本研究使用的对照样品为市售的硬膜修补片(商品名:EthisorbTM),该产品经环氧乙烷灭菌,一次性使用。见图1。

Figure 1. Test sample (left) and control sample (right)
图1. 试验样品(左图)和对照样品(右图)
2.2. 材料表征
2.2.1. 微观结构
对试验样品进行喷金处理,然后将处理后的样品放置在扫描电子显微镜(SEM) (ESEM XL30 HY-3080, FEI, USA)中观察试验样品的微观结构。
2.2.2. 材料对细胞增殖活性的影响
按照采用GB/T 16886.12中的要求制备浸提液,采用MTT法检测试验样品的细胞毒性。试验方法如下:
将对数生长期的L929细胞消化制备成单细胞悬液,调整细胞密度为1 × 105个/mL,接种到96孔板中,每孔100 μL,置于37℃,5% CO2培养箱中培养24小时;分别加入100 μL试验样品浸提液(100%、50%、25%、12.5%)、空白对照液(浸提介质)、ZDEC及ZDBC浸提阳性对照液(100%、50%、25%、12.5%)、高密度聚乙烯浸提阴性对照液(100%),每组3个复孔,培养24小时,弃去培养基,吸出培养液,每孔加50 μL MTT (1 mg/mL),培养2小时,吸出上清,加100 μL 99.5%纯度的异丙醇溶解结晶;在酶标仪上以570 nm为主吸收波长,650 nm为参考波长测定吸光度值。然后根据样品测量值与空白对照细胞的比值,计算的细胞活力百分比。
2.2.3. 力学性能
采用电子拉力试验机(HY3080,上海衡翼精密仪器有限公司)按ISO 527-3标准检测拉伸强度和断裂伸长率。分别按横向和纵向将试样切成1 cm × 6 cm,然后安装在拉力试验机上。每组5个样品,以200 mm/min的速度进行测试。分别记录试验样品和对照样品横向和纵向的拉伸强度和断裂伸长率。
2.3. 动物试验研究
2.3.1. 试验动物选择
试验选择健康成年犬,共15只,雌雄不限,6月龄。所有纳入试验动物毛发光泽发亮,眼角、鼻端无异常分泌物,运动行为协调,肌肉收缩有力。购买回来后予以单笼常规饲养。
2.3.2. 试验方法
将15只试验犬随机分为3组,每组5只。动物随机分组方法参考文献报道 [26] [27] 的随机法,即:使用Excel软件建立随机分组模板文件,记录动物编号和体重结果,并将动物编号与体重结果录入随机分组模板文件中,生成随机分组操作表。分别进行术后4周、12周和26周观察。试验方法为制备矢状线两侧的硬脑膜缺损动物模型,分别对左、右侧硬脑膜缺损使用试验样品及对照样品进行修补,然后于术后不同周期解剖动物,观察评价植入物与植入部位的组织相容性及缺损硬脑膜修复情况。
2.3.3. 手术操作方法
实验动物术前预先肌注阿托品,然后静脉缓慢推注3%戊巴比妥钠(1 ml/kg)予以麻醉。头顶部皮肤剔除毛发,将实验动物俯卧位固定于手术台上。沿头顶矢状线纵向切开头皮,进入头皮后用单极电刀沿矢状缝,旁开约0.5厘米,分别分离双侧顶部肌群,用剥离器分离骨膜,暴露左右两侧颞顶部颅骨约4 cm × 3 cm的范围,用高速磨钻钻磨颅骨,形成3.5 cm × 2.5 cm左右的骨窗。取出骨板,暴露硬脑膜,用显微剪制备尺寸为2.5 cm × 1.5 cm的椭圆形硬脑膜缺损模型,制成硬脑膜缺损。
从无菌包装袋中分别取出硬脑膜补片材料,根据缺损的硬脑膜尺寸修剪材料,以刚好覆盖缺损为宜。使用3/0无损伤丝线分别对补片材料与缺损硬膜周边的自体脑膜进行间断缝合,补片与自体脑膜间不留腔隙。硬膜外双侧放置引流条,放回骨板,分别使用1号丝线缝及4号丝线间断缝合肌肉和头皮,关闭术部切口。
术后待动物完全清醒后送回动物房,常规饲养。动物手术后连续五天抗生素治疗预防术后感染,青霉素2次/天,80万单位/次肌肉注射,氯霉素2次/天,0.5 g/次肌肉注射。术前一周测试体温。每天观察动物饮食、术部情况、四肢活动情况、癫痫抽搐并发症等。
所有试验动物在预设观察期终点时静脉注射戊巴比妥钠(135 mg/kg)进行安乐死。纵向切开头皮和皮下肌肉,取出颅骨板,大体观察两侧补片材料的缺损修复情况,包括材料与脑组织之间的粘连、对缺损硬脑膜修复等。然后分别取出植入的试验样品及对照样品侧修补材料及周围组织固定于10%的福尔马林中,制作病理切片,HE染色后进行组织病理学观察评价,评价内容包括植入材料降解、细胞长入、胶原沉积情况等,及周围组织、细胞反应情况。
3. 实验结果
3.1. 微观结构
新型仿生硬脑膜材料的扫描电镜如图2所示。由图可知,新型仿生硬脑膜材料微观结构由纤维层层堆积构成高度贯穿的三维网络结构,与人体硬脑膜微观结构相似,为细胞提供一个接近于真实环境的微环境,为细胞生长增殖提供一个仿生环境。
3.2. 材料对细胞增殖活性的影响
通过MTT方法评价新型仿生材料对细胞增殖活性的影响。结果如表1所示,100%浓度的新型仿生材料浸提液的细胞活力百分比大于70%,根据GB/T 16886.5标准可以判定仿生材料对细胞增值活性无毒性影响,具有良好的细胞相容性。

Figure 2. The SEM of the novel biomimetic material
图2. 新型仿生材料SEM图
Table 1. The MTT test result of the novel biomimetic material
表1. 新型仿生材料MTT试验结果
3.3. 力学性能
新型仿生材料和对照品EthisorbTM的力学性能如图3所示。新型仿生材料横向平均拉伸强度为(5.49 ± 0.91) MPa,纵向平均拉伸强度为(4.80 ± 0.41) MPa;新型仿生材料横向平均断裂伸长率为(109.63 ± 7.73)%,新型仿生材料纵向平均断裂伸长率为(111.4 ± 24.05)%。对照品EthisorbTM横向平均拉伸强度为(1.52 ± 0.10) MPa,纵向平均拉伸强度为(1.41 ± 0.17) MPa;对照品EthisorbTM横向平均断裂伸长率为(24.21 ± 2.97)%,纵向平均断裂伸长率为(25.92 ± 0.10)%。新型仿生材料的拉伸强度和断裂伸长率明显高于对照品EthisorbTM,为硬脑膜缺损修复过程中提供更高的力学支撑。
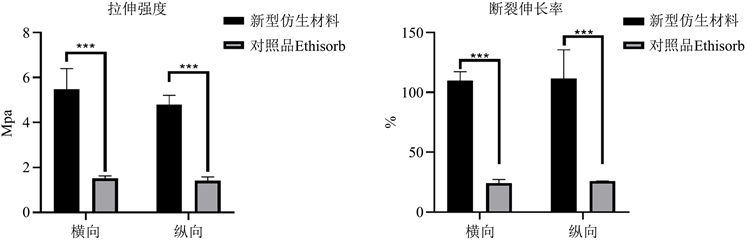
Figure 3. The mechanical properties of novel biomimetic material and control group (Left: tensile strength; Right: breaking elongation rate; ***represents P < 0.001)
图3. 新型仿生材料和对照品的力学性能(左图:拉伸强度;右图:断裂伸长率;***表示P < 0.001)
3.4. 动物试验
3.4.1. 手术过程
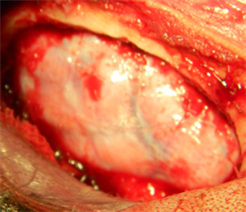
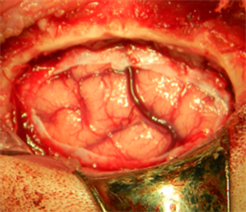
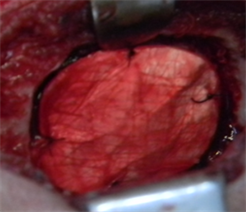
无菌操作条件下制备犬硬膜缺损动物模型,将试验样品新型仿生材料及对照样品EthisorbTM分别植入缺损硬膜部位,如图4所示。手术过程中可观察到新型仿生材料和对照品均可很好的贴附在周边组织上,封闭缺损部位。
 (a)
(a)
 (b)
(b)
 (c)
(c)
 (d)
(d)
Figure 4. Intraoperative operation ((a) Expose the dura mater; (b) defect dura mater (size: about 2 × 1.5 cm; (c) Implant the novel biomimetic material; (d) Implant control group EthisorbTM)
图4. 术中操作((a) 暴露硬脑膜;(b) 缺损硬脑膜(大小约2 × 1.5 cm);(c) 植入新型仿生材料;(d) 植入对照品EthisorbTM)
3.4.2. 术后护理及观察
所有实验动物术后均恢复清醒,无麻醉死亡情况。手术后第3天,动物恢复正常的饮食,体重无减轻。术后5天动物体温均有轻度的升高,5天后逐渐恢复正常。所有实验动物术部均未发生感染。在术后2~4天期间,有2只发生皮下积液,皮下触摸有波动感,穿刺抽取为淡红色液体,经过一次穿刺治疗皮下积液消失,术部愈合良好。所有试验动物无神经行为异常、无癫痫发生、无CSF渗漏。实验观察期间,无动物死亡。
3.4.3. 解剖大体观察
术后4周:新型仿生材料和对照样品EthisorbTM硬脑膜替代物均与自身脑膜较好的融合长入,解剖可见到明显的硬脑膜缺损边沿,硬脑膜补片完整封闭硬脑膜缺损,无脑脊液渗漏。剥离硬脑膜暴露脑组织,未见脑组织出血和脑水肿,新型仿生材料和EthisorbTM与脑组织均无粘连。
术后12周:新型仿生材料和EthisorbTM材料边沿与自体硬脑膜较好的结合,完整的封闭硬脑膜缺损,无脑脊液渗漏。剥离硬脑膜暴露脑组织,未见脑组织出血和脑水肿。新型仿生材料与脑组织无粘连,EthisorbTM与脑组织有较薄束状粘连。EthisorbTM植入处内表面较光滑,肉眼未见明显材料。
术后26周:新型仿生材料和EthisorbTM材料边沿与自体硬脑膜较好的结合,完整的封闭硬脑膜缺损,无脑脊液渗漏。剥离硬脑膜暴露脑组织,未见脑组织出血和脑水肿。试验样品组及对照样品组与脑组织均未见无明显粘连。
解剖观察情况见下图5:
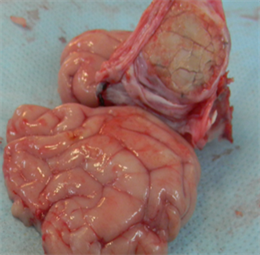 (a1)
(a1)
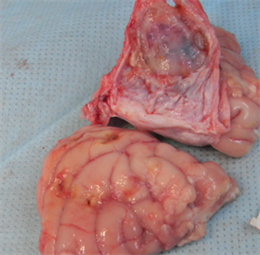 (b1)
(b1)
 (a2)
(a2)
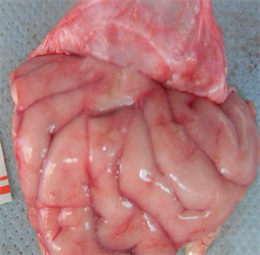 (b2)
(b2)
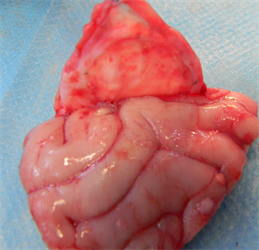 (a3)
(a3)
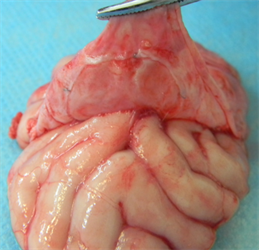 (b3)
(b3)
Figure 5. Postoperative anatomy ((a1), (a2) and (a3) were the anatomical images of the novel biomimetic material at 4 weeks, 12 weeks and 26 weeks after operation, respectively; (b1), (b2) and (b3) were the anatomical images of the EthisorbTM at 4 weeks, 12 weeks and 26 weeks after operation, respectively)
图5. 术后解剖((a1)、(a2)和(a3)分别为新型仿生材料术后4周、12周和26周解剖图;(b1)、(b2)和(b3)分别为EthisorbTM术后4周、12周和26周解剖图)
3.4.4. 硬脑膜组织病理观察
植入4周:新型仿生材料表面纤维组织增生,内部可见成纤维细胞和微血管长入,其间可见少量淋巴细胞和少量巨噬细胞浸润。软脑膜轻度增厚,蛛网膜下腔未见扩张及出血,大脑皮质组织细胞未见异常。
对照组EthisorbTM材料呈团块状,结构致密,可见材料周围纤维组织增生,长入材料间隙,未见明显细胞长入材料内部,其间可见少量淋巴细胞及较多巨噬细胞浸润,局部可见钙化灶和出血灶。软脑膜未见增厚,蛛网膜下腔未见扩张及出血,大脑皮质组织细胞未见异常。
植入12周:新型仿生材料表面纤维组织增生,开始有胶原沉积形成。可见大量成纤维细胞和毛细血管长入材料内部,其间见少量淋巴细胞及少量巨噬细胞浸润。软脑膜可见轻度增厚,硬脑膜可见中度增厚,蛛网膜下腔未见扩张及出血,大脑皮质组织细胞未见异常。
对照组EthisorbTM材料呈团块状,周边纤维组织增生,并开始有胶原沉积形成。可见较少纤维细胞和毛细血管长入材料内部,其间可见少量淋巴细胞浸润。软脑膜可见轻度增厚,蛛网膜下腔未见扩张及出血,大脑皮质组织细胞未见异常。
植入26周:新型仿生材料新生硬脑膜基本完成修复,可见胶原沉积,形成致密的典型的硬脑膜组织结构。局部见小部分材料残留,无明显炎性反应。大脑皮质组织细胞未见异常。
对照组EthisorbTM新生硬脑膜基本完成修复,可见胶原沉积,形成致密的典型的硬脑膜组织结构。EthisorbTM材料基本降解完成,未见明显炎性反应。大脑皮质组织细胞未见异常。
3.4.5. 试验评价结果
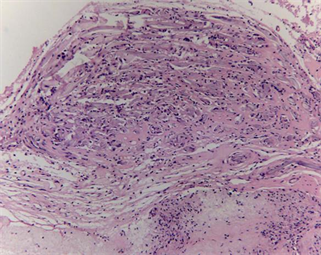
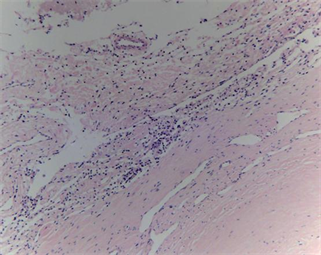
采用动物模型模拟临床使用硬脑膜补片修复硬脑膜缺损,将新型仿生脑膜补片与EthisorbTM同时使用在同一只动物的左、右两侧,进行对比试验。从试验动物术后愈合情况来看,无脑脊液漏、癫痫、四肢运动不协调等并发症发生,无感染发生。试验动物术后5天有轻度发热,随后恢复正常,推测为动物术后正常临床反应。15只试验动物其中有2只出现术部皮下少量积液,可能与手术操作有关,通过穿刺治疗后皮下积液均消失,术部愈合良好,植入部位无不良刺激反应。新型仿生脑膜补片与EthisorbTM硬脑膜替代物均能有效的修复硬脑膜缺损,防止脑脊液渗漏。术后4周、12周及26周的组织病理观察发现(如图6所示),新型仿生材料和EthisorbTM硬脑膜替代物均具有轻度炎症反应,但总体炎症反应均在可接受范围内,且随着植入时间延长,材料降解被吸收代谢后,局部组织的炎症反应减轻逐步达到稳定,并伴随着硬脑膜材料内的成纤维细胞长入和胶原沉积,最终达到硬脑膜细胞再生修复的效果。
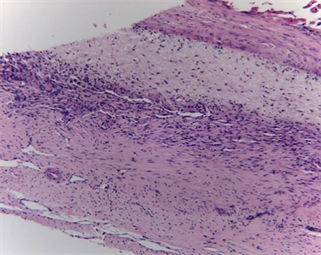 (a1)
(a1)
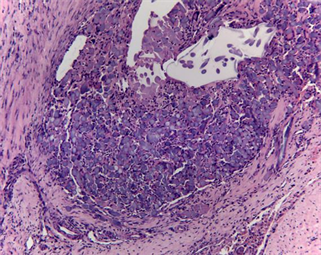 (b1)
(b1)
 (a2)
(a2)
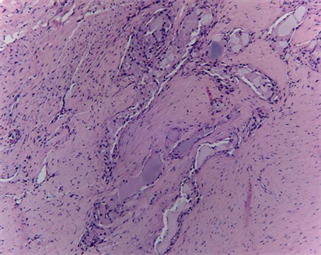 (b2)
(b2)
 (a3)
(a3)
 (b3)
(b3)
Figure 6. Histopathology of implanted dural mater materials and around tissue (HE, ×100). ((a1), (a2) and (a3) were histopathology at 4 weeks, 12 weeks and 26 weeks after implantation of the novel biomimetic material, respectively; (b1), (b2) and (b3) were histopathology at 4 weeks, 12 weeks and 26 weeks after implantation of EthisorbTM, respectively)
图6. 硬脑膜植入物与周围组织的组织病理(HE, ×100)。((a1)、(a2)和(a3)分别为新型仿生材料植入后4周、12周和26周组织病理图,(b1)、(b2)和(b3)分别为EthisorbTM植入后4周、12周和26周组织病理图)
4. 讨论
硬脑膜重建或硬脑膜成形术,是一种重要的神经外科手术,可用于修复缺损的硬脑膜,防止脑脊液渗漏等并发症发生。根据文献报道 [28] [29] [30],硬脑膜修复过程中,硬脑膜愈合机制为细胞由硬脑膜缺损的边缘向缺损中间生长实现修复。
新型仿生材料微观结构为三维孔隙微观结构,与人体机体细胞外基质微纤维结构类似,为新生成的纤维细胞生长迁移提供仿生的基质 [31],更加有助于促进新生脑膜的修复重建,其修复效果在动物试验中得到验证。动物实验结果显示新型仿生材料可以促进更多成纤维细胞长入材料内部,并且植入材料周边可见大量毛细血管增生,更多的成纤维细胞及毛细血管的增长均有利于新生组织的形成;而EthisorbTM由于其结构致密,细胞较难长入材料内部。因此,新型仿生材料相较于致密结构的EthisorbTM在硬膜缺损修复方面更具备优势。且随着植入时间延长,材料降解被吸收代谢后,局部组织的炎症反应减轻逐步达到稳定,并伴随着硬脑膜材料内的成纤维细胞长入和胶原沉积,最终达到硬脑膜细胞再生修复的效果。另外,本研究的新型仿生材料在体内可被降解吸收,且降解代谢产物为CO2和H2O,对人体安全 [32]。同时,新型仿生材料具有良好的拉伸强度和断裂伸长率,可以为硬脑膜临床使用和修复提供较好的力学支持,是一种较为接近理想硬脑膜替代物的产品。
本研究中通过采用MTT法检测新型仿生材料的细胞毒性和动物试验对新型仿生材料生物相容性进行评价。若增加细胞水平和分子水平相关研究,如:研究细胞如何在新型仿生材料上实现分化和新型仿生材料如何对细胞DNA,RNA,细胞调控及细胞外基质相关基因表达水平产生影响,进而从微观机理上对新型仿生材料实现硬脑膜修复进行研究,则将使本研究更全面,更深入。
5. 结论
在本研究中,新型仿生材料展示了较好的力学性能和良好的组织相容性,可诱导周边组织细胞爬行到支架,诱导新生毛细血管生成促进新生组织形成,可作为硬膜缺损修复的新材料,实现硬脑膜再生修复,为临床上硬脑膜缺损修补提供选择。
致谢
感谢广州市创新创业领军团队项目(项目编号:201809020010)对本研究的资助。
文章引用
邓坤学,代兴亮,林丽敏,李宗奕,袁玉宇,徐 弢. 一种新型仿生材料用于硬脑膜缺损修复研究
The Novel Biomimetic Material Study for Repairing the Defect Dura Mater[J]. 临床医学进展, 2022, 12(12): 11631-11642. https://doi.org/10.12677/ACM.2022.12121676
参考文献
- 1. 何建军, 佘晓春. 人工硬脑膜在颅脑损伤手术中的应用[J]. 江苏医药, 2011, 37(10): 1231-1232.
- 2. 周玉峰, 黄梅, 邓聪颖, 汤立新. 人工硬脑膜材料的生物相容性[J]. 中国组织工程研究与临床康复, 2011, 15(16): 2945-2948.
- 3. 曾多, 肖妮, 叶世阳, 胡稻, 胡斌, 刘传金, 游涛. 生物型人工硬脑膜用于颅脑损伤硬膜修补术中的效果观察[J]. 中国实用医药, 2020, 15(29): 1-3.
- 4. Sonig, A., Thakur, J.D., Chittiboina, P., et al. (2012) Is Posttraumatic Cerebrospinal Fluid Fistula a Predictor of Posttraumatic Meningitis? A US Nationwide Inpatient Sample Database Study. Neurosurgical Focus, 32, E4. https://doi.org/10.3171/2012.5.FOCUS1269
- 5. Goldschmidt, E., Landriel, F., Bendersky, D., et al. (2011) Mas-sive Subarachnoid Pneumocephalus after a Stereotactic Brain Biopsy. Neurology India, 59, 640-641. https://doi.org/10.4103/0028-3886.84362
- 6. Schlosser, R.J. and Bolger, W.E. (2004) Nasal Cerebrospinal Fluid Leaks: Critical Review and Surgical Considerations. Laryngoscope, 114, 255-265. https://doi.org/10.1097/00005537-200402000-00015
- 7. Sanpakitwattana, A., Suvannapruk, W., Chumnanvej, S., et al. (2022) Cefazolin Loaded Oxidized Regenerated Cellulose/Polycaprolactone Bilayered Composite for Use as Poten-tial Antibacterial Dural Substitute. Polymers (Basel), 14, Article No. 4449. https://doi.org/10.3390/polym14204449
- 8. Entezami, P., Field, N.C., Qian, J. and Yamamoto, J. (2021) Delayed Hypersensitivity Reaction to a Dural Repair Substitute. British Journal of Neurosurgery, 1-4. https://doi.org/10.1080/02688697.2021.1967879
- 9. 徐蒙蒙, 阳范文, 张雅欣, 王晨光, 陈晓明, 田秀梅, 朱继翔. 人工脑膜研究现状及3D打印技术应用前景[J]. 合成材料老化与应用, 2019, 48(1): 93-98.
- 10. 王位坐, 敖强. 硬脑膜修复材料的研究及应用进展[J]. 中华临床医师杂志(电子版), 2018, 12(11): 639-645.
- 11. Lipovka, A.A.-O., Kharchenko, A.A.-O., Dubovoy, A.A.-O., et al. (2021) The Effect of Adding Modified Chitosan on the Strength Properties of Bacterial Cellulose for Clinical Applications. Polymers, 13, Article No. 1995. https://doi.org/10.3390/polym13121995
- 12. Deng, W., Tan, Y., Riaz Rajoka, M.S., et al. (2021) A New Type of Bilayer Dural Substitute Candidate Made Up of Modified Chitin and Bacterial Cellulose. Carbohydrate Polymers, 256, Article ID: 117577. https://doi.org/10.1016/j.carbpol.2020.117577
- 13. Filippi, R., Schwarz, M., Voth, D., et al. (2001) Bovine Peri-cardium for Duraplasty: Clinical Results in 32 Patients. Neurosurgical Review, 24, 103-107. https://doi.org/10.1007/PL00012392
- 14. Jenkins, S.D., Klamer, T.W., Parteka, J.J. and Condon, R.E. (1983) A Comparison of Prosthetic Materials Used to Repair Abdominal Wall Defects. Surgery, 94, 392-398.
- 15. Anson, J.A. and Marchand, E.P. (1996) Bovine Pericardium for Dural Grafts: Clinical Results in 35 Patients. Neurosurgery, 39, 764-768. https://doi.org/10.1097/00006123-199610000-00025
- 16. Freeman III, L. (1898) The Use of Egg-Membrane in Trephining Operations upon the Skull. Annals of Surgery, 28, 455-457.
- 17. Rosomoff, H.L. (1959) Ethylene Oxide Sterilized, Freeze-Dried Dura Mater for the Repair of Pachymeningeal Defects. Journal of Neurosurgery, 16, 197-208. https://doi.org/10.3171/jns.1959.16.2.0197
- 18. Rendón-Medina, M.A., Galeana-Pavón, A., Vázquez-Medina, M.U., et al. (2022) Initial Histological Evaluation of a Novel Dura Mater Graft Based on Capsule Granulation Harvested from Subcutaneous Tissue: Experimental Model. Journal of Craniofacial Surgery, 33, 710-712. https://doi.org/10.1097/SCS.0000000000007985
- 19. Li, J., He, Z., Liu, X., et al. (2022) 3D-Printed Bionic Tita-nium Alloy Artificial Lamina Prevents Epidural Adhesion and Restores the Stability after Laminectomy in Pigs. Journal of Biomedical Nanotechnology, 18, 875-883. https://doi.org/10.1166/jbn.2022.3290
- 20. Yamahara, S., Montenegro Raudales, J.L., Akiyama, Y., et al. (2022) Appropriate Pore Size for Bone Formation Potential of Porous Collagen Type I-Based Recombinant Peptide. Regenera-tive Therapy, 21, 294-306. https://doi.org/10.1016/j.reth.2022.08.001
- 21. Liu, W., Wang, X., Su, J., et al. (2021) In Vivo Evaluation of Fi-brous Collagen Dura Substitutes. Frontiers in Bioengineering and Biotechnology, 9, Article ID: 628129. https://doi.org/10.3389/fbioe.2021.628129
- 22. Marton, E., Giordan, E., Gallinaro, P., et al. (2021) Homologous Amniotic Membrane as a Dural Substitute in Decompressive Craniectomies. Journal of Clinical Neuroscience, 89, 412-421. https://doi.org/10.1016/j.jocn.2021.05.030
- 23. Huang, Y.-O., Liu, Z.-O., Kuo, C.Y. and Chen, J.-O. (2022) Photo-Crosslinked Hyaluronic Acid/Carboxymethyl Cellulose Composite Hydrogel as a Dural Substitute to Pre-vent Post-Surgical Adhesion. International Journal of Molecular Sciences, 23, Article No. 6177. https://doi.org/10.3390/ijms23116177
- 24. Shimada, Y., Hongo, M., Miyakoshi, N., et al. (2006) Dural Substitute with Polyglycolic Acid Mesh and Fibrin Glue for Dural Repair: Technical Note and Preliminary Results. Journal of Or-thopaedic Science, 11, 454-458. https://doi.org/10.1007/s00776-006-1044-7
- 25. 李文辉, 吴日乐, 岑莲. 人工硬脑膜修补材料的研究及其临床应用[J]. 组织工程与重建外科杂志, 2013, 9(2): 113-115.
- 26. 孙建析, 朱勇. 大鼠亚慢性试验随机表的生成与应用[J]. 环境与职业医学, 2007, 24(5): 558-561.
- 27. 孙建析, 洪雅青, 张芳芳, 朱勇. 豚鼠皮肤致敏试验随机分组模板的建立[J]. 职业与健康, 2010, 26(9): 969-972.
- 28. Zhou, F., Chen, G., Zhang, J.M. and Huang, Z.S. (2006) An in Vitro Culturing Model for Rabbit Dural Cells. Annals of Clinical & Laboratory Science, 36, 341-344.
- 29. Schick, B., Wolf, G., Romeike, B.F., et al. (2003) Dural Cell Culture. A New Approach to Study Duraplasty. Cells Tissues Organs, 173, 129-137. https://doi.org/10.1159/000069469
- 30. Goldschmidt, E., Hem, S., Ajler, P., Ielpi, M., et al. (2013) A New Model for Dura Mater Healing: Human Dural Fibroblast Culture. Neurological Research, 35, 300-307. https://doi.org/10.1179/1743132812Y.0000000136
- 31. Chuan, D., Wang, Y., Fan, R., et al. (2020) Fabrication and Properties of a Biomimetic Dura Matter Substitute Based on Stereocomplex Poly(Lactic Acid) Nanofibers. Interna-tional Journal of Nanomedicine, 15, 3729-3740. https://doi.org/10.2147/IJN.S248998
- 32. Kulkarni, R.K., Pani, K.C., Neuman, C. and Leonard, F. (1966) Polylac-tic Acid for Surgical Implants. The Archives of Surgery, 93, 839-843. https://doi.org/10.1001/archsurg.1966.01330050143023
NOTES
*第一作者。
#通讯作者。
