Pharmacy Information
Vol.
08
No.
03
(
2019
), Article ID:
30313
,
6
pages
10.12677/PI.2019.83015
To Investigate the Effects of Folic Acid and Homocysteine on Neurological and Cognitive Function Recovery in Stroke
Jie Liu, Rong Jing*, Junxiang Wu
Affiliated Hospital of Yan’an University, Yan’an Shaanxi

Received: May 1st, 2019; accepted: May 14th, 2019; published: May 21st, 2019

ABSTRACT
Objective: To evaluate the effects of folic acid and homocysteine on neurologic and cognitive function in stroke patients. Methods: Selection of Yanan university hospital neurology dongguan branch between January 2018 and January 2019 was diagnosed with brain stroke combined high homocysteine levels, 401 cases of patients, on the basis of conventional treatment after admission by single blind method consistently give oral folic acid in 401 patients (tianjin 5 mg/day) for 3 months, then before the treatment (baseline), 1 month and 3 months after treatment were determined serum folate and homocysteine (Hcy) concentration, the US national institutes of health stroke scale (NIHSS) and modified Rankin scale (mRS), the study was approved by the ethics committee of the hospital affiliated to Yanan university, all patients or their families signed the informed consent. Results: Serum folic acid levels increased gradually before treatment (baseline), 1 month and 3 months after treatment (p < 0.05), and homocysteine, NIHSS and mRS scores decreased gradually before treatment (baseline), 1 month and 3 months after treatment (p < 0.05), and the difference was statistically significant. Conclusion: High folic acid level can reduce homocysteine concentration and promote neurological and cognitive function recovery in stroke.
Keywords:Folic Acid, Homocysteine, Stroke, Prognosis, Scale
探究叶酸、同型半胱氨酸对脑卒中神经 及认知功能恢复的影响
刘杰,景蓉*,武军祥
延安大学附属医院,陕西 延安
收稿日期:2019年5月1日;录用日期:2019年5月14日;发布日期:2019年5月21日

摘 要
目的:评价叶酸、同型半胱氨酸对脑卒中神经及认知功能恢复的影响。方法:选取延安大学附属医院东关分院神经内科2018年1月至2019年1月被确诊为脑卒中合并高同型半胱氨酸血症的患者401例,入院后在常规治疗的基础上采用单盲法持续给予401例患者口服叶酸(天津力生5 mg/日) 3个月,然后在治疗前(基线)、治疗后1月和3月分别测定血清叶酸、同型半胱氨酸(Hcy)浓度、美国国立卫生院脑卒中量表(NIHSS)和改良Rankin量表(mRS),该研究经延安大学附属医院伦理委员会批准,所有患者或其家属均签署知情同意书。结果:治疗前(基线)、治疗后1月和3月血清叶酸水平逐渐升高(p < 0.05),同型半胱氨酸、NIHSS和mRS评分在治疗前(基线)、治疗后1月和3月逐渐下降(p < 0.05),差异有统计学意义。结论:高叶酸水平在一定程度上可以降低同型半胱氨酸浓度,促进脑卒中神经及认知功能恢复。
关键词 :叶酸,同型半胱氨酸,脑卒中,预后,量表

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
根据世界卫生组织的数据,脑卒中是导致死亡的主要原因,而其列出的2020年人类前三位死亡原因之首即为心脑血管疾病 [1],全球23%的死亡人口是死于冠心病和脑卒中 [2],而脑卒中是我国成年人致死、致残的首位原因 [3],尽管在更好理解其生物学和干预其发病机制方面全世界范围内都做出了重大努力 [4] [5],但是仅死亡率、患病率等似乎不足以解释这类疾病造成的全部负担,脑卒中给幸存者留下了严重的神经功能缺陷,是世界范围内导致重大残疾的主要原因 [6]。如果能在一定程度上改善脑卒中患者的预后降低其致残率,这对减轻脑卒中后遗症负担有很重大的意义。
叶酸、同型半胱氨酸(HCY)与脑卒中患者临床预后密切相关 [7],血中HCY水平升高是一种公认的影响心脑血管疾病转归的危险因素,因此,有效地降低脑卒中患者HCY水平对心脑血管疾病有重要意义 [8]。在过去的20多年里有共识认为叶酸是降低HCY水平最常见、最有效的药物之一 [9],Shu XJ等人认为叶酸与HCY呈负相关关系,叶酸可通过降低HCY的机制来预防血栓的形成与复发 [10],更有研究证实脑卒中患者补充叶酸能降低HCY水平和改善不良结局的发生 [11] [12],Lan X1等人的一项回顾研究显示:小剂量叶酸不仅对脑卒中的发生有预防作用,而且能降低HCY水平和脑卒中风险 [13],连续服用2年叶酸能显著延缓脑血管疾病导致的脑损伤的进展 [14]。这样看来降低高同型半胱氨酸血症(HHCY)患者血中HCY水平至正常范围,对预防和改善脑卒中预后、促进健康具有重要意义,即便如此,叶酸降低HCY的有效性尚未显示一致的结论 [9],而本研究就叶酸通过降低同型半胱氨酸水平来商讨其对改善脑卒中预后的相关性影响,为今后脑卒中预后的临床治疗工作提供一些新的思路。
2. 资料与方法
2.1. 一般资料
选取我院神经内科2018年1月至2019年1月被确诊为脑卒中合并高同型半胱氨酸血症 [15] 的患者401例,年龄40~90岁,平均(64.468 ± 11.613)岁,平均病程(13.389 ± 3.937)天,入院后在常规治疗的基础上采用单盲法持续给予401例患者口服叶酸(天津力生5 mg/日) 3个月,然后在治疗前(基线)、治疗后1月和3月分别测定血清叶酸、同型半胱氨酸(Hcy)浓度、美国国立卫生院脑卒中量表(NIHSS)和改良Rankin量表(mRS) [16] [17]。脑卒中合并高同型半胱氨酸血症的401例患者在年龄、病程、文化程度、饮食习惯、生活环境等方面无明显差异性。列入本研究的对象均具备完整的影像学资料:CT (德国西门子SOMATOM Definition Flash256层螺旋CT)/MRI (德国西门子Magnetom Verio3.0核磁共振成像仪)检查;精确的检验学资料:肾功电解质含同型半胱氨酸值(全自动生化分析仪(ADVIA Chemistry XPT,多点均相免疫测定法)、叶酸值检测(全自动生化分析仪(ADVIA Centaur CP,直接化学发光法);可靠的脑卒中预后评估资料:美国国立卫生研究院脑卒中量表(NIHSS)和改良Rankin量表(mRS)评估患者的神经功能损伤状况。叶酸、同型半胱氨酸、NIHSS评分、mRS评分的获取在入院常规治疗前(基线)收集一次、出院1月后、3月后分别于其两次保养治疗之际再由之前的的同一医生抽取血液标本送检并完成两项评分内容。该研究经延安大学附属医院伦理委员会批准,所有患者或其家属均签署知情同意书。
2.2. 纳入标准和排除标准
纳入标准:1) 符合脑卒中诊断标准,被影像学CT和MRI证实 [18];2) 高同型半胱氨酸血症的诊断标准 [15] 为:血清同型半胱氨酸值 ≥ 15 umol/L;3) 年龄40~90周岁;4) 在入院时抽取血液样本,进行标准的生化常规、肝、肾功、电解质(同型半胱氨酸值)、叶酸、血糖血脂和血液流变学检测等临床资料完整的患者;5) 遵循患者及家属自愿并签署知情同意书。排除标准:1) 不符合脑卒中诊断标准;2) 有基因遗传缺陷的患者如:早老性痴呆症、精神分裂症、抑郁症、癌症等,代谢障碍、内分泌激素紊乱、高脂肪饮食,入院前1周内饮酒、咖啡、浓茶或服用影响同型半胱氨酸和叶酸代谢的药物;3) 存在严重认知及交流障碍无法配合者、脑肿瘤及严重颅内器质性病变者。
2.3. 研究方法
将脑卒中合并高同型半胱氨酸血症患者401例,所有人于入院后抽取清晨空腹静脉血液标本获得叶酸值(全自动生化分析仪(ADVIA Centaur CP,直接化学发光法)、同型半胱氨酸值(全自动生化分析仪(ADVIA Chemistry XPT),多点均相免疫测定法),同一主管医生于床头进行NHISS量表和mRS量表的评分,该次测量作为本次研究的基线水平,之后在常规治疗的基础上采用单盲法持续给予401例患者口服叶酸(天津力生5 mg/日)3个月,后再于出院后1月、3月分别行两次住院保养治疗(醒脑等常规治疗 + 相应后遗症的康复治疗如针灸、微波等),届时再由之前的同一医生做出以上4项指标的测量结果,最后对三次测量结果做统计学分析。
2.4. 观察指标
同一医生负责测量记录脑卒中合并高同型半胱氨酸血症的基线血清叶酸值、基线同型半胱氨酸值,美国国立卫生研究院脑卒中量表(NIHSS)量表和改良Rankin量表(mRS)评定脑卒中合并高同型半胱氨酸血症患者基线水平的神经功能缺陷情况,入院后在常规治疗的基础上加叶酸处理,分别于出院后1月、3月两次测量记录血清叶酸值、同型半胱氨酸值、(NIHSS)量表和改良Rankin量表(mRS)得分情况,最后将三次得到的实验数据进行统计分析。其中NHISS评分和mRS评分,得分高者提示神经功能受损情况较重,得分降低提示神经功能受损情况较前改善,是一种提示较好预后结局的指标。(NHISS评分:0~1分正常或近乎正常;1~4分:轻度卒中/小卒中;5~15分:中度卒中;15~20分:中重度卒中;21~42分:重度卒中);(mRs评分:0分:完全无症状;1分:有症状,无明显功能障碍;2分:轻度残疾,不能完成病前能从事的活动;3分:中度残疾,要求一些帮助,但行走不需要协助;4分:重度残疾,不能独立行走;5分:严重残疾,要求持续护理和照顾) [19]。
2.5. 统计方法
本研究为连续性计量资料,采用swilk-shapiro-wilk检验,服从正态分布,计量资料用均数±标准差(x ± s)表示,进行配对样本t检验,鉴于评分高具有意义,以采用单侧p < 0.05,表示差异有统计学意义,p < 0.01表示差异具有显著性统计意义,所有统计分析均采用SPASS22.0软件实现。
3. 结果
基线水平叶酸值(7.364 ± 1.586) mmol/L、同型半胱氨酸值(34.083 ± 21.670) umol/L、NIHSS量表(12.299 ± 2.243)分和mRS量表(34.083 ± 0.824)分;1月后叶酸值(13.326 ± 2.054**) mmol/L、同型半胱氨酸值(27.467 ± 12.177) umol/L、NIHSS量表(9.837 ± 1.685**)分和mRS量表(9.837 ± 1.685**)分;3月后叶酸值(18.254± 2.739**) mmol/L、同型半胱氨酸值(11.937 ± 2.574) umol/L、NIHSS量表(4.618 ± 2.426**)分和mRS量表(1.516 ± 0.724**)分。发现从基线水平、1月后和3月后的叶酸水平逐次升高,而同型半胱氨酸值,NIHSS量表和mRS量表评分逐次下降,p < 0.05,差异具有统计学意义。可见在叶酸水平相对升高的同时,脑卒中危险因子同型半胱氨酸呈下降状态,神经功能以及认知功能恢复较好。在脑卒中患者中补充叶酸能减低同型半胱氨酸浓度,使得脑卒中的预后向着更有益的方向发展,在降低同型半胱氨酸水平的基础上改善脑卒中后神经功能恢复,减轻或者治疗脑卒中后遗症,为减轻脑卒中的各方面负担起到了一定的积极作用。见表1、表2。
Table 1. Baseline, January and March changes of folic acid and homocysteine in the study group ( x ¯ ± s scores)
表1. 研究组叶酸及同型半胱氨酸基线、一月及三月变化情况( 分)
注:**p < 0.01。
Table 2. Comparison between NIHSS score and mRS score for neurological function recovery in the study group ( x ¯ ± s scores)
表2. 研究组神经功能恢复NIHSS评分和mRS评分变化比较(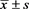 分)
分)
注:**p < 0.01。
4. 讨论
高同型半胱氨酸血症(HHCY)在中国的总体合并患病率为27.5%,在健康的北方人群中,HHCY的患病率可能高达67.7%,明显高于发达国家的报道 [9]。叶酸和钴胺是同型半胱氨酸(HCY)代谢途径重要的辅助因子,任何一种异常变化都会导致HCY水平升高。HHCY是一种多因素的疾病,能反映B族维生素缺乏,并与人类心脑血管疾病、血栓形成、神经退行性疾病和慢性胃肠疾病的风险增加有关 [20],HHCY是心脑血管疾病的一个独立危险因素 [21]。亚甲基四氢叶酸还原酶(MTHFR)是叶酸代谢途径中的关键酶,可介导HCY在人体内的清除,促进DNA甲基化,有研究表明,MTHFR C677T基因多态性导致MTHFR酶活性下降,引发叶酸代谢障碍,MTHFR C677T基因多态性引起的HHCY还可以诱导内皮细胞激活促凝因子,使机体处于高凝状态,从而促进血栓形成,HCY浓度的下降依赖于血清叶酸水平,按照0.8 mg/d的叶酸治疗量能降低HCY,而对于MTHFR C677T基因型个体将受益于更高计量的叶酸,如果能将血清叶酸水平提高到阈值(15 ng/ml),HCY的降低幅度能够达到最理想的状态,而我国70%的MTHFR C677T基因型患者血清叶酸水平低于阈值,需要补充叶酸来降低心脑血管疾病的危险因素之一——HCY [8]。另外降低HCY可通过多种机制延缓脑白质病变的进展,首先,HHCY相关的内皮功能障碍可能会减少;其次,低甲基化,磷脂的完整性与HCY水平有关,降低HCY浓度可能在去髓鞘和髓鞘化过程中发挥有利作用;再者,HCY的降低可能通过其作为n-甲基-α-天冬氨酸激动剂的作用,导致其直接神经毒性作用的减弱 [14]。HCY浓度升高会增加脑卒中的风险,而叶酸对患者不良预后具有良好的改善作用 [7],叶酸的补充既可以显著改变HCY对脑卒中的不良影响,又能改善脑卒中后神经功能的恢复,监测血清叶酸的水平可能有助于更精确地预测人群脑卒中风险,并开发出针对个人遗传背景和营养状况的脑卒中预后叶酸干预措施 [22]。本研究仅证实补充叶酸可降低同型半胱氨酸改善脑卒中预后,但是由于各种条件限制还未精确到各个年龄段最佳服用剂量,最有效服用时间、服用期限、停用时间,这些结论还需要更多的实验研究来佐证,有待于我们未来进一步的努力探索。
文章引用
刘 杰,景 蓉,武军祥. 探究叶酸、同型半胱氨酸对脑卒中神经及认知功能恢复的影响
To Investigate the Effects of Folic Acid and Homocysteine on Neurological and Cognitive Function Recovery in Stroke[J]. 药物资讯, 2019, 08(03): 119-124. https://doi.org/10.12677/PI.2019.83015
参考文献
- 1. Beshchasna, N., Ho, A.Y.K., Saqib, M., et al. (2019) Surface Evaluation of Titanium Oxynitride Coatings Used for De-veloping Layered Cardiovascular Stents. Materials Science and Engineering: C, 99, 405-416. https://doi.org/10.1016/j.msec.2019.01.131
- 2. 赵洁, 刘坤杰, 刘佳梅, 赵玲, 马玉春, 李清林, 霍明艳, 王天星. 一、二级预防在心脑血管患者及相关人群中的应用及效果评价[J]. 河北医药, 2014, 36(20): 3172-3173+3174.
- 3. 王陇德, 刘建民, 杨弋, 彭斌, 王伊龙. 我国脑卒中防治仍面临巨大挑战——“中国脑卒中防治报告2018”概要[J]. 中国循环杂志, 2019, 34(2): 105-119.
- 4. Chandra, A., Stone, C.R., Du, X., Li, W.A., Huber, M., Bremer, R., Geng, X. and Ding, Y. (2017) The Cerebral Circulation and Cerebrovascular Disease III: Stroke. Brain Circulation, 3, 66-77.
- 5. Li, W.A., Geng, X. and Ding, Y. (2017) Stroke Is a Global Epidemic: New Develop-ments in Clinical and Translational Cerebrovascular Diseases Research. Neurological Research, 39, 475-476. https://doi.org/10.1080/01616412.2017.1330307
- 6. Shen, J., Rastogi, R., Geng, X. and Ding, Y. (2019) Nico-tinamide Adenine Dinucleotide Phosphate Oxidase Activation and Neuronal Death after Ischemic Stroke. Neural Regen-eration Research, 14, 948-953. https://doi.org/10.4103/1673-5374.250568
- 7. 张红梅, 高峰. 血清铁蛋白、同型半胱氨酸、叶酸、维生素B12对老年高血压脑室出血患者预后的影响[J]. 中国老年学杂志, 2019, 39(7): 1568-1571.
- 8. Huang, X., Qin, X., Yang, W., et al. (2018) MTHFR Gene and Serum Folate Interaction on Serum Homocysteine Lowering: Prospect for Precision Folic Acid Treatment. Arteriosclerosis, Thrombosis, and Vascular Biology, 38, 679-685. https://doi.org/10.1161/ATVBAHA.117.310211
- 9. Tian, H., Tian, D., Zhang, C., et al. (2017) Efficacy of Folic Acid Therapy in Patients with Hyperhomocysteinemia. Journal of the American College of Nutrition, 36, 528-532. https://doi.org/10.1080/07315724.2017.1330162
- 10. Shu, X.-J., Li, Z.-F., Chang, Y.-W., Liu, S.-Y. and Wang, W.-H. (2017) Effects of Folic Acid Combined with Vitamin B12 on DVT in Patients with Homocysteine Cerebral Infarc-tion. European Review for Medical and Pharmacological Sciences, 21, 2538-2544.
- 11. Xia, X.-S., Li, X., Wang, L., Wang, J.-Z., Ma, J.-P. and Wu, C.-J. (2014) Supplementation of Folic Acid and Vitamin B12 Reduces Plasma Levels of Asymmetric Dimethylarginine in Patients with Acute Ischemic Stroke. Journal of Clinical Neuroscience, 21, 1586-1590. https://doi.org/10.1016/j.jocn.2013.11.043
- 12. Hankey, G.J., Ford, A.H., Yi, Q., et al. (2013) Effect of B Vita-mins and Lowering Homocysteine on Cognitive Impairment in Patients with Previous Stroke or Transient Ischemic At-tack: A Prespecified Secondary Analysis of a Randomized, Placebo-Controlled Trial and Meta-Analysis. Stroke, 44, 2232-2239. https://doi.org/10.1161/STROKEAHA.113.001886
- 13. Lan, X., Dang, S.-N., Zhao, Y.-L., Yan, H. and Yan, H. (2016) Meta-Analysis on Effect of Combined Supplementation of Folic Acid, Vitamin B12 and B6 on Risk of Car-dio-Cerebrovascular Diseases in Randomized Control Trials. Chinese Journal of Epidemiology, 37, 1028-1034.
- 14. Cavalieri, M., Schmidt, R., Chen, C., et al. (2012) B Vitamins and Magnetic Resonance Imag-ing-Detected Ischemic Brain Lesions in Patients with Recent Transient Ischemic Attack or Stroke: The VITAmins TO Prevent Stroke (VITATOPS) MRI-Substudy. Stroke, 43, 3266-3270. https://doi.org/10.1161/STROKEAHA.112.665703
- 15. Zhang, Y., Wang, L., Zhou, X., Geng, J. and Li, X. (2019) The Immunomodulatory Mechanism of Brain Injury Induced by Hyperhomocysteinemia in Spontaneously Hypertensive Rats. Journal of Cellular Biochemistry, 120, 9421-9429. https://doi.org/10.1002/jcb.28217
- 16. Wan, J.-L. and Ma, Z.-W. (2017) The Value of Mean Platelet Volume for Prognosis of Patients with Acute Cerebral Infarction. Clinical La-boratory, 63, 1801-1807. https://doi.org/10.7754/Clin.Lab.2017.170419
- 17. Zeng, X., Zhang, G., Yang, B., et al. (2016) Neopterin as a Predictor of Functional Outcome and Mortality in Chinese Patients with Acute Ischemic Stroke. Molecular Neurobiology, 53, 3939-3947. https://doi.org/10.1007/s12035-015-9310-3
- 18. Xu, S., Wang, L. and Zhao, L. (2019) Clinical Application Value of Brain CT Perfusion Imaging in the Treatment of Acute Ischemic Stroke Thrombolytic Therapy. Experimental and Therapeutic Medicine, 17, 3971-3976. https://doi.org/10.3892/etm.2019.7431
- 19. Liu, H., Chu, J., Zhang, L., Liu, C., Yan, Z. and Zhou, S. (2016) Clin-ical Comparison of Outcomes of Early versus Delayed Carotid Artery Stenting for Symptomatic Cerebral Watershed In-farction due to Stenosis of the Proximal Internal Carotid Artery. BioMed Research International, 2016, Article ID: 6241546. https://doi.org/10.1155/2016/6241546
- 20. Heilmann, R.M., Grützner, N., Iazbik, M.C., Lopes, R., Bridges, C.S., Suchodolski, J.S., Couto, C.G. and Steiner, J.M. (2017) Hyperhomocysteinemia in Greyhounds and Its Association with Hypofolatemia and Other Clinicopathologic Variables. Journal of Veterinary Internal Medicine, 31, 109-116. https://doi.org/10.1111/jvim.14597
- 21. Azad, M.A.K., Huang, P., Liu, G., Ren, W., Teklebrh, T., Yan, W., Zhou, X. and Yin, Y.-L. (2018) Hyperhomocysteinemia and Cardiovascular Disease in Animal Model. Amino Acids, 50, 3-9. https://doi.org/10.1007/s00726-017-2503-5
- 22. Zhao, M., Wang, X., He, M., et al. (2017) Homocysteine and Stroke Risk: Modifying Effect of Methylenetetrahydrofolate Reductase C677T Polymorphism and Folic Acid Interven-tion. Stroke, 48, 1183-1190. https://doi.org/10.1161/STROKEAHA.116.015324
