International Journal of Ecology
Vol.
08
No.
03
(
2019
), Article ID:
31867
,
7
pages
10.12677/IJE.2019.83031
Study on Soil Nutrient Activation Process by Different Colors of Light
Yike Wang1,2,3,4, Tingting Cao1,2,3,4
1Institute of Land Engineering and Technology, Shaanxi Provincial Land Engineering Construction Group Co., Ltd., Xi’an Shaanxi
2ShaanXi Provincial Land Engineering Construction Group Co., Ltd., Xi’an Shaanxi
3Key Laboratory of Degraded and Unused Land Consolidation Engineering, The Ministry of Land and Resources, Xi’an Shaanxi
4Shaanxi Provincial Land Consolidation Engineering Technology Research Center, Xi’an Shaanxi

Received: Jul. 30th, 2019; accepted: Aug. 16th, 2019; published: Aug. 26th, 2019

ABSTRACT
Illumination can activate the soil nutrient elements from the original inert state, thereby reducing the use of fertilizers in the production process. In this study, the effects of different bands of light were studied by using the indoor illumination experiment method, the illumination band was set to visible light, infrared light and ultraviolet light, and the soil placed in the dark was as a control. The results showed that: 1) the first week of different bands of light increased the total nitrogen content of the soil, and the total nitrogen content increased by 50% in the first week; 2) the infrared, ultraviolet and visible light increased the available potassium content of the soil. The effect of ultraviolet light on the activation of soil available potassium is more obvious; 3) under different light conditions, the effective phosphorus content of the soil is all higher than the initial effective phosphorus content by 100%, and the maximum increase is close to 200%; 4) infrared, ultraviolet and visible light have the effect of reducing the content of active organic carbon in the soil. Experiments have shown that light has an activation effect on the components in the soil and has further research value.
Keywords:Soil Nutrient, Light, Activation
不同颜色光照对土壤养分活化过程研究
汪怡珂1,2,3,4,曹婷婷1,2,3,4
1陕西地建土地工程技术研究院有限责任公司,陕西 西安
2陕西省土地工程建设集团有限责任公司,陕西 西安
3自然资源部退化及未利用土地整治工程重点实验室,陕西 西安
4陕西省土地整治工程技术研究中心,陕西 西安

收稿日期:2019年7月30日;录用日期:2019年8月16日;发布日期:2019年8月26日

摘 要
光照过程能够使得土壤养分元素从原来的惰性状态被激活,通过研究土体活化技术,加速土壤中养分的转化效率,从而降低生产过程中化肥的使用,进一步减少化肥的过量使用所带来的土壤污染问题。本研究以通过室内光照实验方法,设定光照波段为蓝光、红光、绿光,以放置在暗处的土壤为对照,研究不同波段光照对于土壤养分活化过程的影响。结果表明:1) 不同颜色光照首周对于土壤全氮含量的提升较高,全氮含量首周均提升50%;2) 红、绿、蓝光三种光照对土体速效钾含量均有增加的作用,特别是蓝光对于土壤速效钾的活化作用明显;3) 在不同波长光照情况下,土壤有效磷含量较初始有效磷含量提升效果均在100%之上,最大提升量接近200%;4) 绿、蓝、红光光照对土体活性有机碳含量均有降低的作用。试验表明光照对于土壤中的成分具有活化作用,具有进一步研究价值。
关键词 :土壤养分,光照,活化

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
人类生存与发展离不开土地 [1] 。我们国家是人口大国,人多地少的矛盾始终是现代化进程中的一个带有全局性、战略性的重大问题。我国人均耕地面积不到世界平均水平的一半,且有2/3以上的耕地是中低产田 [2] ,在中低产田土体中常常出现某些营养元素的缺乏或土体结构不良而影响植物正常生长 [3] ,具有很大的增产潜力 [4] 。光照是作物进行光合作用、并赖以生长的前提条件;而养分则是作物生长的物质基础,作物对养分的吸收和利用,有赖于其生长状况所确定的对养分的需要及其吸收能力。在一定的光照变化范围内,作物的光合速率和生长随光照的改变而改变,因而对养分的需要量亦随之增加、且吸收能力增强,其同时也必将会因此影响土壤的养分状况。光照的改变,将最终导致土壤–植物系统中养分供求关系的变化,并将在很大程度上决定作物的肥料需要量、需肥比例和相应的所采取的施肥技术。
国内外均展开了光照与中低产田关系的相关研究,1964年,Pauli提出光照可能是沙漠地区有机质降解的主要因素 [5] ,光照使土壤凋落物中难降解有机物发生光化学转化,促进土壤有机质中DOC含量而促进碳的释放,增加土壤碳库,并能通过光照与土壤水分、大气CO2浓度之间的交互作用,进一步促进土壤有机质的生物和非生物降解过程。林波等对美国里奥格兰德河岸森林凋落物的降解研究表明 [6] ,光照增强和水分含量增加,胞外酶,尤其是氧化酶类的活性会显著提高。进而影响陆地生态系统的碳循环。施入土壤的N肥,除被作物吸收利用外,还有微生物的固定,粘土矿物的吸附,挥发和反硝化损失,最终有相当一部分以NO3-N的形式残存于土壤中。早在1979,Zafiriou和Ture [7] 实验证实水体中的 和 均具有光化学活性。 的紫外吸收带在200 nm、310 nm处, 的紫外吸收带在205 nm、360 nm处。 和 在阳光辐射下可光解生成羟基(∙OH)和氮氧化物(NO2、NO)等活性物质,可以和多数有机物发生快速反应,从而显著影响地球C、N和重金属的生物。
本文以具有代表性的关中塿土为研究对象,设定不同光照波段的长期光照试验,进行长期光照,并定期采样,探究了塿土在不同波段光照情况下,土壤总氮,有效磷,速效钾及有机碳随时间的变化规律,探究土壤在光照情况下的养分变化规律,从而为光照活化土体的机理及应用研究,奠定研究基础。
2. 材料与方法
2.1. 供试材料
试验土样采集自在陕西省富平县中试基地(东经109˚12'10,北纬34˚42'31)表层0~15 cm,采样时间为2018年3月10日。各土样均按S形线路随机选取5个采样点采集,将各土样混合均匀摊放在干净地面上,挑拣出红的动植物残体,室内避光自然风干。风干后的土壤过1 mm筛,分别用于土壤基本理化性质测定、室内光照试验。测定土壤养分初始含量,其中全氮含量0.06 g/kg,速效钾4.08 mg/kg,有效磷3.94 mg/kg,活性有机碳3.22 g/kg。
2.2. 试验方法
该实验在不透光纸箱中进行,纸箱尺寸为65 × 65 × 50 (cm),纸箱的三边和顶部均用加厚铝箔包好,防止环境中其它杂质光线射入箱体。如图1,纸箱内放置不同波长的LED灯,模拟不同波长太阳光源,灯泡距样品台20 cm,光照强度为1.14 × 106 W∙m−2,使光反应箱内温度维持在28℃ ± 1.5℃。样品放在直径10 cm培养皿中,培养皿高度3 cm,控制实验土壤装填高度与培养皿高度相平,防止厚度对于试验结果产生影响。
 (a) 蓝光照反应箱
(a) 蓝光照反应箱
 (b) 绿光照反应箱
(b) 绿光照反应箱
Figure 1. Light reaction box
图1. 光照反应箱
2.3. 测定方法
2.3.1. 采样方式
采样时间为2018年3月2日至6月22日,每周采样一次,共计采样17周,每次采样取出一个培养皿,将培养皿中实验土壤取出,倒入密封袋内保存。
2.3.2. 样品检测
速效磷含量采用0.5 mol/L NaHCO3浸提比色法测定;速效钾含量采用NH4Ac浸提火焰光度法测定;土壤全氮含量用2 mol/L KCl溶液浸提(水、土比为5:1),用全自动间断化学分析仪(cleverchem200,德国)测定。
2.3.3. 数据处理
实验每个处理设个平行,试验结果均以平均值表示,采用统计软件对数据进行统计检验及方差分析,数据多重比较采用Turkey法,运用Excel绘制相关图表。
3. 结果与讨论
3.1. 红、蓝、绿光照对全氮的活化作用
未进行光照处理的土样全氮含量为0.06 g/kg,由图2可知,红光照射17周情况下的全氮含量变化,在红光照射首周,全氮含量达到0.09 g/kg,相比于未经光照处理的土壤提高50%,提升效果明显,随着红光照时间的增长,土壤全氮含量,并未随时间呈现线性增长,反而呈现出不断波动的变化特征,可能首周土壤中的全氮在光照作用下活化,并在后续的时间情况下处于动态平衡的过程。全氮含量土壤全氮含量在第5周出现第一个峰值0.095 g/kg,相较于未经照射土壤提升58.33%,相较于首周仅提升8.33%,随后在第13周出现第二个峰值0.1036,相较未经照射土壤全氮含量提升76.2%,相较于首周提升26.2%,可能由于在光照能量积累,及全氮的释放需要较长时间过程,因此全氮含量在出现峰值后又继续降低,对于土壤全氮而言,红光照射对其的活化作用,主要在首周内。蓝光对于土壤全氮的活化作用与红光相似,首周全氮含量增加50%,随后在0.08~0.1范围内不断波动保持平稳,在能量的光照能量的积累过程需要时间,在第5周和第12周,土壤全氮含量开始变化,并分别在第5周和第12周达到峰值,由此可以推测,红光对于全氮的提升效果,可能主要是蓝光的影响导致的 [8] ;绿光对于土壤全氮的影响与红光、蓝光不同,绿光对于土壤全氮的影响呈现持续上升的趋势,随着光照时间的增加,土壤全氮含量也随之增加,但整体的趋势仍为随光照时间增长而增长,并在17周达到最大值0.12 g/kg,相较于初始含氮量增加100%,绿光是以热量的方式来影响土壤中的全氮含量的,由于光照活化装置较为密闭,在光照过程中,土壤温度较高,因此,相比较于蓝光与白光,绿光的活化提升效果更加明显。
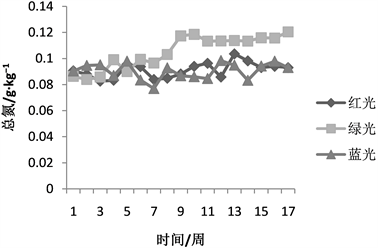
Figure 2. The effect of visible, ultraviolet and infrared light on soil total nitrogen
图2. 红、蓝、绿光对土体全氮的影响
3.2. 红、蓝、绿光照对速效钾的活化作用
未进行光照处理的土样速效钾含量为4.08 mg/kg,红光对于土壤速效钾的活化作用并不明显,在红光照首周,土壤速效钾含量为4.34 mg/kg,速效钾含量提升0.26 mg/kg,提高6.37%,随着光照时间的增长,土壤速效钾含量逐步提升,第12天出现的峰值为红光照17周的最大值,在达到最大值后开始平缓,这可能是由于速效钾与全氮并不相同,速效钾在形成之后,主要为水溶性钾与交换性钾,在光照情况下较为稳定,并且对于温度的变化,敏感度较低,因此在形成速效钾后,含量的变化不如全氮明显。
由图3,可以看出,绿光照处理首周的土体速效钾含量为4.34 mg/kg,速效钾含量提升6.3%,与首周红光光照相同,峰值出现在第5周、第11周,分别为4.74 mg/kg、5.21 mg/kg,相较于未经绿光照射的土壤分别提升16.2%、27.7%,第11周的峰值与红光照射12周相似,在17周,达到绿光照射下的最大值5.41 mg/kg,相较于未照射土壤提升1.33 mg/kg,提高速效钾含量近33%,提升效果较红光明显。
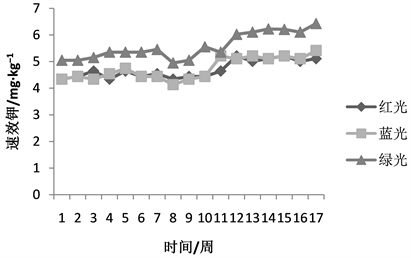
Figure 3. The effect of visible, ultraviolet and infrared light on soil available potassium
图3. 红、蓝、绿光对土体速效钾的影响
蓝光照17周内土壤速效钾含量呈现逐步上升的趋势,土壤速效钾的变化,如图3所示,蓝光光照首周土壤速效钾含量为5.05 mg/kg,比初始情况下土壤速效钾含量提升23.7%,首周提升效果高于绿光、红光照射情况下的首个峰值,在首周提升后,从第二周开始缓慢提升,第3天5.15 mg/kg,第4天5.35 mg/kg,持续增大,且增大程度较绿光照射更好,在第17周时达到最高6.43 mg/kg,相对初始值增加57.6%。由此可知,光照对于土壤速效钾的提高,有显著作用,特别是蓝光照射,有助于土壤中速效钾的释放。可能是蓝光对于土壤中的缓释钾结构具有较大的破坏作用,相较于以热的形式扩散的绿线和包含各种波段光源的白光,蓝光的频率更高,波长更短,更易使土壤中的缓释结构破坏,从而进一步的促进土壤中速效钾的释放 [9] 。
3.3. 红、蓝、绿光照对有效磷的活化作用
未进行光照处理的土样有效磷含量为3.94 mg/kg,红光对于土壤有效磷的提升效果如图4所示,红光照射首周,土壤有效磷含量为6.03 mg/kg,相较于未经光照土壤提高了53%,并在第6周出现一个小峰,有效磷含量为6.8 mg/kg,第9周、第14周出现较大波动,有效磷含量分别为11.67 mg/kg、11.35 mg/kg,土壤有效磷含量分别提升了196%、188%,第9周出现的峰值为最大值。绿光对于土壤有效磷的照射与红光相似,均在首周照射后有较大提升,并在17周内出现多处峰值。绿光照条件下,首周有效磷含量提升至6.59 mg/kg,相较于未经光照土壤提高了67%,而在第7周、第11周、第14周出现三个峰值,照射时间越长,峰值越大,分别为9.38 mg/kg、10.68 mg/kg及11.30 mg/kg,相对初始含量提高了138%、171%、187%,第14周达到最大值。红,白光对于土壤中有效磷含量的影响,主要体现在通过绿光照射的影响,有效磷包括全部水溶性磷、部分吸附态磷、一部分微溶性的无机磷和易矿化的有机磷,等在7周以后,均出现不断波动的情况,可能主要由于土壤中有效磷含量处于动态平衡中,在能量积蓄后,土壤中有效磷含量增加 [10] 。

Figure 4. Shows the effect of ultraviolet and infrared light on soil available phosphorus
图4. 红、蓝、绿光对土体有效磷的影响
蓝光对于土体有效磷的活化作用如图4所示,蓝光光照首周土壤有效磷含量为5.64 mg/kg,比初始情况下土壤有效磷含量提升43.1%,首周提升效果低于绿光、红光照射情况下首周含量,并在第6周开始含量突然提高,在第8周达到首个峰值,随后以增大–减少–增大的趋势持续波动,并在第8周、第14周均达到较大值,含量为10.1 mg/kg,相较初始值增加156%。于航等 [11] 研究认为,光照促进土壤微生物把土壤中的有机态磷转化为无机态磷,从而促进内源磷的释放。
3.4. 红、蓝、绿光照对活性有机碳的活化作用
土壤有机碳含量随光照时长的增加而降低。此结果与河流、海口沉积物在光照下的反应结果相近 [2] ,光照可以促进植物残体质量的损失 [4] 和土壤腐殖酸的降解 [5] 。土壤中富含植物残体和腐殖酸类物质,而且是河流、海口沉积物中有机物的主要来源 [6] ,因而光照使土壤有机碳含量降低是在预料之中。

Figure 5. Shows the effect of ultraviolet and infrared light on soil organic carbon
图5. 红、蓝、绿光对土体有机碳的影响
如图5,在17周光照过程中,首周红光照射情况下,土壤活性有机碳含量降低至1.62 g/kg,随后持续降低,在第6周达到1.188 g/kg,降低63%,随后逐渐增加,可能是土壤中腐殖质等降解,为土壤提供活性有机碳,从而补充了因光照产生的活性有机碳消耗,红光照8周后,活性有机碳开始补充,至16周时含量为1.89 g/kg,相对第6周提升59%。绿光对于土壤活性有机碳的影响,分为三个阶段,初始阶段,从第1周到第8周,含量波动降低,从第1周的1.51 g/kg降低至第8周的0.94 g/kg;稳定阶段从第8周至11周,含量保持基本稳定;增加阶段则出现在第11周以后,最终稳定在1.74 g/kg。蓝光对于土体活性有机碳的影响与红光相似,从第1周至第9周,波动下降,从首周的1.46 g/kg下降至0.96 g/kg,下降34%,随后开始呈现上升趋势。
4. 结论
不同颜色、不同光照时间对土体全氮、速效钾、有效磷及活性有机碳的含量存在影响:
1) 光照对于土壤全氮含量的影响,主要出现在首周,光照首周对于土壤全氮含量的提升较高,全氮含量首周均提升50%;
2) 绿、蓝、红光三种光照对土体速效钾含量均有增加的作用,特别是蓝光对于土壤速效钾的活化作用明显,相较于红光与绿光在首周活化速效钾6.3%,蓝光照射首周提升23.7%,经17周照射后,含量提升57.6%;
3) 绿、蓝、红光光照对土体有效磷含量均有增加的作用,随光照时间的推移呈增加趋势,且在不同波长光照情况下,土壤有效磷含量较未活化土壤提升效果均在100%之上,最大提升量接近200%;
4) 绿、蓝、红光光照对土体活性有机碳含量均有降低的作用,可能由于光照过程中产生有机碳降解的现象,但在总体降低的情况下,可能同样存在对于活性有机碳含量的补充,蓝光与红光照射下,均存在波动下降,在第8周含量增加的情况。
基金项目
陕西省土地工程建设集团内部科研项目“光照活化土体元素研究”(DJNY2018-15)。
文章引用
汪怡珂,曹婷婷. 不同颜色光照对土壤养分活化过程研究
Study on Soil Nutrient Activation Process by Different Colors of Light[J]. 世界生态学, 2019, 08(03): 233-239. https://doi.org/10.12677/IJE.2019.83031
参考文献
- 1. 王先进. 我国耕地的现状、发展趋势及对策[J]. 科技导报, 1989, 7(4): 42-45.
- 2. 周健民. 浅谈我国土壤质量变化与耕地资源可持续利用[J]. 中国科学院院刊, 2015, 30(4): 459-467.
- 3. 刘玉. 河北省耕地综合生产能力分析及应用研究[D]: [硕士学位论文]. 保定: 河北农业大学, 2008.
- 4. 徐莹. 硫素胁迫对烟草生长和生理过程的影响研究[D]: [硕士学位论文]. 福州: 福建农林大学, 2010.
- 5. Gallo, M., Amonette, R., Lauber, C., Sinsabaugh, R.L. and Zak, D.R. (2004) Microbial Community Structure and Oxidative Enzyme Activity in Nitrogen-Amended North Temperate Forest Soils. Microbial Ecology, 48, 218-229.https://doi.org/10.1007/s00248-003-9001-x
- 6. 林波, 刘庆, 吴彦,等. 森林凋落物研究进展[J]. 生态学杂志, 2004, 23(1): 60-64.
- 7. Zafiriou, O.C. and True, M.B. (1979) Nitrate Photolysis in Seawater by Sunlight. Marine Chemistry, 8, 9-32.https://doi.org/10.1016/0304-4203(79)90029-X
- 8. Schiebel, H.N., Wang, X., Chen, R.F. and Peri, F. (2015) Photochemical Release of Dissolved Organic Matter from Resuspended Salt Marsh Sediments. Estuaries & Coasts, 38, 1692-1705. https://doi.org/10.1007/s12237-014-9893-3
- 9. Hoorens, B. and Aerts, R.M. (2010) El-evated UV-B Radiation Has No Effect on Litter Quality and Decomposition of Two Dune Grassland Species: Evidence from a Long-Term Field Experiment. Global Change Biology, 10, 200-208.https://doi.org/10.1111/j.1529-8817.2003.00735.x
- 10. Schneider, S.H., Turner, B.L. and Garriga, H.M. (1998) Imaginable Surprise in Global Change Science. Journal of Risk Research, 1, 165-185. https://doi.org/10.1080/136698798377240
- 11. Goni, M.A., Monacci, N., Gisewhite, R., et al. (2006) Distribution and Sources of Particulate Organic Matter in the Water Column and Sediments of the Fly River Delta, Gulf of Papua (Papua New Guinea). Estuarine Coastal & Shelf Science, 69, 225-245. https://doi.org/10.1016/j.ecss.2006.04.012