Hans Journal of Agricultural Sciences
Vol.
13
No.
05
(
2023
), Article ID:
66306
,
8
pages
10.12677/HJAS.2023.135060
饲料中添加β-葡聚糖对福瑞鲤生长指标、非特异性免疫相关酶活力及抗病力的影响
刘群1,2* ,霍文慧1,2,刘桐山1,2,王菁1,2,冯守明1,2
,霍文慧1,2,刘桐山1,2,王菁1,2,冯守明1,2
1天津市动物疫病预防控制中心,天津
2天津市水生动物疫病监测中心,天津
收稿日期:2023年4月25日;录用日期:2023年5月23日;发布日期:2023年5月31日

摘要
本实验研究了饲料中添加β-葡聚糖对福瑞鲤(Cyprinus carpio)生长性能、免疫性能及抗病力的影响。以基础饲料和含有2‰ β-葡聚糖的基础饲料分别作为对照组和实验组投喂初始体重为251.5 g ± 3.2 g福瑞鲤240 d。实验结果表明:实验组终末体质量(FBW)、绝对增重率(AGR)和体重增长率(IR)较对照组升高;实验组实验鱼血浆超氧化物歧化酶(SOD)、溶菌酶(LZM)、酸性磷酸酶(ACP)、过氧化氢酶(CAT)活力较对照组显著升高(P < 0.05);实验组血清总蛋白、球蛋白含量较对照组显著升高(P < 0.05),实验组血清白蛋白(ALB)较对照组差异不显著(P > 0.05)。攻毒实验结果显示,免疫组在爱德华氏菌攻毒后的相对免疫保护率为25%。本实验结果显示:饲料中添加2‰ β-葡聚糖能提高福瑞鲤生长性能、非特异免疫性能,增强福瑞鲤抗病力。
关键词
福瑞鲤,β-葡聚糖,生长性能,免疫性能

Effects of Dietary β-Glucan on Activities of Growth, Non-Specific Immune Related Enzymes and Disease Resistance of Cyprinus carpio
Qun Liu1,2* , Wenhui Huo1,2, Tongshan Liu1,2, Jing Wang1,2, Shouming Feng1,2
, Wenhui Huo1,2, Tongshan Liu1,2, Jing Wang1,2, Shouming Feng1,2
1Animal Disease Prevention and Control Center of Tianjin, Tianjin
2Tianjin Surveillance Center of Aquatic Animal Infections Disease, Tianjin
Received: Apr. 25th, 2023; accepted: May 23rd, 2023; published: May 31st, 2023

ABSTRACT
This study explored the effects of β-glucan on the growth performance, serum immune parameters, and disease resistance of juvenile carp. In this experiment, one group diet containing 2‰ β-glucan was designed to juvenile carp (251.5 g ± 3.2 g) for 240 days. The results showed, in experimental group the final body weight (FBW), absolute growth rate (AGR) and increasing rate of body weight (IR) of fish were significantly increased compared with fish of control group; compared with control group, serum superoxide dismutase (SOD), lysozyme (LZM), acid phosphatase (ACP), and catalase (CAT) of fish in all experimental groups were significantly increased (P < 0.05), the serum total protein content, globulin content of fish in experiment group increased significantly (P < 0.05), the difference on the content of albumin was not significant (P > 0.05); The relative percentage of survival rate was 25% after Edwardsiella spp. challenge. The experiment included that dietary β-glucan could improve the growth performance, immune performance, and disease resistance.
Keywords:Cyprinus carpio, β-Glucan, Growth Performance, Immune Performance

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
近年来,随着淡水鱼集约化和规模化养殖的发展,病害防控越来越成为人们关注的焦点。应用β-葡聚糖等免疫增强剂提高淡水鱼的非特异性免疫能力和对病害的抵抗力,是解决此类问题的有效途径之一。β-葡聚糖(β-glucan)作为一种具有免疫刺激作用的生物活性物质,对水产动物的生长和生理功能表现出多方面的作用,是一种研究相对深入、应用广泛的免疫增强剂。现有研究表明,β-葡聚糖可以增强大西洋鲑(Salmo salar)抗病原感染的能力 [1] ,提高花鲈(Lateolabrax jaonocus)增重率、免疫性能和抗氨氮应激能力 [2] ,可以提高暗纹东方鲀(Takifugu obscures)的机体免疫功能 [3] 。福瑞鲤是中国水产科学研究院淡水渔业研究中心以建鲤和野生黄河鲤为原始亲本进行杂交,通过1代群体选育和连续4代家系选育后获得的鲤鱼新品种,是农业农村部主推的大宗淡水养殖鱼类新品种 [4] 。目前,关于β-葡聚糖对福瑞鲤生长性能和抗病力等的研究较少。因此,本试验通过在饲料中添加一定水平的β-葡聚糖,并采用间隔投喂方式,研究β-葡聚糖对福瑞鲤生长性能、血清生化指标及抗爱德华氏菌感染能力的影响,以便为β-葡聚糖在福瑞鲤养殖中的应用提供理论依据。
2. 材料与方法
2.1. 实验用鱼
本试验于天津市蓟州区某水产养殖场试验示范基地进行池塘养殖,苗种规格整齐,无病无伤,雌雄比例约1:1。放养池塘面积均为1 hm2,放养密度均为22,500尾/hm2,平均体质量为251.5 g ± 3.2 g。整个养殖周期持续240 d,养殖期间水源充足,水质清新,水质符合国家渔业水域水质标准。
2.2. 日常管理
2.2.1. 实验饲料
试验中选用某公司生产的鲤鱼全价配合饲料作为基础饲料。在基础饲料中添加2‰ β-葡聚糖制成实验饲料,对照组养殖期间始终投喂基础饲料,实验组连续投喂15 d实验饲料和45 d基础饲料为1个投饲周期;投饲频率为2次/d,投喂时间点为每天8时与16时,投饲量为鱼体重量10%~15%,每次投喂采取少量多次地将实验饲料投放至食台,并在投喂时仔细观察实验鱼的摄食情况,坚持定时、定量、定位、定质的“四定”原则;每个投饲周期的第60 d对随机选取实验鱼称重并记录体质量,用以调整下一投饲周期投喂量。
2.2.2. 巡视管理
每天坚持巡塘,定时开启增氧机,定期检查鱼类生长情况,合理调整投喂量,认真观察、分析鱼情,发现问题及时处理。在养殖过程中,除了坚持巡塘外,特别注意水质变化,水质要求达到“肥、活、嫩、爽”,透明度在30 cm左右,水质变坏及时加换水,每次加换水15 cm左右。养殖过程中常见病害主要是寄生虫病,采取泼洒消毒剂、杀虫剂来预防寄生虫危害。
2.3. 样品采集与方法
在养殖第1 d、60 d、120 d、180 d、240 d随机挑选实验组和对照组各3尾实验鱼称量体质量(W),并使用一次性注射器(2 mL)从鱼体尾静脉采血,所采血液样品需在室温下静置2 h,然后于4℃保存6 h,随后于4℃下3000 r/min离心10 min取上层血浆;使用南京建成生物公司生产的超氧化物歧化酶、溶菌酶、酸性磷酸酶和过氧化氢酶试剂盒测定酶含量。另随机取3尾进行尾静脉抽血,所采血液样品于4℃下3000 r/min离心5 min取上层血清用于血清中总蛋白、白蛋白、球蛋白含量测定。
2.4. 免疫保护率测定
攻毒菌株为本实验分离保存的爱德华氏菌(Edwardsiella spp.),每尾实验鱼腹腔注射0.2 mL 7.74 × 106 CFU/mL爱德华氏菌新鲜菌液,对照组注射相同剂量生理盐水,连续观察7 d,统计死亡率,按照以下公式计算免疫保护率 [5] :免疫保护率/% = [1 − (实验组实验鱼死亡尾数/对照组实验鱼死亡尾数)] × 100。
2.5. 数据处理与分析
采用SPSS 19.0数据统计软件对实验数据进行单因素方差分析(one way ANOVA),显著水平采用0.05。对实验组与对照组鱼的体质量的平均值(MN)、标准差(SD)和变异系数(CV)进行测算,计算公式如下 [6] :CV/% = SD/MN × 100,体重增长率(Increasing rate of body weight, IR, %) = (W2 − W1)/W1 × 100,绝对增重率(Absolute growth rate, AGR, g/d) = (W2 − W1)/T,其中W1为试验开始时的初始体质量,W2为试验结束时的终末体质量,T为养殖时间。
3. 结果
3.1. 养殖期间实验鱼生长指标
在整个养殖试验期间,实验鱼均未出现死亡,存活率均为100%。由表1可知,经240 d养殖试验,添加β-葡聚糖的实验组实验鱼平均体质量、绝对增重率和体重增长率相比对照组实验鱼均为最大值,绝对增重率为4.41 g/d。养殖试验期间,实验组体重增长率为419.9%,对照组体重增长率为383.1%,实验组相对于对照组生长快9.6%,故实验组比对照组生长速度快。
Table 1. The growth performance of crap in different groups
表1. 试验池塘养殖实验鱼生长性能情况
注:a表示差异显著(P < 0.05)。
3.2. 免疫相关酶活力指标
实验组与对照组血浆超氧化物歧化酶(SOD)、溶菌酶(LZM)、酸性磷酸酶(ACP)与过氧化氢酶(CAT)活力见图1。从图1结果可以看出,在240 d养殖期间,实验组与对照组血浆超氧化物歧化酶活力呈先升后降趋势,且同一养殖时间段内该免疫酶活力差异不显著(P > 0.05);当养殖第120 d、180 d、240 d时的实验组实验鱼血浆LZM活力均显著高于对照组(P < 0.05);养殖第120 d、240 d时的实验组实验鱼血浆ACP、CAT活力均显著高于对照组(P < 0.05);养殖第60 d时的实验鱼血浆ACP活力显著高于对照组(P < 0.05),其余养殖时间点的免疫酶活力指标差异不显著(P > 0.05)。
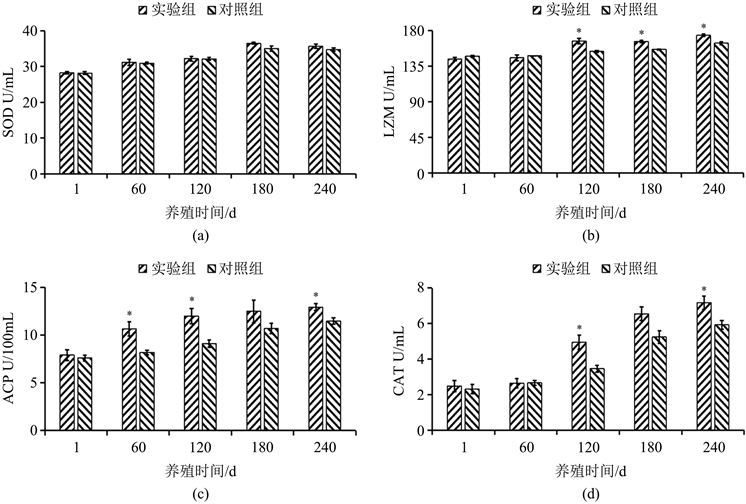
Figure 1. The activity of SOD, LZM, ACP and CAT in serum of fish in groups (n = 3). Note: The symbol “*” represents a significant difference (P < 0.05)
图1. 试验组实验鱼血浆超氧化物歧化酶(SOD)、溶菌酶(LZM)、酸性磷酸酶(ACP)和过氧化氢酶(CAT)活力 (n = 3)。注:*表示差异显著(P < 0.05)
3.3. 血清蛋白指标
实验组与对照组血清总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)见图2。从图2结果可以看出,仅养殖第120 d、180 d、240 d时的实验组实验鱼的血清TP、GLB指标显著高于对照组(P < 0.05),其它养殖时间点各组血清蛋白指标均差异不显著(P > 0.05)。
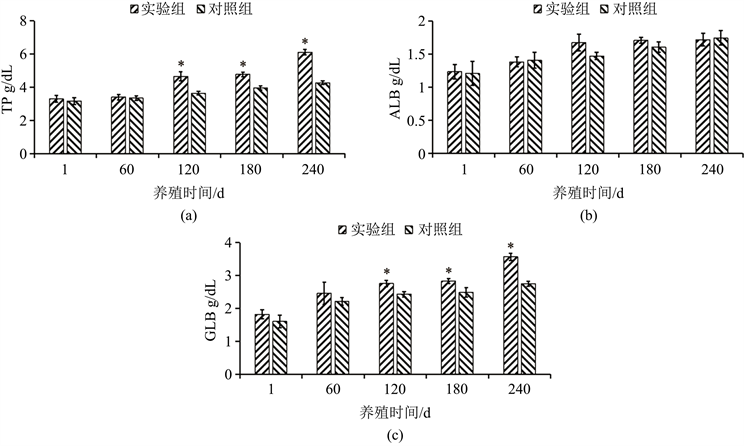
Figure 2. The total protein (TP), albumin (ALB), and globulin (GLB) in serum of fish in groups (n = 3). Note: The symbol “*” represents a significant difference (P < 0.05)
图2. 试验组实验鱼血清总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB) (n = 3)。注:*表示差异显著(P < 0.05)
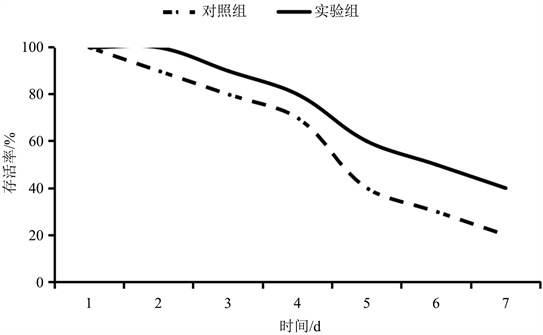
Figure 3. Survival rate of Cyprinus carpio challenged with Edwardsiella spp. in 7 days
图3. 爱德华氏菌感染7 d内福瑞鲤存活率
3.4. 攻毒感染实验
含β-葡聚糖实验饲料投喂福瑞鲤240 d后,进行爱德华氏菌注射感染实验,感染期间各组存活率统计结果见图3。对照组实验鱼感染后第2 d即出现死亡,7 d内死亡率急剧增加,存活率仅20%;实验组实验鱼感染后第3 d出现死亡,7 d内死亡情况相比对照组较平缓,最终存活率为40%。通过计算处理组相对免疫保护率,实验组的相对免疫保护率为25%。
4. 讨论
当前,鱼类养殖疫病频发对水产养殖业造成巨大损失,水体污染及高密度养殖都会造成鱼类自身的免疫机能低下,成为疫病暴发流行的主要原因之一 [7] 。目前有关水产动物疫病的防治,多是使用抗生素。大量使用抗生素容易造成药物残留、水体微生物种群失调、耐药性微生物增加、养殖鱼类内脏机能损伤等不良后果 [8] [9] 。采用免疫增强剂增强鱼体免疫力与抗病力,以减少疫病发生,正渐渐成为控制疫病、保证养殖效益的关键措施,因而通过在鱼类饲料中添加免疫增强剂成为国内外学者研究的热点 [10] [11] 。
β-葡聚糖对水产动物生长性能的作用已有大量研究,可增强水产动物的非特异性免疫系统功能,具体作用机制是:水产动物机体内巨噬细胞的表面上存在着一个β-葡聚糖的特殊受体,当β-葡聚糖与巨噬细胞结合后,激活巨噬细胞的活性,继而诱发一系列的免疫反应,从而使机体通过吞噬作用吸收、破坏和清除体内的病原微生物,进而提高了水产动物的免疫功能 [12] ;但是作用效果却因饲料配方、添加剂量或生长阶段等不同而表现出差异性 [13] [14] 。本试验向饲料中添加β-葡聚糖用以投喂福瑞鲤,通过测定特定的免疫指标,如血浆中的超氧化物歧化酶(SOD)、溶菌酶(LZM)、酸性磷酸酶(ACP)和过氧化氢酶(CAT),以及血清中总蛋白(TP)、白蛋白(ALB)、球蛋白(GLB)等来评价免疫增强剂对实验鱼免疫机能的影响。从实验结果看,服用该免疫增强剂的福瑞鲤血液中LZM、ACP和CAT活力都得到了显著提高,血清总蛋白含量也有一定程度提高,同时,实验组实验鱼对爱德华氏菌的免疫保护率相比对照组提高了25%。试验组实验鱼在体质量增长上相比对照组有较大差异。这表明在饲料中添加适当β-葡聚糖可提高福瑞鲤的免疫功能、抵抗水生动物致病原,而且对鲤鱼生长具有一定促进作用。
血清生化指标可以反映机体物质代谢和某些组织器官的变化,常用来评价鱼体健康和营养状况等。血清中的蛋白质主要维持渗透压,其含量变化与机体的生理密切相关,可反映动物的健康状况,具有免疫功能。本试验中,实验组血清总蛋白和球蛋白含量出现显著差异,两者的变化趋势基本一致。现有研究表明 [15] ,β-葡聚糖是一种天然提取的多糖,分子量大约在6500以上,大多数为水不溶性或胶质的颗粒,在自然环境中可以找到相当多种类的β-葡聚糖,通常存在于特殊种类的细菌、酵母菌、真菌的细胞壁中,也可存在于高等植物种子的包被中,作为一种具有免疫刺激作用的生物活性物质,对水产动物的生长和生理功能表现出多方面的作用,是一种研究相对深入、应用广泛的免疫增强剂。研究表明 [16] 在鳗鱼饲料中添加葡聚糖,可使鳗鱼肠炎发病率降低,同时也能刺激鳗鱼食欲,促进生长。水产动物作为一种低等的脊椎动物,主要依靠非特异性免疫提高机体防御功能。作为一种免疫活性物质,β-葡聚糖已经被广泛应用到水产养殖中以提高动物的抗感染能力。陈俭等 [17] 研究显示β-葡聚糖能有效增强珍珠龙胆石斑鱼的抗氧化能力及提高其肠道菌群物种丰度和多样性以抵御外界有害菌的繁殖,同时提升珍珠龙胆石斑鱼的抗炎症和抗病等免疫能力,在珍珠龙胆石斑鱼上具有良好的生长和免疫增强效果,可作为新型免疫增强剂推广应用。另外有研究表明 [18] ,β-葡聚糖可以提高斑点叉尾鮰(Ictalurus punctatus)抗爱德华氏菌感染的能力。但是,亦有报道指出 [14] ,单独高剂量投喂葡聚糖会对动物造成免疫抑制。对鲤鱼的研究 [19] 发现,投喂β-葡聚糖60 d,感染后对照组的死亡率显著低于添加组,而Couso等 [20] 对鲤的研究结果显示,注射方式可以显著提高相对保护率,浸泡和口服方式对相对保护率没有显著影响。这表明,即使对同种水产动物,葡聚糖的给予方式或投喂时间等都可能导致抗感染能力不同。
可见,在养殖鱼的饲料中添加适量的免疫增强剂对减少养殖鱼类病害发生有一定作用,β-葡聚糖作为鱼类的免疫增强剂具有廉价易得,性质稳定易储存,具显著免疫刺激作用,能在短时间内提高水产养殖动物的免疫力,使养殖动物对病毒、细菌、真菌和寄生虫的抵抗力增强,因此可以预期β-葡聚糖在水产养殖中将成为减少水产养殖动物疫病发生的重要工具,值得在今后养殖生产中加以大力推广 [21] 。
5. 结论
本实验条件下,饲料中添加2‰ β-葡聚糖进行间歇性长期投喂福瑞鲤,其部分生长指标、非特异免疫酶活力和抗爱德华氏菌致死的能力均有显著提高。福瑞鲤间歇性长期摄食含β-葡聚糖饲料,其血清中LZM、ACP和CAT活力均显著升高,SOD活力无显著差异,血清中TP、ALB含量显著提高,GLB含量无显著差异,并且抗爱德华氏菌致死的相对保护率达25%。
文章引用
刘 群,霍文慧,刘桐山,王 菁,冯守明. 饲料中添加β-葡聚糖对福瑞鲤生长指标、非特异性免疫相关酶活力及抗病力的影响
Effects of Dietary β-Glucan on Activities of Growth, Non-Specific Immune Related Enzymes and Disease Resistance of Cyprinus carpio[J]. 农业科学, 2023, 13(05): 446-453. https://doi.org/10.12677/HJAS.2023.135060
参考文献
- 1. Bridle, A.R., Carter, C.G., Morrison, R.N., et al. (2005) The Effect of β-Glucan Administration on Macrophage Respir-atory Burst Activity and Atlantic Salmon, Salmo salar L., Challenged with Amoebic Gill Disease—Evidence of Inherent Resistance. Journal of Fish Diseases, 28, 347-356. https://doi.org/10.1111/j.1365-2761.2005.00636.x
- 2. 吴春玉, 曹俊明, 黄燕华, 等. 饲料中添加β-葡聚糖对花鲈生长性能、体成分、血清生化指标和抗氨氮应激能力的影响[J]. 动物营养学报, 2013, 25(12): 3033-3040.
- 3. 王永宏, 杨小玉, 郭正龙, 等. β-葡聚糖对暗纹东方鲀幼鱼非特异性免疫及生长性能的影响[J]. 中国水产科学, 2013, 20(6): 10.
- 4. 陆敬波, 姚俊杰, 毛国栋, 等. 网箱养殖福瑞鲤鱼种体长与体重关系分析[J]. 河北渔业, 2017(7): 28-29, 37. http://doi.org/10.3969/j.issn.1004-6755.2017.07.008
- 5. 祝璟琳, 邹芝英, 李大宇, 等. 异源无乳链球菌胞外产物灭活疫苗对罗非鱼的免疫效果[J]. 中国水产科学, 2022, 29(2): 325-340. http://doi.org/10.12264/JFSC2021-0367
- 6. 杨宾兰, 王培培, 廖愚. 不同养殖环境建鲤新品系试养效果分析[J]. 水产研究, 2018, 5(1): 1-5. https://doi.org/10.12677/OJFR.2018.51001
- 7. 高桂平, 彭淇, 冯健. 饲料中添加酵母、酵母RNA、β-葡聚糖和酵母 RNA + β-葡聚糖对吉富罗非鱼幼鱼生长和免疫性能的影响[J]. 水产研究, 2018, 5(1): 6-14. https://doi.org/10.12677/ojfr.2018.51002
- 8. 陈爱平, 朱泽闻, 王立新. 2006年中国水产养殖病害检测报告[J]. 科学养鱼, 2006, 9(11): 48. https://doi.org/CNKI:SUN:KXYY.0.2007-11-040
- 9. 张辽, 温安详. β-葡聚糖对齐口裂腹鱼生长及免疫功能的影响[J]. 动物营养学报, 2009, 21(5): 688-689. https://doi.org/10.3969/j.issn.1006-267x.2009.05.013
- 10. 刘云, 孙峰, 王丹. 免疫增强剂对鲫鱼非特异性免疫功能的影响[J]. 海洋科学, 2004, 28(9): 42-45. https://doi.org/10.3969/j.issn.1000-3096.2004.09.009
- 11. 陈旭衍, 侯亚义. 鱼类细胞因子研究进展[J]. 水生生物学报, 2004, 28(6): 668-673.
- 12. 朱旺明, 阳会军, 关国强, 等. β-葡聚糖在水产养殖中的应用前景[J]. 饲料工业, 2000, 21(11): 38-39.
- 13. 刘立鹤, 郑石轩, 谭斌, 等. 不同饲料配方下β-葡聚糖对凡纳滨对虾生长性能、非特异性免疫力的影响及成本分析[J]. 饲料工业, 2005, 26(8): 26-30.
- 14. 李富东, 叶继丹, 王琨, 等. 长时间连续投喂β-葡聚糖对鲤生长性能及非特异性免疫功能的影响[J]. 动物营养学报, 2009, 21(4): 499-505. https://doi.org/10.3969/j.issn.1006-267x.2009.04.013
- 15. 郭瑞, 周爽, 王文秀, 等. β-葡聚糖的营养健康功能研究进展[J]. 粮油食品科技, 2023, 31(1): 33-39.
- 16. 凌统, 程树东, 李英文. 免疫增强剂—β-葡聚糖在水产饲料中的应用[J]. 饲料工业, 2005, 26(12): 36-38. https://doi.org/10.3969/j.issn.1001-991X.2005.12.012
- 17. 陈俭, 代冰涛, 王红明, 等. 饲料中添加β-葡聚糖对珍珠龙胆石斑鱼生长性能、免疫指标、转录组及肠道菌群的影响[J]. 南方农业学报, 2022, 53(5): 1434-1447. https://doi.org/10.3969/j.issn.2095-1191.2022.05.026
- 18. 孟思妤, 孟长明, 陈昌福. β-葡聚糖对鱼类免疫防御机能的增强作用[J]. 渔业致富指南, 2010(21): 58-59. https://doi.org/CNKI:SUN:YYZF.0.2010-21-037
- 19. Chen, D. and Ainsworth, A.J. (2010) Glucan Administra-tion Potentiates Immune Defence Mechanisms of Channel Catfish, Ictalurus punctatus Rafinesque. Journal of Fish Dis-eases, 15, 295-304. https://doi.org/10.1111/j.1365-2761.1992.tb00667.x
- 20. Ye, J.D., Wang, K., Li, F.D., et al. (2011) Effects of Long-Term Dietary Administration of Beta-Glucan on Tissue Enzyme Activity and Disease Resistance in Common Carp, Cyprinus carpio. The Israeli Journal of Aquaculture-Bamidgeh, 63, 664.
- 21. Couso, N., Castro, R., Magarinos, B., et al. (2003) Effect of Oral Administration of Glucans on the Resistance of Gilthead Seabream to Pasteurellosis. Aquacul-ture, 219, 99-109. https://doi.org/10.1016/S0044-8486(03)00019-X
NOTES
*通讯作者。
