Botanical Research
Vol.07 No.02(2018), Article ID:24258,9
pages
10.12677/BR.2018.72024
Prokaryotic Expression and Polyclonal Antibody Preparation of PtrLAC-2 Gene of Populus trichocarpa
Ying Li, Jiaxin Li, Xiaotong Teng, Xiaorui Guo, Ziyi Cheng, Bin Yin, Yongzhuo Zhang, Hai Lu, Hui Li
College of Biological Sciences and Biotechnology, Beijing Forestry University, Beijing
Received: Mar. 2nd, 2018; accepted: Mar. 21st, 2018; published: Mar. 28th, 2018

ABSTRACT
Objective: To clone and express the Populus trichocarpa laccase PtrLAC-2 gene. This study prepared polyclonal antibody with high affinity and specificity to improve the study of structure and function of laccase. Methods: According to the principle of homologous cloning, laccase gene from Arabidopsis thaliana was used to blast the database JGI of Populus trichocarpa. The Populus trichocarpa laccase PtrLAC-2 gene was cloned by PCR before being ligated with pET-30a(+) to construct prokaryotic expression vector PtrLAC-2-pET30a(+). PtrLAC-2-pET30a(+) was then transformed into E. coli BL21(DE3) competent cells for induction expression. Recombinant protein was purified as antigen to immune rabbit to prepare polyclonal antibody. Titer of the polyclonal antibody and specificity were analyzed using ELISA and Western bolt at last. Results: Populus trichocarpa laccase gene was isolated (renamed PtrLAC-2, Genebank: XP_002308164). Prokaryotic expression vector PtrLAC-2-pET30a(+) was constructed successfully. The recombinant protein with the length of 62 KDa was obtained. ELISA analysis showed that the titer of the obtained antibody was 1:102,400. Western blot showed that the antibody could specifically combine with PtrLAC-2 protein in Populus trichocarpa. Conclusion: The PtrLAC-2 genes successfully expressed in E. coli and the PtrLAC-2 polyclonal antibody with high affinity and specificity was generated. This study will supply theoretical foundation in the following enzyme biochemical function.
Keywords:Populus trichocarpa, Laccase, Gene Clone, Prokaryotic Expression, Polyclonal Antibody
毛果杨漆酶基因PtrLAC-2的原核表达与多克隆抗体制备研究
李盈,李嘉鑫,滕晓瞳,郭晓蕊,程子义,尹玢,张永卓,陆海,李慧
北京林业大学生物科学与技术学院,北京
收稿日期:2018年3月2日;录用日期:2018年3月21日;发布日期:2018年3月28日

摘 要
目的:克隆毛果杨漆酶基因PtrLAC-2,并对其进行原核表达,同时制备高特异性、高效价的PtrLAC-2多克隆抗体,为研究漆酶基因蛋白在体外结构与功能奠定基础。方法:利用拟南芥中的漆酶基因序列对毛果杨基因组数据库进行同源检索,PCR同源克隆并扩增得到毛果杨PtrLAC-2基因序列,将其亚克隆到pET30a(+)载体得到PtrLAC-2-pET30a(+)原核表达载体,转化到大肠杆菌BL21(DE3)中诱导表达并纯化得到PtrLAC-2重组蛋白。采用皮下免疫法将纯化的PtrLAC-2蛋白免疫兔子制备多克隆抗体,用ELISA和Western blot检测血清多克隆抗体的效价和特异性。结果:克隆获得了毛果杨漆酶基因的序列(命名PtrLAC-2,基因登录号XP_002308164),成功构建了PtrLAC-2-pET30a(+)原核表达载体,诱导表达获得了62 KDa的重组蛋白,ELISA检测显示抗体效价达1:102,400,经Western blot鉴定,制备的多克隆抗体能特异性检测毛果杨中的PtrLAC-2蛋白。结论:毛果杨漆酶PtrLAC-2基因可以在体外成功进行原核表达,同时获得了高特异性、高效价的兔抗PtrLAC-2多克隆抗体,为后续研究该酶生化功能提供了一定的理论基础。
关键词 :毛果杨,漆酶,基因克隆,原核表达,多克隆抗体

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
[研究意义]漆酶是一种含铜的糖蛋白氧化酶,广泛存在于高等植物植物、真菌、细菌和一些昆虫中。有关真菌漆酶的研究近年来取得了很大的进展,并已成功应用于造纸行业原料的处理,燃料废水的降解和食品饮料的等方面 [1] ;而高等植物中有关漆酶的研究则相对较少,近年来对植物漆酶的不断研究表明植物漆酶可能参与了木质素的合成,植物细胞壁的维持等 [2] 。木质素作为存在于高等植物中的一种天然芳香聚合物,可为植物细胞壁提供足够的强度和硬度,并能在运输水分的同时避免植物遭受水和生物的侵害 [3] [4] [5] ;在造纸工业中木质素会严重影响纸浆质量 [6] ;在畜牧业中木质素则会影响牲畜的消化与营养吸收 [7] 。因此改变木质素的含量或组分有助于人类合理地利用木质素资源,通过基因工程的手段调控木质素合成途径中的关键基因漆酶则成为了重要的研究方向。要想深入了解植物漆酶在体内的具体生化功能,分子水平和蛋白水平上的研究是必不可少的。[前人研究进展]目前,有关漆酶的异源表达的研究主要集中在真菌漆酶。Christoph J等 [8] 克隆了担子菌中的一个漆酶基因并在毕赤酵母GS115中成功实现异源表达;Shuangxin Ma等 [9] 克隆了大斑病菌中的一个漆酶基因Stlac4并在大肠杆菌中成功实现异源表达。植物漆酶的异源表达特别是原核表达甚少见报道。[本研究切入点]毛果杨作为模式植物其基因组测序已经完成,因此研究其漆酶基因序列为进一步阐明漆酶在植物中的功能具有重要意义。[拟解决的关键问题]鉴于此,本研究以毛果杨为材料,对其漆酶PtrLAC-2进行了克隆、原核表达和纯化,并制备了多克隆抗体,旨在为进一步研究木质素合成途径中的关键酶漆酶的蛋白功能研究提供参考。
2. 材料与方法
2.1. 材料与试剂
实验材料毛果杨为本实验室继代保存。大肠杆菌JM109和BL21(DE3),表达载体pET30a(+)为本实验室保存;克隆载体pMD-18T购自TaKaRa公司;植物总RNA提取试剂盒,反转录试剂盒,琼脂糖凝胶DNA回收试剂盒、普通质粒小提试剂盒购自北京天根生物公司;T4-DNA连接酶,限制性内切酶Kpn I和BamH I购自promega公司;异丙醇基硫代β-D-半乳糖苷(IPTG)购自Sigma公司;蛋白marker购自北京全式金生物技术有限公司;聚偏二氟乙烯膜(PVDF)购自Roche公司,HPR标记羊抗兔IgG购自北京康为世纪生物科技有限公司;化学发光剂购自Millipore公司;其他试剂均为国产分析纯试剂。
2.2. 实验方法
2.2.1. 毛果杨漆酶基因PtrLAC-2的电子克隆与序列分析
利用拟南芥中的漆酶基因序列对毛果杨基因组数据库进行同源检索,得到与拟南芥中的漆酶基因AtLAC17同源性较高的漆酶基因序列,用生物信息学的方法对获得的漆酶的基因序列PtrLAC-2(基因登陆号XP_002308164)进行分析。
2.2.2. 毛果杨漆酶基因PtrLAC-2的克隆和PtrLAC-2-pET30a(+)表达载体的构建
以毛果杨组培苗的叶片为材料,根据北京天根生物公司的总RNA提取试剂盒的操作步骤,提取毛果杨的总RNA,并进行反转录得到毛果杨的cDNA序列,设计特异性引物,上游引物:5’-GGGGTACCAAGAAACATATCAGAAAAATGGGC-3’(下划线为Kpn I酶切位点),下游引物:GCCCTAGGGAGAGTACTCGAAATCAAAGGCTC-3’(下划线为BamH I酶切位点),以cDNA为模板进行PCR扩增目的基因,电泳检测完后用琼脂糖凝胶回收试剂盒回收目的条带,将回收的产物与pMD-18T载体连接后转化大肠杆菌JM109感受态细胞,并涂布于含Amp (100 mg/L)的LB培养基上,于37℃培养箱中过夜培养,挑取单菌落扩大培养并提取质粒进行PCR鉴定,将阳性个体送至北京华大基因公司进行测序鉴定。对测序正确的阳性克隆进行扩大培养,提取质粒,同时提取pET30a(+)质粒进行限制性内切酶的双酶切(Kpn I和BamH I),电泳检测回收目的条带,用T4-DNA连接酶进行连接,连接产物转化大肠杆菌BL21 (DE3)后涂布于含Kana (100 mg/L))的LB培养基上,于37℃培养箱中过夜培养,挑取单菌落扩大培养提取质粒进行双酶切鉴定(Kpn I和BamH I),得到PtrLAC-2-pET30a(+)的重组原核表达载体。
2.2.3. 重组蛋白的诱导表达
将含有PtrLAC-2-pET30a(+)重组载体的大肠杆菌BL21 (DE3)用接种环蘸取涂布在含Kana (100 mg/L)的LB固体培养基中,37℃培养12 h待长出单菌落;挑取单菌落接入10 ml含有Kana (100 mg/L)的LB液体培养基中,37℃ 200 r/min振荡培养12 h;将菌体培养液吸出5 ml接种于500 ml含有Kana (100 mg/L)的LB液体培养基中,37℃ 200 r/min震荡培养3~4 h,待OD600达到0.4~0.6之间,加入终浓度为0.3 mM的IPTG,37℃ 200 r/min振荡培养,4℃ 12000 rpm离心收集诱导3 h后的菌液。将收集的菌体用20 ml重悬液(300 mM Nacl, 50 mM Tris-Hcl, pH8.0)重悬后冰水浴超声裂解,4℃ 12000 r/min离心30 min弃上清,将沉淀用10 ml 8 M尿素溶解,冰水浴超声裂解,离心后收集上清4℃保存。将保存的蛋白和蛋白缓冲液按1:1混合后100℃水浴10 min,以未加IPTG组作为阴性对照,进行12%的SDS-PAGE凝胶电泳分离蛋白,并用考马斯亮蓝染色检测蛋白的表达。
2.2.4. 重组蛋白的纯化
将收集的菌体用20 ml重悬液(300 mM Nacl, 50 mM Tris-Hcl, pH8.0)重悬,冰水浴超声裂解菌液,12000 r/min离心30 min弃上清;沉淀依次用20 ml含有2 M/4 M/6 M尿素的洗涤液(50 mM Tris-Hcl, 50 mM Nacl, 1 mM EDTA-NA2, 2 M/4 M/6 M尿素,0.5%Triton x100, 2 mM B-巯基乙醇,pH 8.0)重悬,每级于冰上震荡30 min,离心后弃上清,最终沉淀用20 ml含有8 M尿素的包涵体预溶液(8 M尿素,50 mM Tris-Hcl,1 mM EDTA-NA2, 50 mM NACl, pH 8.0)重悬,离心后收集上清,进行12%的SDS-PAGE凝胶电泳分离蛋白,考马斯亮蓝染色后检测蛋白的表达。
2.2.5. 多克隆抗体的制备
参照李芳等的方法将200 μg纯化后的融合蛋白用生理盐水稀释到200~500 μl,与等体积弗氏完全佐剂混合乳化后,采用皮下6点注射法免疫新西兰大耳白兔,12d后取200 μg融合蛋白与等体积弗氏不完全佐剂混合乳化后加强免疫,第24天和36天分别用不加佐剂的纯化蛋白200 μg加强免疫,第四次免疫10d后采全血,分离抗血清,−20℃保存。动物免疫前取血做阴性对照 [10] 。
2.2.6. 多克隆抗体效价的检测及特异性分析
用ELISA检测抗血清的效价。抗原包被封闭后用抗血清孵育,之后用HRP标记的羊抗兔IgG孵育,TMB显色后最后用终止液终止反应,酶标仪450 nm紫外光波长下检测。
用Western blot方法进行抗体的特异性分析,提取毛果杨的全蛋白并进行12%的SDS-PAGE电泳,300 mA电转1 h转至PVDF膜上,用5%脱脂奶粉4℃封闭过夜,TBST洗涤3次,用1:1000倍稀释制备的多抗作为一抗,室温孵育1 h,TBST洗涤3次,用1:1000倍稀释的HPR标记羊抗兔IgG作为二抗,室温孵育1 h,TBST洗涤3次,用HRP-ECL化学发光法鉴定蛋白。
3. 结果与分析
3.1. 漆酶PtrLAC-2的序列分析
利用拟南芥漆酶基因AtLAC17对毛果杨基因组数据库同源检索,我们得到同源性较高的毛果杨的的基因PtrLAC-2,对其进行序列分析可知,其基因全长为3518 bp,其中含有6个外显子和3个内含子,其CDS序列全长为1743 bp,编码580个氨基酸,该序列没有信号肽大小约为62 KDa。由DNAMAN软件分析PtrLAC-2与拟南芥酶基因AtLAC17的序列同源性高达66.21%(如图1)。
3.2. 重组表达载体的鉴定
将重组表达载体PtrLAC-2-pET30a(+)进行Kpn I和BamH I双酶切鉴定,由酶切图可以看出重组蛋白切出了两条明显的条带,分别是5000 bp左右和1700 bp左右,结果与序列的大小一致(如图2)。将酶切鉴定的质粒测序,最终确定目的基因已正确插入pET30a(+)表达载体中。
3.3. 重组蛋白的诱导表达
将PtrLAC-2-pET30a(+)转化至大肠杆菌BL21(DE3)中,取阳性单菌落扩大培养,重组菌在37℃、IPTG浓度为0.3 mM条件下诱导3 h,SDS-PAGE电泳检测可见,诱导重组菌比未诱导重组菌多出一条蛋白质条带,其分子量约为62 kDa,与预期表达蛋白的大小一致(如图3)。
3.4. 重组蛋白的纯化
将诱导表达后的重组蛋白菌体在不同浓度的洗涤液中洗涤以纯化目的蛋白,SDS-PAGE电泳结果发现仅在62 kDa处有一条明显条带,表明重组蛋白已成功进行纯化(如图4)。

Figure 1. The amino acid sequence alignments of Populus trichocarpa PtrLAC-2 and Arabidopsis thaliana AtLAC17
图1. 毛果杨漆酶PtrLAC-2与拟南芥漆酶AtLAC17的氨基酸序列比对
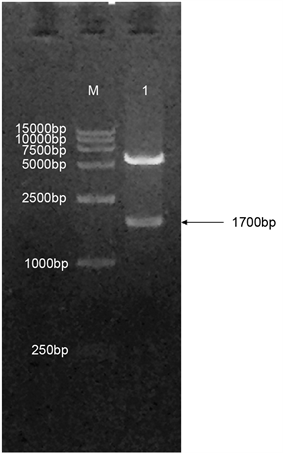
Figure 2. Identification of recombinant plasmid PtrLAC-2-pET-30a(+) with restriction enzyme, M. DNA Marker DL15000; 1. PtrLAC-2-pET-30a(+) digested by Kpn I and BamH I
图2. PtrLAC-2-pET30a(+)。重组质粒双酶切鉴定结果,M. DNA Marker DL15000;1. Kpn I和BamH I双酶切后的PtrLAC-2-pET30a(+)

Figure 3. Induced expression of laccase PtrLAC-2 protein; M. Protein Marker; 1. Did not induced strain; 2. Protein expression by IPTG 3 hours
图3. 漆酶PtrLAC-2蛋白的诱导表达;M. 蛋白marker;1. 未经诱导的重组蛋白;2. IPTG诱导3 h后的重组蛋白

Figure 4. Purification result of recombinant protein; M. Protein Marker t; 1. The purified protein of PtrLAC-2
图4. 重组蛋白的纯化;M. 蛋白marker;1. 纯化后的PtrLAC-2蛋白
3.5. 漆酶PtrLAC-2多克隆抗体的效价和特异性
以免疫前的兔血清为阴性对照,倍比稀释抗血清,ELISA分析结果表明多克隆抗体的效价可达1:102400(如图5)。多克隆抗体以1:1000倍稀释后进行Western blot鉴定,结果显示多克隆抗体能与毛果杨全蛋白提取液在62 kDa大小的位置呈现特异性反应条带,实验结果表明制备的PtrLAC-2多克隆抗体具有较好的特异性(如图6)。
4. 讨论
漆酶于1883年首次于漆树漆液中被发现,此后不断有新的漆酶被报道,除漆树科外,在火炬松、埃及榕、烟草、毛果杨、北美鹅掌楸、黑麦草都已被鉴定发现漆酶基因 [11] 。漆酶按照来源大致可分为植物漆酶、微生物(包括真菌和细菌)漆酶和动物漆酶。几类漆酶中研究报道较多的是真菌漆酶,植物漆酶一直缺乏有效的系统研究。早在1958年,Freudenberg就提出植物漆酶可能与木质素合成相关,随后由于较长时间无法从植物中提取高纯度漆酶,该理论一直未受到重视 [12] 。直到Sterjiades等和Bao等分别从欧亚槭和火炬松中分离得到漆酶,并证明其可以在体外催化木质素单体的氧化聚合,有关植物漆酶的作用才逐渐引起人们的关注 [13] [14] 。Berthet S等通过T-DNA插入诱变技术将拟南芥中的两个漆酶AtLAC4和AtLAC17敲除后发现植株根茎的木质部塌陷,并在双突变体的研究中发现木质素含量相比对照组有大量降低 [15] 。Zhao等通过对拟南芥AtLAC4,AtLAC11,AtLAC17的三突变体研究,发现木质素无法正常沉积,同时也严重影响了拟南芥的正常生长 [16] 。上述研究报道表明拟南芥AtLAC17和其他漆酶基因一起在木质素的合成途径中发挥重要作用。
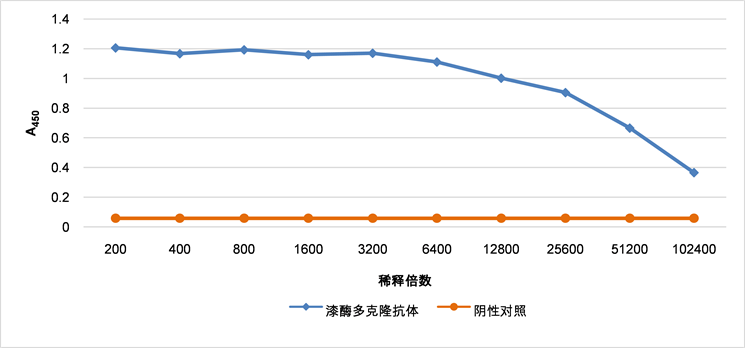
Figure 5. Titer of polyclonal antibody of PtrLAC-2 detected by ELISA
图5. PtrLAC-2多克隆抗体效价的ELISA测定
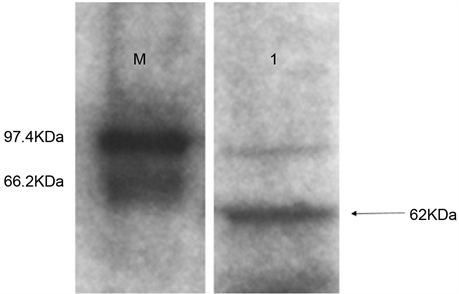
Figure 6. Identification of the specificity of PtrLAC-2 polyclonal antibody by Western blot; M. Protein Marker; 1. The recombinant protein of PtrLAC-2
图6. PtrLAC-2多克隆抗体特异性的Western blot检测;M. 蛋白marker;1. PtrLAC-2重组蛋白
通过在原核生物中表达目的基因的重组蛋白产物,是研究目标蛋白功能特征和酶学特性的基础。常用的原核表达系统大肠杆菌由于生长迅速,培养基成分简单,可实现外源蛋白高效表达被广泛应用。本研究首先通过生物信息学方法结合基因人工合成技术,克隆出与AtLAC17同源性高达66.21%的毛果杨漆酶基因PtrLAC-2,并构建PtrLAC-2-pET30a(+)原核表达载体,经IPTG诱导表达实现了重组质粒在大肠杆菌BL21(DE3)中的高效表达,获得了大量重组蛋白。随后采用洗涤液对重组蛋白进行了纯化,获得了高纯度的目的蛋白,最后选用4次免疫方式对兔子进行抗原免疫,最终获得特异性较好的PtrLAC-2多克隆抗体,为深入理解植物漆酶的功能以及促进其在生物工程领域的应用奠定基础。
5. 结论
本研究成功实现毛果杨漆酶在大肠杆菌原核表达系统中进行体外表达,并制备了针对毛果杨漆酶PtrLAC-2多克隆抗体。该抗体的效价理想,为进一步研究PtrLAC-2蛋白功能提供基础。
基金项目
北京林业大学杰出青年人才计划100万“中央高校基本科研业务费专项资金资助”(JC2015-01)。
文章引用
李 盈,李嘉鑫,滕晓瞳,郭晓蕊,程子义,尹 玢,张永卓,陆 海,李 慧. 毛果杨漆酶基因PtrLAC-2的原核表达与多克隆抗体制备研究
Prokaryotic Expression and Polyclonal Antibody Preparation of PtrLAC-2 Gene of Populus trichocarpa[J]. 植物学研究, 2018, 07(02): 177-185. https://doi.org/10.12677/BR.2018.72024
参考文献
- 1. 艾明强. 吡喃糖氧化酶和漆酶在木质素生物降解中作用的研究[D]: [博士学位论文]. 济南: 山东大学, 2015: 28-30.
- 2. 王国栋, 陈晓亚. 漆酶的性质、功能、催化机理和应用[J]. 植物学通报, 2003(20): 469-475.
- 3. Guo, D.J., Chen, F., Inoue, K., et al. (2001) Downregulation of Caffeic Acid 3-O-Methyltransferase and Caffeoyl CoA 3-O-Methyltransferase in Transgenic Alfalfa. Impacts on lignin structure and Implications for the Biosynthesis of G and S Lignin. Plant Cell, 13, 73-88.
https://doi.org/10.1105/tpc.13.1.73 - 4. Raes J, Rohde A, Christensen J H, et al. Genome-wide characterization of the lignification toolbox in Arabidopsis [J]. Plant Physiol, 2003,133:1051-1071.
https://doi.org/10.1104/pp.103.026484 - 5. Rogers, L.A., Dubos, C., Cullis, I.F., et al. (2005) Light, the Circadian Clock, and Sugar Perception in the Control of Lignin Biosynthesis. Journal of Experimental Botany, 56, 1651-1663.
https://doi.org/10.1093/jxb/eri162 - 6. 冷东梅. 造纸黑液木质素资源化处理[J]. 化学工程与装备, 2009(12): 164-167.
- 7. 徐世晓, 赵新全, 孙平, 等. 青藏高原5种牧草木质素含量及其体外消化率研究[J]. 西北植物学报, 2003(23): 1605-1608.
- 8. Behrens, C.J., Linke, D., et al. (2017) Variants of PpuLcc, a Multi-Dye Decolorizing Laccase from Pleurotus pulmonarius Expressed in Pichia pastoris. Protein Expression and Purification, 137, 34-42.
https://doi.org/10.1016/j.pep.2017.06.014 - 9. Ma, S.X., Liu, N., Jia, H., et al. (2017) Expression, Purification, and Characterization of a Novel Laccase from Setosphaeria turcica in Eschericha coli. Journal of Basic Microbiology, 58, 68-75.
https://doi.org/10.1002/jobm.201700212 - 10. 李芳, 罗军, 许会芬, 等. 西农萨能羊MAT基因的原核表达及多克隆抗体制备[J]. 西北农林科技大学学报, 2014(42): 10-11.
- 11. 曹山. 毛果杨木质素形成相关基因克隆及功能研究[D]. 北京: 北京林业大学, 2016: 10-11.
- 12. Freudenberg, K., Harkin, J., Rechert, M., et al. (1958) Die and der verholzung beteiligten enzyme die dehydrierung des sinapyl alcohol. Chemische Berichte, 91, 581-590.
https://doi.org/10.1002/cber.19580910317 - 13. Sterjiades, R., Dean, J.F.D. and Eriksson, K.E.L. (1992) Laccase from Sycamore Maple (Acer Pseudoplatanus) Polymerizes Monolignols. Plant Physiology, 99, 1162-1168.
https://doi.org/10.1104/pp.99.3.1162 - 14. Bao, W., Omalley, D.M., Whetten, R., et al. (1993) A Laccase Asso-ciated with Lignification in Loblolly Pine Xylem. Science, 260, 672-674.
https://doi.org/10.1126/science.260.5108.672 - 15. Berthet, S., Demont-Caulet, N., Pollet, B., et al. (2011) Dis-ruption of LACCASE4 and 17 Results in Tissue-Specific Alterations to Lignification of Arabidopsis thaliana Stems. Plant Cell, 23, 1124-1137.
https://doi.org/10.1105/tpc.110.082792 - 16. Zhao, Q., Nakashima, J., Chen, F., et al. (2013) LACCASE Is Nec-essary and Nonredundant with PEROXIDASE for Lignin Polymerization during Vascular Development in Arabidopsis. Plant Cell, 25, 3976-3987.
https://doi.org/10.1105/tpc.113.117770