Botanical Research
Vol.07 No.04(2018), Article ID:26080,8
pages
10.12677/BR.2018.74056
Expression Analysis of EndoPG Genes in Peach Fruits of Different Cultivars
Peizhuo Liu, Chao Gu
College of Horticulture, Nanjing Agricultural University, Nanjing Jiangsu
Received: Jul. 3rd, 2018; accepted: Jul. 18th, 2018; published: Jul. 25th, 2018

ABSTRACT
Endopolygalacturonase is an important cell wall hydrolase, which plays an important role in the ripening and softening of fruits. In order to explore the molecular mechanism of peach fruit softening, six EndoPG genes, EndoPG1, EndoPG2, EndoPG3, EndoPG4, EndoPG5 and EndoPG6, were isolated from the whole genome of peach. Different peach cultivars “Nanshantiantao”, “Zhaohui” and “Myojo” were chosen as experiment materials to compare the expression level of six EndoPG genes during fruit development by real-time fluorescence quantitative analysis. The results showed that six EndoPG genes expressed in “Nanshantiantao” and “Zhaohui” during fruit development. Specially, EndoPG3/4 gene showed a significant level. In the fruit of “Myojo”, only four EndoPG genes, EndoPG1, EndoPG2, EndoPG5 and EndoPG6 were detected. The results show that the EndoPG gene plays an important role in the fruit ripening of peach. This study laid the foundation for further exploring the molecular mechanism of peach fruit ripening and softening regulation of endopolygalacturonase.
Keywords:Endopolygalacturonase, Peach, Fruit Softening, Gene Expression
不同品种桃果实中内切多聚半乳糖醛酸酶EndoPG基因的表达分析
刘佩卓,谷超
南京农业大学园艺学院,江苏 南京
收稿日期:2018年7月3日;录用日期:2018年7月18日;发布日期:2018年7月25日

摘 要
内切多聚半乳糖醛酸酶(endopolygalacturonase, EndoPG)是一种重要的细胞壁水解酶,在果实的成熟软化过程中具有重要作用。为探究桃果实软化的分子机制,本研究从桃全基因组中分离出6个EndoPG基因EndoPG1、EndoPG2、EndoPG3、EndoPG4、EndoPG5和EndoPG6,以不同桃品种“南山甜桃”、“朝晖”和“明星”果实为研究材料,通过实时荧光定量分析了这6个EndoPG基因在果实发育过程中的表达情况。研究结果显示:6个EndoPG基因在“南山甜桃”和“朝晖”的果实发育过程中均有表达,其中EndoPG3/4基因表达水平显著;在“明星”中,仅检测到4个EndoPG基因EndoPG1、EndoPG2、EndoPG5和EndoPG6的表达。结果表明EndoPG基因在桃果实成熟过程中发挥了重要作用。本研究为进一步探究内切多聚半乳糖醛酸酶调控桃果实成熟软化的分子机制奠定了基础。
关键词 :内切多聚半乳糖醛酸酶,桃,果实软化,基因表达

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
桃(Prunus persica)是蔷薇科李属的核果类植物,其果实风味鲜美、营养丰富,深受人们喜爱 [1] 。桃果实属于呼吸跃变型果实,成熟的果实采收以后会迅速出现呼吸高峰并变软,严重影响其贮藏、运输及销售。按照成熟期以后的软化特点,桃果实在肉质上可分为溶质桃和不溶质桃两种类型 [2] ;而根据粘离核状态又可分为离核、半离核和黏核三种类型 [3] 。我国主栽桃品种多为溶质桃,果实采后极易软化。在商业上为了减少损失,延长供应期,人们常在果实较硬的时候早采,但早采的果实在颜色和风味上常常不佳 [4] 。因此,研究桃果实软化的分子机制,有利于改善桃的口感和风味,延长贮藏期,对我国桃相关产业的发展具有重要意义。
桃的果实软化是由大量细胞壁多糖物质降解以及细胞壁结构丧失导致细胞发生分离所致 [5] 。多聚半乳糖醛酸酶(polygalacturonase, PG)能够降解细胞壁的主要成分果胶,因此它在桃果实的成熟软化过程中发挥着重要的作用。多聚半乳糖醛酸酶(polygalacturonase, PG)是一种水解酶,按作用方式的不同可分为外切多聚半乳糖醛酸酶(ExoPG)和内切多聚半乳糖醛酸酶(EndoPG) [6] 。外切多聚半乳糖醛酸酶可以水解果胶分子的非还原端产生半乳糖醛酸;而内切多聚半乳糖醛酸酶 [7] 随机地水解切开果糖分子中间的α-1,4半乳糖糖苷键,使多聚半乳糖醛酸链断裂,最终果实细胞壁中多聚半乳糖醛酸被降解为寡聚半乳糖醛酸和半乳糖醛酸,引起细胞壁结构解体导致果实软化 [8] 。已有研究表明,水解酶对于多种水果的细胞壁分解至关重要,如番茄 [9] ,草莓 [10] ,苹果 [11] 和杏 [12] 。然而,越来越多的证据表明,与果实软化有关的细胞壁水解酶在物种间有所不同,它们对果实软化的特殊作用仍不明确 [13] [14] 。
本研究以三种不同桃品种“南山甜桃”、“朝晖”和“明星”桃果实为研究材料,对6个桃EndoPG基因EndoPG1、EndoPG2、EndoPG3、EndoPG4、EndoPG5和EndoPG6在果实从发育至成熟阶段的表达进行了分析,为深入开展内切多聚半乳糖醛酸酶对桃果实软化分子机制的调控研究提供基础。
2. 材料与方法
2.1. 实验材料
供试材料为三种不同品种的桃果实,分别为离核溶质型“南山甜桃”、黏核溶质型“朝晖”和黏核不溶质型“明星”。三个品种的桃果实均取自中国科学院武汉植物园江夏基地。自花授粉后30 d起,每两周收集一次桃果实样品,直至果实成熟。“南山甜桃”和“明星”共收集9次样品,“朝晖”收集10次。样品收集后立即使用液氮冷冻并保存于−80℃冰箱中备用。
2.2. 实验方法
2.2.1. RNA提取与反转录
按照多酚多糖RNA提取试剂盒(南京有晴生物科技有限公司)说明书提取样品的总RNA,并采用反转录试剂盒TransScript® One-Step RT-PCR SuperMix (北京全式金生物技术有限公司)将其反转录为cDNA,合成的cDNA用于实时荧光定量PCR (qRT-PCR)测定。
2.2.2. 特异引物设计
根据从桃全基因组中分离出的6个EndoPG基因序列,利用Primer 5.0软件设计特异引物,引物序列见表1。
2.2.3. 荧光定量PCR
以合成的cDNA为模板,使用罗氏lightCycler 480II PCR仪进行实时荧光定量PCR (qRT-PCR)分析。反应试剂为SYBR Premix ExTaqTM (北京宝日医生物技术有限公司),以Pbrtublin为内参基因,不同样品得到的数据经内参基因均一化处理后,采用2−ΔΔCt法 [15] 计算基因的相对表达量。试验数据的处理与分析在Microsoft Excel 2010中完成。
3. 结果与分析
3.1. EndoPG基因的鉴定
基于桃全基因组进行分析鉴定,共分离出6个EndoPG基因,ppa021953m、ppa025787m、ppa006839m、Ppa006857m、ppa025098m、ppa007271m,分别命名为EndoPG1-EndoPG6。其中EndoPG1-EndoPG4
Table 1. Sequences of primers used in this study
表1. 本研究中使用的特异引物序列
位于4号染色体上,EndoPG5和EndoPG6分别位于6号和7号染色体。EndoPG3和EndoPG4分别是已报道的EndoPGM和EndoPGF基因,二者同源性超过99% [16] 。为正确鉴定这6个EndoPG基因在桃果实中的表达水平,分别设计了6个EndoPG基因的特异引物及EndoPG3和EndoPG4的共同特异引物。
3.2. EndoPG基因在“南山甜桃”果实中的表达谱
荧光定量结果(图1)显示:3个EndoPG基因,EndoPG1、EndoPG2和EndoPG5在花后40天(N2)的表达水平达到最高值,随后开始下降;EndoPG6在花后30天(N1)和40天(N2)的表达水平较高,其它发育阶段表达水平均较低;EndoPG3/4的表达水平在花后80天(N6)开始上升,花后90天(N7)的表达水平达到峰值。综合分析发现,EndoPG1、EndoPG2、EndoPG5和EndoPG6在离核溶质型“南山甜桃”各发育阶段果实中的表达水平均较低,而EndoPG3/4在成熟果中的表达水平显著高(p-value = 0 < 0.05)于其它基因。
3.3. EndoPG基因在“朝晖”果实中的表达谱
如图2所示,EndoPG1在花后60天(Z4)的表达水平达到最高值,随后表达水平开始下降,在花后90天(Z7)时不表达;EndoPG2在花后70天(Z5)的表达水平较高,在其他发育阶段的表达水平较低,并且在花后60天(Z4),花后90天(Z7)和花后100天(Z8)这三个阶段不表达;EndoPG3/4仅在花后100天(Z8)的表达水平较高,在其他发育阶段不表达;EndoPG5的表达水平从花后30天(Z1)到花后60天(Z4)持续上升,在花后60天(Z4)和70天(Z5)达到最高值,随后逐渐下降;EndoPG6在花后40天(Z2)的表达水平较高,自花授粉后60天(Z4)起不表达。综合分析发现,EndoPG1、EndoPG2、EndoPG5和EndoPG6在黏核溶质型“朝晖”各阶段发育果实中的表达水平均较低,EndoPG3/4在成熟果中的表达水平显著高(p-value = 0 < 0.05)于其它基因。
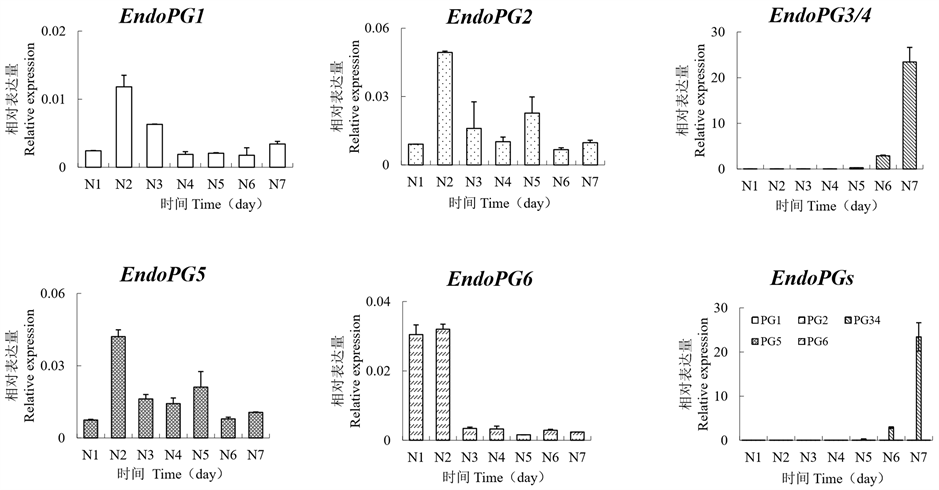
Figure 1. Expression profiles of different EndoPG genes in “Nanshantiantao” fruit. N1: 30 days after flowering; N2: 40 days after flowering; N3: 50 days after flowering; N4: 60 days after flowering; N5: 70 days after flowering; N6: 80 days after flowering; N7: 90 days after flowering
图1. 不同EndoPG基因在“南山甜桃”果实中表达谱。N1:花后30天;N2:花后40天;N3:花后50天;N4:花后60天;N5:花后70天;N6花后80天;N7:花后90天
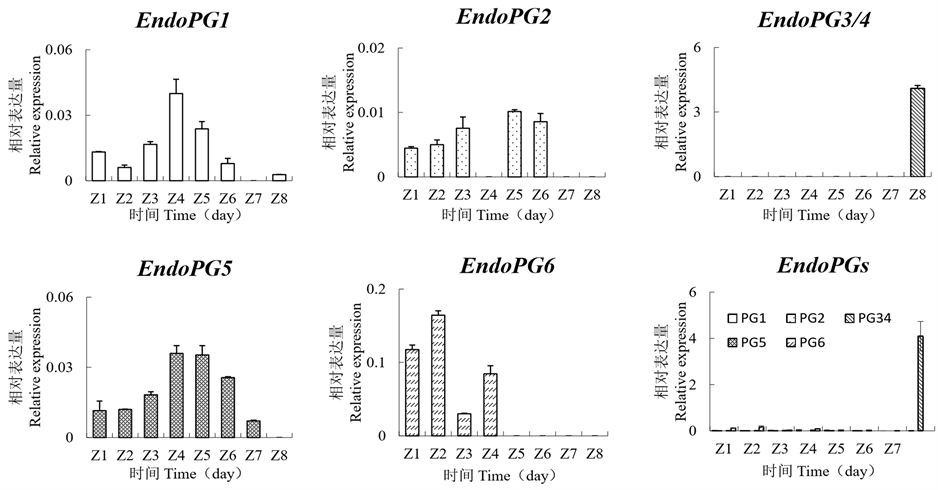
Figure 2. Expression profiles of different EndoPG genes in “Zhaohui” fruit. Z1: 30 days after flowering; Z2: 40 days after flowering; Z3: 50 days after flowering; Z4: 60 days after flowering; Z5: 70 days after flowering; Z6: 80 days after flowering; Z7: 90 days after flowering; Z8: 100 days after flowering
图2. 不同EndoPG基因在“朝晖”果实中表达谱。Z1:花后30天;Z2:花后40天;Z3:花后50天;Z4:花后60天; Z5:花后70天;Z6:花后80天;Z7:花后90天;Z8:花后100天
3.4. EndoPG基因在“明星”果实中的表达谱
由图3可知,EndoPG1的表达水平从花后30天(M1)开始先表现出下降的趋势,在花后60(M4)天达到最高值,在之后的发育阶段再次降到较低的水平;EndoPG2在花后40天(M2)和花后80天(M6)的表达水平较高,在其他发育阶段的表达水平较低,在花后60天(M4)和花后70天(M5)这两个阶段不表达;EndoPG5在果实发育过程中表达水平不断起伏,其中花后40天(M2)、花后60天(M4)及花后80天(M6)处于较高水平,在其他发育阶段表达水平较低。EndoPG6基因仅在花后80天(M6)的表达水平较高,在其他发育阶段的表达量均较低。特别地,在整个“明星”果实发育阶段中均未检测到EndoPG3/4基因的表达。
3.5. 不同引物对扩增下EndoPG3基因的表达谱
为探究不同EndoPG3/4基因扩增引物的特异性,分别用多组引物鉴定了EndoPG3基因在三种桃果实中的表达谱。荧光定量结果如图4所示,结果显示:利用三组引物对PG3F/PG3R、PG3F/PG34R和PG34F/PG3R鉴定出EndoPG3基因在黏核溶质型“朝晖”果实中的表达趋势一致;在离核溶质型“南山甜桃”果实中的表达趋势略有差异,其中,使用PG3F/PG34R与PG34F/PG3R引物对测定的EndoPG3基因表达水平较为相似;而在黏核不溶质型“明星”中未检测到EndoPG3基因的表达。该结果表明这三对引物均可特异扩增EndoPG3,且以PG3F/PG34R扩增效果最佳。
3.6. PG4F/PG4R引物对扩增下EndoPG4在三种桃果实中的表达谱
利用特异引物对PG4F/PG4R分别检测EndoPG4基因在三种桃果实中的表达趋势,发现该基因在黏核溶质型“朝晖”和黏核不溶质型“明星”果实中均不表达,而在离核溶质型“南山甜桃”的发育果实中表达水平较低,在成熟果中的表达水平较高(图5)。

Figure 3. Expression profiles of different EndoPG genes in “Myojo” fruit. M1: 30 days after flowering; M2: 40 days after flowering; M3: 50 days after flowering; M4: 60 days after flowering; M5: 70 days after flowering; M6: 80 days after flowering; M7: 90 days after flowering
图3. 不同EndoPG基因在“明星”果实中表达谱。M1:花后30天;M2:花后40天;M3:花后50天;M4:花后60天;M5:花后70天;M6:花后80天;M7:花后90天

Figure 4. Expression profile of EndoPG3 gene in two different peach fruits. Z1: 30 days after flowering; Z2: 40 days after flowering; Z3: 50 days after flowering; Z4: 60 days after flowering; Z5: 70 days after flowering; Z6: 80 days after flowering; Z7: 90 days after flowering; Z8: 100 days after flowering. N1: 30 days after flowering; N2: 40 days after flowering; N3: 50 days after flowering; N4: 60 days after flowering; N5: 70 days after flowering; N6: 80 days after flowering; N7: 90 days after flowering
图4. EndoPG3在两种桃果实中的表达谱。Z1:花后30天;Z2:花后40天;Z3:花后50天;Z4:花后60天;Z5:花后70天;Z6花后80天;Z7:花后90天;Z8:花后100天。N1:花后30天;N2:花后40天;N3:花后50天;N4:花后60天;N5:花后70天;N6:花后80天;N7:花后90天
4. 讨论
果实的软化是一个复杂的生理过程,它可以提高果实的口感和食用价值,但降低了果实抵御外界不良因素的能力,同时降低了果实的抗病性和耐藏性。细胞壁结构改变和细胞壁成分物质降解目前被认为

Figure 5. Expression profile of EndoPG4 gene in “Nanshantiantao” fruit. N1: 30 days after flowering; N2: 40 days after flowering; N3: 50 days after flowering; N4: 60 days after flowering; N5: 70 days after flowering; N6: 80 days after flowering; N7: 90 days after flowering
图5. EndoPG4在“南山甜桃”中的表达谱。N1:花后30天;N2:花后40天;N3:花后50天;N4:花后60天;N5:花后有70天;N6:花后80天;N7:花后90天
是果肉质地下降的主要原因,这一过程与一系列水解酶有关 [17] 。因此研究与果实成熟软化相关的细胞壁降解酶有利于找出果实成熟过程中关键的影响因子,为果实软化调控和延长果实保鲜期提供依据 [18] 。
目前对于同为蔷薇科的苹果、草莓等其他品种的EndoPG基因的表达已有了初步的研究,如MdPG1和FAPG1已分别被鉴定为苹果和草莓果实软化的原因 [10] [11] 。并且经过了系统发育分析发现,桃、苹果和草莓的EndoPG基因有差异,属于不同的分支。本研究通过观察6个EndoPG基因在三个不同品种桃果实的成熟软化过程中的表达情况,发现了多聚半乳糖醛酸酶主要在桃果实的成熟软化后期发挥作用,其中EndoPG3/4基因在离核溶质型“南山甜桃”和黏核溶质型“朝晖”果实的成熟过程中起主要作用,而在黏核不溶质型“明星”未发现显著表达的EndoPG基因。对于多聚半乳糖醛酸酶的研究,有利于利用它的作用来改善桃的品质,如通过生物技术调控EndoPG基因的表达,培育新品种,或者通过调节多聚半乳糖醛酸酶的作用条件来改善桃果实的软化。但桃果实软化的原因还尚未明确,仍需要深入研究。
文章引用
刘佩卓,谷超. 不同品种桃果实中内切多聚半乳糖醛酸酶EndoPG基因的表达分析
Expression Analysis of EndoPG Genes in Peach Fruits of Different Cultivars[J]. 植物学研究, 2018, 07(04): 463-470. https://doi.org/10.12677/BR.2018.74056
参考文献
- 1. 索标. 桃果实软化过程中细胞壁多糖降解特性的研究[D]: [硕士学位论文]. 扬州: 扬州大学, 2006.
- 2. 麻国升. 桃果实肉质、粘离核及硬度的关联分析[D]: [硕士学位论文]. 北京: 中国科学院, 2012.
- 3. 孙升. 杏, 李资源粘离核分级标准的探讨[C]//全国李杏资源研究与利用学术交流会. 2000.
- 4. 陈昆松, 张上隆, 吕均良, 沈淦卿, 林意珠. “玉露”桃不同采收成熟度的贮运性及其生理基础研究[J]. 浙江农业学报, 1993, 5(4): 237-239.
- 5. John, M.A. and Dey, P.M. (1986) Postharvest Changes in Fruit Cell Wall. Advances in Food Research, 30, 139-193. https://doi.org/10.1016/S0065-2628(08)60349-3
- 6. 薛炳烨, 束怀瑞. 多聚半乳糖醛酸酶(PG)与果实成熟软化研究进展[J]. 山东农业大学学报, 2002, 33(2): 252-256.
- 7. PhaffH, J. and Demain, A.L. (1956) The Unienzymatic Nature of Yeast Polygalac-turonase. Journal of Biological Chemistry, 218, 875.
- 8. Crooks, P.R. and Grierson, D. (1983) Ultrastructure of Tomato Fruit Ri-pening and the Role of Polygalacturonase Isoenzymes in Cellwall Degradation. Plant Physiology, 72, 248-254.
- 9. Brummell, D.A. and Harpster, M.H. (2001) Cell Wall Metabolism in Fruit Softening and Quality and Its Manipulation in Transgenic Plants. Plant Molecular Biology, 47, 311-340. https://doi.org/10.1023/A:1010656104304
- 10. Quesada, M.A., Blanco-Portales, R., Posé, S., García-Gago, J.A., Jiménez-Bermúdez, S., Muñoz-Serrano, A., Caballero, J.L., Pliego Alfaro, F., Mercado, J.A. and Muñoz-Blanco, J. (2009) Antisense Downregulation of the FaPG1 Gene Reveals an Unexpected Central Role for Polygalacturonase in Strawberry Fruit Softening. Plant Physiology, 150, 1022-1032. https://doi.org/10.1104/pp.109.138297
- 11. Tacken, E., Ireland, H., Gunaseelan, K., Karunairetnam, S., Daisy, Z.W., Keith, S., Bowen, J., Atkinson, G.R., Johnston, J., Putterill, J., Hellens, R. and Schaffer, J.R. (2010) The Role of Ethylene and Cold Temperature in the Regulation of the Apple Polygalacturonase1 Gene and Fruit Softening. Plant Physiology, 153, 294-305. https://doi.org/10.1104/pp.109.151092
- 12. Leida, C., Ríos, G., Soriano, J.M., Pérez, B., Llácer, G., Crisosto, C.H. and Badenes, M.L. (2011) Identification and Genetic Characterization of an Ethylene-Dependent Polygalacturonase from Apricot Fruit. Postharvest Biology & Technology, 62, 26-34. https://doi.org/10.1016/j.postharvbio.2011.04.003
- 13. Prasanna, V. and Prabha, T.N. (2007) Tharanathan, R.N. Fruit Ripening Phenomena—An Overview. Critical Reviews in Food Science & Nutrition, 47, 1-19. https://doi.org/10.1080/10408390600976841
- 14. Tomassen, M.M., Barrett, D.M., van der Valk, H.C. and Woltering, E.J. (2007) Isolation and Characterization of a Tomato Non-Specific Lipid Transfer Protein Involved in Polygalacturonase-Mediated Pectin De-gradation. Journal of Experimental Botany, 58, 1151-1160. https://doi.org/10.1093/jxb/erl288
- 15. Livak, K.J. and Schmittgen, T.D. (2001) Analysis of Relative Gene Expression Data Using Real-Time Quantitative PCR and the 2-ΔΔCtMethod. Methods, 25, 402-408. https://doi.org/10.1006/meth.2001.1262
- 16. Chao, G., Lu, W., Wei, W., Hui, Z., Baiquan, M., Hongyu, Z., Ting, F., Collins, O., Sornkanok, V. and Yuepeng, H. (2016) Copy Number Variation of a Gene Cluster Encoding Endopolygalacturonase Mediates Flesh Texture and Stone Adhesion in Peach. Journal of Experimental Botany, 67, 1993-2005. https://doi.org/10.1093/jxb/erw021
- 17. 彭丽桃, 饶景萍, 杨书珍, 任小林, 王俊宁. 果实软化的胞壁物质和水解酶变化[J]. 热带亚热带植物学报, 2002, 10(3): 271-280.
- 18. 赵云峰, 林河通, 林娇芬, 陈绍君. 果实软化的细胞壁降解酶及其调控研究进展[J]. 仲恺农业技术学院学报, 2006, 19(1): 65-70.
