Advances in Clinical Medicine
Vol.
13
No.
01
(
2023
), Article ID:
60911
,
10
pages
10.12677/ACM.2023.131145
PD-1抑制剂对非小细胞肺癌患者Mito+ T淋巴 细胞免疫代谢影响模式
王铮1*,陈存海2,马学真2#
1青岛大学医学部,山东 青岛
2青岛大学附属青岛市中心医院,山东 青岛
收稿日期:2022年12月28日;录用日期:2023年1月21日;发布日期:2023年1月31日

摘要
目的:探究PD-1抑制剂对非小细胞肺癌患者Mito+ T淋巴细胞免疫代谢影响模式。方法:选取在2020-07-01至2022-08-01在青岛市中心医院接受II线单药应用免疫治疗(替雷利珠单抗200 mg q3w)的70例NSCLC癌症患者作为观察组,以及50例体健的志愿者作为对照组。利用Mito-Tracker,通过流式细胞术探究非小细胞肺癌患者T淋巴细胞免疫代谢变化,以及应用替雷利珠单抗探究对非小细胞肺癌患者T淋巴细胞免疫代谢影响模式。结果:非小细胞肺癌患者Mito+ CD3+、Mito+ CD3+ CD4+、Mito+ CD3+ CD8+计数较健康人均明显下降,差距具有统计学意义(p < 0.05)。经PD-1抑制剂治疗4周期后,T淋巴细胞线粒体损伤阳性的观察组患者Mito+ CD3+、Mito+ CD3+ CD4+、Mito+ CD3+ CD8+计数较治疗前差异无统计学意义,T淋巴细胞线粒体损伤阴性的观察组患者则较治疗前明显提高(p < 0.05),且通过应用Logistic回归对多因素分析并绘制ROC曲线,发现T淋巴细胞线粒体损伤阴性组患者Mito+ CD3+、Mito+ CD3+ CD4+、Mito+ CD3+ CD8+计数对免疫治疗疗效具有一定的预测作用。结论:PD-1抑制剂可以在一定程度上调节非小细胞肺癌患者较健康人群受损的淋巴细胞亚群,而T淋巴细胞线粒体损伤指数阴性患者拥有更佳临床受益。
关键词
非小细胞肺癌,免疫治疗,T淋巴细胞,免疫代谢

Effect Model of PD-1 Inhibitors on Immune Metabolism of Mito+ T Lymphocytes in Patients with Non-Small Cell Lung Cancer
Zheng Wang1*, Cunhai Chen2, Xuezhen Ma2#
1Medical Department of Qingdao University, Qingdao Shandong
2Qingdao Central Hospital Affiliated to Qingdao University, Qingdao Shandong
Received: Dec. 28th, 2022; accepted: Jan. 21st, 2023; published: Jan. 31st, 2023

ABSTRACT
Objective: To explore the effect model of PD-1 inhibitor on the immune metabolism of Mito+ T lymphocytes in patients with non-small cell lung cancer. Methods: From July 1, 2020 to August 1, 2022, 70 NSCLC cancer patients who received second-line single drug immunotherapy (Tirelizumab 200 mg q3w) in Qingdao Central Hospital were selected as the observation group, and 50 healthy volunteers as the control group. Mito-Tracker was used to investigate the changes of T lymphocyte immune metabolism in patients with non-small cell lung cancer by flow cytometry, and the effect of tirelizumab on T lymphocyte immune metabolism in patients with non-small cell lung cancer. Results: The Mito+ CD3+, Mito+ CD3+ CD4+, Mito+ CD3+ CD8+ counts in NSCLC patients were significantly lower than those in healthy people (p < 0.05). After 4 cycles of PD-1 inhibitor treatment, the Mito+ CD3+, Mito+ CD3+ CD4+, Mito+ CD3+ CD8+ counts in the observation group with positive T lymphocyte mitochondrial damage had no significant difference compared with those before treatment, while those in the observation group with negative T lymphocyte mitochondrial damage were significantly higher than those before treatment (p < 0.05). By using logistic regression to analyze multiple factors and draw ROC curve, it was found that Mito+ CD3+, Mito+ CD3+ CD4+ and Mito+ CD3+ CD8+ counts can predict the efficacy of immunotherapy. Conclusion: PD-1 inhibitor can regulate the damaged lymphocyte subsets in NSCLC patients to a certain extent, and the patients with negative T lymphocyte mitochondrial damage index have better clinical benefits.
Keywords:Non-Small Cell Lung Cancer, Immunotherapy, T Lymphocytes, Immune Metabolism

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
原发性肺癌是我国最常见的恶性肿瘤,也是我国近30年来发生率增加幅度最大的恶性肿瘤。肺癌大致上可以分类为非小细胞肺癌(non small cell lung cancer, NSCLC)和小细胞肺癌(small cell lung cancer, SCLC),非小细胞肺癌约占80%左右 [1]。而肺癌自发生起便与机体的免疫系统息息相关,尤以T淋巴细胞所介导的细胞免疫在抵抗肿瘤中发挥着重要作用 [2]。
近年来,新开发的免疫检查点抑制剂在肺癌的治疗领域中大放异彩。PD-L1在非小细胞肺癌中广泛表达,这种免疫抑制配体的频繁表达,以及肿瘤微环境中高水平的肿瘤浸润性淋巴细胞(tumor infiltrating lymphocyte, TIL),表明疲惫和无效的抗肿瘤T细胞反应可能是肺癌进展和免疫逃避的关键机制,并与患者的不良预后相关 [3]。抗PD-1导向的药物阻断PD-1与其配体PD-L1 (B7-H1)和PD-L2 (B7-DC)的相互作用,激活先前功能耗尽的免疫反应 [4],进而发挥出抗肿瘤的作用。替雷利珠单抗作为一种PD-1抑制剂近年来在非小细胞肺癌治疗中发挥了极其重要的作用 [5]。本文旨在利用Mito-Tracker,即一种作用于线粒体的特殊荧光染料 [6],通过流式细胞术探究非小细胞肺癌患者T淋巴细胞免疫代谢变化,以及应用替雷利珠单抗探究对非小细胞肺癌患者T淋巴细胞免疫代谢影响模式。
2. 资料与方法
2.1. 一般资料
选取在2020-07-01至2022-08-01在青岛市中心医院接受II线单药应用免疫治疗(替雷利珠单抗200 mg q3w)的70例NSCLC癌症患者作为观察组,以及50例体健的志愿者作为对照组。该研究已获得青岛市中心医院伦理委员会批准,患者与志愿者签署知情同意书。两组的基线数据如表1所示。
Table 1. Baseline data
表1. 基线数据
NSCLC: non-small cell lung cancer.
2.1.1. 纳入标准
1) 经组织病理学确诊的非小细胞肺癌患者;2) 所有患者随访期内均规律接受4周期免疫治疗;3) 所有患者既往均未使用免疫抑制剂治疗。
2.1.2. 排除标准
1) 伴发自身免疫性疾病,如系统性红斑狼疮、风湿性骨关节炎等;2) 在规定时间内未行相关检查,无法客观检测患者T淋巴细胞亚群;3) 因故中断治疗,随访资料不完整者;4) 近期存在明显感染的患者。
2.2. 研究方法
2.2.1. 检测试剂
1) 荧光抗体:PerCP-anti-CD45 (用于界定淋巴细胞)、FITC-anti-CD3 (用于界定淋巴细胞)、PE-Cy7-anti-CD4、PE-anti-CD8。
2) 线粒体染料:MitoTracker (标记有活性的线粒体) (MitoTracker染料是用于活细胞线粒体染色的膜电位依赖性探针。MitoTracker染料在有活性的线粒体中产生的荧光信号比其在膜去极化的线粒体中产生的荧光信号强 [6] )。
2.2.2. 检测步骤
1) 采集人外周血2~3毫升于EDTA抗凝管中,尽快送至实验室处理。
2) 对以上细胞进行红细胞裂解,收集白细胞。
3) 对以上收集的白细胞进行荧光抗体及线粒体染料孵育。
4) 利用流式细胞仪对以上荧光抗体标记的白细胞进行检测。根据不同的荧光参数,对各淋巴细胞亚群比例、绝对数量及功能代谢进行统计分析,根据Mito Dye (线粒体染色)数值匹配内置算法得出线粒体损伤指数。检测结果如图1所示。

Figure 1. Mito+ T lymphocyte immune metabolism
图1. Mito+ T淋巴细胞免疫代谢
2.3. 疗效评价标准
根据实体瘤疗效评价标准1.1指南,疗效标准为:完全缓解(complete response, CR):所有目标病灶完全消失;部分缓解(partial response, PR):所有可测量的目标病灶的直径总和低于基线 ≥ 30%;疾病稳定(stable disease, SD):基线病灶直径总和有缩小趋势,但是未达到PR的标准,或有所增加但是未达到疾病进展(progressive disease, PD)的评价标准;PD:目标病灶的直径总和增大20%超过基线或者出现新的病灶。本文中所有患者的疗效评价均通过影像资料参照疗效评价标准进行评价。
2.4. 统计学方法
用Excel进行数据收集及预处理,统计过程用SPSS统计软件完成。统计描述均用均数 ± 标准差(X ± S)表示,对于正态分布且方差齐性的资料采用t检验,对于非正态分布或方差不齐的资料采用Wilcoxon秩和检验,以p < 0.05为差异具有统计学意义。
3. 结果
3.1. 观察组应用PD-1抑制剂治疗前与对照组Mito+ T淋巴细胞免疫代谢比较
如图2所示,观察组应用PD-1抑制剂治疗前与对照组相比,Mito+ CD3+、Mito+ CD3+ CD4+、Mito+ CD3+ CD8+计数均差异显著,且明显下降(p < 0.05)。而观察组T淋巴细胞线粒体损伤指数阳性比例(58.57%)明显大于对照组(8.00%)。由此可知,非小细胞肺癌患者体内免疫系统处于损伤状态,相较健康人群,缺乏足够的免疫细胞维持免疫功能,且T淋巴细胞的线粒体功能障碍明显。
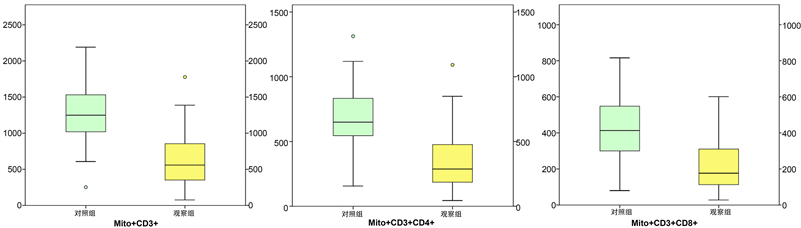
Figure 2. Comparison of immune metabolism of Mito+ T lymphocytes in the observation group before PD-1 inhibitor treatment and in the control group
图2. 观察组应用PD-1抑制剂治疗前与对照组Mito+ T淋巴细胞免疫代谢比较
3.2. 观察组应用PD-1抑制剂治疗前、后Mito+ T淋巴细胞免疫代谢比较
如表2、图3所示,观察组应用PD-1抑制剂治疗后,Mito+ CD3+、Mito+ CD3+ CD4+计数均较治疗前稍有提高,但差异无统计学意义(p > 0.05),且患者治疗前后平均数值均在参考值以下(Mito+ CD3+: 723~2271, Mito+ CD3+ CD4+: 396~1309),仅Mito+ CD3+ CD8+较治疗前明显提高(p < 0.05),且相应数值处于参考值范围内(224~1014)。而以治疗前T淋巴细胞线粒体损伤指数进一步分组后,如图4所示,T淋巴细胞线粒体损伤指数阳性(n = 41)的观察组患者经PD-1抑制剂治疗4周期后,Mito+ CD3+、Mito+ CD3+ CD4+、Mito+ CD3+ CD8+计数较治疗前差异无统计学意义,T淋巴细胞线粒体损伤阴性(n = 29)的观察组患者Mito+ CD3+、Mito+ CD3+ CD4+、Mito+ CD3+ CD8+计数则较治疗前明显提高(p < 0.05)。
Table 2. Comparison of immune metabolism of Mito+ T lymphocytes in the observation group before and after treatment with PD-1 inhibitors compared with the control group
表2. 观察组应用PD-1抑制剂治疗前、后与对照组Mito+ T淋巴细胞免疫代谢比较
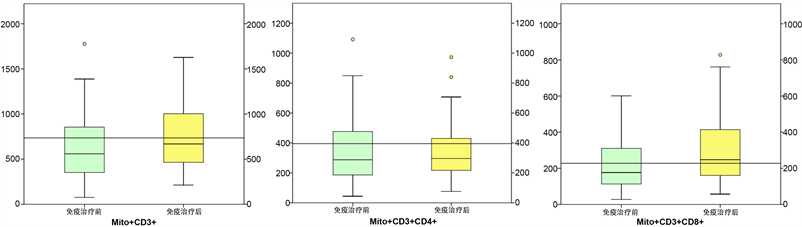
Figure 3. Comparison of the immune metabolism of Mito+ T lymphocytes in the observation group before and after PD-1 inhibitor treatment
图3. 观察组应用PD-1抑制剂治疗前、后Mito+ T淋巴细胞免疫代谢比较

Figure 4. Comparison count after incorporating the mitochondrial damage of T lymphocytes
图4. 纳入T淋巴细胞线粒体损伤后计数比较
3.3. 观察组应用PD-1抑制剂治疗后疗效评价
如表3所示,观察组70名患者应用PD-1抑制剂治疗4周期后,PR/SD的患者占总患者75%。T淋巴细胞线粒体损伤阳性患者中,PR/SD患者占69%。T淋巴细胞线粒体损伤阴性患者中,PR/SD患者达到82%。如表4所示,疗效评价达到PR/SD的患者线粒体损伤阴性组Mito+ CD3+、Mito+ CD3+ CD4+、Mito+ CD3+ CD8+显著高于线粒体损伤阳性组(p < 0.05),而疗效评价为PD的患者则两组间差异无统计学意义(p > 0.05)。相应的,通过应用Logistic回归对多因素分析并绘制ROC曲线(图5),发现T淋巴细胞线粒体损伤阴性组患者Mito+ CD3+、Mito+ CD3+ CD4+、Mito+ CD3+ CD8+计数对免疫治疗疗效具有一定的预测作用。
Table 3. Evaluation of curative effect after treatment with PD-1 inhibitor in observation group
表3. 观察组应用PD-1抑制剂治疗后疗效评价
Table 4. Detection value after treatment with PD-1 inhibitor in observation group
表4. 观察组应用PD-1抑制剂治疗后检测数值
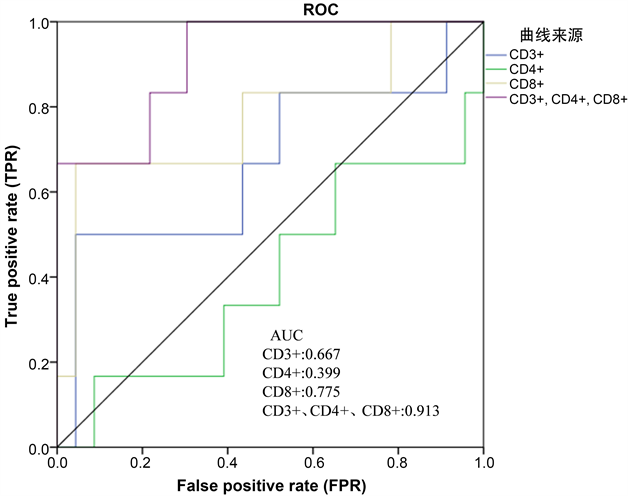
Figure 5. ROC curves of Mito+ CD3+、Mito+ CD3+ CD4+、Mito+ CD3+ CD8+ count after treatment with PD-1 inhibitor in observation group
图5. 观察组应用PD-1抑制剂治疗后Mito+ CD3+、Mito+ CD3+ CD4+、Mito+ CD3+ CD8+ count ROC曲线
4. 讨论
随着对恶性肿瘤研究的不断深入,免疫检查点阻断在临床上取得显著成功,人们重新唤起了对免疫系统潜在机制的兴趣,对免疫细胞的研究也愈发的深入 [7]。CD4+细胞表现出复杂的生物学特性,在肿瘤免疫中,它们的作用业已远远超出向CD8+细胞提供辅助信号的任务 [8],例如,这些T细胞迁移到肿瘤,大量募集并激活巨噬细胞,并且可以通过分泌激活肿瘤细胞表面死亡受体的细胞因子和诱导表位扩散参与杀死肿瘤细胞 [9]。CD8+细胞亦可通过T细胞受体(TCR)识别人白细胞抗原I类(HLA-I)呈递在靶细胞表面的特定抗原肽后杀死恶性细胞,从而在肿瘤免疫中发挥核心作用 [10]。免疫细胞互相串扰,成为肿瘤免疫循环的重要部分 [11]。
本研究发现,所观察的非小细胞肺癌患者与健康人相比,Mito+ CD3+、Mito+ CD3+ CD4+、Mito+ CD3+ CD8+计数均明显下降,这提示恶性肿瘤患者免疫功能受到一定程度的抑制与损伤,机体缺乏足够的免疫细胞用以募集,免疫功能处于较低水平 [12]。匹兹堡大学的Delgoffe教授团队研究指出,肿瘤浸润性T细胞通过Akt信号通路抑制T细胞氧化代谢,导致效应细胞代谢需求无法满足,继而引发线粒体功能障碍 [13],这与本研究中非小细胞肺癌患者的T淋巴细胞线粒体损伤指数阳性比例明显高于健康人群相一致。
作为动态且具有关联性的细胞器,线粒体在T细胞的激活、增殖、分化和效应功能中起着关键作用 [14]。线粒体功能和动力学受损是衰竭T细胞的关键特征,结构缺陷和去极化的线粒体在T细胞中积累,这种积累伴随着活性氧(ROS)生成的显着增加,导致氧化磷酸化缺陷(OXPHOS)和T细胞耗竭 [15],进而对机体的免疫系统产生影响,肿瘤微环境抑制线粒体的生物发生 [13] 同样加剧了这一过程。代谢充分性在启动和维持肿瘤免疫中的重要作用毋庸置疑 [16],已有学者利用增强线粒体代谢的化学物质与PD-1阻断疗法协同作用,以减少小鼠的肿瘤生长 [17]。
在本研究中,线粒体损伤指数阴性的患者经替雷利珠单抗治疗4周期后,Mito+ CD3+、Mito+ CD3+ CD4+、Mito+ CD3+ CD8+计数均较前升高,而线粒体损伤指数阳性的患者相应的免疫细胞则未发生明显的改变。这提示线粒体损伤阳性的患者免疫抑制的肿瘤微环境可能未在免疫治疗中得到较好的改善,更多的T细胞耗竭对疗效产生了负面影响。而线粒体损伤阴性的患者则在治疗过程中产生更多的免疫细胞用以免疫应答,进而拥有更佳的治疗响应,这与本研究中,T淋巴细胞线粒体损伤阴性组患者具有更佳的疗效评价这一结果相一致。
尽管在治疗非小细胞肺癌的临床实践中,免疫治疗发挥出举足轻重的作用,但仍有相当一部分患者未有相应的临床获益 [18]。并且,考虑相应药物的较高成本,如何为NSCLC患者确定合适的PD-1/PD-L1抑制剂成为当务之急,然而,如今仍未确定一种能够预测临床效果或耐药性的生物标志物,诸多研究致力于识别额外的免疫系统生物标志物,同时,这可能为抗免疫检查点抗体发挥其作用的方式提供额外的见解 [19]。PD-L1在癌组织中的表达作为目前为止其中研究最深入的标志物 [20],对其临床价值仍存在许多不同的意见 [21]。其他生物标志物,如肿瘤组织和外周血中的肿瘤突变负荷(TMB),在预测PD-1抑制剂治疗肺癌方面存在不同的意见 [22]。在本研究中,T淋巴细胞线粒体损伤阴性,即线粒体代谢异常程度较轻的患者Mito+ CD3+、Mito+ CD3+ CD4+、Mito+ CD3+ CD8+计数对免疫治疗疗效具有一定的预测作用,展现出其在临床治疗的精准和个性化中的应用价值。亦有学者指出,存在一种可遗传的表观遗传机制驱动T细胞耗竭,而PD-1抑制剂并不能完全逆转这种耗竭 [23],如何改善非小细胞肺癌患者T淋巴细胞免疫代谢或可成为抗肿瘤治疗的另一方向。
本研究存在一定的局限性,即样本数量有限,选择偏倚的可能性,以及样本取材于外周血,可能与肿瘤部位T淋巴细胞免疫代谢的真实情况有所差别,为继续验证实验结果,仍需进一步收集、分析数据。
综上所述,替雷利珠单抗可以在一定程度上调节非小细胞肺癌患者淋巴细胞亚群,而T淋巴细胞线粒体损伤较轻的患者淋巴细胞可得到更好的恢复,并相应拥有更佳的疗效。通过传统的淋巴细胞亚群监测,与患者T淋巴细胞线粒体损伤指数相结合,或可对患者治疗疗效与治疗方案的选择提供一定程度的参考价值,并为进一步探究PD-1抑制剂这一方兴未艾治疗方式的作用机制提供帮助。
文章引用
王 铮,陈存海,马学真. PD-1抑制剂对非小细胞肺癌患者Mito+ T淋巴细胞免疫代谢影响模式
Effect Model of PD-1 Inhibitors on Immune Metabolism of Mito+ T Lymphocytes in Patients with Non-Small Cell Lung Cancer[J]. 临床医学进展, 2023, 13(01): 1038-1047. https://doi.org/10.12677/ACM.2023.131145
参考文献
- 1. 国家卫生健康委办公厅. 原发性肺癌诊疗指南(2022年版) [J]. 协和医学杂志, 2022, 13(4): 549-570. https://xhyxzz.pumch.cn/cn/article/doi/10.12290/xhyxzz.2022-0352
- 2. Schalper, K.A., et al. (2015) Objective Measurement and Clinical Significance of TILs in Non-Small Cell Lung Cancer. Journal of the National Cancer Institute, 107, dju435. https://doi.org/10.1093/jnci/dju435
- 3. Mu, C.-Y., et al. (2011) High Expression of PD-L1 in Lung Cancer May Contribute to Poor Prognosis and Tumor Cells Immune Escape through Suppressing Tumor Infiltrating Dendritic Cells Maturation. Medical Oncology, 28, 682-688. https://doi.org/10.1007/s12032-010-9515-2
- 4. Brahmer, J.R. and Pardoll, D.M. (2013) Immune Checkpoint In-hibitors: Making Immunotherapy a Reality for the Treatment of Lung Cancer. Cancer Immunology Research, 1, 85-91. https://doi.org/10.1158/2326-6066.CIR-13-0078
- 5. Wang, J., et al. (2021) Tislelizumab plus Chemotherapy vs Chemotherapy Alone as First-Line Treatment for Advanced Squamous Non-Small-Cell Lung Cancer: A Phase 3 Ran-domized Clinical Trial. JAMA Oncology, 7, 709-717. https://doi.org/10.1001/jamaoncol.2021.0366
- 6. Clutton, G., et al. (2019) A Reproducible, Objective Method Using MitoTracker Fluorescent Dyes to Assess Mitochondrial Mass in T Cells by Flow Cytometry. Cytometry Part A, 95, 450-456. https://doi.org/10.1002/cyto.a.23705
- 7. Newell, E.W. and Becht, E. (2018) High-Dimensional Pro-filing of Tumor-Specific Immune Responses: Asking T Cells about What They “See” in Cancer. Cancer Immunology Research, 6, 2-9. https://doi.org/10.1158/2326-6066.CIR-17-0519
- 8. Hanson, H.L., Kang, S.S., Norian, L.A., et al. (2004) CD4-Directed Peptide Vaccination Augments an Antitumor Response, but Efficacy Is Limited by the Number of CD8+ T Cell Precursors. The Journal of Immunology, 172, 4215-4224. https://doi.org/10.4049/jimmunol.172.7.4215
- 9. Knutson, K.L. and Disis, M.L. (2005) Tumor Antigen-Specific T Helper Cells in Cancer Immunity and Immunotherapy. Cancer Immunology, Immunotherapy, 54, 721-728. https://doi.org/10.1007/s00262-004-0653-2
- 10. Bossi, G., Trambas, C., Booth, S., et al. (2002) The Secretory Synapse: The Secrets of a Serial Killer. Immunological Reviews, 189, 152-160. https://doi.org/10.1034/j.1600-065X.2002.18913.x
- 11. Preusser, M., Berghoff, A.S., Thallinger, C. and Zielinski, C.C. (2016) Cancer Immune Cycle: A Video Introduction to the Interaction between Cancer and the Immune System. ESMO Open, 1, e000056. https://doi.org/10.1136/esmoopen-2016-000056
- 12. Junttila, M.R. and de Sauvage, F.J. (2013) Influence of Tu-mour Micro-Environment Heterogeneity on Therapeutic Response. Nature, 501, 346-354. https://doi.org/10.1038/nature12626
- 13. Scharping, N.E., et al. (2016) The Tumor Microenvironment Represses T Cell Mitochondrial Biogenesis to Drive Intratumoral T Cell Metabolic Insufficiency and Dysfunction. Immunity, 45, 374-388. https://doi.org/10.1016/j.immuni.2016.07.009
- 14. MacIver, N.J., Michalek, R.D. and Rathmell, J.C. (2013) Met-abolic Regulation of T Lymphocytes. Annual Review of Immunology, 31, 259-283. https://doi.org/10.1146/annurev-immunol-032712-095956
- 15. Vardhana, S.A., Hwee, M.A., Berisa, M., et al. (2020) Impaired Mitochondrial Oxidative Phosphorylation Limits the Self-Renewal of T Cells Exposed to Persistent An-tigen. Nature Immunology, 21, 1022-1033. https://doi.org/10.1038/s41590-020-0725-2
- 16. Patsoukis, N., Weaver, J.D., Strauss, L., et al. (2017) Im-munometabolic Regulations Mediated by Coinhibitory Receptors and Their Impact on T Cell Immune Responses. Fron-tiers in Immunology, 8, Article No. 330. https://doi.org/10.3389/fimmu.2017.00330
- 17. Chamoto, K., Chowdhury, P.S., Kumar, A., et al. (2017) Mito-chondrial Activation Chemicals Synergize with Surface Receptor PD-1 Blockade for T Cell-Dependent Antitumor Activ-ity. Proceedings of the National Academy of Sciences of the United States of America, 114, E761-E770. https://doi.org/10.1073/pnas.1620433114
- 18. Farkona, S., Diamandis, E.P. and Blasutig, I.M. (2016) Cancer Im-munotherapy: The Beginning of the End of Cancer? BMC Medicine, 14, 73. https://doi.org/10.1186/s12916-016-0623-5
- 19. Dronca, R.S., Liu, X., Harrington, S.M., et al. (2016) T Cell Bim Levels Reflect Responses to Anti-PD-1 Cancer Therapy. JCI Insight, 1, e86014. https://doi.org/10.1172/jci.insight.86014
- 20. Munari, E., Zamboni, G., Lunardi, G., et al. (2018) PD-L1 Expres-sion Heterogeneity in Non-Small Cell Lung Cancer: Defining Criteria for Harmonization between Biopsy Specimens and Whole Sections. Journal of Thoracic Oncology, 13, 1113-1120. https://doi.org/10.1016/j.jtho.2018.04.017
- 21. Lisberg, A. and Garon, E.B. (2016) The Value of PD-L1 Testing in Non-Small-Cell Lung Cancer. JAMA Oncology, 2, 571-572. https://doi.org/10.1001/jamaoncol.2016.0043
- 22. Proto, C., Ferrara, R., Signorelli, D., et al. (2019) Choosing Wisely First Line Immunotherapy in Non-Small Cell Lung Cancer (NSCLC): What to Add and What to Leave Out. Cancer Treatment Reviews, 75, 39-51. https://doi.org/10.1016/j.ctrv.2019.03.004
- 23. Ghoneim, H.E., Fan, Y., Moustaki, A., et al. (2017) De Novo Epi-genetic Programs Inhibit PD-1 Blockade-Mediated T Cell Rejuvenation. Cell, 170, 142-157.e19. https://doi.org/10.1016/j.cell.2017.06.007
NOTES
*第一作者。
#通讯作者。
