Advances in Analytical Chemistry
Vol.
12
No.
02
(
2022
), Article ID:
51824
,
8
pages
10.12677/AAC.2022.122020
叶酸快速检测方法及电化学分析综述
李浩,林珍富,何文畅,陈柳君,陈悦欣,冯小珍*
桂林电子科技大学生命与环境科学学院,广西 桂林
收稿日期:2022年5月2日;录用日期:2022年5月16日;发布日期:2022年5月27日

摘要
叶酸(Folic acid)是人体不可少的维生素,体液中叶酸浓度的降低会导致多种疾病。目前叶酸的检测方法种类繁多,包括微生物法、比色法、高效液相色谱法、荧光法、薄层层析法、离子捕获法、紫外分光光度法和电化学分析法等,本文对主要的快速检测方法进行了综述。其中较为主流的就是微生物法和高效液相色谱法,其简单易行且灵敏度高,非常适合低质量分数的叶酸检测。而在实验室的研究中,电化学分析由于可以在电脑上快速清楚地呈现电化学反应,非常便于分析其线性关系,同时它还具有高灵敏度、低成本和操作简便等优点,所以更加适用。另外,电化学方法还可以深层次研究叶酸的反应机理和动力学参数,因而有很大的发展潜力。
关键词
叶酸,检测方法,快速检测,电化学分析

A Review for Rapid Detection Methods and Electrochemical Analysis of Folic Acid
Hao Li, Zhenfu Lin, Wenchang He, Liujun Chen, Yuexin Chen, Xiaozhen Feng*
College of Life and Environmental Sciences, Guilin University of Electronic Technology, Guilin Guangxi
Received: May 2nd, 2022; accepted: May 16th, 2022; published: May 27th, 2022

ABSTRACT
Folic acid (FA) is an indispensable vitamin in human body. The reduction of FA concentration in body fluid will lead to a variety of diseases. At present, there are many detection methods of FA, including microbial method, high performance liquid chromatography (HPLC), colorimetry, fluorescence, thin layer chromatography, ion capture, ultraviolet spectrophotometry and electrochemical analysis. In this paper, we summarized the main rapid detection methods. Among them, microbial method and HPLC are the mainstream because they are simple, sensitive and very suitable for the detection of FA with low mass fraction. In laboratory research, however, electrochemical analysis is more suitable because it can quickly and clearly show the electrochemical reaction of FA on a computer, which is very convenient to analyze the linear relationship. Meanwhile, it also has the advantages of high sensitivity, low cost and simple operation. In addition, various methods of electrochemical analysis can also deeply study the reaction mechanism and kinetic parameters of FA, indicating great potential.
Keywords:Folic Acid, Detection Methods, Rapid Detection, Electrochemical Analysis

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
叶酸(Folic Acid, FA),因绿叶中含量十分丰富而得名,是一种水溶性的B族维生素 [1]。最早于1931年Wills博士在酵母或肝脏提取物中发现,后来Mitchell在1941年从菠菜中也分离得到,而Angier等人在1945年首次合成了叶酸并给出化学结构式 [2]。它的结构式为N-[4-[(2-氨基-4-氧代-1,4-二氢-6-蝶啶)甲氨基]苯甲酰]-L-谷氨酸(C19H19N7O6, 441.40 g∙mol−1),如图1所示,完整的叶酸分子由蝶呤、对氨基苯甲酸以及谷氨酸依次通过亚甲基与酰胺键结合而成,因而又名蝶酰谷氨酸 [3]。叶酸为黄色固体粉末,微溶于水或乙醇,不溶于三氯甲烷和四氢呋喃,但极易溶于NaOH溶液,对酸性和光等不稳定 [4] [5]。人体自身不能合成叶酸,必须通过外界饮食摄入。天然存在的叶酸基本由多聚谷氨酸形成长尾,主要存在于绿色蔬菜、水果和动物肝脏中。而这种带着谷氨酰基长尾链的叶酸必须通过蛋白介导的内吞作用进入小肠细胞内,并被粘膜细胞分解为蝶酰谷氨酸才能被吸收到血液循环中 [6]。叶酸根据其蝶啶环的还原状态常被分为二氢叶酸(Dihydrofolate, DHF)和四氢叶酸(Tetrahydrofolate, THF),但它的生物活性形式只有四氢叶酸,且常在N(5)和N(10)位形成具有辅酶功能的四氢叶酸取代化合物 [7]。
据报道,叶酸缺乏会引发许多的疾病,如冠心病和贫血等的发病与其有直接或间接关系 [8]。孕妇叶酸不足还有可能导致神经管畸形、胎儿宫内发育迟缓、低出生体重等,因而医生会嘱咐孕妇在孕前和孕后都应该补充适量的叶酸 [9]。近几年的研究显示叶酸缺乏也与高同型半胱氨酸血症、心血管疾病、成年人痴呆和癌症等发病风险增加密切相关 [10]。针对叶酸缺乏导致的不同疾病和风险,世界卫生组织建议叶酸摄入量为成人每人每日0.2 mg,孕妇和乳母每人每日0.4 mg [11]。另外,现代畜牧业由于改用高能量高蛋白的饲料进行喂养,因而也需要额外添加叶酸,否则会因叶酸缺乏而导致生长迟缓甚至发病 [2]。与之相适应,叶酸药品、保健品和食品以及饲料等的产品如雨后春笋,已经被开发出非常多的产品,它们的叶酸含量检测也是非常必需的 [12]。所以,研制出一种操作简单、检测便捷、结果精准、稳定性较强大的电化学传感器来检测叶酸是当今社会的热点,也是迫切目标之一。
目前叶酸的检测方法种类繁多,包括微生物法、比色法、高效液相色谱法、荧光法、薄层层析法、离子捕获法、紫外分光光度法和电化学分析法等,本文对主要的快速检测方法依次进行了综述。其中,电化学分析由于具有清晰可视化、高灵敏度、低成本和操作简便等优点,并可以深层次研究叶酸的反应机理和动力学参数,因而在第三部分单独进行了重点讲述。它在未来具有很大的发展潜力。
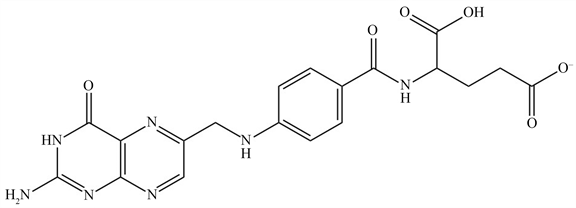
Figure 1. Chemical structure of FA molecule
图1. 叶酸分子的化学结构
2. 叶酸的检测
2.1. 叶酸检测方法
叶酸的检测方法多种多样,不同的样品试剂采用特定的检测方法。当前叶酸检测的方法主要有微生物法、比色法、高效液相色谱法、荧光分析法、薄层层析法、离子捕获法、紫外分光光度法和电化学分析法等,如表1所示。
Table 1. Current main methods of FA detection
表1. 当前叶酸检测的主要方法
2.1.1. 微生物法
微生物法是检测食品中叶酸的经典分析方法,当前仍然是我国国标中检测乳制品和婴幼儿配方奶中叶酸主要的方法之一 [13]。其原理为培育对叶酸灵敏度不同的微生物以及以叶酸为生长必须物质的微生物,这些微生物的生长状况跟叶酸浓度呈线性关系,因此,可通过菌落的生长情况推断食品中叶酸的含量 [14]。微生物法也用来估算血液和其它组织中的总叶酸含量 [15]。通常所用到的微生物有啤酒小球菌、干酪样乳酸杆菌以及粪链球菌等。
此法灵敏度高,但是受菌种的限制较大,只能检测总的叶酸类化合物的含量,不同菌种对不同叶酸化合物的结合力也可能不同,同时抗生素还会对菌种的生长情况产生较大影响。
2.1.2. 比色法
比色法测叶酸应用的比较早。基本原理是通过一定试剂可以使叶酸产生某种颜色的物质,该有色物质对特定波长的光有较大的吸收,吸收强度与一定范围内叶酸浓度符合朗伯–比尔定律。根据形成显色络合物的方法不同,主要包括茚三酮比色法、直接比色法和还原裂解比色法等 [16]。
此法比较简便,但干扰物质较多,精确性有待提高,因而更适合高纯度叶酸的定量检测。
2.1.3. 高效液相色谱法
高效液相色谱(HPLC)法近年来已经成为检测叶酸的常规方法,1990年Gregory和他的团队 [17] 率先把高效液相色谱应用于叶酸的检测。该方法简单易行,灵敏度高,且能够高效、迅速地分离样品。任一平等人 [18] 报道使用高效液相色谱法可检测食品中最低含量为0.01 μg∙mL−1的叶酸。张春燕等人 [19] 也报道可采用反相高效液相色谱法同时对临床血浆中的亚叶酸、5-甲基四氢叶酸及甲氨蝶呤进行定量检测。此外,大气压电离和质谱技术的突破使得高效液相色谱–质谱/质谱(LC-MS/MS)联用技术不断发展,已成为现代分析化学中必不可少的检测手段。
天然存在的叶酸有多种衍生物,用一般的化学分析方法不能将各种衍生物一一甄别,但是高效液相色谱法完全可以将它们分离开并定量。此方法灵敏度高,可于混合物中检测低含量的叶酸,比如饲料 [20] 或牙膏 [21] 等中叶酸的测定。
2.1.4. 荧光分析
许多叶酸类化合物在受紫外光照射后都能产生蓝色的荧光,基于这一特性就可以完成某些材料中叶酸的定量分析。首先从试样中溶解提取叶酸并滤除其它干扰性荧光物质,然后通过荧光分光光度计测得荧光强度,根据既定标准曲线即求出叶酸的含量 [2]。
若荧光活性较弱,还可以采用柱后衍生法借助一些强氧化剂来增强荧光强度,比如次氯酸盐、高锰酸钾和过硫酸钾等。刘欣等人 [22] [23] 通过高锰酸钾或过氧化氢氧化叶酸生成强荧光活性的物质蝶呤-6-羧酸,从而间接测定了片剂中叶酸的含量,得到非常低的检测限,分别为0.74和5.2 μg∙L−1。他们团队还基于荧光法通过叶酸氧化产物与Eu3+形成具有强荧光特性的五元环络合物实现了铕的测定 [24]。
2.1.5. 薄层层析法
薄层层析法是一种需要先用干法或湿法将吸附剂均匀涂在平板上,然后采用上行法或下行法(若为圆形薄板则采用径向展开或向心展开)的方式使展开剂从点样处逐渐迁移并展开形成薄层的分离混合物组分的常见方法 [25]。该方法操作简单,试样用量少,所需设备便宜,可实现各组分及其含量的快速筛选分析。叶酸常用醋酸乙酯、氨水和正丁醇作为展开剂,并且由于分离过程中叶酸样品溶液的各种成分及含量都没有改变,因而分离后仍可用于显色、吸光度和液相色谱等分析 [26]。
2.1.6. 离子捕获法
离子捕获法检测叶酸最早由Wilson等人 [27] 在1995年率先提出并实施,而国内市场从2010年起Abbott就已经被批准上市了在AxSYM全自动化学发光免疫分析仪上配套使用的成熟的离子捕获免疫检测叶酸试剂盒(国食药监械(进)字2010第2400384号)定量测定人血清、血浆或红细胞中的叶酸。
2.1.7. 紫外分光光度法
由于很多化合物都表现出紫外光吸收特性而对叶酸造成干扰,因而本方法只适用于高纯度叶酸的鉴定以及药片或针剂中叶酸含量的测定 [28]。首先用0.1 mol∙L−1的NaOH溶解叶酸(此时有最大吸收作用),然后使用分光光度计对256、283和365 nm附近的紫外光吸收强度进行检测,该处的最大吸收峰可用于间接测量叶酸的含量,并且256与365 nm的吸收度之比应为2.8~3.0 [29]。实验证明吸收度与叶酸浓度呈现线性关系,可以由吸收度计算出叶酸含量的多少。
2.1.8. 电化学分析法
常见的电化学现象一般在溶液里发生,电化学工作站与浸泡在溶液当中的电极之间依托尖嘴电线夹连接,形成了一个完整的闭合回路,电脑的图形化界面上会将所发生的电化学反应呈现出来。这样,我们就可以通过图像分析检测物质的氧化还原性能,并找出检测物质浓度与电流值的线性关系 [30]。
2.1.9. 其它方法
放射免疫分析(RIA)由诺贝尔奖得主Yalow和Berson在1959年创立,通过放射性同位素取代分子中的氢原子进行标记,是一种体外的超微量检测技术 [31]。到了70年代,同位素放射免疫法就已经实现了用于叶酸的检测,并且因为灵敏度高、检测快速、稳定和无污染等优点迅速得到普及 [32] [33]。
此后,又发展出一些非放射性免疫分析方法,包括时间分辨荧光免疫分析、克隆酶供体免疫测定法、酶联配体吸附试验以及化学发光受体实验等 [26]。比如在2007年,沈国松等人 [34] 报道他们采用芬兰Wallac公司时间分辨荧光分析仪VICTORTM1420和美国PerkinElmer公司的试剂盒Auto DELFIA对不同组别(早孕、非孕和不孕不育)的妇女红细胞叶酸含量进行了时间分辨荧光免疫技术分析。
另外1986年,Newman等人 [35] 提出了一种引进96孔板和酶标仪测定叶酸含量的微生物方法。这项基于传统微生物法发展起来的微孔板法,不仅降低了试剂用量,简化了移液过程,而且减少了之前手动阅读样品分光光度值的时间,目前常被用于测定乳品等中的叶酸 [36]。
2.2. 电化学分析法
电化学分析法是在1922年捷克化学家Jaroslav Heyrovsky发明了极谱法才真正开始建立,随后,他又与Masuzo Shikata合作于1924年制造了第一台极谱仪,因此而荣获1959年诺贝尔化学奖。当前,电化学分析最常用的测量仪器为电化学工作站,它与电解池之间多采用三电极体系连接,简单的检测叶酸过程如图2所示。
电化学分析法具有灵敏度高、准确度好、测量范围宽、成本低廉和操作简单的优点,适合快速的微量和痕量分析,但是部分也存在选择性和重复性差的缺点 [37]。各种极谱法最早被报道应用于叶酸的检测,但现在使用较多的还是伏安法。下面列出检测叶酸的常用电化学伏安方法。
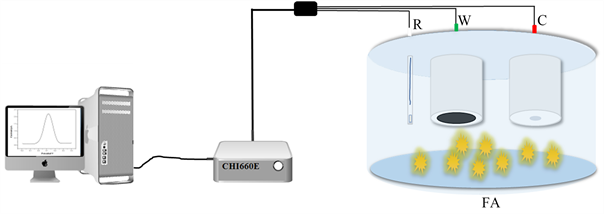
Figure 2. Electrochemical detection process of FA
图2. 叶酸的电化学检测过程
2.2.1. 循环伏安法
循环伏安法(Cyclic Voltammetry, CV)是电化学检测中最基本的方法,电极反应的性质、表面修饰物的电聚合、物质含量以及物质的氧化还原性能等都可通过它来研究 [38]。工作电极的活化最常用的就是CV法 [30],电活性物质的可逆程度也可通过CV图判断。
Zhang等人 [39] 采用CV法基于传感器MB/ERGO/GCE对叶酸进行检测,设计的传感器对叶酸的电催化活性优于裸GCE、MB/GCE和ERGO/GCE,对浓度范围4.0~67 μmol∙L−1的叶酸表现良好的线性关系,最低检测限为0.5 μmol∙L−1,检测叶酸片时回收率为96%~100%。而Manoj等人 [40] 采用CV法测试了CuONLs/MWCNTs/GCE纳米复合修饰电极对叶酸的电化学性能,该电极具有良好的电化学活性,灵敏度高达3.35 μA∙μmol−1∙L,最低检测限为0.0152 μmol∙L−1。
2.2.2. 差分脉冲伏安法
差分脉冲伏安法(Differential Pulse Voltammetry, DPV)灵敏度和分辨率高,可以减小充电电流和背景干扰的影响,适用于物质的定量分析 [41]。厦门大学的Ye等人 [42] 把空心纳米球(CHN)修饰在二硫化钼纳米片构成CHN@MoS2,并组装在玻碳电极表面,由于协同作用该传感器对叶酸表现出优异的传感特性,线性范围为0.08~10.0 μmol∙L−1,最低检测限低至0.02 μmol∙L−1。
2.2.3. 方波伏安法
方波伏安法(Square Wave Voltammetry, SWV)同样有很高的灵敏度,但测试速度更快,适合物质的定量分析。Garcia等人 [43] 制备出核壳结构Fe3O4@MIPs与氧化石墨烯(GO)复合构成的材料并修饰在碳糊电极上,构造的传感器通过DPV法检测,在2.5~48 μmol∙L−1的叶酸溶液中表现出很好的线性关系,最低检测限为0.65 μmol∙L−1。
2.2.4. 电流–时间曲线
电流–时间曲线(Amperometric i-t Curve, i-t)除了测定目标物质的含量外,还常被用于物质的原位电沉积和选择性实验 [44]。操作时,我们需要在溶液中插入三电极,并设置好一定的初始电压和总时间。如果是沉积过程,存在于修饰物溶液内的电极表层就会发生氧化还原反应,从而使修饰物析出然后附着在工作电极表面。任超超等人 [45] 使用稳态i-t曲线描绘出在MWCNT/GCE上叶酸的响应电流与浓度的关系,最低的响应浓度可达1.0 μmol∙L−1,并且指出叶酸的电化学氧化响应是一个2电子1质子的不可逆反应过程。
3. 总结
叶酸是人体必不可少的维生素,叶酸的缺乏会导致多种疾病,因此研究一种快速检测叶酸的方法极为重要。综上所述,目前叶酸的检测方法多种多样,其中较为主流的就是高效液相色谱法,其简单易行、灵敏度高、高效迅速,非常适合叶酸等低质量分数物质的检测。而在实验室的研究中,电化学分析由于可以在电脑上快速地清楚呈现电化学反应,便于分析其线性关系方程,同时还具有高灵敏度、低成本和操作简便等优点,所以更加适用。同时电化学方法还可以深层次研究叶酸的反应机理和动力学参数。所有的检测方法都不可能完美,都有各自的局限性,相信随着对叶酸检测方法的不断改进,叶酸检测可以得到更加广泛的应用。
基金项目
大学生创新创业计划项目(S202110595250, S202110595252)资助。
文章引用
李 浩,林珍富,何文畅,陈柳君,陈悦欣,冯小珍. 叶酸快速检测方法及电化学分析综述
A Review for Rapid Detection Methods and Electrochemical Analysis of Folic Acid[J]. 分析化学进展, 2022, 12(02): 157-164. https://doi.org/10.12677/AAC.2022.122020
参考文献
- 1. 陈伟才, 李忠信, 渠海, 付光宇. 叶酸及维生素B12检测方法的发展及现状[J]. 分子诊断与治疗杂志, 2015, 7(5): 357-360+356.
- 2. 杨玉柱, 王储炎, 焦必宁. 叶酸的研究进展[J]. 农产品加工学刊, 2006(5): 31-35+39.
- 3. Angier, R.B., Boothe, J.H., Hutchings, B.L., Mowat, J.H., Semb, J., Stokstad, E.L., et al. (1946) The Structure and Synthesis of the Liver L. casei Factor. Science, 103, 667-669.
https://doi.org/10.1126/science.103.2683.667 - 4. 倪青, 曹岸江, 主编. 常用临床药物手册[M]. 北京: 中国医药科技出版社, 1999: 169.
- 5. 方尚玲. 叶酸及其检测[J]. 武汉工业学院学报, 2000(1): 8-11.
- 6. Birn, H., Selhub, J. and Christensen, E.I. (1993) Internalization and Intracellular Transport of Folate-Binding Protein in Rat Kidney Proximal Tubule. American Journal of Physiology: Cell Physiology, 264, C302-C310.
https://doi.org/10.1152/ajpcell.1993.264.2.C302 - 7. 王翔朴, 王营通, 李珏声, 主编. 卫生学大辞典[M]. 青岛: 青岛出版社, 2000: 844-844.
- 8. 王博伦, 顾丰颖, 刘子毅, 张帆, 刘昊, 杨婷婷, 等. 食品中叶酸测定方法的研究进展[J]. 食品科学, 2020, 41(9): 294-300.
- 9. 陈朴, 潘柏申. 血清叶酸和红细胞叶酸检测的临床应用[J]. 检验医学, 2016, 31(3): 232-236.
- 10. O’Broin, S. and Kelleher, B. (1992) Microbiological Assay on Microtitre Plates of Folate in Serum and Red Cells. Journal of Clinical Pathology, 45, 344-347.
https://doi.org/10.1136/jcp.45.4.344 - 11. Tamura, T. and Picciano, M.F. (2006) Folate and Human Reproduction. The American Journal of Clinical Nutrition, 83, 993-1016.
https://doi.org/10.1093/ajcn/83.5.993 - 12. 黄新河, 莫宏春, 刘克武. 叶酸及其应用[J]. 四川食品与发酵, 2003(4): 27-30.
- 13. 中华人民共和国国家卫生和计划生育委员会. GB5009 211-2014食品安全国家标准 食品中叶酸的测定[S]. 北京: 中国标准出版社, 2015.
- 14. Han, J.Y. and Tyler, R.T. (2003) Determination of Folate Concentrations in Pulses by a Microbiological Method Employing Trienzyme Extraction. Journal of Agricultural and Food Chemistry, 51, 5315-5318.
https://doi.org/10.1021/jf0211027 - 15. Spray, G.H. (1964) Microbiological Assay of Folic Acid Activity in Human Serum. Journal of Clinical Pathology, 17, 660-665.
https://doi.org/10.1136/jcp.17.6.660 - 16. 汪锦邦, 顾鹏, 章德宏, 李东. 叶酸分析方法的研究进展[J]. 中国食品添加剂, 2000(3): 49-54.
- 17. Englehardt, R. and Gregory, J.F. (1990) Adequacy of Enzymatic Deconjugation in Quantification of Folate in Foods. Journal of Studies in Education, 38, 154-158.
https://doi.org/10.1021/jf00091a033 - 18. 任一平, 张爱珍, 朱黎炎, 黄百芬, 铁晓威. 高效液相色谱法测定食品中的叶酸[J]. 食品与发酵工业, 2003(10): 46-49.
- 19. 张春燕, 顾健. 反相高效液相色谱法同时测定人血浆中亚叶酸、5-甲基四氢叶酸及甲氨蝶呤的浓度及临床应用[J]. 中国药学杂志, 2010, 45(7): 543-547.
- 20. 中华人民共和国农业部. NY/T 2895-2016饲料中叶酸的测定 高效液相色谱法[S]. 北京: 中国标准出版社, 2016.
- 21. 中华人民共和国工业和信息化部. QB/T 5346-2018口腔清洁护理用品 牙膏中叶酸含量的测定 高效液相色谱法[S]. 北京:中国标准出版社, 2018.
- 22. 刘欣, 黄汉国. 高锰酸钾氧化-荧光分光光度法测定片剂中叶酸含量[J]. 分析化学, 2000, 28(11): 1406-1409.
- 23. 刘欣, 黄汉国. 过氧化氢氧化-荧光分光光度法测定片剂中叶酸含量[J]. 分析化学, 2002, 30(8): 1018.
- 24. 刘欣, 黄汉国. 叶酸氧化产物体系荧光法测定铕[J]. 河北化工, 2004(3): 62-64.
- 25. 吴琼, 孙洋, 谷伟, 钱方. 薄层层析法检测乳糖水解产物的研究[J]. 食品与机械, 2011, 27(6): 135-136+156.
- 26. 石丹, 贾云虹, 包怡红, 生庆海. 叶酸检测方法的研究现状及发展趋势[J]. 中国乳品工业, 2009, 37(3): 42-45.
- 27. Wilson, D.H., Hermamn, R., Hsu, S., Biegalski, T., Sohn, L., Forsythe, C., et al. (1995) Iron Capture Assay for Folate with the Abbott IMx Analyzer. Clinical Chemistry, 41, 1780-1781.
https://doi.org/10.1093/clinchem/41.12.1780 - 28. 陈懿. 分光光度法测定叶酸含量[J]. 医药工业, 1987(7): 327-328.
- 29. 国家市场监督管理总局, 中国国家标准化管理委员会. GB 7302-2018饲料添加剂: 叶酸[S]. 北京: 中国标准出版社, 2018.
- 30. Park, S., Chung, T.D. and Kim, H.C. (2003) Nonenzymatic Glucose Detection Using Mesoporous Platinum. Analytical Chemistry, 75, 3046-3049.
https://doi.org/10.1021/ac0263465 - 31. 王丁泉. 放射免疫分析发展历史和建议[J]. 同位素, 2019, 32(3): 204-207.
- 32. Osganian, S.K., Stampfer, M.J., Spiegelman, D., Rimm, E., Cutler, J.A., Feldman, H.A., et al. (1999) Distribution of and Factors Associated with Serum Omocysteine Levels in Children. JAMA, 281, 1189-1196.
https://doi.org/10.1001/jama.281.13.1189 - 33. Ford, E.S. and Bowman, B.A. (1999) Serum and Red Blood Cell Folate Concentrations, Race, and Education: Findings from the Third National Health and Nutrition Examination Survey. The American Journal of Clinical Nutrition, 69, 476-481.
https://doi.org/10.1093/ajcn/69.3.476 - 34. 沈国松, 何平亚, 张甦, 卢宝庭, 薛建英. 早孕妇女红细胞叶酸含量测定及其临床意义[J]. 浙江医学, 2007, 29(8): 814-815.
- 35. Newman, E.M. and Tsai, J.F. (1986) Microbiological Analysis of 5-Formyltetrahydrofolic Acid and Other Folates Using an Automatic 96-Well Plate Reader. Analytical Biochemistry, 154, 509-515.
https://doi.org/10.1016/0003-2697(86)90023-0 - 36. 范松阳. 微孔板法测定乳粉中叶酸的含量[D]: [硕士学位论文]. 哈尔滨: 东北农业大学食品加工与安全系, 2018.
- 37. Cheng Y.-Y., Zhan T., Feng X.-Z. and Han, G.-C. (2021) A Synergistic Effect of Gold Nanoparticles and Melamine with Signal Amplification for C-Reactive Protein Sensing. Journal of Electroanalytical Chemistry, 895, Article ID: 115417.
https://doi.org/10.1016/j.jelechem.2021.115417 - 38. Han G.-C., Su X., Hou J., Ferranco, A., Feng, X.-Z., Zeng, R., et al. (2019) Disposable electrochemical sensors for hemoglobin detection based on ferrocenoyl cysteine conjugates modified electrode. Sensors and Actuators B: Chemical, 282, 130-136.
https://doi.org/10.1016/j.snb.2018.11.042 - 39. Zhang, D., Yang, X., Ma, W., Li, L. and Zhang, Y. (2016) Voltammetric Determination of Folic Acid Using Adsorption of Methylene Blue onto Electrodeposited of Reduced Graphene Oxide Film Modified Glassy Carbon Electrode. Electroanalysis, 28, 312-319.
https://doi.org/10.1002/elan.201500348 - 40. Manoj, D., Ranjith, K.D. and Santhanalakshmi, J. (2012) Impact of CuO nanoleaves on MWCNTs/GCE Nanocomposite Film Modified Electrode for the Electrochemical Oxidation of Folic Acid. Applied Nanoscience, 2, 223-230.
https://doi.org/10.1007/s13204-012-0093-9 - 41. An, Q.-Q., Feng, X.-Z., Zhou, Z.-F., Zhan, T., Lian, S.-F., Zhu, J., et al. (2022) One Step Construction of an Electrochemical Sensor for Melamine Detection in Milk towards an Integrated Portable System. Food Chemistry, 383, Article ID: 132403.
https://doi.org/10.1016/j.foodchem.2022.132403 - 42. Ye, H., Song, L., Zhang, F., Li, J., Su, Z. and Zhang, Y. (2021) Highly Sensitive Electrochemical Detection of Folic Acid by Using a Hollow Carbon Nanospheres@molybdenum Disulfide Modified Electrode. Analytical Sciences, 37, 575-580.
https://doi.org/10.2116/analsci.20P297 - 43. Garcia, S.M., Wong, A., Khan, S. and Sotomayor, M.D.P.T. (2021) A Simple, Sensitive and Efficient Electrochemical Platform Based on Carbon Paste Electrode Modified with Fe3O4@MIP and Graphene Oxide for Folic Acid Determination in Different Matrices. Talanta, 229, Article ID: 122258.
https://doi.org/10.1016/j.talanta.2021.122258 - 44. Zhan T., Feng X.-Z., An Q.-Q., Li, S., Xue, M., Chen, Z., et al. (2022) Enzyme-Free Glucose Sensors with Efficient Synergistic Electro-Catalysis Based on a Ferrocene Derivative and Two Metal Nanoparticles. RSC Advances, 12, 5072-5079.
https://doi.org/10.1039/D1RA09213H - 45. 任超超, 孙玉琴, 高作宁. 叶酸在多壁碳纳米管修饰玻碳电极上的电催化氧化及其电分析方法[J]. 宁夏大学学报(自然科学版), 2010, 31(1): 70-73.
NOTES
*通讯作者。
