Hans Journal of Biomedicine
Vol.
13
No.
02
(
2023
), Article ID:
64127
,
6
pages
10.12677/HJBM.2023.132027
纳豆激酶及其生物工程研究进展
林飞龙*,李泰明#
中国药科大学生命科学与技术学院,江苏 南京
收稿日期:2023年3月16日;录用日期:2023年4月7日;发布日期:2023年4月19日

摘要
纳豆激酶是从传统发酵食品纳豆中提取分离得到的一种由枯草杆菌分泌的碱性丝氨酸蛋白酶,因其具有强大的溶解血栓的能力,受到广大研究者的关注,有望成为新一代溶栓药物。本文首先从结构、理化特性、催化及溶栓机制方面对纳豆激酶做了介绍,其次简述了纳豆激酶全酶的分子生物学研究,包括信号肽、前导肽和成熟肽的改造,最后进行展望。本文期望为后续纳豆激酶结构和功能关系、药物开发及生物工程研究提供理论基础和新思路。
关键词
纳豆激酶,溶栓,分子生物学,研究进展

Research Progress on Nattokinase and Its Bioengineering
Feilong Lin*, Taiming Li#
China Pharmaceutical University, College of Life Science and Technology, Nanjing Jiangsu
Received: Mar. 16th, 2023; accepted: Apr. 7th, 2023; published: Apr. 19th, 2023

ABSTRACT
Nattokinase is a kind of alkaline serine protease secreted by Bacillus subtilis, which is extracted and isolated from traditional fermented food natto. Due to its powerful thrombolysis ability, nattokinase has attracted the attention of most researchers and is expected to become a new generation of thrombolysis drugs. In this paper, the structure, physicochemical properties, catalysis and thrombolytic mechanism of nattokinase were firstly introduced. Secondly, the molecular biological research of nattokinase was briefly introduced, including the modification of signal peptide, propeptide and mature peptide. Finally, the prospect was made. The paper is expected to provide theoretical basis and new ideas for the relationship between structure and function of nattokinase, bioengineering research and drug development.
Keywords:Nattokinase, Thrombolysis, Molecular Biology, Research Progress

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
心血管疾病(CVD)一直是威胁人类健康的罪魁祸首之一,现有的用于CVD预防和治疗的药物较少且不良反应多,难以满足人们的用药需求。纳豆是一种发酵食品,主要由枯草杆菌在一定的温度下发酵制成。这种食品在一些亚洲国家中已经有两千多年的食用历史。多项研究表明纳豆的摄入有利于降低CVD疾病死亡率,而纳豆激酶是纳豆能够促进心血管健康的关键 [1] ,须见洋行博士在上世纪八十年代破解了纳豆溶栓的玄机,并将这种具有强大纤溶酶活性的纳豆提取物命名为Nattokinase (NK),即纳豆激酶 [2] 。许多国内外学者已对NK进行了大量研究,如纳豆激酶在药理作用方面除了具备强大溶栓功能之外还具有抗高血压 [3] 、抗动脉粥样硬化和降低血脂 [4] 、神经保护 [5] 、改善视网膜 [6] 、治疗鼻窦炎 [7] 等作用;在药物递送方面,纳豆激酶可通过脂质体 [8] 、多糖 [9] 、环糊精 [10] 及蛋白质 [11] 等载体进行包埋递送,从而有效避免胃肠道的不利影响,提高纳豆激酶的稳定性;在发酵表达方面,可通过优化培养基 [12] 、构建工程菌 [13] 等手段提高纳豆激酶产量及活性。此外,纳豆激酶安全性高,成本低,这也使得纳豆激酶在医药及食品领域具有非常广阔的开发及应用潜力。
2. 纳豆激酶简介
2.1. 纳豆激酶结构
纳豆激酶基因由aprN基因编码,具有1146 bp的开放阅读框,以GTG为起始密码子,共编码381个氨基酸,包括NK的信号肽(pre),前导肽(pro)以及成熟肽(nk)。信号肽、前肽及成熟肽分别由29,77,275个氨基酸构成,且依次连接 [14] 。信号肽能引导NK通过细胞膜,分泌到胞外。前导肽具有帮助NK正常折叠形成活性构象的功能。去除信号肽的NK蛋白前体(含前导肽和成熟肽)称为纳豆激酶原(pro-nk)。2010年Yanagisawa等人 [15] 采用凝胶过滤层析法从纳豆枯草芽孢杆菌中分离纯化得到纳豆激酶,并通过X射线衍射,解析了NK的三维结构,如图1A所示。纳豆激酶成熟功能肽的二级结构主要由9个α螺旋和2个β折叠组成,此外还存在2个Ca2+结合位点,其与酶结构稳定性相关。纳豆激酶的两个β折叠位于C末端结构域中,而其他七个的β折叠则位于结构中心附近,纳豆激酶的9个β折叠与9个α螺旋反向组装,其中7个α螺旋在同一表面上 [15] 。纳豆激酶的活性中心由保守的催化三联体(Asp32,His64,Ser221)组成,与其他枯草杆菌蛋白酶类似,纳豆激酶底物结合位点主要包含三个保守的氨基酸(Ser125,Leu126,Gly127) [16] (图1B)。
2.2. 纳豆激酶理化性质
纳豆激酶的成熟肽是一条单链多肽,分子量约为27.7 kDa,无半胱氨酸和二硫键,等电点为8.6,最适
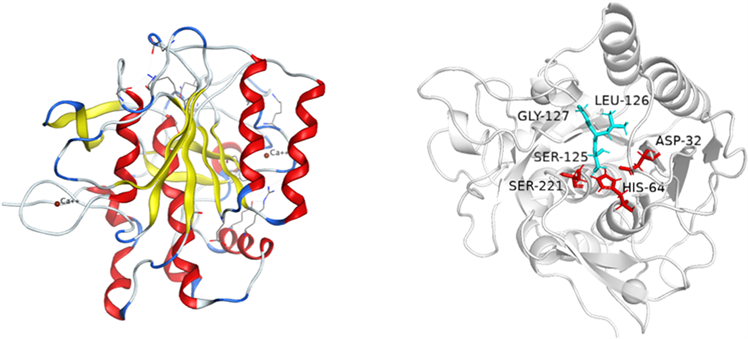 (a) (b)
(a) (b)
Figure 1. Three-dimensional structure of nattokinase
图1. 纳豆激酶三维结构图
pH为7.0、8.0 [17] 。NK活力受到温度、金属离子、pH等的影响。低温下纳豆激酶活性较高,温度高于45℃时活力下降明显,长期保存需在偏碱性的环境中,且温度最好低于37℃。不同浓度、不同种类的金属离子对纳豆激酶的活性作用也不同,如Mg2+、Ca2+对活性有激活作用,且在低浓度时表现出的激活效应更为显著;Fe2+、Zn2+、Cu2+、Ba2+、Al3+、Mn2+对纳豆激酶的活性有不同程度的抑制效果,且与浓度无关;低浓度的K+没有表现出提高或是抑制纳豆激酶活性的效果,反而在高浓度下会抑制NK的活性 [18] 。
2.3. 纳豆激酶的催化及溶栓机理
目前,纳豆激酶的催化机制尚未报道。但由于纳豆激酶结构与其家族中其他枯草杆菌蛋白酶的三维结构基本吻合,其催化机制与枯草杆菌蛋白酶相似。催化机制主要包括 [19] :1) 活性中心的His64残基的环氮原子接收Ser221的羟基质子,增强了Ser221的亲核能力,并攻击底物肽键的羟基碳,形成四面体过渡态中间体,2) Asp32通过羧基的负电荷稳定His64的质子化状态,3) His64向新形成的氨基捐赠一个质子以释放第一个产物(酰化反应),同时形成共价酰基酶复合物,4) 水分子攻击共价酰基–酶复合物形成四面体中间体时,His64将质子转移回Ser221,过渡态分解释放出第一种产物,从而完成脱酰化反应。
纳豆激酶除了具备直接溶栓的能力之外,还可通过其他途径产生间接溶栓的效果,其溶栓途径主要有以下4种 [20] :1) 纳豆激酶与交联的纤维蛋白相互作用,发挥蛋白酶水解活性,将纤维蛋白水解为氨基酸及肽段,2) 尿激酶途径。纳豆激酶将尿激酶原激活形成尿激酶,从而进一步激活纤溶酶原,产生具有溶栓活性的纤溶酶,溶解血栓,3) t-PA途径。NK可帮助组织型纤溶酶原激活剂(t-PA)的生成,促进产生纤溶酶,4) PAI-1途径。纤溶酶原激活物1型抑制剂(PAI-1)可抑制纤维蛋白降解并促进纤维蛋白的沉积,纳豆激酶可降解PAI-1,提升溶栓作用。
3. 纳豆激酶分子生物学研究
3.1. 信号肽
纳豆激酶全基因共编码381个氨基酸,包括信号肽、前导肽及成熟肽。其中信号肽与酶的分泌表达相关,信号肽的改变对酶的表达效率产生显著影响。Liang X [21] 将纳豆激酶天然信号肽替换成PelB信号肽,在大肠杆菌中成功表达处活性纳豆激酶,培养基中的纳豆激酶显示出高纤溶活性且重组纳豆激酶的特性与来自枯草芽孢杆菌YF38的天然纳豆激酶相当。何孝天 [22] 为提高纳豆激酶表达水平,将3种不同信号肽(wapA, yncM, prep)分别与pro-NK进行连接构建穿梭表达载体,并实现其在枯草芽孢杆菌中的表达,结果表明,与其他两个信号肽相比,wap A信号肽实现分泌表达效率最高,且纤溶活性最高。Wei X [23] 首次将纳豆激酶在地衣芽胞杆菌中进行异源重组,同时对vpr信号肽功能进行研究,发现vpr信号肽能实现纳豆激酶的高效分泌表达。
3.2. 前导肽
纳豆激酶前导肽(propeptide)由77个氨基酸构成,是一种分子内伴侣 [24] ,参与协助酶的正确折叠 [25] ,其过程包括1) 前导肽自身折叠形成含有空间结构的多肽,2) 前导肽介导成熟肽正确折叠,3) 具有蛋白酶活性的成熟肽水解前导肽和成熟肽之间的肽键,4) 前导肽降解,成熟肽释放。前导肽的功能最初在枯草杆菌蛋白酶 [26] 中发现,在体外复性折叠试验中,枯草杆菌蛋白酶成熟肽经变性及复性后,成熟肽不能正确折叠,且无活性,因此成熟肽不具备折叠所需的所有信息;而当含有前导肽的成熟肽经相同变性和复性后,成熟肽就能够正确折叠形成有空间结构的蛋白质,并且具有活性。因此,前导肽对于酶的折叠有着极为重要的作用。Jain SC [27] 报告了一种枯草杆菌蛋白酶E与前导肽的复合物结构,分辨率达2.0埃。复合物结果显示枯草蛋白酶E与前导肽之间存在多种相互作用,进一步阐述了前导肽在折叠过程中对成熟肽的重要性。
在高度同源的纳豆激酶中,前导肽同样也扮演着重要角色。田莉 [28] 分别将序列NK和pro-NK与表达载体连接,构建了两个纳豆激酶枯草芽孢杆菌重组菌,研究结果表明,只有含前导肽的蛋白产生活性。同样,Weng [29] 等人也比较了纳豆激酶全酶(前肽 + 成熟肽)和纳豆激酶成熟肽的溶栓活性,发现只有同时表达前肽和成熟肽的纳豆激酶具有溶栓活性,推断前肽参与纳豆激酶作为分子内伴侣的正确折叠。Jia [30] 通过分子生物学手段对纳豆激酶的前导肽功能进行研究,通过单点和多点突变发现,前导肽上的保守氨基酸(Tyr10, Gly13, Gly34, Gly35)与前导肽结构的稳定性相关,且突变会对纳豆激酶结构和功能造成影响。
3.3. 成熟肽
近年来,为改善纳豆激酶特性、提升酶学性质,许多学者们利用基因工程、蛋白质工程等手段对纳豆激酶进行了不同的突变改造。如Cai [31] 采用定向进化方法,经过3轮DNA家族改组,获得了一个具有16个氨基酸取代的理想突变体,该突变体的催化效率约为野生型纳豆激酶的2.3倍。Wu等 [32] 通过对S3亚区的氨基酸进行突变,发现S3亚区的氨基酸对酶的催化活性有重要影响。赵菡 [33] 基于改变电荷网络,将纳豆激酶表面的Asn和Gln分别突变为Asp和Gsp,得到了两个酶学性能(活性、热稳定性)提升的突变体Q59E及N218D。Weng [34] 根据序列比对分析,将优势突变I31L引入纳豆激酶(包括野生型NK、突变体M222A、T220S),结果表明31位突变为Leu使催化效率(kcat/km)得到提升,其原因可能是因为31位的Leu增强了反应过程的电子效应,从而提升了催化能力。何孝天 [35] 根据Zhao [36] 的研究结果,引入正向突变并构建了5个突变体,其中突变体P14L和N76D提高了热稳定性。刘朔 [37] 对NK的成熟肽基因nkD和nkB进行体外诱变处理,并实现其在毕赤酵母中的表达,经序列比对发现,突变体D36G热稳定性提高了20%,比活力提高了16.6%。
4. 展望
心脑血管疾病已成为危害人类健康的“杀手”之一,如何治疗及预防心脑血管疾病的发生也是目前倍受关注的问题。目前临床上常用的抗血栓药物有链激酶、组织纤溶酶原激活剂等,但都存在不良反应多、半衰期短等问题。而纳豆激酶具备溶栓能力,且安全性高、口服有效,是一种新型的具有潜在开发价值的溶栓药物,已成为心血管药物研发的重点。
目前,纳豆激酶在医药及食品领域仍存在许多问题。首先,纳豆激酶溶栓药物的开发离不开其结构和功能关系的研究,目前为止相关研究较少。而随着计算机领域的发展,未来利用一些软件工具将有助于对纳豆激酶的深入研究,如挖掘纳豆激酶与交联纤维蛋白相互作用位点、功能关键结构域。其次,纳豆激酶的酶学性能无法满足工业化生产和应用,如何提高纳豆激酶活性、pH稳定性及热稳定性等需要更多的投入及研究。除此之外,缺乏与其他药物联用的报道,纳豆激酶与其他药物的联用也可能为血栓类疾病的治疗提供新方法。
文章引用
林飞龙,李泰明. 纳豆激酶及其生物工程研究进展
Research Progress on Nattokinase and Its Bioengineering[J]. 生物医学, 2023, 13(02): 240-245. https://doi.org/10.12677/HJBM.2023.132027
参考文献
- 1. Chen, H., McGowan, E.M., Ren, N., et al. (2018) Nattokinase: A Promising Alternative in Prevention and Treatment of Cardiovascular Diseases. Biomark, 13. https://doi.org/10.1177/1177271918785130
- 2. Sumi, H., Hamada, H., Tsushima, H., et al. (1987) A Novel Fibrinolytic Enzyme (Nattokinase) in the Vegetable Cheese Natto; a Typical and Popular Soybean Food in the Japanese Diet. Experientia, 43, 1110-1111. https://doi.org/10.1007/BF01956052
- 3. Jensen, G.S., Lenninger, M., Ero, M.P., et al. (2016) Consumption of Nattokinase Is Associated with Reduced Blood Pressure and von Willebrand Factor, a Cardiovascular Risk Marker: Results from a Randomized, Double-Blind, Placebo-Controlled, Multicenter North American Clinical Trial. Integrative and Comparative Biology, 9, 95-104. https://doi.org/10.2147/IBPC.S99553
- 4. 孟繁宇, 薛菲, 施慧. 纳豆激酶对动脉粥样硬化模型大鼠血脂及血液流变学影响[J]. 中国实验诊断学, 2013, 17(9): 1567-1569.
- 5. Ji, H., Yu, L., Liu, K., et al. (2014) Mechanisms of Nattokinase in Protection of Cerebral Ischemia. European Journal of Pharmacology, 745, 144-151. https://doi.org/10.1016/j.ejphar.2014.10.024
- 6. 占慧琴, 袁志兰, 杨翎, 等. 纳豆激酶对视网膜中央静脉阻塞动物模型中闪光视网膜电图的影响[J]. 南京医科大学学报(自然科学版), 2010, 30(7): 974-976+1016.
- 7. Takabayashi, T., Imoto, Y., Sakashita, M., et al. (2017) Nattokinase, Profibrinolytic Enzyme, Effectively Shrinks the Nasal Polyp Tissue and Decreases Viscosity of Mucus. Allergology International, 66, 594-602. https://doi.org/10.1016/j.alit.2017.03.007
- 8. (2012) Optimisation of Preparation Conditions and Properties of Phytosterol Liposome-Encapsulating Nattokinase. Natural Product Research, 26, 548-556. https://doi.org/10.1080/14786419.2010.528759
- 9. 陈景鑫. 纳豆激酶微胶囊的制备及其稳定性研究[D]: [硕士学位论文]. 大庆: 黑龙江八一农垦大学, 2010.
- 10. 谢建飞. 一种含有纳豆激酶和益生菌的微胶囊及其制备方法和应用[P]. 中国, CN201410618436.7. 2015-02-25.
- 11. Zhang, X., Lyu, X., Tong, Y., et al. (2020) Chitosan/Casein Based Microparticles with a Bilayer Shell-Core Structure for Oral Delivery of Nattokinase. Food & Function, 11, 10799-10816. https://doi.org/10.1039/D0FO02349C
- 12. Deepak, V., Kalishwaralal, K., Ramkumarpandian, S., et al. (2008) Optimization of Media Composition for Nattokinase Production by Bacillus subtilis Using Response Surface Methodology. Bioresource Technology, 99, 8170-8174. https://doi.org/10.1016/j.biortech.2008.03.018
- 13. 李佳增. 纳豆激酶毕赤酵母X33高效表达双启动子系统构建及发酵条件优化[D]: [硕士学位论文]. 沈阳: 辽宁大学, 2021.
- 14. Nakamura, T., Yamagata, Y. and Ichishima, E. (1992) Nucleotide Sequence of the Subtilisin NAT Gene, aprN, of Bacillus subtilis (Natto). Bioscience, Biotechnology, and Biochemistry, 56, 1869-1871. https://doi.org/10.1271/bbb.56.1869
- 15. Yanagisawa, Y., Chatake, T., Chiba-Kamoshida, K., et al. (2010) Purification, Crystallization and Preliminary X-Ray Diffraction Experiment of Nattokinase from Bacillus subtilis Natto. Acta Crystallographica Section F, 66, 1670-1673. https://doi.org/10.1107/S1744309110043137
- 16. Carter, P. and Wells, J.A. (1988) Dissecting the Catalytic Triad of a Serine Protease. Nature, 332, 564-568. https://doi.org/10.1038/332564a0
- 17. Weng, Y., Yao, J., Sparks, S., et al. (2017) Nattokinase: An Oral Antithrombotic Agent for the Prevention of Cardiovascular Disease. International Journal of Molecular Sciences, 18, 523. https://doi.org/10.3390/ijms18030523
- 18. 李睿, 阮文辉, 熊晓辉. 纳豆激酶的酶学性质研究[J]. 扬州大学学报(农业与生命科学版), 2015, 36(2): 106-110.
- 19. Li, Y., et al. (2010) Bioproperties of Potent Nattokinase from Bacillus subtilis YJ1. Journal of Agricultural and Food Chemistry, 58, 5737-5742. https://doi.org/10.1021/jf100290h
- 20. Li, Y., et al. (2022) Biotechnology, Bioengineering and Applications of Bacillus nattokinase. Biomolecules, 12, 980. https://doi.org/10.3390/biom12070980
- 21. Liang, X., Jia, S., Sun, Y., et al. (2007) Secretory Expression of Nattokinase from Bacillus subtilis YF38 in Escherichia coli. Molecular Biotechnology, 37, 187-194. https://doi.org/10.1007/s12033-007-0060-y
- 22. 何孝天, 刘中美, 崔文璟, 等. 介导纳豆激酶分泌表达的信号肽比较[J]. 现代食品科技, 2014, 30(5): 62-68.
- 23. Cai, D., Wei, X., Qiu, Y., et al. (2016) High-Level Expression of Nattokinase in Bacillus licheniformis by Manipulating Signal Peptide and Signal Peptidase. Journal of Applied Microbiology, 121, 704-712. https://doi.org/10.1111/jam.13175
- 24. Jia, Y., Liu, H., Bao, W., et al. (2010) Functional Analysis of Propeptide as an Intramolecular Chaperone for in Vivo Folding of Subtilisin Nattokinase. FEBS Letters, 584, 4789-4796. https://doi.org/10.1016/j.febslet.2010.11.011
- 25. Yang, M., Wu, J., Huang, Q. and Jia, Y. (2021) Probing the Role of Catalytic Triad on the Cleavage between Intramolecular Chaperone and NK Mature Peptide. Journal of Agricultural and Food Chemistry, 69, 2348-2353. https://doi.org/10.1021/acs.jafc.0c07238
- 26. Ikemura, H., Takagi, H. and Inouye, M. (1987) Requirement of Pro-Sequence for the Production of Active Subtilisin E in Escherichia coli. Journal of Biological Chemistry, 262, 7859-7864. https://doi.org/10.1016/S0021-9258(18)47646-6
- 27. Jain, S.C., Shinde, U., Li, Y., et al. (1998) The Crystal Structure of an Autoprocessed Ser221 Cys-Subtilisin E-Propeptide Complex at 2.0 A Resolution. Journal of Molecular Biology, 284, 137-144. https://doi.org/10.1006/jmbi.1998.2161
- 28. 田莉. 构建高产纳豆激酶基因工程菌株及酶活研究[D]: [硕士学位论文]. 武汉: 武汉工程大学, 2019.
- 29. Weng, M., Zheng, Z., Bao, W., et al. (2009) Enhancement of Oxidative Stability of the Subtilisin Nattokinase by Site-Directed Mutagenesis Expressed in Escherichia coli. Biochimica et Biophysica Acta, 1794, 1566-1572. https://doi.org/10.1016/j.bbapap.2009.07.007
- 30. Jia, Y., Cao, X., Deng, Y., et al. (2014) Four Residues of Propeptide Are Essential for Precursor Folding of Nattokinase. Acta Biochimica et Biophysica Sinica (Shanghai), 46, 957-964. https://doi.org/10.1093/abbs/gmu093
- 31. Cai, Y.J., et al. (2011) Directed Evolution Improves the Fibrinolytic Activity of Nattokinase from Bacillus natto. FEMS Microbiology Letters, 325, 155-161. https://doi.org/10.1111/j.1574-6968.2011.02423.x
- 32. Wu, S., Feng, C., Zhong, J. and Huan, L. (2007) Roles of s3 Site Residues of Nattokinase on Its Activity and Substrate Specificity. The Journal of Biochemistry, 142, 357-364. https://doi.org/10.1093/jb/mvm142
- 33. 赵菡, 周丽, 周哲敏. 通过定点突变提高纳豆激酶的酶活及热稳定性[J]. 食品与发酵工业, 2018, 44(9): 36-40+47.
- 34. Weng, M., Deng, X., Bao, W., et al. (2015) Improving the Activity of the Subtilisin Nattokinase by Site-Directed Mutagenesis and Molecular Dynamics Simulation. Biochemical and Biophysical Research Communications, 465, 580-586. https://doi.org/10.1016/j.bbrc.2015.08.063
- 35. 刘中美, 何孝天, 崔文璟, 周哲敏. 通过定点突变增强纳豆激酶的热稳定性[J]. 现代食品科技, 2015, 31(2): 37-41.
- 36. Zhao, H. and Arnold, F.H. (1999) Directed Evolution Converts Subtilisin E into a Functional Equivalent of Thermitase. Protein Engineering, 12, 47-53. https://doi.org/10.1093/protein/12.1.47
- 37. 刘朔, 姜梅, 陈晓红, 等. 纳豆激酶第36位氨基酸突变对其活性及热稳定性的影响[J]. 南京农业大学学报, 2008(3): 130-136.