Advances in Clinical Medicine
Vol.
09
No.
11
(
2019
), Article ID:
33185
,
7
pages
10.12677/ACM.2019.911207
Efficacy and Safety of Transarterial Chemoembolization Combined with Apatinib Mesylate in Patients with Advanced Hepatocellular Carcinoma
Lidong Qin1*, Qingxiao Deng2, Nan Wang2#
1Department of Oncology, Central Hospital of Xinwen Mining Group, Taian Shandong
2Shandong First Medical University (Shandong Academy of Medical Sciences), Shandong Institute of Cancer Prevention and Treatment, Jinan Shandong
Received: Nov. 2nd, 2019; accepted: Nov. 20th, 2019; published: Nov. 27th, 2019

ABSTRACT
Objective: To investigate the clinical efficacy and safety of transarterial chemoembolization (TACE) combined with apatinib in the treatment of advanced hepatocellular carcinoma (HCC). Methods: The clinical data of 40 patients with advanced liver cancer treated with TACE combined with apatinib in Central Hospital of Xinwen Mining Group from December 2017 to October 2018 were collected. The treatment response was evaluated in the first month and the third month after TACE treatment, respectively. The long-term efficacy and adverse reactions were evaluated. Results: One month after treatment, the objective remission rate and disease control rate were 62.50% and 92.50%, respectively. Three months after treatment, the objective response rate (65.00%) was slightly higher, and the disease control rate (90.00%) was lower. The levels of aspartate aminotransferase, alanine aminotransferase, serum albumin or total bilirubin in one month after interventional therapy or three month after interventional therapy were not different from those in M0 (p > 0.05). The median progression-free survival was 10.50 months (95% CI, 8.95 - 12.05 months), and the median overall survival time was 23.00 months (95% CI, 14.95 - 31.07 months). Of the 40 patients, 4 had hypertension and 2 had grade 3 diarrhea; The rest had mild to moderate acceptable adverse reactions and no serious adverse reactions. Conclusion: TACE combined with apatinib is a safe and promising method for the treatment of advanced liver cancer.
Keywords:Hepatocellular Carcinoma, TACE, Apatinib, Prognosis
肝动脉化疗栓塞术联合甲磺酸阿帕替尼片治疗晚期肝癌的疗效及安全性评价
秦立东1*,邓庆潇2,王楠2#
1新汶矿业集团中心医院肿瘤科,山东 泰安
2山东省肿瘤防治研究院,山东第一医科大学(山东省医学科学院),山东 济南
收稿日期:2019年11月2日;录用日期:2019年11月20日;发布日期:2019年11月27日

摘 要
目的:探讨经动脉化疗栓塞(TACE)联合阿帕替尼治疗晚期肝细胞癌(HCC)的临床疗效和安全性。方法:收集2017年12月至2018年10月在新汶矿业集团中心医院接受TACE联合阿帕替尼治疗40例晚期肝癌患者临床资料,分别在TACE治疗后的第1个月和第3个月评估治疗反应,评价远期疗效和不良反应。结果:治疗后1个月的客观缓解率和疾病控制率分别为62.50%和92.50%。治疗后3个月,客观应答率(65.00%)略高,疾病控制率(90.00%)较低。术后1月或术后3月的天冬氨酸氨基转移酶、丙氨酸氨基转移酶、血清白蛋白或总胆红素水平与术前相比无差异(均p > 0.05)。中位无进展生存期为10.50个月(95% CI,8.95~12.05个月),中位总生存期为23.00个月(95% CI,14.95~31.07个月)。在40例患者中,4名患有高血压,2名患有3级腹泻;其余患者有轻度到中度的可接受的不良反应,没有发生严重的不良反应。结论:TACE联合阿帕替尼治疗晚期肝癌是一种安全、有前景的治疗方法。
关键词 :肝细胞癌,TACE,阿帕替尼,预后

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肝细胞癌(hepatocellular carcinoma, HCC)是最常见的原发性肝癌,是第六大最常见的肿瘤和第三大癌症相关死亡原因 [1]。大多数肝细胞癌患者起病隐匿且伴有不典型临床症状,确诊时常为中晚期。目前,经动脉化疗栓塞术(transcather arterial chemoembolization, TACE)已被普遍认为是晚期HCC患者的标准治疗方法 [2] [3],然而,TACE已被证实可诱导缺氧并提高HCC组织中促血管生成因子血管内皮生长因子(vascular endothelial growth factor, VEGF)的水平,后者参与肿瘤的生长、发展和转移 [4]。
甲磺酸阿帕替尼片(简称:阿帕替尼)作为一种新型的抗血管生成小分子,通过有效结合和抑制VEGF受体2 (VEGFR-2),可以有效的延缓TACE后肿瘤新生血管形成,进而发挥抗癌作用 [5]。Zhen等人证明阿帕替尼对治疗晚期肝癌有效,疾病控制率(disease control rate, DCR)为60% [6]。因此,将TACE与全身性抗血管生成药物结合的理论基础在科学上是合理的,其目的是控制TACE后血管生成。越来越多的研究报告指出,阿帕替尼联合TACE能够明显地延长中晚期HCC患者的无疾病进展生存期(progression-free survival, PFS) [7]。目前,对于晚期肝癌关于TACE联合阿帕替尼治疗的临床研究并不是很多,因此,本研究的目的是评估TACE联合阿帕替尼治疗晚期肝癌的安全性和有效性。
2. 资料与方法
2.1. 一般临床资料
回顾性分析2017年12月至2018年10月就诊于新汶矿业集团中心医院接受TACE联合口服阿帕替尼的 40例患者临床资料,所有患者诊断符合2017年版原发性肝癌诊疗规范标准 [8],并接受1次或多次TACE,术后3 d均开始口服阿帕替尼治疗。在治疗前获得所有患者的书面知情同意,本研究经过本院伦理委员会的同意。纳入标准:根据美国肝病研究协会肝病指南1) 诊断为原发性肝癌的患者;2) 患者的年龄 ≥ 18岁;3) 巴塞罗那B或C期;4) Child-Pugh A级或B级;5) ECO G评分0或1分。2;6) 患者预期生存时间大于3个月。排除标准为:1) 继发性肝癌患者;2) 严重凝血障碍患者;3) 心、肺、肾和其他重要器官存在严重功能障碍;4) 停用阿帕替尼超过1个月。共有40名患者(29名男性,11名女性)纳入本研究。患者平均年龄53.20 ± 8.90岁。28例(70%)患者伴有乙肝病史,10例(25%)伴有丙肝病史。在所有患者中,29例(72.50%)为Child-Pugh A级,11例(27.5%)为Child-Pugh B级。巴塞罗那临床肝癌B期和C期患者分别为16例(40.00%)和24例(60.00%)。有19名患者(47.50%)的ECOG评分为0,门静脉癌栓18例(45.00%),患者基线资料见表1。
Table 1. Baseline data of patients with primary liver cancer before operation
表1. 原发性肝癌患者术前基线资料
2.2. 治疗方法
采用Seldinger技术常规行右侧股动脉穿刺,置入5F导管鞘,将5F-Yashiro或RH (Terumo, Japan)导管通过5-F血管鞘引入腹腔干动脉,在DSA指导下对肝总动脉进行血管造影,如果未观察到明确的肿瘤供血动脉,应进行肠系膜上动脉、膈下动脉、肾上腺动脉和肠系膜上动脉的血管造影以确定肿瘤供血动脉。在确认肿瘤的血液供应后,2.7F的ProGreat微导管(Terumo, Japan)被超选择性地插管到肿瘤供血动脉中,采用表柔比星及超液化碘油乳剂栓塞肿瘤血管,必要时辅以颗粒栓塞剂。最后,进行另一次血管造影以确定血管闭塞的程度。所有患者至少接受一次TACE,治疗时间考虑每个患者的身体状况,肝功能,肿瘤复发和血液指标。患者最初被建议每天服用阿帕替尼(江苏恒瑞医药股份有限公司产品,国药准字:H20140103)进行治疗500 mg,若服药期间出现与阿帕替尼相关的III级或III级以上不良反应时,剂量减半或暂停用药。阿帕替尼口服给药周期为28天。阿帕替尼从TACE后第4天开始口服,并在每次TACE治疗前4天停药。
2.3. 观察指标和标准
患者每隔1~3个月行增强影像学检查(CT或MRI),近期疗效采用最新修订的实体瘤疗效评价标准(modified Response Evaluation Criteria in Solid Tumors, mRECIST) [9] 标准进行评价,分为完全缓解(complete response, CR):所有靶病灶动脉期没有强化;部分缓解(partial rate, PR):所有目标病灶的长径总和减少≥30%;疾病稳定(stable disease, SD):变化介于PR和PD之间;PD:所有目标病灶的长径总和增加≥20%,或出现新发病灶。分别在术前和术后检测血清白蛋白(ALB)、总胆红素(TBIL)、丙氨酸氨基转移酶(ALT)和天冬氨酸氨基转移酶(AST)等参数,以评估患者的肝功能情况。PFS (progression-free survival, PFS)被定义为第一次接受TACE治疗至肿瘤进展的时间。OS (overall survival, OS)指的是患者接受第一次TACE治疗直至死亡或最后一次随访的时间。药物不良反应评价采用美国国家癌症研究所(NCI)常见毒性标准(NCICTC v 4.0)。
2.4. 统计学分析
使用SPSS 21.0统计软件进行数据分析。分类变量表示为数字或百分比(%),连续变量表示为平均值 ± 标准差。患者治疗前后差异采用配对t检验或符号秩和检验比较。Kaplan-Meier生存曲线用于计算PFS和OS。p值 < 0.05表示差异具有统计学意义。
3. 结果
3.1. 近期疗效
截至2019年3月10日,所有患者均随访成功,在整个治疗过程中,29例(90.6%)患者口服阿帕替尼500 mg,只有3例(9.4%)患者由于药物耐受性不好而减至250 mg。TACE治疗频率为3.60 ± 1.10。通常于TACE术后3 d开始口服阿帕替尼,初始剂量250 mg/d,同时根据mRECIST标准评价患者联合治疗1个月、治疗后3个月后的疗效(表2)。治疗后1个月的ORR和DCR分别是62.50%和92.50%。治疗后3个月,ORR (65.00%)略高,DCR (90.00%)较低。
Table 2. The follow-up results according to mRECIST criteria n (%)
表2. 根据mRECIST标准的随访结果n (%)
CR: complete response; PR: partial response; SD: stable disease; PD: progressive disease; ORR: objective response rate; DCR: disease control rate.
3.2. 肝功能的变化
与术前相比,术后1周AST、ALT和TBil升高,并且ALB水平降低,差异具有统计学意义(p < 0.05),但所有这些水平在第一次手术后的第一个月恢复到基线水平。见表3。
Table 3. The changes of liver function indexes in patients with primary liver cancer before and after treatment
表3. 原发性肝癌患者治疗前后肝功指标的变化
3.3. 治疗相关的不良反应
包括栓塞后综合征和阿帕替尼相关的不良反应。常见的不良反应,如腹部疼痛、体温升高、呕吐或恶心等胃肠道反应,以及阿帕替尼相关的副作用,主要包括乏力、骨髓抑制、血压升高、手足反应、腹泻和蛋白尿,都是轻微的,在本研究中没有发生中毒性死亡。在40名患者中,4名患有高血压,2名患有3级腹泻,他们被迫将阿帕替尼的剂量减少一半。15例(37.50%)有发热,6例(15.00%)有呕吐,2例(5.00%)有蛋白尿。11名患者(27.50%)有手足综合征,8名(20%)患者有疲劳症状。
3.4. 远期疗效
图1和图2分别描绘了PFS和OS的Kaplan-Meier曲线。中位数PFS为10.50个月(95% CI,8.95~12.05个月),中位OS为23.00个月(95% CI,14.95~31.07个月) (图2)。

Figure 1. The median progression-free survival time curve
图1. 中位无进展生存时间曲线
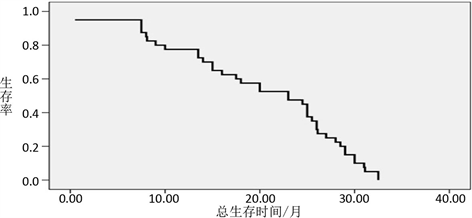
Figure 2. The median overall survival time curve
图2. 中位总生存时间曲线曲线
4. 讨论
肝动脉化疗栓塞术目前是中晚期肝癌首选的微创治疗方式 [10]。但是,该治疗方式存在一些缺点,如短时间内需要多周期的反复介入治疗、不能彻底灭活肿瘤、局部缺氧诱发肿瘤新生血管的生成和易出现肿瘤复发和转移。最新的VEGFR-2抑制剂——阿帕替尼具有以下作用:VEGF刺激的内皮细胞迁移和增殖得到明显的抑制、微血管密度显著降低,肿瘤细胞加速凋亡,从而延缓肿瘤的复发 [11]。多项研究指出,肿瘤患者接受阿帕替尼治疗后,其OS和PFS得到显著延长,DCR得到显著提升 [12]。在目前的研究中,患者的肝功能在治疗后第一周恶化,并在手术后1个月恢复。与以前专注于传统TACE的研究相比,我们研究中的肝脏损伤相对较轻 [13]。虽然这种联合疗法在肝癌的治疗中取得了很好的疗效,但也说明了一些不良反应。总的来说,不良反应可分为两类,包括栓塞后综合征和阿替尼相关的不良反应。然而,没有观察到4级AEs和治疗引起的死亡。在整个过程中,两个人患有高血压,一个人患有3级腹泻,他们被迫将阿帕替尼的剂量减少一半。其余患者均耐受不良反应,经对症治疗后所有症状均缓解。总的来说,患者的不良反应是可以接受的,没有发生严重的不良反应。
在我们的研究中,我们发现TACE联合阿帕替尼对晚期HCC患者显示出良好的疗效:术后1月和术后3月的ORR率分别为62.5%和65.0%。此外,术后1月和术后3月的DCR率分别高达92.50%和90.00%,与李等人所做比较,在接受TACE联合阿帕替尼治疗的晚期肝癌患者中,我们研究中术后1月的ORR略低(62.50%比66.70%),但在术后3月的ORR高得多(65.00%比45.80%) [14]。虽然这些不是面对面的比较,但仍然可以得出结论,TACE联合阿帕替尼与单独使用TACE或阿帕替尼单一疗法相比较,无论在OS还是PFS方面,得到显著改善,显示出良好的治疗效果。在目前的研究中,我们发现中位数OS比既往报道的TACE单药治疗的中位OS长(23.00个月对11.50个月) [15]。研究(13个月)相比,我们的研究可以看到生存时间的轻微优势 [16]。索拉非尼与TACE联合治疗的II期试验显示出良好的局部疾病控制率和生存率 [17]。越来越多的研究表明,TACE (或DEB-TACE)与Apatinib (或sorafenib)联合治疗对晚期HCC患者有生存益处 [18]。
综上所述,TACE联合阿帕替尼治疗晚期肝癌患者,安全、有效,这种联合治疗有希望能够提高中晚期HCC的临床疗效,降低肿瘤的负荷,可以明显提高患者的生存质量。本研究研究对象很少,随访时间不够,此研究可能受到主观选择偏差的影响,仍需要进行大样本多中心前瞻性研究,以验证DEB-TACE与阿帕替尼联合应用的效果。
基金项目
吴阶平医学基金(320.6750.19088-23)。
文章引用
秦立东,邓庆潇,王 楠. 肝动脉化疗栓塞术联合甲磺酸阿帕替尼片治疗晚期肝癌的疗效及安全性评价
Efficacy and Safety of Transarterial Chemoembolization Combined with Apatinib Mesylate in Patients with Advanced Hepatocellular Carcinoma[J]. 临床医学进展, 2019, 09(11): 1339-1345. https://doi.org/10.12677/ACM.2019.911207
参考文献
- 1. Forner, A., Reig, M. and Bruix, J. (2018) Hepatocellular Carcinoma. The Lancet, 391, 1301-1314. https://doi.org/10.1016/S0140-6736(18)30010-2
- 2. Covey, A.M. and Hussain, S.M. (2017) Liver-Directed Therapy for Hepatocellular Carcinoma: An Overview of Techniques, Outcomes, and Post-Treatment Imaging Findings. American Journal of Roentgenology, 209, 67-76. https://doi.org/10.2214/AJR.17.17799
- 3. Wu, B., Zhou, J., Ling, G., et al. (2018) Calli-Spheres Drug-Eluting Beads versus Lipiodol Transarterial Chemoembolization in the Treatment of Hepatocellular Carcinoma: A Short-Term Ef-ficacy and Safety Study. World Journal of Surgical Oncology, 16, 69. https://doi.org/10.1186/s12957-018-1368-8
- 4. Ter Veer, E., Haj, M.N., van Valkenhoef, G., et al. (2016) Sec-ond- and Third-Line Systemic Therapy in Patients with Advanced Esophagogastric Cancer: A Systematic Review of the Literature. Cancer and Metastasis Reviews, 35, 439-456. https://doi.org/10.1007/s10555-016-9632-2
- 5. Mi, Y.J., Liang, Y.J., Huang, H.B., et al. (2010) Apatinib (YN968D1) Reverses Multidrug Resistance by Inhibiting the Efflux Function of Multiple ATP-Binding Cassette Transporters. Cancer Research, 70, 7981-7991. https://doi.org/10.1158/0008-5472.CAN-10-0111
- 6. Zhen, L., Yong, F., et al. (2018) The Efficacy and Safety of Apatinib Treatment for Patients with Unresectable or Relapsed Liver Cancer: A Retrospective Study. Journal of Cancer, 9, 2773-2777. https://doi.org/10.7150/jca.26376
- 7. Yang, Z., Chen, G., Cui, Y., et al. (2019) The Safety and Ef-ficacy of TACE Combined with Apatinib on Patients with Advanced Hepatocellular Carcinoma: A Retrospective Study. Cancer Biology & Therapy, 20, 321-327. https://doi.org/10.1080/15384047.2018.1529099
- 8. 中华人民共和国国家卫生和计划生育委员会. 原发性肝癌诊疗规范(2017年版)[J]. 临床肝胆病杂志, 2017, 33(8): 1419-1431.
- 9. Lencioni, R. and Llovet, J.M. (2010) Modified RECIST (mRECIST) Assessment for Hepatocellular Carcinoma. Seminars in Liver Disease, 30, 52. https://doi.org/10.1055/s-0030-1247132
- 10. 杨泽冉, 苏天昊, 尉建安, 等. 肝动脉化疗栓塞术联合阿帕替尼治疗中晚期原发性肝癌疗效评价[J]. 中国肿瘤临床, 2017, 44(17): 880-885.
- 11. Wang, E., Xia, D., Bai, W., et al. (2019) Tumor Hypervascularity and Hand-Foot-Skin Reaction Predict Better Outcomes in Combination Treatment of TACE and Sorafenib for Intermediate Hepatocellular Carcinoma. BMC Cancer, 19, 409. https://doi.org/10.1186/s12885-019-5570-z
- 12. Qin, S. (2014) Apatinib in Chinese Patients with Advanced Hepatocellular Carcinoma: A Phase II Randomized, Open-Label Trial. Journal of Clinical Oncology, 32, 4019. https://doi.org/10.1200/jco.2014.32.15_suppl.4019
- 13. Sartorius, K., Sartorius, B., Aldous, C., et al. (2015) Global and Country Underestimation of Hepatocellular Carcinoma (HCC) in 2012 and Its Implications. Cancer Epidemi-ology, 39, 284-290. https://doi.org/10.1016/j.canep.2015.04.006
- 14. 李威, 满文玲, 郭欢庆, 等. TACE联合甲磺酸阿帕替尼治疗中晚期肝癌的临床研究[J]. 肿瘤药学, 2017, 7(1): 74-78.
- 15. Chen, H.D., Zhou, J., Wen, F., et al. (2017) Cost Effectiveness Analysis of Apatinib Treatment for Chemotherapy Refractory Advanced Gastric Cancer. Journal of Cancer Research and Clinical Oncology, 143, 361-368. https://doi.org/10.1007/s00432-016-2296-z
- 16. Wei, Y., Liu, J., Yan, M., et al. (2019) Effectiveness and Safety of Combination Therapy of Transarterial Chemoembolization and Apatinib for Unresectable Hepatocellular Carcinoma in the Chinese Population: A Meta-Analysis. Chemotherapy, 64, 94-104. https://doi.org/10.1159/000502510
- 17. Shiozawa, K., Watanabe, M., Ikehara, T., et al. (2015) Efficacy of Soraf-enib versus Hepatic Arterial Infusion Chemotherapy for Advanced Hepatocellular Carcinoma Refractory to Transcatheter Arterial Chemoembolization. Gan To Kagaku Ryoho, 42, 953-956.
- 18. Chen, S., Yu, W., Zhang, K., et al. (2018) Comparison of the Efficacy and Safety of Transarterial Chemoembolization with and without Apatinib for the Treatment of BCLC Stage C Hepatocellular Carcinoma. BMC Cancer, 18, 1131. https://doi.org/10.1186/s12885-018-5081-3
