Hans Journal of Chemical Engineering and Technology
Vol.08 No.04(2018), Article ID:25771,7
pages
10.12677/HJCET.2018.84027
DSA Preparation of Fe3O4 NPs@MIL-53 and Catalytic Performance
Chunming Yuan1, Yuanrui Wang2, Yafeng Li2*
1Central of Intelligence, Department of Energy of Jilin Province, Changchun Jilin
2School of Chemical Engineering, Changchun University of Technology, Changchun Jilin

Received: Jun. 17th, 2018; accepted: Jun. 29th, 2018; published: Jul. 6th, 2018

ABSTRACT
The Fe3O4 NPs@MIL-53 composite has been prepared by method of directing self-assembly (DSA) and characterized by PXRD, FTIR, TEM and N2 adsorption at 77 K. The results show that Fe3O4 NPs are embedded into the framework of MIL-53 and locked inside by the lattice of MIL-53. The catalytic performance exhibits that Fe3O4 NPs@MIL-53 composite can selectively catalyze the styrene epoxidation. PXRD testifies the acidic stability of Fe3O4 NPs@MIL-53 composite.
Keywords:Directing Self-Assembly, Mono-Disperse Nano-Particle, MIl-53, Epoxidation
Fe3O4 NPs@MIL-53的直接自组装制备以及催化性能
袁纯明1,王元瑞2,李亚丰2*
1吉林省能源信息中心,吉林 长春
2长春工业大学化学工程学院,吉林 长春

收稿日期:2018年6月17日;录用日期:2018年6月29日;发布日期:2018年7月6日

摘 要
通过直接自组装的方法制备了Fe3O4 NPs@MIL-53复合材料,并且通过PXRD,FTIR,TEM以及77 K下的N2吸附进行了表征。结果显示Fe3O4 NPs是被嵌入到MIL-53骨架结构中并被固定在晶格内部。Fe3O4 NPs@MIL-53复合材料对苯乙烯催化环氧化有高的选择性。PRXD证明了Fe3O4 NPs@MIL-53复合材料的酸稳定性。
关键词 :直接自组装,单分散的纳米离子,MIL-53,环氧化

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
在过去的十几年,一类可用于气体存储/分离、药物缓释、化学传感以及催化的多孔材料——MOF (metal-organic framework)吸引了人们的关注 [1] [2] [3] [4] [5] 。迄今,已经报道了上万种不同结构和组成的MOF材料 [6] ,包括HKUST-1 [7] ,MIL-53 [8] ,MIL-100 [9] ,MIL-101 [10] ,ZIF-8 [11] and UIO-66 [12] 。MOF材料的结构是由金属离子/金属氧化物团簇为节点有机配体为连接体形成的具有三维结构的多孔材料,MOF材料内部的孔可以是孔道结构也可以是孔洞结构。近来,MOF复合材料也吸引了人们的关注,MOF在复合材料中既可以作为“主体”也可以作为“客体” [13] 。
催化是MOF材料重要的应用之一,这不仅在于MOF材料本身具有“分子反应器”的孔道/笼,还在于MOF可以与其他活性组分结合构建新的催化体系催化需要的反应 [14] 。MOF材料可以作为主体,将包括金属、合金、金属氧化物以及POM分子嵌入到其结构内部构成MOF复合材料 [13] [14] [15] 。从制备方法来说,与传统的沸石以及分子筛类似,由MOF构成的复合材料可以通过液相浸渍或者气体渗透方法进行制备 [16] [17] 。近来,一种称作直接自组装(DSA, directing self-assemble)或者模板法的方法被发展起来用于制备M或者MOx NPs@MOF [15] [18] 。Lu等详细的研究了M/MOx/MX NPs@ZIF-8的DSA制备方法,催化性能测试的结果表明Pt NPs@ZIF-8具有区域加氢催化能力 [15] 。在Pt NPs@ZIF-8复合材料中,Pt NPs尽可能地分散在ZIF-8结构的内部并被ZIF-8的晶格锁定高效地避免了Pt NPs之间的团聚。但是ZIF-8的窗口仅3.4 Å,这对大多数有机分子来说太小了。MIL-53具有一维孔道结构,孔道的尺寸在0.8~1.3 nm之间变化,这是因为MIL-53的“呼吸”作用。在这个尺寸水平上,分子量大约100~200 Da的有机分子可以自由进出。作为催化剂,不同尺寸的贵金属以及金属氧化物均可以大批量的制备 [19] [20] [21] [22] [23] 。在本文中,我们通过直接自组装的方法将8 nm Fe3O4组装进MIL-53,进而考察了Fe3O4 NPs@MIL-53复合材料催化苯乙烯环氧化。
2. 实验部分
2.1. 合成
被PVP帽封的单分散的Fe3O4 NPs是根据文献 [24] 制备。
MIL-53的制备。在单口烧瓶中,连续搅拌下将Cr(NO3)3∙9H2O (19.95 g, 49.5 mmol, Aladdin)和H2BDC (12.45 g, 75 mmol)溶解到DMF (1 L, 13 mmol)中形成绿色溶液,再连续搅拌0.5小时,最后混合物的摩尔比为Cr(NO3)3∙9H2O:H2BDC:DMF = 1:1.5:260。将此混合物置于微波反应器中在100℃下反应1小时,所获得的产品在6000 rpm下离心5分钟,用乙醇洗三次,80℃干燥过夜。产率91%。
Fe3O4 NPs@MIL-53的制备。与MIL-53的制备相同,将需要量的Fe3O4 NPs加入到MIL-53的反应体系中,Fe3O4 NPs与制备MIL-53的原料在反应条件下自组装生成产品Fe3O4 NPs@MIL-53。
2.2. 苯乙烯环氧化
Fe3O4 NPs@MIL-53的催化氧化活性通过苯乙烯环氧化进行表征。将2.4 ml苯乙烯(21 mmol),3.2 ml 65% TBHP (tert-butyl hydroperoxide, 32 mmol, Aladdin),200 mg Fe3O4 NPs@MIL-53复合材料以及20 ml乙腈加入到装有冷凝管的三口烧瓶中。将此混合物加热到80℃恒温保持反应正常进行。每隔2小时取样,通过装有HP-5色谱柱的Agilent-6890N GC进行样品分析。
2.3. 材料表征
Rigaku D/MAX PC2200粉末衍射仪,Cu Kα射线(λ = 1.5406 Å),扫速5˚/min;JEOL-2000ex透射电镜;Nicolet iS10 FTIR红外光谱仪,400~4000 cm−1,KBr压片;TriStar II 3020吸附仪(Micromeritics Instrument Corporation),N2 77K,样品120℃活化12小时;Agilent-6890N气相色谱仪,氢焰检测器,HP-5毛细管柱,30 Mx 0.32 mm (内径) X 0.25 μm (膜厚),条件:N2作为载气;100:1分离比;柱温:180℃;气化室:180℃;检测器:220℃。
3. 结果与讨论
3.1. Fe3O4 NPs@MIL-53的表征
从图1可以看出,图1(a)是通过MIL-53的晶体结构模拟所获得的PXRD,图1(b)是拟合的Fe3O4 NPs,图1(c)是通过本文方法制备的MIL-53的PXRD,图1(d)为复合物Fe3O4 NPs@MIL-53的PXRD。合成的MIL-53以及复合物Fe3O4 NPs@MIL-53与通过晶体结构模拟所获得的PXRD在衍射峰位置以及衍射峰强度略有差别,这是因为MIL-53具有“呼吸作用”,用于晶体结构模拟的MIL-53是含有结晶水的形式,而我们合成的MIL-53以及复合物Fe3O4 NPs@MIL-53在合成之后均经过了干燥处理,因此衍射峰位置以及衍射峰强度略有差别。合成的MIL-53以及复合物Fe3O4 NPs@MIL-53的PXRD的峰位置以及峰强度基本一致,说明嵌入Fe3O4 NPs的MIL-53的结构依然保持,并且结晶度没有发生较大变化。
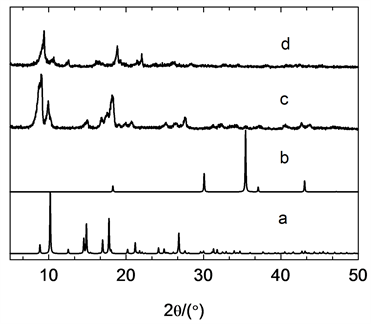
Figure 1. PXRD patterns of samples. (a) Simulated MIL-53, (b) simulated Fe3O4 NPs, (c) as-synthesized MIL-53, (d) Fe3O4 NPs@MIL-53 composite
图1. 样品的PXRD。(a) 拟合的MIL-53;(b) 拟合的Fe3O4 NPs;(c) 制备的MIL-53;(d) 制备的Fe3O4 NPs@MIL-53复合材料
波数在455 cm−1和588 cm−1的红外吸收是Fe3O4的特征吸收峰。从图2(a),所制备的Fe3O4 NPs FTIR光谱,波数在455 cm−1和588 cm−1有很强的红外吸收,同时在图2(b)的MIL-53中没有相应的红外吸收,但在图2(c)的Fe3O4 NPs@MIL-53复合材料中有相应的红外吸收。这表明,Fe3O4 NPs与MIL-53构成了复合材料。
Fe3O4 NPs与合成MIL-53的起始原料同时加入到反应体系中,通过DSA的方法制备Fe3O4 NPs@MIL-53复合材料,这些加入的Fe3O4 NPs嵌入到MIL-53的结构中。从Fe3O4 NPs@MIL-53复合材料的TEM图(图3)可以清楚的观察到这种结构。
MIL-53样品在77 K下利用N2吸附测定的BET比表面积为1044 m2/g (图4),随着Fe3O4 NPs嵌入到MIL-53的结构中,所获得的Fe3O4 NPs@MIL-53复合材料的比表面积略有下降,比表面积为730 m2/g。
3.2. Fe3O4 NPs@MIL-53对苯乙烯环氧化的催化性能
苯乙烯环化是一个精细的催化氧化反应,经常被用于探测催化剂的氧化催化性能。在本实验中Fe3O4 NPs@MIL-53复合材料是被用于催化苯乙烯环氧化以检测Fe3O4 NPs@MIL-53复合材料的催化性能。图5的结果显示,Fe3O4 NPs@MIL-53可用于催化苯乙烯环氧化。苯乙烯的选择性可达到75%。进而,Fe3O4 NPs@MIL-53复合材料的稳定性通过在80℃在苯甲酸/乙腈溶剂中浸泡10 h进行表征。图6给出了Fe3O4 NPs@MIL-53复合材料浸泡前后的PXRD对比图。可以发现,尽管在酸性溶剂中浸泡10 h,Fe3O4 NPs@MIL-53复合材料基本没有变化,也证明了Fe3O4 NPs@MIL-53复合材料的稳定性。

Figure 2. FTIR curves of samples. (a) Fe3O4 NPs; (b) MIL-53; (c) Fe3O4 NPs@MIL-53 composite
图2. 样品的FTIR。(a) Fe3O4 NPs;(b) MIL-53;(c) Fe3O4 NPs@MIL-53复合材料

Figure 3. TEM diagrams of samples. (A) MIL-53; (B) Fe3O4 NPs@MIL-53 composite
图3. 样品的TEM图。(A) MIL-53;(B) Fe3O4 NPs@MIL-53复合材料

Figure 4. N2 adsorption of samples at 77 K. (a) MIL-53; (b) Fe3O4 NPs@MIL-53 composite
图4. 样品在77 K下的N2气吸附。(a) MIL-53;(b) Fe3O4 NPs@MIL-53复合材料

Figure 5. The styrene epoxidation catalyzed by Fe3O4 NPs@MIL-53. (A) the blank experiment: () conversion of styrene; (£) selectivity of benzaldehyde; (s) selectivity of styrene oxide; (B) Fe3O4 NPs@MIL-53 as the catalyst: () conversion of styrene; (£) selectivity of benzaldehyde; (s) selectivity of styrene oxide; (r) benzoic acid
图5. Fe3O4 NPs@MIL-53催化的苯乙烯环氧化。(A) 空白实验:() 苯乙烯转化率;(£) 苯甲醛的选择性;(s) 环氧苯甲醛的选择性;(B) Fe3O4 NPs@MIL-53 作为催化剂:() 苯乙烯转化率;(£) 苯甲醛的选择性;(s) 环氧苯甲醛的选择性;(r) 苯甲酸

Figure 6. PXRD patterns of Fe3O4 NPs@MIL-53(Fe). (a) Fe3O4 NPs@MIL-53 (Fe); (b) Fe3O4 NPs@MIL-53(Fe) (50 mg) soaked into benzoic acid/CH3CN (50 mg/10 ml) at 80˚C for 10 h
图6. 样品的PXRD图。(a) Fe3O4 NPs@MIL-53;(b) 80℃下,在苯甲酸/乙腈(50 mg/10 ml)溶液中浸泡10 h的Fe3O4 NPs@MIL-53 (50 mg)
4. 结论
通过DSA方法制备Fe3O4 NPs@MIL-53复合材料,结果表明该复合材料对苯乙烯环氧化具有高选择性。PXRD结果表明了Fe3O4 NPs@MIL-53复合材料的酸稳定性。
文章引用
袁纯明,王元瑞,李亚丰. Fe3O4 NPs@MIL-53的直接自组装制备以及催化性能
DSA Preparation of Fe3O4 NPs@MIL-53 and atalytic Performance[J]. 化学工程与技术, 2018, 08(04): 216-222. https://doi.org/10.12677/HJCET.2018.84027
参考文献
- 1. Suh, M.P., Park, H.J., Prasad, T.K. and Lim, D.-W. (2012) Hydrogen Storage in Metal-Organic Frameworks. Chemical Reviews, 112, 782-835. https://doi.org/10.1021/cr200274s
- 2. Sumida, K., Rogow, D.L., Mason, J.A., et al. (2012) Carbon Dioxide Capture in Metal-Organic Frameworks. Chemical Reviews, 112, 724-781. https://doi.org/10.1021/cr2003272
- 3. Kreno, L.E., Leong, K., Farha, O.K., Allendorf, M., Van Duyne, R.P. and Hupp, J.T. (2012) Metal-Organic Framework Materials as Chemical Sensors. Chemical Reviews, 112, 1105-1125. https://doi.org/10.1021/cr200324t
- 4. Horcajada, P., Gref, R., Baati, T., et al. (2012) Metal-Organic Frameworks in Biomedicine. Chemical Reviews, 112, 1232-1268. https://doi.org/10.1021/cr200256v
- 5. Lee, J.Y., Farha, O.K., Roberts, J., Scheidt, K.A., Nguyena, S.B.T. and Hupp, J.T. (2009) Metal-Organic Framework Materials as Catalysts. Chemical Society Reviews, 38, 1450-1459. https://doi.org/10.1039/b807080f
- 6. Tranchemontagne, D.J., Mendoza-Cortés, J.L., O’Keeffe, M. and Yaghi, O.M. (2009) Secondary Building Units, Nets and Bonding in the Chemistry of Metal-Organic Frameworks. Chemical Society Reviews, 38, 1257-1283. https://doi.org/10.1039/b817735j
- 7. Stephen, S.Y.C., Samuel, M.F.L., Jonathan, P.H.C., Orpen, A.G. and Williams, I.D. (1999) A Chemically Functionalizable Nanoporous Material [Cu3(TMA)2(H2O)3]n. Science, 283, 1148-1150. https://doi.org/10.1126/science.283.5405.1148
- 8. Serre, C., Millange, F., Thouvenot, C., et al. (2002) Very Large Breathing Effect in the First Nanoporous Chromium(III)-Based Solids: MIL-53 or CrIII(OH)•{O2C-C6H4-CO2}•{HO2C-C6H4-CO2H}x•(H2O)y. Journal of the American Chemical Society, 124, 13519-13526. https://doi.org/10.1021/ja0276974
- 9. Horcajada, P., Serre, C., Vallet-Regí, M., Sebban, M., Taulelle, F. and Férey, G. (2006) Metal-Organic Frameworks as Efficient Materials for Drug Delivery. Angewandte Chemie International Edition, 45, 5974-5978. https://doi.org/10.1002/anie.200601878
- 10. Férey, G., Mellot-Draznieks, C., Serre, C., et al. (2005) A Chromium Tereph-thalate-Based Solid with Unusually Large Pore Volumes and Surface Area. Science, 309, 2040-2042. https://doi.org/10.1126/science.1116275
- 11. Huang, X.C., Lin, Y.Y., Zhang, J.P., et al. (2006) Ligand-Directed Strategy for Zeo-lite-Type Metal-Organic Frameworks: Zinc (II) Imidazolates with Unusual Zeolitic Topologies. Angewandte Chemie International Edition, 45, 1557-1559. https://doi.org/10.1002/anie.200503778
- 12. Cavka, J.H., Jakobsen, S., Olsbye, U., et al. (2008) A New Zirconium Inorganic Building Brick Forming Metal Organic Frameworks with Exceptional Stability. Journal of the American Chemical Society, 130, 13850-13851. https://doi.org/10.1021/ja8057953
- 13. Zhu, Q.L. and Xu, Q. (2014) Metal-Organic Framework Composites. Chemical Society Re-views, 43, 5468-5512. https://doi.org/10.1039/C3CS60472A
- 14. Dhakshinamoorthy, A. and Garcia, H. (2012) Catalysis by Metal Nanoparticles Embedded on Metal-Organic Frameworks. Chemical Society Reviews, 41, 5262-5284. https://doi.org/10.1039/c2cs35047e
- 15. Lu, G., Li, S.Z., Guo, Z., et al. (2012) Imparting Functionality to a Metal-Organic Framework Material by Controlled Nanoparticle Encapsulation. Nature Chemistry, 4, 310-316. https://doi.org/10.1038/nchem.1272
- 16. Ameloot, R., Roeffaers, M.B.J., Cremer, G.D., et al. (2011) Metal-Organic Framework Single Crystals as Photoactive Matrices for the Generation of Metallic Microstructures. Advanced Materials, 23, 1788-1791. https://doi.org/10.1002/adma.201100063
- 17. Hermes, S., Schröter, M.K., Schmid, R., et al. (2005) Metal@MOF: Loading of Highly Porous Coordination Polymers Host Lattices by Metal Organic Chemical Vapor Deposition. Angewandte Chemie International Edition, 44, 6237-6241. https://doi.org/10.1002/anie.200462515
- 18. Tsuruoka, T., Kawasaki, H., Nawafune, H., et al. (2011) Controlled Self-Assembly of Metal-Organic Frameworks on Metal Nanoparticles for Efficient Synthesis of Hybrid Nanostructures. ACS Applied Materials & In-terfaces, 3, 3788-3791. https://doi.org/10.1021/am200974t
- 19. Rioux, R.M., Song, H., Hoefelmeyer, J.D., et al. (2005) High-Surface-Area Catalyst Design: Synthesis, Characterization, and Reaction Studies of Platinum Nanoparticles in Mesoporous SBA-15 Silica. The Journal of Physical Chemistry B, 109, 2192-2202. https://doi.org/10.1021/jp048867x
- 20. Ricco, R., Malfatti, L., Takahashi, M., et al. (2013) Applications of Magnetic Metal-Organic Framework Composites. Journal of Materials Chemistry A, 1, 13033-13045. https://doi.org/10.1039/c3ta13140h
- 21. Bagheri, A., Taghizadeh, M., Behbahan,i M., et al. (2012) Synthesis and Characterization of Magnetic Metal-Organic Framework (MOF) as a Novel Sorbent, and Its Optimization by Experimental Design Methodology for Determination of Palladium in Environmental Samples. Talanta, 99, 132-139. https://doi.org/10.1016/j.talanta.2012.05.030
- 22. Zhang, T., Zhang, X., Yan, X., et al. (2013) Synthesis of Fe3O4@ZIF-8 Magnetic Core-Shell Microspheres and Their Potential Application in a Capillary Microreactor. Chemical Engineering Journal, 228, 398-404. https://doi.org/10.1016/j.cej.2013.05.020
- 23. Lohe, M.R., Gedrich, K., Freudenberg, T., et al. (2011) Heating and Separation Using Nanomagnet-Functionalized Metal-Organic Frameworks. Chemical Communications, 47, 3075-3077. https://doi.org/10.1039/c0cc05278g
- 24. Park, J., An, K., Hwang, Y., et al. (2004) Ultra-Scale Synthesis of Monodisperse Nano-crystals. Nature Materials, 3, 891-895. https://doi.org/10.1038/nmat1251
NOTES
*通讯作者。