Hans Journal of Food and Nutrition Science
Vol.05 No.04(2016), Article ID:18662,8
pages
10.12677/HJFNS.2016.54018
Structural Characterization of Acid Polysaccharides from the Base of Flammulina Velutipes
Shengnan Wu, Shuchao Ren, Qian Cheng, Jianbo Jia*
Huaiyin Institute of Technology, Huaian Jiangsu

Received: Sep. 5th, 2016; accepted: Sep. 27th, 2016; published: Sep. 30th, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Acid polysaccharides extracted from the flammulina velutipes were isolated and purified by DEAE-52 cellulose and gel chromatography. Their preliminary structural characterizations were also analyzed. The results showed that the purified acid polysaccharides contained no protein. The molecular weights of FVP1 and FVP2 were 1.9 × 106 Da and 9.8 × 103 Da, respectively. By the analysis of IR, FVP1 was a beta pyranose galactan, and FVP2 was alpha glucan pyran type. TLC proved that FVP1 was composed of galactose and glucose, and FVP2 was composed of glucose.
Keywords:The Base of Flammulina Velutipes, Polysaccharides, Isolation, Purification

金针菇菇脚酸性多糖结构表征
吴胜男,任书超,程倩,贾建波*
淮阴工学院,江苏 淮安

收稿日期:2016年9月5日;录用日期:2016年9月27日;发布日期:2016年9月30日

摘 要
本文采用DEAE-52纤维素离子交换层析和Sephadex G-100层析对金针菇菇脚多糖进行分离纯化,得到两个酸性多糖组分FVP1和FVP2,相对分子质量分别为1.9 × 106 Da和9.8 × 103 Da。通过红外光谱鉴定,表明FVP1和FVP2分别为β-吡喃型半乳聚糖和α-吡喃型葡聚糖。TLC法表明FVP1的单糖组成为半乳糖和葡萄糖,FVP2的单糖组成为葡萄糖。
关键词 :金针菇菇脚,多糖,分离,纯化

1. 引言
金针菇作为一种富含丰富营养物质的食用菌,在我国消费量极大。金针菇中生物活性物质含量丰富,如多糖、朴菇素、多酚、糖蛋白等 [1] 。大量研究成果表明,金针菇体内含有两种以上的不同的多糖,已经分离出的多糖既包含均一多糖也包含杂多糖,其结构特征也是丰富多样的 [2] 。
本课题所研究的金针菇菇脚(采摘金针菇时根部向上10 cm左右切下的下脚料)来源于江苏省华绿生物科技股份有限公司。公司在生产食用金针菇的同时,大量菇脚无法利用。迄今为止,公司尚未找到合适的方法将其变废为宝,只能将其作为垃圾随意丢弃,导致环境污染和资源浪费十分严重。
本论文主要是用DEAE-52纤维素离子交换柱层析对金针菇菇脚粗多糖溶液进行分离纯化,并用Sephadex G-100进一步分离酸性多糖,用分子排阻色谱法测定分离后酸性多糖的分子量,再用红外光谱法和TLC法对酸性多糖进行初步结构表征。通过这些实验方法对金针菇菇脚酸性多糖进行初步结构分析,对其进一步开发和利用有重要的指导意义。
2. 材料与方法
2.1. 材料与设备
金针菇菇脚粗多糖溶液是用江苏省华绿生物科技有限公司提供的菇脚经水提醇沉 [3] 和sevage法 [4] 初步纯化而得;其他化学试剂均为分析纯。
DEAE-52层析柱(江阴市新辉层析设备有限公司);DHL-B电脑数显定时恒流泵(上海沪西分析仪器厂有限公司);UV-2410PC型紫外可见分光光度计(UNICO仪器有限公司);Agilent 1100 series高效液相色谱仪(沃特世科技上海有限公司);Sephadex G-100 (Pharmacia公司);傅里叶变换红外光谱仪(美国赛默飞公司);薄层层析板(青岛海洋化工有限公司)。
2.2. 实验方法
2.2.1. DEAE-52纤维素柱层析纯化多糖
1) 多糖纯化条件的优化 [5] [6]
用刻度吸管吸取5 mL粗多糖溶液沿柱壁缓缓加入到DEAE-52纤维素柱内,用0,0.1,0.2,0.3,0.4 mol/L的NaCl溶液依次对多糖溶液进行梯度洗脱,洗脱体积100 mL,流速1 mL/min,分管收集,每管10mL,收集洗脱液,苯酚硫酸法测定洗脱液中多糖含量。
2) 多糖纯化的最佳条件
再次平衡DEAE-52纤维素色谱柱,用刻度吸管吸取5 mL粗多糖溶液沿柱壁缓缓加入到DEAE-52纤维素柱内,先用去离子水洗脱多糖溶液,弃去洗脱液 [7] [8] ,再用0.1 mol/L的NaCl溶液洗脱多糖溶液,弃去洗脱液,最后用0.2 mol/L的NaCl溶液洗脱多糖溶液,收集洗脱液,洗脱体积均为100 mL,流速均为1 mL/min。
2.2.2. Sephadex G-100凝胶柱进一步分离纯化多糖
浓缩蒸干纯化后的多糖溶液,配制10 mL质量浓度为4 mg/L的多糖溶液,然后将其沿柱壁缓慢加入到Sephadex G-100凝胶色谱柱内,用去离子水洗脱,流速1 mL/min,每管收集10 mL。用苯酚硫酸法分管检测多糖含量,合并相同组分后,浓缩蒸干,进行红外光谱检测 [9] 。
2.2.3. 紫外光谱法测定多糖纯度
量取纯化后的金针菇菇脚多糖溶液2 mL进行紫外光谱分析,扫描范围为180~600 nm,根据扫描出来的谱图确定纯化后的多糖溶液中有无蛋白质和核酸 [10] 。
2.2.4. 分子排阻色谱法测定多糖分子量
标准多糖分子量分别为9750 Da、36800 Da、135350 Da、300600 Da、2 × 106 Da,用流动相配成1.0 mg/mL的标准溶液,0.45 µm水系滤膜过滤后用分子排阻色谱法进行分析。流动相为含0.1 mol/L Na2SO4的0.01 mol/L磷酸缓冲溶液,缓冲溶液pH值为6.8,控制流动相流速为0.8 mL/min,色谱柱柱温为25℃,检测器温度为25℃,进样体积为20 µL,按分子量大小由大到小进样,记录色谱图,用Excel软件以标准多糖分子量的对数logMr对其在色谱图上的保留时间t进行回归处理,标准多糖分子量的对数logMr为纵坐标,色谱图上的保留时间t为横坐标,绘制多糖分子量的标准曲线。
将分离纯化后的多糖溶液用流动相配制成1.0 mg/mL溶液,用0.45 µm水系滤膜过滤后在相同条件下用分子排阻色谱法进行分析,记录多糖的出峰时间,代入到标准曲线中计算多糖的分子量。
2.2.5. 多糖的红外光谱分析
取微量KBr粉末在红外烘箱中烘干后,放入玛瑙研钵中研磨均匀,用压片机压成薄片,置于傅里叶变换红外光谱仪进行扫描作为背景,扫描次数32次,扫描范围4000 cm−1~5000 cm−1,分辨率2 cm−1 [11] 。取微量分离后的多糖加入到KBr粉末中,重复上述步骤。
2.2.6. 薄层层析法分析多糖的单糖组成
1) 菇脚多糖的水解
分别取20 mg在2.2.2中分离的多糖置于安瓿瓶,加入2 mol/L的硫酸溶液5 mL,封管,置于120℃烘箱内4 h后冷却,加碳酸钡溶液调至中性,4000 r/min离心,取上清液,即为多糖水解液 [12] 。
2) TLC法试剂准备
标准单糖溶液:分别称取葡萄糖、半乳糖、甘露糖、葡萄糖、鼠李糖10 mg,溶于10 mL蒸馏水中,终浓度为1 mg/mL。
展开剂:乙酸乙酯:甲醇:乙酸:水配比为13:3:3:3。
显色剂:量取100 mL正丁醇,加入1.6 g邻苯二甲酸和0.93 g苯胺 [13] 。
3) 点样
将标准品单糖溶液和多糖水解液按一定顺序分别点样在薄层板上,点样量约10 μL,点样扩散后直径不超过5 mm,点样过程中用吹风机吹加快样品干燥。
4) 展层
将点好样品的薄层板放置于密闭的层析缸中,用配置的展开剂,采用倾斜上行法,将薄层板的下端浸在展开剂中小于0.5 cm,至展开剂距离薄层板的上端约1 cm左右时取出自然风干。
5) 显色
在除去溶剂后的薄层板上,均匀喷上显色剂,置于110℃烘箱中加热显色。
3. 结果与分析
3.1. DEAE-52纤维素柱层析纯化多糖结果分析
图1表明洗脱曲线中共有三个峰,管号0~10的去离子水洗脱的峰面积最大,说明中性多糖含量最高,占总多糖的54.2%,管号21~30的0.2 mol/L的NaCl溶液洗脱的峰面积较大,说明酸性多糖含量较高,占总多糖的46.4%,管号11~20的0.1 mol/L的NaCl溶液洗脱的峰面积太小,仅占总多糖的0.2%,可以忽略不计,分析出现此小峰的原因,可能是因为去离子水洗脱时,中性多糖还有少量未洗脱下来,或者是金针菇菇脚中含有微量的带电荷量较小的酸性多糖。
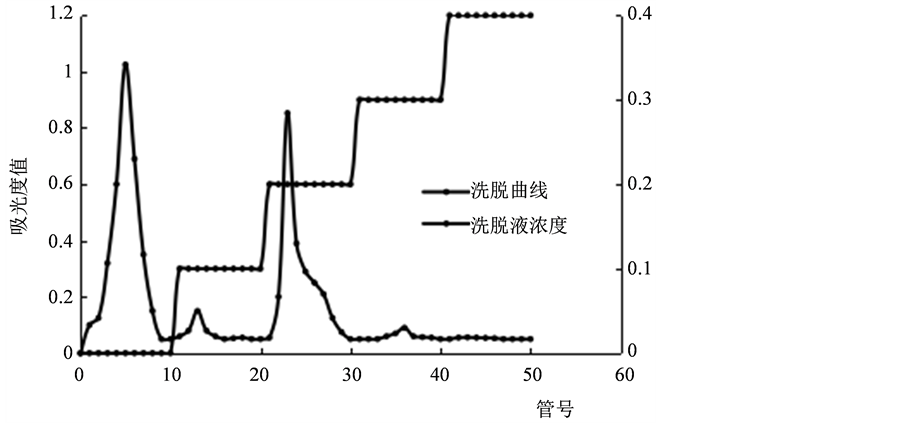
Figure 1. The elution curve of DEAE-52 cellulose column
图1. DEAE-52纤维素柱洗脱曲线
图1中透析过的多糖溶液中仍含有少量色素和杂质,一开始选用去离子水洗脱多糖溶液,一方面是把其中的中性多糖给洗脱下来,但最主要的目的是为了把多糖溶液中仍存在的少量色素和杂质给去除干净,为后期制备高纯度的酸性多糖做准备,所以洗脱下来的中性多糖是不纯的,故本论文不对中性多糖进行进一步的研究,仅研究高盐洗脱下来的酸性多糖。
3.2. Sephadex G-100凝胶柱进一步分离纯化多糖结果分析
Sephadex G-100分离分子量范围是2000~120,000,分子量大的先洗脱出来,图2中共有两个峰,15~28管是第一个峰,收集的是大分子量的多糖,命名为FVP1,占金针菇菇脚酸性多糖的69.23%,66~76管是第二个峰,收集的是小分子量的多糖,命名为FVP2,占金针菇菇脚酸性多糖的30.77%。
3.3. 多糖纯度的测定结果
FVP1,FVP2紫外光度分析结果均如图3所示,在260 nm和280 nm处均没有明显的吸收峰,说明FVP1,FVP2中均不含核酸和蛋白质。

Figure 2. The elution curve of Sephadex G-100 column
图2. SephadexG-100洗脱曲线

Figure 3. The curve of the purity of acid polysaccharide
图3. 酸性多糖纯度测定曲线
3.4. 多糖分子量的测定结果
3.4.1. 多糖相对分子质量标准曲线
由图4得,多糖相对分子质量标准曲线线性回归曲线方程:y = 0.5078x + 10.609。
3.4.2. FVP1、FVP2保留时间曲线
分子排阻法测多糖分子量,相对分子质量大的先出峰,由图5得,FVP1的出峰时间为7.577 min,FVP2的出峰时间为11.590 min,根据标准品多糖相对分子质量线性回归方程计算得FVP1相对分子质量1.9 × 106 Da,FVP2相对分子质量9.8 × 103 Da。
3.5. FVP1、FVP2红外光谱分析
根据图6的红外光谱图分析,波数在3400 cm−1~4000 cm−1处有3个吸收峰,表明多糖内可能有3个游离羟基,波数为2891.81 cm−1、3128.62 cm−1处有峰,说明多糖内可能含有分子内缔合羟基,波数1623.53
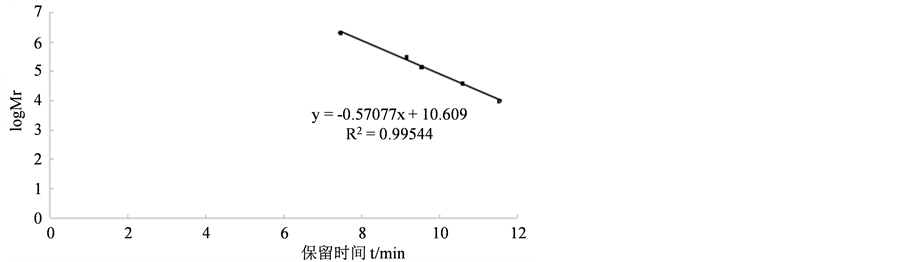
Figure 4. The standard curve of relative molecular weight of acid polysaccharide
图4. 酸性多糖相对分子质量标准曲线
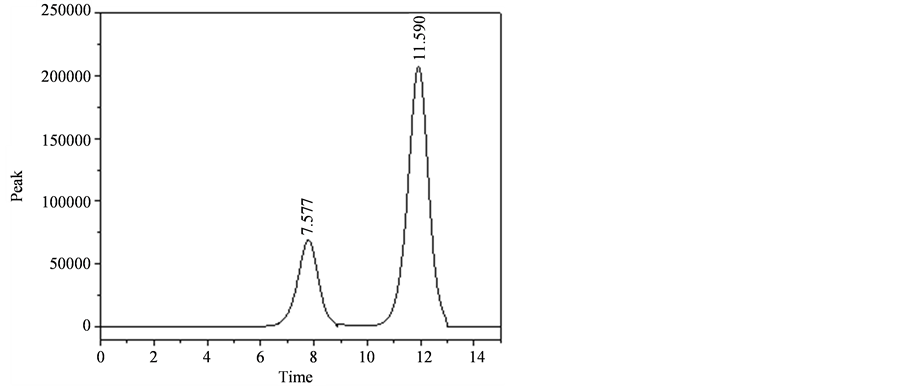
Figure 5. The retention time curve of acid polysaccharide
图5. 酸性多糖保留时间曲线

Figure 6. The infrared spectrum of FVP1
图6. FVP1的红外谱图
cm−1处有峰,说明多糖内可能有羰基,波数为1401.18 cm−1有峰,说明多糖内可能含有-CH3、-CH2和-CH,这些区域的特征峰都是多糖特征峰 [14] ,波数1081.21 cm−1处有峰,为吡喃型糖环特征,是其糖苷键C-O-C的非对称振动峰,波数891.18 cm−1处有峰,为β-D-半乳吡喃糖的C-O-C骨架对称伸缩振动峰,由此,初步判断FVP1为β-吡喃型半乳聚糖。
根据图7的红外光谱图分析,波数为3409.33 cm−1、1189.73 cm−1处有峰,说明多糖内可能含有游离羟基,波数2861.00 cm−1和2929.22 cm−1处有峰,说明多糖内可能含有分子内螯合羟基,波数为1693.61 cm−1处有峰,说明多糖内可能含有羰基,波数1413.26 cm−1处有峰,说明多糖内可能含有-CH3、-CH2和-CH,这些区域的特征峰都是多糖特征峰,波数1054.90 cm−1处有峰,为吡喃型糖环特征,是其糖苷键C-O-C的非对称振动峰,波数835.91 cm−1处有峰,为α-D-葡萄吡喃糖的C-O-C骨架对称伸缩振动峰,初步判断FVP2为α-吡喃型葡聚糖。

Figure 7. The infrared spectrum of FVP2
图7. FVP2的红外谱图
3.6. FVP1、FVP2的单糖组成
用薄层层析板对多糖FVP1、FVP2的单糖组分进行薄层色谱分析,其薄层色谱分析结果见图8。
 1.木糖 2.半乳糖 3.葡萄糖 4.甘露糖 5.鼠李糖 6.FVP2 7.FVP1
1.木糖 2.半乳糖 3.葡萄糖 4.甘露糖 5.鼠李糖 6.FVP2 7.FVP1
Figure 8. Composition of FVP1 and FVP2 indicated by TLC
图8. TLC法测定FVP1、FVP2的单糖组成
由图8可知,FVP1经酸水解在层析图谱中呈现两个斑点,与半乳糖,葡萄糖斑点位置一致,表明FVP1多糖的单糖组分是半乳糖和葡萄糖,FVP2经酸水解在层析图谱中呈现一个斑点,与葡萄糖斑点位置一致,表明FVP2多糖的单糖组分是葡萄糖,说明FVP1多糖的单糖组分是半乳糖和葡萄糖,FVP2多糖的单糖组分是葡萄糖。
4. 结论与讨论
本文中所用的材料金针菇菇脚粗多糖溶液是用热水浸提法结合超声波辅助法提取的,与目前较为成熟的超声波辅助打提取水溶性大豆多糖的提取工艺较为一致,只是在操作条件上有所区别。本文用DEAE-52纤维素离子交换柱层析法和SephadexG-100的凝胶柱层析法分离纯化金针菇菇脚多糖溶液,与Sevage法去除大豆粗多糖溶液中蛋白质相比 [15] ,效果十分理想,多糖纯度显著提高,且易工业化,产品回收率高。IR法说明FVP1为β-吡喃型半乳聚糖,FVP2为α-吡喃型葡聚糖。TLC法证明FVP1多糖的单糖组分是半乳糖和葡萄糖,FVP2多糖的单糖组分是葡萄糖,确定金针菇菇脚酸性多糖的单糖组成,对其进一步的开发利用有一定的指导意义。
基金项目
江苏省大学生创新创业训练计划项目(201411049055x)。
文章引用
吴胜男,任书超,程 倩,贾建波. 金针菇菇脚酸性多糖结构表征
Structural Characterization of Acid Polysaccharides from the Base of Flammulina Velutipes[J]. 食品与营养科学, 2016, 05(04): 149-156. http://dx.doi.org/10.12677/HJFNS.2016.54018
参考文献 (References)
- 1. 傅亚欣. 金针菇菌柄基部多糖的提取纯化及细胞免疫活性研究[D]:[硕士学位论文]. 南京: 南京农业大学, 2012.
- 2. Ren, A.-N., Lu, Y., Zou, Y.-F., et al. (2013) Separation, Purification and Preliminary Structure Analysis of Acidic Polysaccharides from Safflower. European Food Research and Technology, 237, 449-455. http://dx.doi.org/10.1007/s00217-013-2009-7
- 3. 李守勉, 任清, 李明, 等. 金针菇多糖的提取及其美容功效评价[J]. 食用菌, 2009, 31(5): 72-73.
- 4. 占建波. 金针菇多糖提取纯化及生物活性研究[J]. 农业科技辑, 2011(S1): 109-170.
- 5. 杨文建. 金针菇多糖的分离纯化, 结构分析及其记忆功能改善作用机制研究[D]: [博士学位论文]. 南京: 南京农业大学, 2012.
- 6. 邓颖琳. 金针菇子实体多糖的提取分离纯化及结构鉴定[D]: [硕士学位论文]. 浙江: 浙江工业大学, 2011.
- 7. Chen, R.Z., Yang, S.M., Dong, H., et al. (2012) Polysaccharides from Acanthopanacis Senticosi Isolation Purification Antioxidant and Immunological Activities in Vitro. Chinese Academy of Sciences, 45, 955-956.
- 8. 李敏晶, 毛婕昕, 付荣香, 等. DEAE-纤维素分离提纯海带硫酸多糖的研究[J]. 广东化工, 2010, 37(9): 30-31.
- 9. 刘芳, 陈贵堂, 胡秋辉, 等. 金针菇锌多糖分离纯化及其结构特征[J]. 食品科学, 2014, 35(5): 1-7.
- 10. 卢艳. 金针菇子实体水溶性多糖纯化结构鉴定及对乙酰胆碱酯酶抑制活性的研究[D]: [硕士学位论文]. 浙江: 浙江工业大学, 2011.
- 11. 夏朝红, 戴奇, 房韦, 等. 几种多糖的红外光谱研究[J]. 武汉理工大学学报, 2007, 29(1): 45-47.
- 12. 屠婕红, 陈伟光, 盛静, 等. 葎草多糖的提取分离及组成性质研究[J]. 北京中医药大学学报, 2008, 31(18): 561-563.
- 13. 贾建波, 李相前, 杨文, 等. 桑黄多糖分离纯化及其结构初步鉴定[J]. 食品科学, 2006, 27(12): 446-449.
- 14. 武汉大学. 分析化学[M]. 北京: 高等教育出版社, 2007: 273.
- 15. 超声波辅助提取水溶性大豆多糖及纯化工艺[J]. 食品科学, 2011, 32(6): 139-143.
*通讯作者。