Traditional Chinese Medicine
Vol.
09
No.
02
(
2020
), Article ID:
34185
,
11
pages
10.12677/TCM.2020.92011
Investigation in Molecular Mechanisms of Da-Chai-Hu-Tang in the Treatment of Hepatocellular Carcinoma by Integrated Pharmacology
Shihao Xu, Yaoting Li, Ziyi Zhu, Wenqing Cui, Kaikai Shen*
School of Basic Medical Sciences, Shanghai University of Traditional Chinese Medicine, Shanghai

Received: Jan. 6th, 2020; accepted: Feb. 4th, 2020; published: Feb. 14th, 2020

ABSTRACT
OBJECTIVE: To investigate the bioactive chemicals and mechanisms of Da-Chai-Hu-Tang in the treatment of liver cancer. METHOD: We applied the integrative pharmacology platform (TCMIP), combining with formulas, traditional Chinese herbs, chemical compounds, and disease gene target to establish the pharmacological network of Da-Chai-Hu-Tang/traditional Chinese herbs/chemical compounds/gene target/signaling pathway/liver cancer. RESULTS: It predicts that 138 major bioactive ingredients from Da-Chai-Hu-Tang interact with 51 gene targets to treat liver cancer progression. They are involved in processes of energy metabolism, amino acid synthesis and transport, protein translation, lipid metabolism, bile secretion, nervous system, purine metabolism, nucleotide metabolism, and etc. CONCLUSION: We explore the underlying mechanisms of Da-Chai-Hu-Tang in multiple ways, provide the theoretical support for the clinical application of Da-Chai-Hu-Tang in the treatment of liver cancer progression, and widen the horizon on how to explore mechanisms of traditional Chinese formula.
Keywords:Da-Chai-Hu-Tang, Liver Cancer, Integrated Pharmacology

基于整合药理学探索大柴胡汤治疗肝癌的作用机制
许世豪,李姚婷,朱紫依,崔文清,沈凯凯*
上海中医药大学基础医学院,上海

收稿日期:2020年1月6日;录用日期:2020年2月4日;发布日期:2020年2月14日

摘 要
目的:探析大柴胡汤防治肝癌的药效物质基础及其潜在作用机制。方法:运用中药整合药理学计算平台(TCMIP),基于方剂、中药材、中药成分、疾病靶标四大数据库平台,从化学成分、疾病靶标预测、基因功能和通路富集分析大柴胡汤,建立“大柴胡汤–中药材–化学成分–靶标–信号通路–疾病”的可视化网络关系。结果:预测大柴胡汤抗肝癌主要活性成分138个,与肝癌发生发展过程相交互的靶标有51个,主要参与能量代谢、氨基酸合成转运、蛋白质翻译、脂质代谢、胆汁分泌、神经系统、嘌呤代谢、核苷酸代谢等作用机制。结论:本研究从多层次、多靶点、多角度阐述大柴胡汤防治肝癌的作用机制,为大柴胡汤防治肝癌临床运用提供理论依据,丰富中医复方研究的新思路。
关键词 :大柴胡汤,肝癌,整合药理学

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
肝癌(hepatocellular carcinoma, HCC)是世界上最常见的恶性肿瘤之一,中国是肝癌大国,我国每年肝癌患者的死亡人数占全球的42.5% [1]。中医认为,肝胆是调节人体气机升降出入的枢纽,肝主疏泄,无论外感或内伤,均可影响肝脏气机失调,日久则由气及血、气滞血瘀、脉络不通,因此,原发性肝癌患者多以肝气郁结为主,伴随湿热、瘀阻或毒聚,阻碍肝胆气机的正常升降,导致肝胆疏泄功能失常,表现出不同程度上有寒热往来或发热、胸胁苦满及心下痞硬、心下急、呕吐、大便不爽等临床表现,具有大柴胡汤证的特点,与大柴胡汤治疗黄疸型肝癌、肝癌栓塞后综合征和肝癌肝动脉栓塞灌注化疗术后综合征的观点不谋而合 [2]。
大柴胡汤出自东汉时期张仲景所著《伤寒杂病论》,其曰“伤寒发热,汗出不解,心下痞硬,呕吐而下利者,大柴胡汤主之” [3]。其方主要由柴胡半斤、黄芩三两、芍药三两、半夏半升(洗)、生姜五两(切)、枳实四枚(炙)、大枣十二枚(擘),大黄二两组成,具有和解少阳、内泻热结的功效。临床研究报道,大柴胡汤联合化疗药物能够更好地提升化疗效果,更大程度地缓解肝癌的临床症状,减缓肝癌进程,提高肝癌患者用药后的健康状态和生活质量,缓解化疗药物的不良反应,增加患者耐受性 [4] [5] [6] [7]。另者,加味大柴胡汤辅助常规疗法治疗肝癌合并阻塞性黄疸,能有效改善患者临床症状,改善患者预后,发挥抑制肝损伤和保护肝功能的作用 [8] [9]。中医理论认为,大柴胡汤通过攻肠胃之邪,疏利肝胆之气来治疗临床各期的肝癌患者,以此提高患者生存时间和生活质量。
中医方剂强调“药有个性之专长、方有合群之妙用”,大柴胡汤整体疗效显著,然而,其方中的活性成分、活性成分与疾病靶标相关性、潜在作用机制等方面研究欠缺,因此本研究运用中药整合药理学计算平台(integrative pharmacology of traditional Chinese medicine, TCMIP, http://www.tcmip.cn/),基于方剂、中药材、中药成分、疾病靶标四大数据库平台,构建“药物成分–作用靶标–疾病通路”互相作用的网络关系 [10],从“复方–中药–化合物–潜在靶点”多层次、多角度阐释大柴胡汤转少阳之枢机、开阳明之气结,达疏肝利胆从而减缓肝癌进程的潜在作用机制,为大柴胡汤的质量控制和临床定位提供科学依据。
2. 实验方法
2.1. 大柴胡汤的化学成分来源
在TCMIP的“中药材数据库”中,添加“柴胡”、“黄芩”、“白芍”、“半夏”、“生姜”、“枳实”、“大枣”、“大黄”,建立大柴胡汤的化学成分数据库。
2.2. 候选靶标来源及其靶标预测
在TCMIP的“疾病靶标信息设定”中,以“liver cancer”为关键词,检索疾病/症状的靶标,作为肝癌的已知疾病靶标;在“中药靶标预测”界面中,选取药物相似性分数 ≥ 0.7的化学成分预测的靶标当做候选靶标来源,TCMIP可采用二维结构进行相似性搜索,并采用与美国FDA批准的所有药物进行化学结构(“1.1”项筛选出的)相似性比对,对大柴胡汤中柴胡、黄芩、白芍、半夏、生姜、枳实、大枣、大黄8味药材的共有靶标预测,并进行共有靶标分析 [10] [11]。
2.3. 蛋白质–蛋白质相互作用信息
TCMIP整合了8个现有数据库中的蛋白质–蛋白质相互作用(protein-protein interaction, PPI)数据资源,分别为Human Annotated and Predicted Protein Interaction Database、Reactome、Online Predicted Human Interaction Database、InAct、Human Protein reference Database、Molecular Interaction Database、Database of Interacting Protein和PDZBase。通过TCMIP的PPI数据库,即可获得大柴胡汤作用靶标与肝癌之间的PPI信息。
2.4. 网络构建与分析
通过TCMIP的网络分析模块,针对大柴胡汤潜在药靶与肝癌之间的PPI计算网络拓扑特征值,以“节点连接度(degree)”的2倍中位数为卡值,选取中药方剂矫正疾病失衡网络的关键靶标网络。最后,对关键靶标网络进行通路富集,选取P-Value值前30的关键通路,构建“中药材–化学成分–核心靶标–关键通路–疾病关键病例环节”的多层次关联网络,从而揭示大柴胡汤的作用机制和药效物质基础。
2.5. 基因功能和通路富集分析
TCMIP镶嵌了基因本体(Gene Ontology, GO)数据库和京都基因与基因组百科全书(Kyoto Encyclopedia of Genes and Genomes, KEGG)通路数据库的资源,对关键靶标的基因和通路富集分析,分别选择P-Value值前20和P-Value值前15的关键通路信息列于表中。
3. 实验结果
3.1. 大柴胡汤化学成分及其预测靶标分析
首先,基于TCMIP平台,收集大柴胡汤组方中药成分及靶标数量,研究结果如表1所示,大柴胡汤共有8味中药组成,共有中药成分543个,预测靶标共有3650个;通过单味药材间共有靶标分析,结果说明大柴胡汤中药成分彼此间存在协同或拮抗作用(如表2所示)。
Table 1. Basic information on “Traditional Chinese Medicine-Ingredient-Target” of Da-Chai-Hu-Tang
表1. 大柴胡汤“中药–成分–靶标”基本信息
Table 2. Common targets of single herbs in Da-Chai-Hu-Tang
表2. 大柴胡汤中单味药材间共有靶标分析
3.2. 大柴胡汤候选靶基因功能及所参与的通路分析
继而,本研究对大柴胡汤的潜在药靶进行GO基因功能分析,筛选P-Value值前20的主要基因功能信息,结果如表3所示,我们不难发现,大柴胡汤候选靶基因主要参与了谷氨酸转运、线粒体电子传输、能量代谢、细胞色素c氧化等生物信息功能。其次,对大柴胡汤的潜在药靶进行KEGG通路富集分析,选择P-Value值前15的关键通路信息,结果显示,大柴胡汤候选靶基因主要参与了谷氨酸、丙氨酸、天冬氨酸等氨基酸合成代谢、嘌呤代谢等生物学信号通路(如表4所示)。
3.3. 大柴胡汤防治肝癌的核心靶标网络、基因功能和通路富集分析
3.3.1. 大柴胡汤防治肝癌的核心靶标网络
根据条件筛选大柴胡汤关键靶标,筛选得到528个关键靶标,其中药物直接作用靶标156个,已知的疾病靶标89个,疾病与药物间的直接靶标3个,间接靶标280个。根据degree值,图1显示前100个靶点的PPI蛋白互作网络,图中节点大小与degree值呈正相关,红色代表药物靶标,黄色代表疾病靶标,灰色代表其他靶标。
3.3.2. 大柴胡汤防治肝癌的GO基因功能及KEGG通路富集分析
基于TCMIP的疾病靶标信息,对大柴胡汤防治肝癌进行GO基因功能分析,筛选P-Value值前20的主要基因功能信息,结果显示,大柴胡汤减缓肝癌发生发展过程的主要基因体现在线粒体电子传输、能量代谢、细胞色素C传递、脂质代谢、RNA聚合酶合成等过程(如表5所示)。继而,本研究分析大柴胡汤防治肝癌的KEGG通路富集信息,选择P-Value值前15的关键通路,结果如表6所示,主要集中于胆汁分泌、能量代谢、脂质代谢等过程,调控循环系统、内分泌系统、神经系统等微环境,从而干预肝癌发生发展的进程。
Table 3. The gene function information of candidate target of Da-Chai-Hu-Tang
表3. 大柴胡汤候选靶标具有的基因功能信息
Table 4. The pathway information of candidate target of Da-Chai-Hu-Tang
表4. 大柴胡汤候选靶标参与的通路信息
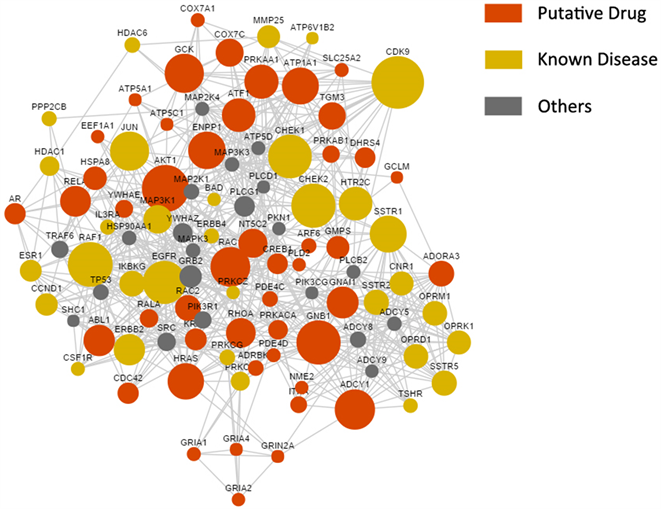
Figure 1. The candidate target network of Da-Chai-Hu-Tang for liver cancer
图1. 大柴胡汤治疗肝癌的候选靶标网络
Table 5. The gene function information of key target of Da-Chai-Hu-Tang for liver cancer
表5. 大柴胡汤治疗肝癌关键靶标具有的基因功能信息
Table 6. The pathway information of key target of Da-Chai-Hu-Tang for liver cancer
表6. 大柴胡汤治疗肝癌关键靶标所参与的通路信息
3.4. 大柴胡汤防治肝癌的“中药–核心成分–关键靶标–主要通路”多维网络关系分析
运用平台的关键靶标分析功能,对大柴胡汤核心靶标网络进行可视化分析、关键靶标功能富集分析、关键靶标的通路富集分析、中药–核心成分–关键药靶–通路网络可视化分析,结果如图2所示,绿色表示中药,紫色表示化学成分,蓝色表示药物靶标,红色表示信号通路。由图2可见,大柴胡汤抗肝癌的作用主要与138个化学成分相关联,作用于30条主要作用通路的51个核心靶标,这是该方发挥防治肝癌药效的核心所在,也体现了多成分与多靶点之间共同作用的机制,符合中医复方作用的特点。由图2可见,大柴胡汤抗肝癌的作用主要与138个化学成分相关联,作用于30条主要作用通路的51个核心靶标,这是该方发挥防治肝癌药效的核心所在,也体现了多成分与多靶点之间共同作用的机制,符合中医复方作用的特点。
4. 结论
经典名方是中医临床治疗的主要手段,在中医药传承、发挥中医药特色上具有重要的意义。中医方剂强调“药有个性之专长、方有合群之妙用”,然后,由于经典名方其多成分与多靶点的特点,其研究存在着整体与局部脱节、宏观与微观分离、体内过程与活性评价不一致等问题,难以体现复方的有机配伍与遣药组方的内涵,成为中医学研究的热点和难点。
大柴胡汤为东汉张仲景所创,出自于《金匮要略》,临床疗效肯定,应用广泛,中医方解分析大柴胡汤中柴胡具有调畅气机、疏肝利胆之功效,配黄芩和解清热,以除少阳之邪;轻用大黄配积实以内泻阳明热结,行气消痞;芍药柔肝缓急止痛,与大黄相配可治腹中实痛,与枳实相伍可以理气和血,以除心下满痛;半夏和胃降逆,配伍大量生姜,以治呕逆不止;大枣与生姜相配,能和营卫而行津液,并调和脾胃。该方是和解少阳、内泄热结的经典名方,在肿瘤临床应用广泛,据文献记载,主要集中于黄疸型肝癌、肝癌栓塞后综合征和肝癌肝动脉栓塞灌注化疗术。本研究以中医理论为指导,借助整合药理学方法,从多成分、多靶标、多角度阐释该组方治疗肝癌的潜在分子机制,为其临床运用提供参考依据。
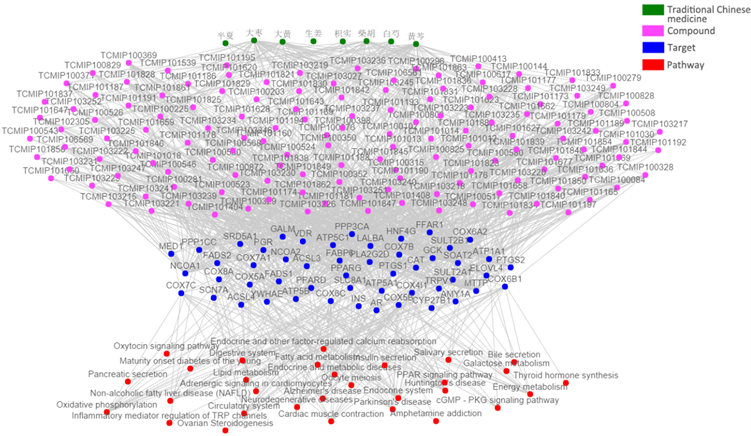
Figure 2. The multidimensional network relationship of “core component-key target-main pathway” of Da-Chai-Hu-Tang for liver cancer
图2. 大柴胡汤治疗肝癌“核心成分–关键靶标–主要通路”多维网络关系图
4.1. 大柴胡汤治疗肝癌的靶点预测
大柴胡汤治疗肝癌主要与138个化学成分相关,其活性成分可针对多个靶点、多条通路发挥治疗肝癌的作用,其作用主要与能量代谢、氨基酸合成转运、蛋白质翻译、脂质代谢、胆汁分泌、神经系统、嘌呤代谢、核苷酸代谢等相关通路有关,这些靶点及通路与文献报道中的调控肝癌发生发展过程相匹配 [12] - [18],涉及到肝癌发病机制的各个重要环节,且表明TCMIP在预测复方治疗疾病的潜在作用机制方面具有较高的正确性。综上所述,本研究基于TCMIP平台进行靶标预测分析,发现大柴胡汤减缓肝癌进程主要集中于胆汁分泌、能量代谢、脂质代谢等过程,调控循环系统、内分泌系统、神经系统等微环境,从而干预肝癌发生发展的进程,此研究结果可为大柴胡汤治疗肝癌相关研究提供一定参考。此外,预测结果提示大柴胡汤在乙型肝炎、非酒精性脂肪肝等疾病治疗中存在一定的应用价值,与临床应用相关联,为大柴胡汤的后续研究与应用提供了借鉴。
4.2. 大柴胡汤活性成分治疗肝癌的作用机制
结合TCMIP研究结果与国内外文献报道,我们对大柴胡汤中关键活性成分抗肝癌研究进行一一阐述。大柴胡汤中的君药柴胡,其主要药效活性成分为柴胡皂苷类化合物,其中,柴胡皂苷A、C、D能通过调控细胞膜上药物转运体的活性来调节药物在细胞中的浓度 [19]。柴胡皂苷D可通过调控肿瘤凋亡基因Bcl-2、Bax、TNF-α等多种途径从而发挥诱导肝癌细胞凋亡、抑制肝癌细胞恶性增殖和阻滞肿瘤细胞周期的作用 [20]。另有研究报道,柴胡皂苷D在高剂量时能够促进肿瘤细胞凋亡且直接导致细胞毒作用,而在低剂量时能够通过上调P38/MAPK,下调NF-κB呈剂量依赖性诱导肝癌细胞分化 [21]。此外,柴胡皂苷D能够通过Caspase-3通路及非Caspase-3通路诱导哺乳动物肝星状细胞HSC-T6和LX-2细胞凋亡;且促使HSC细胞中BAX和BAK由基质向线粒体移位,导致线粒体功能异常与膜电位破坏,使HSC周期停滞,发挥保肝作用 [22]。大柴胡汤中的臣药黄芩,其主要成分为黄酮类成分,其中黄芩苷、黄芩素、汉黄芩素的抗肝癌作用在国内外研究较为深入。黄芩苷通过抑制MEK/ERK信号通路,从而发挥抑制肿瘤细胞增殖且诱导细胞凋亡的作用 [23],同时黄芩苷在内质网应激过程中通过激活ATF6信号通路诱发肝癌细胞凋亡 [24]。黄芩苷通过促进TIMP2表达、抑制细胞基质溶解相关基因蛋白MMP2表达、抑制黏附分子E-cadherin表达和促进integrinβ1表达,从而抑制肝癌细胞BEL-7402迁移运动,发挥阻滞肝癌细胞侵袭与转移的作用 [25]。汉黄芩素通过抑制肝癌细胞中MMP-9蛋白活性,从而削弱MHCC97L和PLC/PRF/5细胞侵袭转移能力 [26]。黄芩苷和汉黄芩素通过调控肝癌细胞中Bcl-2、Bax蛋白表达,同时增加细胞内Ca2+,激发线粒体膜通透性转运孔开放,线粒体跨膜电位降低,最终促使肝癌细胞凋亡 [25] [27]。大柴胡汤中的臣药大黄,其主要成分为蒽醌类、黄酮类和鞣质类化合物,其中,大黄素通过调控MAPK和PI3K/AKT信号通路,从而抑制肝癌细胞增殖和诱导肝癌细胞凋亡,最终抑制小鼠体内肝癌生长 [28] [29]。除此之外,半夏中含有生物碱、有机酸、多糖、甾醇、氨基酸、挥发油及无机元素等多种化学成分。半夏酒精提取液和醋酸乙酯提取部位具有一定抗肝癌活性,酒精提取液可抑制肝癌细胞HepG2增殖,醋酸乙酯部位对促进肝癌细胞Bel-7402凋亡且呈剂量依赖性 [30] [31]。白芍中的芍药苷,枳实中的橙皮苷,大枣中的酸枣仁皂苷,以及生姜中的姜酚均可不同程度的促进肝癌细胞凋亡 [32] [33] [34] [35]。芍药苷通过提高ALB,TP水平,降低血清ALT、AST和ALP水平,发挥保肝作用;且通过mTOR依赖信号通路,抑制HSC异常增殖,维持HSC正常功能,缓解肝纤维化 [36]。这些化合物均被证实具有多靶点联合交互调控肝癌的发生发展,主要涉及抑制肝癌细胞恶性增殖、诱导肝癌细胞凋亡、抑制肝癌血管生成、抑制肝癌细胞侵袭转移、抑制肝癌细胞多药耐药、发挥增效减毒、保肝利胆等作用,这些研究结果均在TCMIP结果中被体现出来。除上述已有的研究报道外,运用TCMIP结果发现,大柴胡汤具备调控丙氨酸、谷氨酸和天冬氨酸等氨基酸代谢通路,以及能量代谢、线粒体电子传输、细胞色素c转运、ATP结合、胆汁酸分泌等过程的潜在作用机制,提示大柴胡汤可通过上述途径发挥减缓肝癌进程的作用,为今后的复方研究提供可探寻的科研思路。
综上所述,本研究首次运用整合药理学平台,以“大柴胡汤–中药材–化学成分–靶标–信号通路–疾病”为研究模式,将传统中医理论与现代医学研究有机结合,中医治法与疾病发病机制相结合,既贴合中药多成分、多靶标、多活性的特色,又不脱离中医理论,从抑制肝癌细胞增殖、诱导肝癌细胞凋亡、抑制肝癌血管生成、保肝利胆、抗肝纤维化等多维度阐述大柴胡汤各药有机配伍减缓肝癌进程的作用机制,诠释大柴胡汤转少阳之枢机,开阳明之气结,达疏肝利胆的经方理论,为大柴胡汤的质量控制和临床运用提供科学依据,丰富中医复方的研究思路。
基金项目
上海人才发展资金;2019~2021年度中华中医药学会“青年人才托举工程”(2019-QNRC2-B07);上海中医药大学杏林学者。
文章引用
许世豪,李姚婷,朱紫依,崔文清,沈凯凯. 基于整合药理学探索大柴胡汤治疗肝癌的作用机制
Investigation in Molecular Mechanisms of Da-Chai-Hu-Tang in the Treatment of Hepatocellular Carcinoma by Integrated Pharmacology[J]. 中医学, 2020, 09(02): 70-80. https://doi.org/10.12677/TCM.2020.92011
参考文献
- 1. Bray, F., Ferlay, J., Soerjomataram, I., et al. (2018) Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians, 68, 394-424. https://doi.org/10.3322/caac.21492
- 2. 乔喜婷, 王克穷, 闫明亮, 等. 加味大柴胡汤治疗原发性肝癌患者TACE术后综合征的临床观察[J]. 中医药导报, 2016, 22(11): 28-31.
- 3. 刘述梅, 吕书勤. 中医药治疗中晚期肺癌机制的研究进展[J]. 新疆中医药, 2017, 35(2): 79-81.
- 4. 易小成. 加味大柴胡汤治疗癌症化疗患者的疗效与不良反应观察[J]. 当代医学, 2018, 24(3): 132-133.
- 5. 孟凡力. 大柴胡汤联合化疗治疗恶性消化道肿瘤43例临床观察[J]. 内蒙古中医药, 2010, 29(3): 22-23.
- 6. 张辉, 田纪凤, 郑瑾, 等. 大柴胡汤治疗中晚期消化道肿瘤癌性发热临床观察[J]. 中国中医急症, 2017, 26(9): 1636-1638.
- 7. 张振兴, 王克穷. 王克穷运用大柴胡汤治疗上腹部恶性肿瘤经验[J]. 浙江中西医结合杂志, 2011, 21(10): 692-693.
- 8. 刘满成. 加味大柴胡汤对肝癌合并阻塞性黄疸患者预后的影响[J]. 实用中西医结合临床, 2018, 18(5): 44-46.
- 9. 费国新. 加味大柴胡汤辅助治疗原发性肝癌合并阻塞性黄疸的临床观察[J]. 湖北中医杂志, 2010, 32(9): 36-37.
- 10. 许海玉, 刘振明, 付岩, 等. 中药整合药理学计算平台的开发与应用[J]. 中国中药杂志, 2017, 42(18): 3633-3638.
- 11. 薛潇春, 胡晋红. 网络药理学的研究方法与应用进展[J]. 药学实践杂志, 2015(5): 401-405.
- 12. Korhan, P., Erdal, E. and Atabey, N. (2014) MiR-181a-5p Is Downregulated in Hepatocellular Carcinoma and Suppresses Motility, Invasion and Branch-ing-Morphogenesis by Directly Targeting c-Met. Biochemical and Biophysical Research Communications, 450, 304-1312. https://doi.org/10.1016/j.bbrc.2014.06.142
- 13. Liu, Z., Peng, Q., Li, Y., et al. (2018) Resveratrol En-hances Cisplatin-Induced Apoptosis in Human Hepatoma Cells via Glutamine Metabolism Inhibition. BMB Reports, 51, 474-479. https://doi.org/10.5483/BMBRep.2018.51.9.114
- 14. Hsu, W.H., Chiou, H.L., Lin, C.L., et al. (2019) Metastasis-Associated Protein 2 Regulates Human Hepatocellular Carcinoma Metastasis Progression through Modulating p38MAPK/MMP2 Pathways. Journal of Cancer, 10, 6716-6725. https://doi.org/10.7150/jca.35626
- 15. Shi, X.J., Zheng, Q.Q., Niu, J.Q., et al. (2019) Research Progress of Lipo-lipomics in Primary Hepatocellular Carcinoma. Chinese Journal of Hepatology, 27, 809-812.
- 16. Raza, S., Rajak, S., Anjum, B., et al. (2019) Molecular Links between Non-Alcoholic Fatty Liver Disease and Hepatocellular Carcinoma. Hepatoma Research, 5, 42. https://doi.org/10.20517/2394-5079.2019.014
- 17. Infantino, V., Dituri, F., Convertini, P., et al. (2019) Epigenetic Upregulation and Functional Role of the Mitochondrial Aspartate/Glutamate Carrier Isoform 1 in Hepatocellular Carcinoma. Biochimica et Biophysica Acta—Molecular Basis of Disease, 1865, 38-47. https://doi.org/10.1016/j.bbadis.2018.10.018
- 18. Ma, F., Zhu, Y., Liu, X., et al. (2019) Dual-Specificity Tyro-sine Phosphorylation-Regulated Kinase 3 Loss Activates Purine Metabolism and Promotes Hepatocellular Carcinoma Progression. Hepatology, 70, 1785-1803. https://doi.org/10.1002/hep.30703
- 19. Feng, L., Liu, L., Zhao, Y., et al. (2017) Saikosaponins A, C and D En-hance Liver-Targeting Effects of Anticancer Drugs by Modulating Drug Transporters. Oncotarget, 8, 110092-110102. https://doi.org/10.18632/oncotarget.22639
- 20. 刘丹, 王佳贺. 柴胡皂苷抗肿瘤作用机制的研究进展[J]. 现代药物与临床, 2018, 33(1): 203-208.
- 21. 张丰华, 黄秀深. 柴胡皂甙D对肝癌细胞体外分化的影响[J]. 广东医学, 2009, 30(12): 1775-1777.
- 22. Chen, M.F., Huang, S.J., Huang, C.C., et al. (2016) Saikosaponin D Induces Cell Death through Caspase-3-Dependent, Caspase-3-Independent and Mitochondrial Pathways in Mammalian Hepatic Stellate Cells. BMC Cancer, 16, Article No. 532. https://doi.org/10.1186/s12885-016-2599-0
- 23. Liang, R.R., Zhang, S., Qi, J.A., et al. (2012) Preferential Inhibition of Hepatocellular Carcinoma by the Flavonoid, Baicalein through Blocking MEK-ERK Signaling. International Journal of Oncology, 41, 969-978. https://doi.org/10.3892/ijo.2012.1510
- 24. Yu, Z., Luo, X., Wang, C., et al. (2016) Baicalin Promoted Site-2 Protease and Not Site-1 Protease in Endoplasmic Reticulum Stress-Induced Apoptosis of Human Hepatocellular Car-cinoma Cells. FEBS Open Bio, 6, 1093-1101. https://doi.org/10.1002/2211-5463.12130
- 25. 郭昱, 郭霞, 武京学, 等. 黄芩甙对人肝癌BEL-7402细胞增殖和侵袭转移的影响及机制[J]. 中国组织化学与细胞化学杂志, 2008(4): 329-334.
- 26. Hong, M., Cheng, H., Song, L., et al. (2018) Wogonin Suppresses the Activity of Matrix Metalloproteinase-9 and Inhibits Migration and Invasion in Human Hepatocellular Carcinoma. Molecules, 23, 384. https://doi.org/10.3390/molecules23020384
- 27. Li, Y., Tu, M., Cheng, C., et al. (2015) Wogonoside Induces Apoptosis in Bel-7402, a Hepatocellular Carcinoma Cell Line, by Regulating Bax/Bcl-2. Oncology Letters, 10, 1831-1835. https://doi.org/10.3892/ol.2015.3408
- 28. El-Saied, M.A., Sobeh, M., Abdo, W., et al. (2018) Rheum Palmatum Root Extract Inhibits Hepatocellular Carcinoma in Rats Treated with Diethylnitrosamine. Journal of Phar-macy and Pharmacology, 70, 821-829. https://doi.org/10.1111/jphp.12899
- 29. Lin, W., Zhong, M., Yin, H., et al. (2016) Emodin Induces Hepatocellular Carcinoma Cell Apoptosis through MAPK and PI3K/AKT Signaling Pathways in Vitro and in Vivo. Oncology Reports, 36, 961-967. https://doi.org/10.3892/or.2016.4861
- 30. 黄必胜, 李娟, 陈科力. 半夏类药材不同提取物对人肝癌细胞Bel-7402的诱导凋亡作用[J]. 中国医院药学杂志, 2007, 27(11): 1510-1512.
- 31. 郑国灿. 半夏提取液的抗肿瘤性研究[J]. 四川中医, 2004, 22(9): 9-11.
- 32. 晏雪生, 李瀚旻, 彭亚琴, 等. 芍药苷对人肝癌细胞HepG-2凋亡及其调控基因的影响[J]. 中华中医药学刊, 2007(7): 1346-1347.
- 33. 夏荣木, 陆红玲. 橙皮苷抗肿瘤活性研究进展[J]. 重庆医学, 2018, 47(21): 2846-2849.
- 34. 徐吉敏, 张世安, 黄艳, 等. MTT法研究酸枣仁皂苷A对肝细胞、肝星状细胞和肝癌细胞增殖的影响[J]. 西北药学杂志, 2013, 28(3): 281-284.
- 35. 陈建新, 吴依芬, 李树基, 等. 10-姜酚通过Src/STAT3信号通路抑制肝癌HepG2细胞增殖[J]. 南方医科大学学报, 2018, 38(8): 1002-1007.
- 36. Zhao, Y., Ma, X., Wang, J., et al. (2014) Paeoniflorin Alleviates Liver Fibrosis by Inhibiting HIF-1α through mTOR-Dependent Pathway. Fitoterapia, 99, 318-327. https://doi.org/10.1016/j.fitote.2014.10.009
NOTES
*通讯作者。
