Botanical Research
Vol.
09
No.
05
(
2020
), Article ID:
37538
,
9
pages
10.12677/BR.2020.95056
湿地植物大薸对氮胁迫的生理响应研究
奚霄松*,钱怡婷
上海园林绿化建设有限公司,上海

收稿日期:2020年8月16日;录用日期:2020年9月3日;发布日期:2020年9月10日

摘要
本文以硝态氮( -N)作为唯一氮形态的模拟污水,以浮水植物大薸为受试材料,研究了大薸对硝态氮的去除效果以及生长参数、硝酸还原酶、抗氧化酶活性和可溶性糖等的生理响应变化。结果表明,随外源硝态氮浓度的增加,培养液中硝态氮的减少量也越多。与对照值相比,施加硝态氮对大薸的硝酸还原酶活性产生明显的抑制作用,最多可达约44%。硝态氮对大薸的生长没有产生明显影响,处理组的叶绿素含量、可溶性蛋白和可溶性糖含量都高于对照组。 -N激活了大薸体内的抗氧化酶活性,比如SOD,CAT和POD (LN和MN)。总体来说,可溶性糖含量上升和抗氧化酶激活支持它们有效参与、改善大薸对 -N的耐性。
关键词
大薸,去除效率,抗氧化酶,可溶性糖,生长

The Physiological Responses of Pistia stratiotes to Nitrate-Nitrogen Stress
Xiaosong Xi*, Yiting Qian
Shanghai Gardening-Landscaping Construction Co. Ltd., Shanghai

Received: Aug. 16th, 2020; accepted: Sep. 3rd, 2020; published: Sep. 10th, 2020

ABSTRACT
In this study, the eliminate capacity for nitrate nitrogen ( -N) and the effects of nitrate-nitrogen on growth index, nitrate reductase and antioxidant enzyme activities, and soluble sugar were investigated in Pistia stratiotes growing in simulated wastewater using
-N as the sole nitrogen form. The results indicated that the loss of 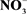 -N increased significantly with augment of exogenous
-N increased significantly with augment of exogenous 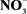 -N in cultural solution. Compared to the control value, plants supplied with
-N had decreased nitrate reductase activity with the maximum reduction of 44%. The
-N had less influence on growth of P. stratiotes. Pigment, soluble protein and soluble sugar content was significantly higher (P < 0.01) in
-N treated P. stratiotes respectively, compared to controls. The activation of antioxidant enzymes, such as superoxide dismutase and catalase, peroxidase (LN and MN) was observed in
-N exposed P. stratiotes. Overall, the increase in concentration of soluble sugar and activation of antioxidative enzymes support their effective involvement in improving
-N tolerancein P. stratiotes.
-N in cultural solution. Compared to the control value, plants supplied with
-N had decreased nitrate reductase activity with the maximum reduction of 44%. The
-N had less influence on growth of P. stratiotes. Pigment, soluble protein and soluble sugar content was significantly higher (P < 0.01) in
-N treated P. stratiotes respectively, compared to controls. The activation of antioxidant enzymes, such as superoxide dismutase and catalase, peroxidase (LN and MN) was observed in
-N exposed P. stratiotes. Overall, the increase in concentration of soluble sugar and activation of antioxidative enzymes support their effective involvement in improving
-N tolerancein P. stratiotes.
Keywords:Pistia stratiotes, Removal Efficiency, Antioxidative Enzymes, Soluble Sugar, Growth

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
富营养化已成为我国淡水湖泊面临的最主要生态环境问题。利用水生植物净化氮磷污水是环境污染治理的研究热点 [1] [2] [3]。水生植物,能直接吸收利用污水中的氮磷等营养物质,通过收获植物可将其吸收的营养物质移除 [4],从而达到改善水质的目的。不同生活型水生植物对水体氮和磷都有一定的去除效果,其中,以漂浮植物的净化率最高 [5] [6]。
大薸(Pistia stratiotes L.)是多年生浮水植物,生物量大,繁殖迅速,根系发达,适宜于生长在各营养级水体中,具有较强的污水净化效果,是良好的净化植物物种 [5] [6] [7] [8]。现有研究表明,大薸对富营养化水体总氮去除的贡献率为53%~65% [9]。刘盼等认为大薸对富营养化水体总氮的吸收率达到74%~90% [10]。
化肥的过度使用和畜牧规模化养殖等现代农业集约化管理产生了大量富含高浓度硝态氮的农业废水 [3]。截止目前,根据作者掌握的资料,有关大薸对水体硝态氮的净化和由此引发适应或胁迫生理反应的报道很少。本试验即选用大薸为实验材料,在含不同程度硝酸钾的营养液中进行室内人工培养,分析和比较大薸对硝态氮的去除率以及硝酸还原酶、抗氧化酶和可溶性糖等生理指标的响应变化,研究结果能为探讨浮水植物对富营养化水体的适应机制提供科学依据,也能为用大薸修复农业污水的人工湿地构建提供有益思考。
2. 材料与方法
2.1. 实验材料与处理
大薸取自江苏宿迁。用自来水驯化1周后,选取生长旺盛、大小相似的植株进行实验。试验采用1/10 Hoagland’s E-Medium培养液。培养液成分为:MgSO4·7H2O,246 mg·L−1;Ca(NO3)2·4H2O,543 mg·L−1;KH2PO4,136 mg·L−1;KNO3,251 mg·L−1;FeSO4·7H2O,9. 92 mg·L−1;Na2EDTA,30 mg·L−1;H3BO3,1.43 mg·L−1;MnCl2·4H2O,0.93 mg·L−1;ZnSO4·7H2O,0.11 mg·L−1;Na2MoO4·2H2O,0.045 mg·L−1;CuSO4·5H2O,0.045 mg·L−1。用KNO3做硝态氮源,通过调节KNO3的加入量,控制培养液中的硝态氮浓度分别为9.94 (CK),15.94 (LN),19.94 (MN)和39.94 (HN) mg/L。培养液的其他成分与对照相同。每个处理重复3次,定期用纯净水补充蒸发水量以保证体积恒定。培养第15天测定水样中的硝态氮含量,同时取样分析生物量和抗氧化酶系统等生理指标。
2.2. 水样硝态氮含量测定
水样硝态氮用紫外分光光度法测定 [11]。
2.3. 生长参数分析
分别在实验开始和结束时,从各处理的培养缸中取出植株,吸干后称重。生长参数 = 生物量(第15天)/生物量(第1天) × 100% [12]。
2.4. 叶绿素含量测定
叶绿素含量采用分光光度法 [13] 测定。
2.5. 可溶性蛋白、可溶性糖和硝酸还原酶(NR)活性测定
可溶性蛋白和可溶性糖的提取和测定均参考《植物生理生化实验原理和技术》的方法 [14],可溶性蛋白采用考马斯亮蓝G-250法测定,可溶性糖采用蒽酮硫酸法测定。硝酸还原酶活性采用磺胺比色法测定 [15]。
2.6. 超氧化物歧化酶(SOD)、过氧化物酶(POD)和过氧化氢酶(CAT)活性测定
取材于预冷的研钵中,加入0.05 mol/L的磷酸缓冲液(pH 7.8),冰浴,研磨,10,000 r/min,低温(0℃~
2.7. 数据处理
所有实验至少重复3次。结果表示为平均值±标准差(SD)。采用OriginPro 8和SPSS18.0对数据进行单因素方差分析和相关系数分析。对不同处理间的所有参数进行主成分(PCA)分析。P < 0.05为差异显著,P < 0.01为差异极显著。
3. 结果
3.1. 水体硝态氮去除
大薸对水体硝态氮有一定的去除效果。培养15天后,CK、LN、MN和HN组培养液中的硝态氮浓度分别减少了2.31、3.34、4.21和5.77 mg/L (图1)。统计分析结果表明,水体去除量与外源硝态氮浓度为极显著正相关,R = 0.97,P < 0.01。
3.2. 抗氧化酶活性的变化
由图2看出,不同浓度的外源硝态氮培养后,大薸体内的SOD和CAT活性都呈上升趋势。其中,LN、MN和HN浓度下的SOD活性分别达到对照的1.81,1.88和2.34倍,CAT活性分别是对照值的1.37,2.20和2.22倍。数据分析表明,SOD活性和硝态氮浓度为显著正相关,R = 0.94,P < 0.05。与SOD和CAT变化不同,POD活性只是在MN时比对照上升了11%。而LN和HN浓度的酶活都分别仅比对照略微下降了3%和8%,与对照差异不显著。

Figure 1. Changes of nitrate-nitrogen content in culture solution under different nitrate-nitrogen concentrations
图1. 不同氮浓度下培养液中硝态氮浓度的变化

Figure 2. SOD, POD and CAT activities in P. stratiotes exposed to different nitrate-nitrogen concentrations (The values were expressed relative to the values in control plants (=100%))
图2. 不同氮浓度下大薸SOD,POD和CAT活性(数值表示为与对照的相对值,对照 = 100%)
3.3. 生长参数
3种不同硝态氮浓度对大薸的生长没有产生明显不良影响(图3)。与对照水平(96%)相比,LN、MN和HN浓度时的相对生长速率分别为99%、99%和94%。统计分析结果也显示4组不同处理组之间无显著差异。
大薸体内的可溶性蛋白含量随水溶液硝态氮的上升而显著提高(图4)。LN、MN和HN浓度时的含量分别比对照值增加了9%、28%和510%。统计分析结果显示蛋白含量和硝态氮浓度达到极显著正相关,R = 0.962,P < 0.01。
如图5所示,LN、MN和HN浓度时的叶绿素a和b含量都高于对照水平.其中叶绿素a随外源硝态氮浓度的上升而增加,分别比对照水平提高了18%、21%和53%,统计分析表明叶绿素a和外源硝态氮浓度达到极显著正相关,R = 0.987,P < 0.01。而叶绿素b则在MN时含量达到峰值,比对照增加了51%,其后下降,但仍比对照含量多21%。

Figure 3. Changes in growth index of P. stratiotes exposed to different nitrate-nitrogen concentrations
图3. 不同氮浓度下大薸生长的变化

Figure 4. Changes in soluble protein content of P. stratiotes exposed to different nitrate-nitrogen concentrations
图4. 不同氮浓度下大薸中可溶性蛋白含量变化

Figure 5. Changes in chlorophyll content of P. stratiotes exposed to different nitrate-nitrogen concentrations
图5. 不同氮浓度下大薸叶绿素含量的变化
3.4. 硝酸还原酶活性
施加外源硝态氮对大薸体的硝酸还原酶活性造成明显的抑制作用。由图6可见,LN、MN和HN浓度时的酶活分别降为对照值的56%、61%和42%。

Figure 6. Changes in nitrate reductase activity of P. stratiotes exposed to different nitrate-nitrogen concentrations (The values were expressed relative to the values in control plants (= 100%))
图6. 不同氮浓度下大薸中硝酸还原酶活性变化(数值表示为与对照的相对值,对照 = 100%)
3.5. 可溶性糖含量
如图7所示,大薸体内可溶性糖含量随外源硝态氮浓度的增加呈上升趋势。LN、MN和HN水平下的含量分别比对照增多了30%、91%和121%。统计分析结果显示可溶性糖含量和硝态氮浓度达到显著正相关。

Figure 7. Changes in soluble sugar content of P. stratiotes exposed to different nitrate-nitrogen concentrations
图7. 不同氮浓度下大薸可溶性糖含量变化
4. 讨论
植物的直接吸收利用被认为是水体硝态氮去除的主要途径和重要机制 [6] [9] [16] [17]。我们的结果证明大薸对水体硝态氮有一定的净化效果(图1),这可能是因为大薸生物量较大,根系发达,吸收能力比较强。前人研究认为,栽培植物的营养液中硝态氮的减少是由于吸收造成的,营养液中硝态氮的减少量全部用于植物有机体的建造或贮存在有机体内 [16]。硝态氮进入植物体后,除一部分被还原成铵氮外,其余部分积累存储在液泡中,从而使大薸可以吸收更多的硝态氮并在较高的硝酸盐浓度下也可以生长良好 [1]。作为植物正常生长所必需的大量元素,氮是植物体内许多重要有机化合物如蛋白质、叶绿素、核酸等的组成成分,多方面影响着植物的代谢和生长发育过程。大薸可以利用硝态氮作为无机氮源 [3]。本研究发现,3种浓度硝态氮和正常对照之间对大薸的生长率未产生显著差异(图3),这意味着外源硝态氮浓度的增加并不会明显影响其正常生长。叶绿素含量通常被用来表征植物的生长状况,本实验中不同硝态氮培养条件下大薸叶绿素含量高于对照水平(图5)也是重要佐证。处理组更高的可溶性蛋白含量(图4)说明在受试浓度范围内大薸具有较强的氮转化能力。
可溶性糖是光合产物,主要包括葡萄糖、蔗糖、果糖等,是能量的储存者和参与新陈代谢的重要底物,也是植物合成其他有机物的起始物质。当氮素缺乏时,植物叶片中可溶性糖的积累能诱使某个代谢途径的转录发生改变,从而改变植物体内的某些代谢 [18]。葛芳杰等在研究不同氮浓度水平下穗花狐尾藻的生理反应时发现,可溶性糖含量随着氮浓度的升高而降低 [19]。与之不同,本实验中,我们却发现随外源硝态氮浓度的增加,可溶性糖积累明显上升,这可能是大薸对外源氮胁迫的一种适应反应,借此调控了植物体内的初生和次生代谢活动,比如酚类代谢,从而有利于增强大薸对氮胁迫的耐受性。但具体机制尚需进一步研究。同时,由于在植物体内氮代谢系统与光合作用是耦联的,随着氮在大薸体内积累增加,叶绿素含量也相应会有一定程度增加(图5)。
-N是许多植物能够优先利用的无机氮源。NR是植物氮素代谢中的限速酶,活性既受底物 的诱导刺激而上升,也受到产物 的强烈抑制 [20]。关于NR活性与植物体内硝态氮含量的关系目前尚未达成一致意见。有研究认为硝态氮的供应与植株NR活性之间没有相关关系 [16]。而本文研究却发现培养液中外源硝态氮的施加明显抑制了硝酸还原酶的活性,这意味着大薸体内的NR活性和硝态氮含量之间表现为负相关。
植物抗污水胁迫过程中,抗氧化酶类和非酶类物质都可能起着非常重要的作用,植物对污水胁迫的耐性与它们的抗氧化能力密切相关 [21]。其中,SOD、POD和CAT是清除细胞中活性氧的重要酶,通过协调作用能有效地消除植物过氧化所产生的活性氧化物,防御细胞膜过氧化 [22]。本研究发现施加不同浓度的硝态氮明显上调了大薸体内抗氧化酶系统的活性(图2),这说明大薸可以通过激活体内的保护酶系统而积极应答外源硝态氮胁迫,增强自身对外源硝态氮的适应。

Figure 8. Principal component analysis of physiological parameters in P. stratiotes exposed to different nitrate-nitrogen concentrations
图8. 不同氮浓度下大薸生理指标主成分分析
5. 结论
PCA分析结果表明不同硝态氮处理组之间对大薸的生理生化的影响差异显著(P = 0.01) (图8)。在HN浓度下生长良好以及叶绿素和可溶性蛋白含量显著上升,都说明大薸对氮胁迫有较高的耐受性。本实验结果表明,激活保护酶系统(SOD、POD、CAT)和渗透调节系统(可溶性糖)是大薸在生理水平的适应机制,是保证大薸在外源一定范围内氮胁迫条件下生长正常的生理基础。
基金项目
上海建工集团股份有限公司重点科研项目,城市景观水域生物炭及植物复合净化系统关键技术及应用研究(19JCSF-13)。
文章引用
奚霄松,钱怡婷. 湿地植物大薸对氮胁迫的生理响应研究
The Physiological Responses of Pistia stratiotes to Nitrate-Nitrogen Stress[J]. 植物学研究, 2020, 09(05): 439-447. https://doi.org/10.12677/BR.2020.95056
参考文献
- 1. 种云霄, 胡洪营, 钱易. pH及无机氮化合物对小浮萍生长的影响[J]. 环境科学, 2003, 24(4): 35-40.
- 2. Rahman, M.A. and Hasegawa, H. (2011) Aquatic Arsenic: Phytoremediation Using Floating Macrophytes. Chemosphere, 83, 633-646. https://doi.org/10.1016/j.chemosphere.2011.02.045
- 3. Wu, W., Liu, A., Wu, K., et al. (2016) The Physiological and Biochemical Mechanism of Nitrate-Nitrogen Removal by Water Hyacinth from Agriculture Eutrophic Wastewater. Brazilian Archives Biology and Technology, 59, e16160517. https://doi.org/10.1590/1678-4324-2016160517
- 4. Iamchaturapatr, J., Yi, S.W. and Rhee, J.S. (2007) Nutrient Removals by 21 Aquatic Plants for Vertical Free Surface-Flow (VFS) Constructed Wetland. Ecological Engineering, 29, 287-293. https://doi.org/10.1016/j.ecoleng.2006.09.010
- 5. 胡啸, 蔡辉, 陈刚, 等. 3种类型水生植物及其组合对污染水体中铬、氮和磷的净化效果研究[J]. 水处理技术, 2012, 38(4): 45-54.
- 6. 耿兵, 张燕荣, 王妮珊, 等. 不同水生植物净化污染水源水的试验研究[J]. 农业环境科学学报, 2011, 30(3): 548-553.
- 7. Victor, K.K., Seka, Y., Norbert, K.K., et al. (2016) Phytoremediation of Wastewaters Toxicity Using Water Hyacinth (Eichhornia crassipes) and Water Lettuce (Pistia stratiotes). International Journal of Phytoremediation, 18, 949-955. https://doi.org/10.1080/15226514.2016.1183567
- 8. 张建聪, 赵洋毅, 段旭, 等. 磷胁迫对高原湿地浮水植物大薸根系分泌物的影响[J]. 环境化学, 2019, 38(2): 385-394.
- 9. 李猛, 马旭洲, 王武. 大薸对水体氮磷去除效果的初步研究[J]. 长江流域资源与环境, 2012, 21(9): 1137-1142.
- 10. 刘盼, 宋超, 朱华, 等. 3种水生植物对富营养化水体的净化作用研究[J]. 水生态学杂志, 2011, 32(2): 69-74.
- 11. 国家环保局. 水和废水监测方法(第3版) [M]. 北京: 中国环境科学出版社, 1997: 272.
- 12. Khellaf, N. and Zerdaoui, M. (2010) Growth Response of the Duckweed Lemna gibba L. to Copper and Nickel Phytoaccumulation. Ecotoxicology, 19, 1363-1368. https://doi.org/10.1007/s10646-010-0522-z
- 13. Lichtenthaler, H.K. (1987) Chlorophylls and Carotenoids: Pigments of Photosynthetic Membranes. Methods in Enzymology, 148, 350-382. https://doi.org/10.1016/0076-6879(87)48036-1
- 14. 李合生. 植物生理生化实验原理和技术[M]. 北京: 高等教育出版社, 2000.
- 15. 张志良. 植物生理学实验指导(第2版) [M]. 北京: 高等教育出版社, 1990: 183-184.
- 16. 门中华, 李生秀. 水培硝态氮浓度对冬小麦幼苗氮代谢的影响[J]. 广西植物, 2010, 30(4): 544-550.
- 17. 陈双, 王国祥, 许晓光, 等. 水生植物类型及生物量对污水处理厂尾水净化效果的影响[J]. 环境工程学报, 2018, 12(5): 1424-1433.
- 18. Hermans, C., Hammond, J.P., White, P.J., et al. (2006) How Do Plants Respond to Nutrient Shortage by Biomass Allocation. Trends in Plant Science, 11, 610-617. https://doi.org/10.1016/j.tplants.2006.10.007
- 19. 葛芳杰, 刘碧云, 鲁志营, 等. 不同氮、磷浓度对穗花狐尾藻生长及酚类物质含量的影响[J]. 环境科学学报, 2012, 32(2): 472-479.
- 20. Pearce, I.S.K., Woodins, S.J. and van der Wal, R. (2003) Physiological and Growth Responses of the Montane Bryophyte Racomitrium lanuginosum to Atmospheric Nitrogen Deposition. New Phytologist, 160, 145-155. https://doi.org/10.1046/j.1469-8137.2003.00875.x
- 21. 刘鹏, 俞惠娜, 张晓斌, 等. 几种水生观赏植物对城市污水的生理响应[J]. 水土保持学报, 2008, 22(41): 163-167.
- 22. 杨瑾, 王铭, 李涛, 等. 氮胁迫对雨生红球藻色素积累与抗氧化系统的影响[J]. 植物生理学报, 2011, 47(2): 147-152.
NOTES
*通讯作者。