Asian Case Reports in Veterinary Medicine
Vol.
08
No.
03
(
2019
), Article ID:
31413
,
8
pages
10.12677/ACRPVM.2019.83005
A Case Report of Decreased Hatching Rate of Eggs Caused by Co-Infection of Escherichia coli and Klebsiella
Danjun Zhang1*, Xuehuai Shen1, Qinghe Zhang2, Ruihong Zhao1, Xiaocheng Pan1, Hongyan Hou1, Xiaomiao Hu1, Congjie Rui2, Yin Dai1
1Institute of Animal and Veterinary Science, Anhui Academy of Agricultural Sciences, Hefei Anhui
2Anhui Agricultural University, Hefei Anhui
Received: Jul. 2nd, 2019; accepted: Jul. 18th, 2019; published: Jul. 25th, 2019

ABSTRACT
This paper reports a case of co-infection of Escherichia coli and Klebsiella causing decreased hatching rate of chicken eggs, including isolation and identification of bacteria, drug sensitivity test and chicken embryo lethal test. The results showed that Escherichia coli and Klebsiella were simultaneously isolated from fresh dead embryos with reduced hatching rate, and the bacterial isolation rate was significantly higher than that of dead embryos with normal hatching rate. Moreover, the isolation rates of Escherichia coli and Klebsiella were significantly higher in anal swabs from breeder with reduced hatching rate than the normal. Based on the results, the decreased hatching rate of chicken eggs was diagnosed with co-infection of Escherichia coli and Klebsiella in breeder. After treatment with the sensitive antibiotics to these two kinds of bacteria determinated by susceptibility testing, and embryo hatching rate gradually returns to normal level. The chicken embryo lethality test showed that chicken embryos co-infected with Escherichia coli and Klebsiella simultaneously died faster and had higher mortality rates than those of the infection alone of two kinds of bacteria.
Keywords:Escherichia coli, Klebsiella, Hatching Rate, Drug Sensitivity Test, Chicken Embryo Lethality
一例大肠杆菌和克雷伯氏菌共感染造成种蛋 孵化率降低的病例报告
张丹俊1*,沈学怀1,张庆贺2,赵瑞宏1,潘孝成1,侯宏艳1,胡晓苗1,芮聪杰2,戴银1
1安徽省农业科学院畜牧兽医研究所,安徽 合肥
2安徽农业大学,安徽 合肥
收稿日期:2019年7月2日;录用日期:2019年7月18日;发布日期:2019年7月25日

摘 要
本文报告了一例大肠杆菌和克雷伯氏菌共感染导致鸡群种蛋孵化率降低的病例,内容包括细菌的分离鉴定、药敏试验和鸡胚致死率试验。结果显示,出现种蛋孵化率降低的种蛋死胚中同时分离到大肠杆菌和克雷伯氏菌,两种细菌分离率明显高于正常孵化率的种蛋死胚,且种蛋孵化率降低的种鸡肛拭子中大肠杆菌和克雷伯氏菌的分离率也明显高于孵化率正常的种鸡,据此确诊为种鸡大肠杆菌和克雷伯氏菌共感染造成的鸡胚孵化率降低。通过药敏试验筛选对上述两种细菌均敏感的药物进行治疗后种蛋孵化率逐渐得以恢复;采用鸡胚致死率试验发现大肠杆菌和克雷伯氏菌共感染较两种菌单独感染引起的鸡胚死亡速度更快、死亡率更高。
关键词 :大肠杆菌,克雷伯氏菌,孵化率,药敏试验,鸡胚致死率

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
大肠杆菌属于革兰氏阴性小杆菌,广泛存在于自然环境中,同时也是条件性致病菌,在卫生条件差、饲养管理不良的情况下,很容易造成鸡大肠杆菌病的发生 [1] 。克雷伯氏菌是一种人兽共患的具有明显荚膜的革兰氏阴性杆菌,早在1893年首先从患大叶性肺炎病人的肺组织中分离。该菌在自然界中广泛分布,可引起鸡的眼炎、腹泻、败血症等 [2] ,可通过污染的食品经口感染引起人的腹泻、肺炎等 [3] [4] 。长期以来,由于大肠杆菌和克雷伯氏菌都属于条件性致病菌,对鸡群的危害并未引起足够的重视。2018年10月中旬在安徽省某种鸡孵化场孵化的817鸡苗种蛋孵化率连续多批出现明显下降,死胚增多,经确诊为鸡胚大肠杆菌和克雷伯氏菌共感染引起,现将病例报告如下。
2. 发病情况
2018年10月中旬,安徽省某种鸡孵化场孵化的817鸡苗种蛋孵化率连续多批出现明显下降,死胚增多,下降幅度达到20%左右,并且主要是第3栋鸡舍的种鸡所产种蛋,第1栋和第4栋种鸡所产种蛋孵化率未见异常。该场共饲养海兰产蛋鸡(作为繁育817鸡苗的种鸡) 2.7万羽,分养于第1栋、第3栋和第4栋3栋鸡舍内,鸡群日龄相同,所喂饲料相同,近期均没有更换饲料或使用其他药物。现场查看:3栋鸡舍的种鸡精神、食欲均正常,蛋壳颜色、性状及产蛋率和死淘率也未见明显变化,初步排除因病毒性传染病和饲料、药物因素所致的种蛋孵化率降低,疑似种蛋受到细菌污染,于是开展了下列样本的细菌分离与检测鉴定工作。
3. 样本采集
采集孵化率下降鸡舍(第3栋)和孵化率正常鸡舍(第1栋和第4栋)新鲜鸡蛋各10枚,以及孵化率下降鸡舍所产种蛋和孵化率正常鸡舍所产种蛋孵化至15日龄的正常鸡胚和新鲜死亡鸡胚各10枚,同时每栋分别采集种鸡肛拭子20份。
4. 试剂与材料
营养肉汤;血琼脂平板;普通营养琼脂平板;伊红美兰琼脂;2*PCRMIX试剂盒;SPF鸡胚40枚。
5. 试验方法
5.1. 细菌分离
分别取新鲜鸡蛋内容物、15胚龄正常鸡胚和新鲜死胚的胚体无菌条件下接种于营养肉汤培养基中,37℃,100 r/min振荡培养12 h后转接与普通营养琼脂培养基和血琼脂培养基,观察细菌生长情况,并对培养获得的不同形态的细菌进行纯培养和鉴定;将采集的种鸡肛拭子棉头浸入1 mL营养肉汤培养基,充分混悬后,划线接种于伊红美兰琼脂和血琼脂平板。
5.2. 细菌鉴定
对分离到的不同形态细菌进行16s基因的检测,确定细菌的种属,16s扩增引物为27F:5'-AGAGTTTGATCCTGGCTCAG-3';1942R: 5'-TACGGCTACCTT GTT ACGACTT-3',扩增反应条件为94˚C 5 min;94˚C 30 s,54˚C 30 s,72˚C 90 s,35个循环;72˚C延伸10 min。PCR产物送上海生工生物工程有限公司测序,获得测序序列后经Genbank数据库比对确定细菌种属。
5.3. 药敏试验
对分离菌株进行氨苄西林、氟苯尼考、头孢噻肟、多西环素、左氧氟沙星、复方新诺明、阿米卡星、庆大霉素、链霉素、阿奇霉素、环丙沙星、头孢曲松、大(壮)观霉素等药物的敏感性试验,按WHO提供的Kirby-Bauer纸片扩散方法操作,以抑菌圈的大小作为评定敏感度高低的依据,结果按照药敏纸片说明书进行判定。
5.4. 鸡胚致死率试验
将11日龄SPF鸡胚40枚,分为大肠杆菌接种组(D组)、克雷伯氏菌接种组(K组)、大肠杆菌和克雷伯氏菌共接种组(D + K组)和对照组,每组10枚鸡胚。D组接种2 × 102 cfu/枚大肠杆菌,K组接种2 × 102 cfu/枚克雷伯氏菌,D + K组分别接种1 × 102 cfu/枚的大肠杆菌和克雷伯氏菌,对照组接种无菌生理盐水。各组鸡胚攻毒后继续孵化,连续观察并记录鸡胚致死情况。
6. 结果
6.1. 细菌的分离与鉴定
新鲜鸡蛋和正常鸡胚内容物接种后均未分离到细菌;各组新鲜死胚接种于普通营养琼脂培养基和血琼脂培养基培养24 h后出现四种不同形态的细菌菌落,分别标记为1~4号菌落,细菌生长形态如表1所示。对4种菌落进行纯培养后进行16s rRNA的PCR扩增,扩增结果如图1所示,对扩增产物进行基因序列比对后发现,1~4号菌落分别为大肠杆菌、克雷伯氏菌、阴沟肠杆菌和铜绿假单胞菌。对死胚中四种细菌分离的统计结果如表2所示,在出现孵化率降低的第3栋种蛋死胚中营养琼脂培养基细菌分离率为100% (10/10),其中大肠杆菌为80% (8/10)、克雷伯氏菌为70% (7/10)、阴沟肠杆菌为10% (1/10)和铜绿假单胞菌为10% (1/10);在孵化率正常的第1栋种蛋死胚中细菌分离率为40%,其中大肠杆菌为40% (4/10)、铜绿假单胞菌为10% (1/10);在孵化率正常的第4栋种蛋死胚中细菌分离率为50%,其中克雷伯氏菌为40% (4/10)、铜绿假单胞菌为10% (1/10)。结果显示出现孵化率降低的第3栋鸡舍孵化种蛋死胚中细菌的分离率显著高于正常孵化率的鸡舍,并且大肠杆菌和克雷伯氏菌共感染的比例较高,在孵化率正常的第1栋种蛋死胚中大肠杆菌为致病菌,在孵化率正常的第4栋种蛋死胚中克雷伯氏菌为致病菌,阴沟肠杆菌和铜绿假单胞菌在各鸡舍的死胚中均能分离到,并且比例较低,因此排除两者引起鸡胚大幅度死亡的可能性。结果提示,大肠杆菌和克雷伯氏菌共感染是第3栋鸡舍种蛋孵化率降低的主要原因。
对各栋采集的种鸡肛拭子进行大肠杆菌和克雷伯氏菌的分离培养与鉴定。结果如图2所示,出现孵化率降低的第3栋种鸡肛拭子样品中大肠杆菌分离率为100%,第1栋和第4栋分别为85%和40%;克雷伯氏菌分离结果为第3栋90%,第1栋和第4栋分别为0%和20%。孵化率降低的第3栋种鸡肛拭子中大肠杆菌和克雷伯氏菌的分离率均高于孵化率正常栋舍的种鸡肛拭子,其检测结果与死胚检测结果基本一致,提示鸡胚中大肠杆菌和克雷伯氏菌的感染与种鸡的隐形感染存在直接的关系。
Table 1. Culture characteristics and 16srRNA identification results of isolated bacterial from fresh dead embryos
表1. 新鲜死胚中分离细菌的培养特性和16srRNA鉴定结果
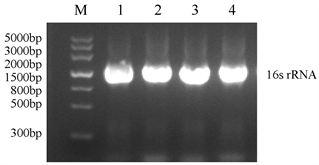
Figure 1. Bacterial 16S gene amplification
图1. 细菌16s基因扩增
Table 2. Isolation and identification of bacteria in fresh dead embryos
表2. 新鲜死胚中细菌分离和鉴定情况
注:表格中“D”代表大肠杆菌;“K”代表克雷伯氏菌;“T”代表铜绿假单胞菌;“Y”代表阴沟肠杆菌;“W”代表无菌。
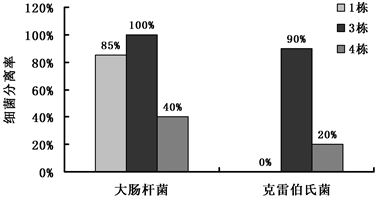
Figure 2. Segregation rate of Escherichia coli and Klebsiella from anal swabs of breeders
图2. 种鸡肛拭子中大肠杆菌和克雷伯氏菌分离率
6.2. 药敏试验与治疗
对分离到的大肠杆菌和克雷伯氏菌进行药物敏感性试验,结果如表3所示,所分离大肠杆菌对头孢噻肟、左氧氟沙星、阿米卡星和环丙沙星中度敏感,对其他药敏用抗生素不敏感;所分离克雷伯氏菌对阿米卡星高度敏感,对氟苯尼考、头孢噻肟、复方新诺明、庆大霉素、链霉素、环丙沙星和大(壮)观霉素中度敏感,对氨苄西林、多西环素、左氧氟沙星、阿奇霉素和头孢曲松等耐药。根据药敏试验结果,选择头孢噻肟和环丙沙星按照说明书用量,分别给孵化率下降的第3栋鸡舍种鸡进行饮水和拌料给药,连用5天,间隔3天后,再加强治疗3天;并且用药前对储水塔和水线进行一次彻底的清洗消毒,用药期间每天用百毒杀按说明书浓度稀释后对鸡舍带鸡消毒一次,观察用药5天后收集入孵种蛋的孵化率变化情况,结果显示用药后的种蛋孵化率逐渐升高,死胚率明显下降,治疗一周后收集的种蛋孵化率已基本恢复到正常水平(见图3)。
Table 3. Results of drug susceptibility test for Escherichia coli and Klebsiella
表3. 大肠杆菌和克雷伯氏菌的药敏试验结果

Figure 3. Changes in hatchability
图3. 孵化率变化
6.3. 鸡胚致死率试验
各组鸡胚接种细菌后继续孵化,连续观察鸡胚存活情况,结果如图4所示,D组单独接种大肠杆菌的鸡胚接种7天后仍有50%存活,K组单独接种克雷伯氏菌在接种后的7天有70%存活,D + K组鸡胚则在接种后较快死亡,在接种后的第4天全部死亡,对照组鸡胚无死亡。结果表明,大肠杆菌和克雷伯氏菌混合感染较单独感染大肠杆菌和克雷伯氏菌对鸡胚的致死速度更快、致死率更高。
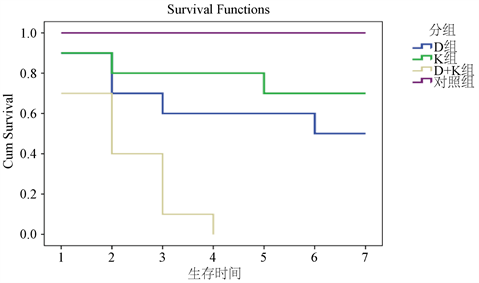
Figure 4. Chicken embryo survival-time curve
图4. 鸡胚存活与时间变化曲线
7. 分析与讨论
鸡大肠杆菌病是鸡群易发和常发的细菌性疫病,可造成鸡的多种大肠杆菌病,包括大肠杆菌性腹膜炎、输卵管炎、脐炎、滑膜炎、气囊炎、肉芽肿、眼炎等,给养鸡业造成了巨大的危害 [5] [6] 。种鸡场发生大肠杆菌感染时,直接影响到种蛋孵化率、出雏率,造成孵化过程中死胚和毛蛋增多,健雏率低 [7] 。克雷伯氏菌属于人兽共患病原菌,在分类学上属肠杆菌科克雷伯氏菌属,可引起人的支气管炎、肺炎和创伤感染,甚至败血症、脑膜炎、腹膜炎 [8] 。国外多篇报道关注于鸡肉产品中污染克雷伯氏菌给食品安全带来的风险 [9] [10] 。国内最早在1987年报告了4周龄小鸡发生眼炎型鸡克雷伯氏菌病的感染 [11] 。金天明在2005年报道了雏鸡感染克雷伯氏菌的病例 [12] ,胡晓苗等在2017年报道在发病的鸡群中分离到克雷伯氏菌 [13] 。鸡感染克雷伯氏菌引起发病的案例近年来虽然报道不多,但随着兽用抗生素使用的减量或禁用,鸡克雷伯氏菌的感染可能会有增加的趋势。本病例通过对不同鸡舍所产种蛋在孵化过程中产生的新鲜死胚中的细菌进行分离与鉴定,并进一步结合种鸡肛拭子大肠杆菌和克雷伯氏菌分离结果,最后确诊大肠杆菌和克雷伯氏菌共感染是造成鸡胚孵化率大幅下降、死胚率显著增高的主要原因。目前国内尚未见有关于鸡大肠杆菌和克雷伯氏菌共感染造成鸡胚孵化率降低的病例报道,本案例中出现孵化率降低的产蛋种鸡群未见明显发病症状和死淘增高现象,综合分析认为;上述两种细菌的共感染可能对健康成年鸡不引起发病,但可通过隐性感染的种鸡污染种蛋,至于新鲜鸡蛋和正常鸡胚没有分离到细菌,可能与采集样本的数量较少有关,也可能与细菌只污染于蛋壳表面有关。
大肠杆菌和克雷伯氏菌都易产生耐药性 [14] [15] [16] ,在抗生素的选择使用方面应结合药敏试验,减少由于用药不对症引起的损失。本病例中分离到的大肠杆菌和克雷伯氏菌通过药敏试验检测均表现出多重耐药性,根据检测结果选择对大肠杆菌和克雷伯氏菌都敏感的头孢噻肟和环丙沙星进行联合用药,结果在用药5天后种蛋的孵化率逐渐恢复到正常水平。
鸡胚致死率试验可用于评价细菌的毒力,李筱筱等 [17] 报道大肠杆菌菌数在100~1000 CFU范围内,菌数与其致病力间相关性不显著,鸡胚死亡率表现为菌株毒力的影响。樊琛等 [18] 探讨了鸡胚致死率在检验鸡大肠埃希菌致病力方面的应用潜力,结果表明雏鸡致死率与鸡胚致死率是显著相关的,表明鸡胚致死试验可反映出大肠埃希菌的毒力强弱。本研究采用鸡胚致死率试验检测大肠杆菌和克雷伯氏菌单独感染以及共感染的鸡胚致死情况,结果显示,大肠杆菌和克雷伯氏菌混合感染较单独感染大肠杆菌和克雷伯氏菌对鸡胚的致死速度更快、致死率更高。这一结果提示两种细菌的共同感染可能存在某种协同作用,其具体机制有待进一步研究。
8. 结论
1. 通过流行病学调查、临床症状观察和采集样本的细菌分离鉴定、鸡胚致死率试验、药物敏感性试验及敏感性药物治疗等结果,初步确诊引起本次种蛋孵化率显著下降的主要病因是大肠杆菌和克雷伯氏菌共感染所致。
2. 大肠杆菌和克雷伯氏菌单独感染鸡胚均可造成一定程度的鸡胚死亡,但两者混合感染较单独感染对鸡胚的致死速度更快、致死率更高。
文章引用
张丹俊,沈学怀,张庆贺,赵瑞宏,潘孝成,侯宏艳,胡晓苗,芮聪杰,戴 银. 一例大肠杆菌和克雷伯氏菌共感染造成种蛋孵化率降低的病例报告
A Case Report of Decreased Hatching Rate of Eggs Caused by Co-Infection of Escherichia coli and Klebsiella[J]. 亚洲兽医病例研究, 2019, 08(03): 31-38. https://doi.org/10.12677/ACRPVM.2019.83005
参考文献
- 1. 刘博. 鸡大肠杆菌病诊断与防治[J]. 畜牧兽医科技信息, 2019(1): 132-133.
- 2. 黄印尧, 万三元, 孔繁德, 陈信忠, 林炳玲, 蔡泽华. 鸡克雷伯氏菌病研究[J]. 福建畜牧兽医, 1996(4): 3-5.
- 3. Liu, P., Li, X., Luo, M., Xu, X., Su, K., Chen, S., Qing, Y., Li, Y. and Qiu, J. (2018) Risk Factors for Carbapenem-Resistant Klebsiella pneumoniae Infection: A Meta-Analysis. Microbial Drug Resistance, 24, 190-198. https://doi.org/10.1089/mdr.2017.0061
- 4. Gorrie, C.L., Mirceta, M., Wick, R.R., Edwards, D.J., Thomson, N.R., Strugnell, R.A., Pratt, N.F., Garlick, J.S., Watson, K.M., Pilcher, D.V., McGloughlin, S.A., Spelman, D.W., Jenney, A.W.J. and Holt, K.E. (2017) Gastrointestinal Carriage Is a Major Reservoir of Klebsiella pneumoniae Infection in Intensive Care Patients. Clinical Infectious Diseases, 65, 208-215. https://doi.org/10.1093/cid/cix270
- 5. 豆龙龙. 鸡大肠杆菌病诊断与防治[J]. 畜牧兽医科学(电子版), 2019(3): 125-126.
- 6. Oikarainen, P.E., Pohjola, L.K., Pietola, E.S. and Heikinheimo, A. (2019) Direct Vertical Transmission of ESBL/pAmpC-Producing Escherichia coli Limited in Poultry Production Pyramid. Veterinary Microbiology, 231, 100-106. https://doi.org/10.1016/j.vetmic.2019.03.001
- 7. 王绍锋. 鸡大肠杆菌病的诊治[J]. 吉林畜牧兽医, 2019, 40(4): 29-31.
- 8. Bengoechea, J.A. and Sa Pessoa, J. (2019) Klebsiella pneumoniae Infection Biology: Living to Counteract Host Defences. FEMS Microbiology Reviews, 43, 123-144. https://doi.org/10.1093/femsre/fuy043
- 9. Projahn, M., von Tippelskirch, P., Semmler, T., Guenther, S., Alter, T. and Roesler, U. (2019) Contamination of Chicken Meat with Extended-Spectrum Beta-Lactamase Producing-Klebsiella pneumoniae and Escherichia coli during Scalding and Defeathering of Broiler Carcasses. Food Microbiology, 77, 185-191. https://doi.org/10.1016/j.fm.2018.09.010
- 10. Eibach, D., Dekker, D., Gyau Boahen, K., Wiafe Akenten, C., Sarpong, N., Belmar Campos, C., Berneking, L., Aepfelbacher, M., Krumkamp, R., Owusu-Dabo, E. and May, J. (2018) Extended-Spectrum Be-ta-Lactamase-Producing Escherichia coli and Klebsiella pneumoniae in Local and Imported Poultry Meat in Ghana. Veterinary Micro-biology, 217, 7-12. https://doi.org/10.1016/j.vetmic.2018.02.023
- 11. 黄印尧, 陈信忠, 林炳玲, 蔡泽华. 幼雏克雷伯氏菌病研究[J]. 福建畜牧兽医, 1995(3): 4-6.
- 12. 金天明. 雏鸡克雷伯氏菌病的诊断及其氢氧化铝灭活疫苗的安全性检测[J]. 畜牧与兽医, 2005, 37(2): 38-39.
- 13. 胡晓苗, 张丹俊, 戴银, 赵瑞宏, 潘孝成, 周学利, 侯宏艳, 沈学怀, 朱传明. 鸡疑似克雷伯氏杆菌病的诊断与药敏试验[J]. 安徽农业科学, 2017, 45(34): 92-94.
- 14. 刘兰平, 朱才箭, 郭文, 陈超, 赖茂生. 健康食源性动物大肠杆菌的耐药性分析[J]. 江西畜牧兽医杂志, 2019(2): 33-34.
- 15. Wyres, K.L. and Holt, K.E. (2018) Klebsiella Pneumoniae as a Key Trafficker of Drug Resistance Genes from Environmental to Clinically Important Bacteria. Current Opinion in Microbiology, 45, 131-139. https://doi.org/10.1016/j.mib.2018.04.004
- 16. Sanchez, G.V., Master, R.N., Clark, R.B., Fyyaz, M., Duvvuri, P., Ekta, G. and Bordon, J. (2013) Klebsiella pneumoniae Antimicrobial Drug Resistance, United States, 1998-2010. Emerging Infectious Diseases, 19, 133-136. https://doi.org/10.3201/eid1901.120310
- 17. 李筱筱, 高霞, 康燕青, 张皎皎, 樊琛, 郑焕芹. 细菌毒力与细菌数量对鸡胚致死率的影响[J]. 湖北农业科学, 2016, 55(7): 1755-1757.
- 18. 樊琛, 刘桂芹, 李丹丹, 王亚君, 李一经. 鸡胚致死率作为检验鸡大肠埃希菌致病力指标的探讨[J]. 动物医学进展, 2010, 31(6): 121-124.
NOTES
*通讯作者。
