Hans Journal of Soil Science
Vol.06 No.03(2018), Article ID:25932,8
pages
10.12677/HJSS.2018.63008
Method and Effects of 13CO2 Pulsed Labelling Plant
Lili Huo1, Yi An1*, Yuanchun Zou2,3
1Agro-Environmental Protection Institute of Ministry of Agriculture, Tianjin
2Key Laboratory of Wetland Ecology and Environment, Northeast Institute of Geography and Agricultural Ecology, Chinese Academy of Sciences, Changchun Jilin
3Joint Key Laboratory of Changbai Mountain Wetland and Ecology, Jilin Province, Changchun Jilin

Received: Jun. 20th, 2018; accepted: Jun. 25th, 2018; published: Jul. 17th, 2018

ABSTRACT
The 13CO2 pulse labeling method was used to label the wetland plants and soybeans grown in wetland and soybean field, the soybean field was reclaimed from wetland. The results showed that the δ13C values of wetland plants and soybeans increased from −16.43‰ and −28.33‰ to 1185.62‰ and 1311.82‰ respectively, after four labels. Atom%13C was 1.198 times and 1.34 times higher than unlabeled wetland plants and soybeans, respectively. And Atom%13C in roots, stems, and leaves of wetland plants increased by 1.03, 1.78, and 0.91 times compared with unlabeled, Atom%13C in soybeans roots, stems, and leaves increased by 1.20, 2.19, and 2.99 times compared to unlabeled; soybeans have better labeling effect than wetland plants. Wetland plants and soybeans Atom%13C showed a trend that the aboveground-part was higher than the underground-part, and the soybeans were more pronounced. With the increase of labeling times (growth period), the roots Atom%13C of wetland plants first increased and then decreased, stems gradually increased and the leaves first decreased and then increased. Soybeans roots and stems Atom%13C also increased first and then decreased, leaves gradually increased. 13C situation in every organs of the same plants in different growth periods is different. The 13CO2 pulse labeling method is effective for the labeling of wetland plants and soybeans. It is simple, practical, and reliable. Under the same labeling methods and labeling conditions, labeling effects are different for different plants, the labeling effects for different organs in same plants are different, the labeling effects of the same organs in the same species of plants are also different with different labeling time. According to this study, the quantity of raw material (13CO2) dosage, labeling time and labeling frequency can be adjusted to achieve the labelling purpose.
Keywords:13C Labeling, Wetland, Soybean, 13C
13CO2脉冲标记植物的方法及效果研究
霍莉莉1,安毅1*,邹元春2,3
1农业部环境保护科研监测所,天津
2中国科学院东北地理与农业生态研究所,吉林 长春
3长白山湿地与生态吉林省联合重点实验室,吉林 长春

收稿日期:2018年6月20日;录用日期:2018年6月25日;发布日期:2018年7月17日

摘 要
为了探讨植物13C标记的方法及其效果,采用13CO2脉冲标记法对湿地植物及由其垦殖而来的旱田主栽作物大豆进行了标记。结果显示:经过四次标记,湿地植物和大豆植株δ13C值分别从−16.43‰和−28.33‰增加到1185.62‰和1311.82‰;Atom%13C分别比未标记的湿地植物和大豆植株高1.198倍和1.34倍,湿地植物根、茎和叶的Atom%13C比未标记增加了1.03、1.78和0.91倍,大豆根、茎和叶的Atom%13C比未标记增加了1.20、2.19和2.99倍,大豆较湿地植物标记效果更好。湿地植物和大豆Atom%13C呈现地上部分高于地下部分的趋势,大豆更明显。随标记次数(生育期)增加,湿地植物根Atom%13C先增加后降低,茎逐渐增加,叶先降低后增加;大豆根和茎Atom%13C也是先增加后降低,叶逐渐增加,同种植物各器官在不同生育期13C情况不同。13CO2脉冲标记法标记湿地植物和大豆效果良好,简单易行,实用可靠。同种标记方法和标记条件下,不同植物标记效果有差异,同类植物不同器官标记效果不同,同类植物相同器官不同标记时间的标记效果亦有不同,据此可根据需求调整标记原材料用量、标记时间和标记频率等,达到标记目的。
关键词 :13C标记,湿地,大豆,13C丰度

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
20世纪80年代以来稳定碳同位素技术从同位素分子的相对反应速度、同位素分馏机理等理论研究转向解决生态系统具体问题,成为研究生态系统碳循环最科学有效的方法之一 [1] [2] [3]。利用稳定性碳同位素技术可以用来区分碳源,研究土壤有机碳及其组分的分解程度和周转速率,示踪碳的迁移转化过程等,近年来稳定性碳同位素在生态系统碳循环研究中得到了广泛应用,对于认识碳的转化途径和地球化学循环具有重要意义 [4] [5] [6]。自然界中12C和13C的相对丰度分别为98.89%和1.11%,14C只有极微量且具有放射性。13C与12C的性质差异比14C与12C要小,13C无放射性对人体不具危害性且具有标记均匀、可长期标记等优点,因而近年来研究者们更倾向于把13C被作为示踪物 [7] [8]。13C示踪法研究大气–植物–土壤中碳的同位素变化规律,能够真实的反映土壤有机碳的累积及分解转化过程。
生态系统碳的迁移转化规律研究过程中往往用到13C标记的实验材料,比如不同植物残体类型对土壤有机碳积累的影响、土壤有机碳库对外源有机物料输入的响应、土壤有机碳组分来源、有机物质进入土壤后的分解转化规律等等问题的研究利用13C同位素标记技术将更加直接、快捷和高效。实际的科学研究工作中,13C标记的实验材料需求也是各式各样,有些能从市场直接购买,有些须得自己人工标记获得。13C脉冲标记的植物材料已在土壤碳循环研究中广泛应用,标记材料主要涉及三大主粮水稻、玉米、小麦 [5] [6] [7] [9] [10] [11] [12] ,其他生态系统植物研究较少。湿地生态系统碳循环是全球碳循环的重要环节,我国东北三江平原地区是我国湿地重要分布区之一,该地区湿地农田化现象严重 [13] [14] ,土地利用方式变化剧烈,研究垦殖对湿地碳循环的影响对于明确我国东北地区碳源汇状况非常重要。本研究探索了13CO2气体脉冲标记湿地植物及湿地垦殖为旱田后主栽作物大豆的技术方法和效果,为深入研究湿地垦殖前后土壤有机碳来源及有机碳组分周转提供材料与科学方法。
2. 材料与方法
2.1. 盆栽试验
2016年6月采集中国科学院兴凯湖湿地生态试验站(132˚20'00E,45˚21'55N)附近的沼泽湿地及相邻的由其垦殖而来的大豆田0~30 cm土层土壤,土壤取回后掰成小块装入50 cm × 40 cm × 30 cm塑料箱,湿地土壤和大豆田土壤各装4箱(各2箱用来标记,剩下的作为对照不标记),剪除湿地土壤表层植物(狭叶甜茅群落,主要是狭叶甜茅,零星几株稗草)待其重新萌发,大豆土壤种植大豆(大豆品种为垦农22号,株距5 cm × 4 cm)。为保证13C标记试验开始时湿地植物和大豆苗长势大致相当,湿地植物萌发出苗后播种大豆,播种日期为2016年7月23日。定期浇水,湿地土壤保持淹水5 cm,大豆土壤保持适宜墒情,二者均未施肥。
2.2. 13CO2气体脉冲标记
本标记装置包括有机玻璃罩和可移动底座,有机玻璃罩长宽高均为1.2 m,呈方形,可移动底座下部有四个轮子方便移动,上表面四周制有围合成方形的橡胶密封槽,槽内可嵌装有机玻璃罩下底边,实现有机玻璃罩内部空间密封。有机玻璃罩顶端内壁镶嵌两个小型风扇,以便混匀通入玻璃罩内的气体,一侧上部有一小孔用于通入13CO2气体。
大豆出苗15天后,湿地植物和大豆盆栽共同放在13C标记装置内同时开始标记。标记试验在密闭的标记装置中进行,每次标记通入购买的丰度99%,纯度99.999%的13CO2气体5升。标记时间为上午8点到12点之间,标记时为防止温度过高,在装置底座放置冰块,使玻璃罩内温度保持在28℃~38℃之间,并在玻璃罩内设置温度计监控温度变化。
标记实验共进行4次,每隔10天进行一次,每次标记步骤为:将湿地植物和大豆盆栽放置在标记装置底座上,底座上放置适量冰块,底座中央设置温度计。扣上玻璃罩,使空间密封,打开玻璃罩顶端内壁的风扇,20分钟后通过玻璃罩侧面开的小孔通入13CO2气体2.5升,待植物光合作用进行一个小时后再次通入13CO2气体2.5升,光合作用再进行一个小时后,通入12CO2气体(NaH12CO3和HCl反应获得) 5升,以使标记效果更好 [7]。标记试验结束后,取下玻璃罩。
2.3. 样品采集与分析
从第二次标记实验开始,在每次标记后的第9天随机采集标记的和未标记的湿地植物和大豆植株各5株,洗净后将根、茎、叶分开,60℃烘干后粉碎过100目筛备用。第4次标记后的第9天收获成熟的植物残体(因试验开始日期靠后,此时植物体已成熟),洗净,部分将根、茎、叶分开,剩下植物体保持整株状态,60℃烘干后粉碎过100目筛备用。采用DELTA V Advantage稳定同位素质谱仪测定其δ13C值,标准样品为PDB国际通用标准(Pee Dee Belelmnite标准)。
2.4. 数据计算与处理
一般情况下,自然的土壤或植物(未标记)的自然丰度用δ13C值来表示,计算公式为δ13C(‰) = (R样品/RPDB − 1) × 1000,其中R样品 = 13C样品/12C样品,RPDB = 13CPDB/12CPDB,RPDB = 0.0112372 (标准物中碳元素重轻同位素丰度之比)。
标记的植物一般采用Atom(%)来表示,Atom(%)和δ13C(‰)转换公式为Atom%13C = [(δ13C + 1000) × RPDB]/[(δ13C + 1000) × RPDB + 1000] × 100 [7]。
采用Origin8.6制图。
3. 结果与分析
3.1. 标记前后湿地植物各器官13C丰度
由图1可知,整个标记试验期内未标记的湿地植物根、茎、叶的Atom%13C范围分别是1.091~1.097,1.092~1.096和1.091~1.092,差异不大;随生长时间根和叶的Atom%13C先降低后升高,茎的Atom%13C逐渐降低。随标记次数增加(生长时间增加),湿地植物根Atom%13C先增加后降低,茎和叶Atom%13C逐渐增加。第二次标记后湿地植物根、茎和叶的Atom%13C比未标记的增加了0.39、1.02和0.86倍,第三次标记后根、茎和叶的Atom%13C比未标记的增加了1.76、1.18和0.52倍,第四次标记后根、茎和叶的Atom%13C比未标记的增加了1.03、1.78和0.91倍。
3.2. 标记前后大豆各器官13C丰度
如图2所示,整个标记试验期内未标记的大豆根、茎、叶的Atom%13C范围分别是1.073244~1.0772,1.074533~1.076012和1.074561~1.079657。随生长时间大豆根和茎的Atom%13C逐渐降低,叶的Atom%13C先降低后升高。随标记次数增加(生长时间增加),大豆的根和茎的Atom%13C先增加后降低,叶Atom%13C逐渐增加。第二次标记后,大豆根、茎和叶的Atom%13C比未标记的增加了1.11、2.02和1.67倍,第三次标记后根、茎和叶的Atom%13C比未标记的增加了1.65、2.38和2.16倍,第四次标记后根、茎和叶的Atom%13C比未标记的增加了1.20、2.19和2.99倍。
3.3. 湿地植物和大豆13C丰度对比
由图3(a)可见,标记后大豆根、茎和叶Atom%13C增加倍数高于湿地植物。第二次标记后大豆根、茎和叶Atom%13C增加倍数分别比湿地植物高1.87%、0.98%和0.95%;第三次标记后增加倍数分别比湿地植物高−0.06%、1.01%和3.11%;第四次标记后增加倍数分别比湿地植物高0.17%、0.23%和2.27%。
第四次标记后即生长季末成熟的标记湿地植物和大豆植株的Atom%13C分别为2.385275和2.519542,分别比未标记的湿地植物和大豆植株高1.19倍和1.34倍。大豆比湿地植物标记效果更好(图3(b))。
4. 讨论
本研究采用13CO2气体脉冲标记法对湿地植物及其垦殖为旱地后主栽作物大豆进行了四次标记。第一次标记后,植物秧苗太小(尤其是大豆秧苗,根茎透明水润,尚未木质化),烘干后干物质质量极小,因此本实验从第二次标记后取样测试。第四次标记后湿地植物和大豆植株δ13C值分别从−16.43‰和−28.33‰增加到1185.62‰和1311.82‰。第四次标记后湿地植物根、茎和叶的Atom%13C比未标记的增加了1.03、1.78和0.91倍;大豆根、茎和叶的Atom%13C比未标记增加了1.20、2.19和2.99倍。本次13C标记实验

Figure 1. 13C value of different organs of wetland plants
图1. 湿地植物不同器官13C丰度
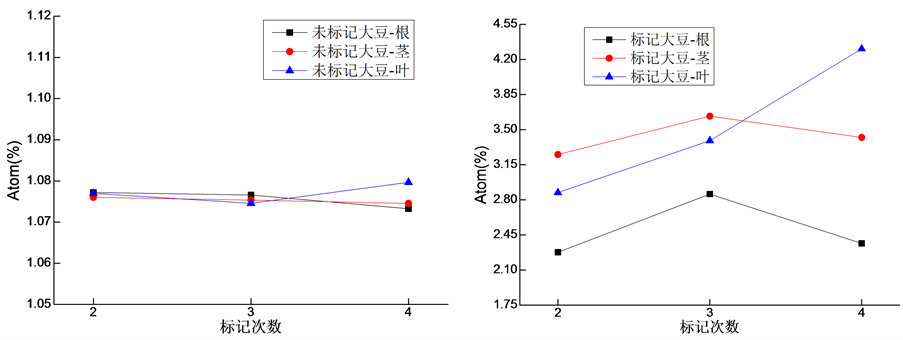
Figure 2. 13C value of different organs of soybeans
图2. 大豆不同器官13C丰度

Figure 3. 13C value of wetland plants and soybeans
图3. 湿地植物和大豆13C丰度对比
标记效果良好。相同标记方法和环境条件下,13C光合产物的积累受植物类型及其相应的物候期及生长管理方式的影响 [10] [11] [15] [16] [17] ,本实验中大豆植株标记效果相比湿地植物更加明显。
不同作物各器官光合产物分配和累积情况不同。通常情况下,植物光合固定的13C分配大小为茎叶 >根,大部分固定的碳留在地上部分,但是具体情况因植物种类而异。四次脉冲标记后水稻累积吸收的光合13C在植株和土壤中的分配比例大致相同,累积吸收的光合碳约72%在植株地上部,7.21%~7.71%分配到根系 [5] ,其他水稻相关研究也得到类似结论 [6] [18] [19]。玉米在整个生育期内分配到地上部和根部的光合碳量,分别占净吸收碳量的62.39%和17.88%,地上部分高于根部 [10]。小麦和大麦亦是如此 [9] [20] [21]。互花米草各器官13C丰度和固定13C量分配比例呈现茎 > 叶 > 根 [22]。在标记期的苜蓿光合固定的δ13C值分配情况为:茎(18%~27%) > 叶(4%~8%) > 根(1%~2%) [23] ;本研究第四次标记后(生长季末)湿地植物和大豆各器官Atom%13C排序为茎 > 根 > 叶和叶 > 茎 > 根,呈现地上部分Atom%13C高于地下部分的趋势。但与林木的标记结果不一致,杉木标记后根、枝干和叶的δ13C分别为124.080‰、106.800‰、116.737‰,δ13C增幅根 > 针叶 > 枝干 [24]。栓皮栎标记1个月后,13C的分配比例根 > 枝 >叶 [25]。影响植物各器官生物量的因子也会影响标记效果,生物量增加,会稀释13C [11]。但同时也有研究认为生物量在各器官中的分配趋势与各器官的δ13C (‰)的高低趋势一致,即分配到哪个器官的生物量大,哪个器官的δ13C (‰)更高,比如水稻和玉米茎中δ13C (‰)最高,其次是叶,根中的δ13C (‰)最低 [12] [25] [26]。本研究中生长季末湿地植物和大豆的根茎叶生物量高低趋势为茎 > (新)根 > 叶和茎 > 叶 > 根,Atom%13C为茎 > 根 > 叶和叶 > 茎 > 根,比较符合陈展等(2014)的说法。
同种作物不同生育期各器官光合产物分配和积累情况也有差异。在标记过程中,湿地植物和大豆根Atom%13C都是先升高后降低,但二者茎和叶Atom%13C变化趋势不同,湿地植物茎Atom%13C逐渐升高,而大豆茎Atom%13C先升高后降低;湿地植物叶Atom%13C先降低后升高,大豆叶Atom%13C逐渐升高。水稻标记后根系13C丰度先增加后降低,茎叶13C丰度逐渐降低 [19]。水稻早期光合碳主要运往地下部(21.7%~52.7%),灌浆期地下部分配比例大大降低(7.50%~8.90%) [5]。水稻地上部分光合13C分配率返青期 < 分蘖期 < 抽穗期,随生育期增加而增加,根部相反 [6] [18]。玉米植株标记后分配到地上部分的13C占玉米净吸收13C的百分含量在灌浆期标记时最大,达到80.01%,随着玉米的生长,分配到地下部分的碳的比例越来越少 [10] [11]。小麦13C同化物在挑旗期、开花期主要向茎秆和叶鞘分配,灌浆期则主要向籽粒分配 [9] [20] [21]。而随标记次数增加,互花米草地上部分13C分配比例逐渐降低,地下部分逐渐升高 [22]。杉木标记后各器官δ13C值随时间呈现明显上升,达到高点后有一定下降。Atom%13C大致呈现出当年生针叶最大,一年生针叶最小,根、枝干居中,当年生针叶固定和吸收的光合产物较多,且主要用于自身的生长,一年生针叶固定吸收的光合产物则较多地输送给其它器官,遵循植物个体的最优化分配原则 [24]。石元豹等(2016) [27] 通过对宁夏枸杞的13C标记研究表明对不同生长时期光合产物在不同器官之间的分配比例存在差异。速生期光合产物在茎中的增加比例最大,而生长后期则在果实和叶中的增加比例较大。
由此可见,植物光合C分配、转移主要由植物生理、遗传特性、自身生长节律以及本身生理生化过程决定,此外,还受植物生长的自然环境(如光、温、水、养分、CO2浓度等)的制约 [24] [28]。Vogel等 [29] 的研究也得出温度降低时,植物根部光合碳增加。覆膜施有机肥处理显著提高了光合固定13C数量及13C 在玉米和土壤中的分配比例,是促进13C同化与分配的主要方式 [5] [11] [24]。13C标记枸杞时CO2倍增处理90 d时δ13C值较对照增加的百分比分别为茎(65.53%) > 根(27.39%) > 叶(18.05%),120 d时为果实(145.04%) > 叶(143.56%) > 根(49.96%) > 茎(43.26%)。因此大气CO2浓度倍增,增强了枸杞的光合能力,增加了光合产物在各器官中的积累 [27]。由13C标记法获取13C标记的植物材料时,可根据需求选择植物类型,并控制外部环境条件,选择合适的标记时间和取样时间,在节约实验成本的情况下达到达到目的,获得所需实验材料。
5. 结论
13CO2脉冲标记法简单易行,标记效果良好。经过四次标记,湿地植物和大豆植株δ13C值分别从−16.43‰和−28.33‰增加到1185.62‰和1311.82‰;Atom%13C分别比未标记的湿地植物和大豆植株高1.198倍和1.34倍,湿地植物根、茎和叶的Atom%13C比未标记增加了1.03、1.78和0.91倍,大豆根、茎和叶的Atom%13C比未标记增加了1.20、2.19和2.99倍。
从湿地植物和大豆植株以及各器官Atom%13C相比未标记植株增加倍数来看,大豆标记效果相比湿地植物更明显。且二者各器官Atom%13C随标记次数(生育期)增加,变化趋势不同。二者标记效果有差异,湿地植物和大豆各器官之间标记效果也有差异,二者相同器官不同标记时间标记效果也不同,可据此结合自身研究需求调整标记原材料用量、标记时间和标记频率,以达到最佳标记目的。
基金项目
本研究得到国家自然科学基金项目(41501102, 41471079, 41601104)和中国农业科学院创新工程项目(2018-cxgc-lyj)支持。
文章引用
霍莉莉,安毅,邹元春. 13CO2脉冲标记植物的方法及效果研究
Method and Effects of 13CO2 Pulsed Labelling Plant[J]. 土壤科学, 2018, 06(03): 60-67. https://doi.org/10.12677/HJSS.2018.63008
参考文献
- 1. 袁红朝, 李春勇, 简燕, 等. 稳定同位素分析技术在农田生态系统土壤碳循环中的应用[J]. 同位素, 2014, 27(3): 170-178.
- 2. Peterson, B.J. and Fry, B. (1987) Stable Isotopes in Ecosystem Studies. Annual Review of Ecology and Systematic, 18, 293-320. https://doi.org/10.1146/annurev.es.18.110187.001453
- 3. Chapin III, F.S., Matson, P.A. and Mooney, H.A. (2011) Principles of Terrestrial Ecosystem Ecology. Springer, Berlin. https://doi.org/10.1007/978-1-4419-9504-9
- 4. 林光辉. 稳定同位素生态学[M]. 北京: 高等教育出版社, 2013.
- 5. 刘萍, 江春玉, 李忠佩. 13C脉冲标记定量研究施氮量对光合碳在水稻–土壤系统中分布的影响[J]. 土壤学报. 2015, 52(3): 567-575.
- 6. 于鹏, 张玉玲, 王春新, 等. 不同生育期光合碳在水稻–土壤系统中的分配[J]. 土壤学报, 2017, 54(5): 1218-1229.
- 7. 尹云峰, 杨玉盛, 高人, 等. 植物富集13C标记技术的初步研究[J]. 土壤科学, 2010, 47(4): 790-793.
- 8. Bromand, S., Whalen, J.K., Janzen, H.H., et al. (2001) A Pulse-Labelling Method to Generate 13C-Enriched Plant Ma-terials. Plant and Soil, 235, 253-257. https://doi.org/10.1023/A:1011922103323
- 9. 孙昭安, 陈清, 韩笑, 等. 13C脉冲标记法定量冬小麦光合碳分配及其向地下的输入[J]. 环境科学, 2018(6): 1-10. http://kns.cnki.net/kcms/detail/11.1895.X.20171229.1048.049.html
- 10. 何敏毅, 孟凡乔, 史雅娟, 等. 用13C脉冲标记法研究玉米光合碳分配及其向地下的输入[J]. 环境科学, 2008, 29(2): 446-453.
- 11. 安婷婷, 汪景宽, 李双异, 等. 用13C脉冲标记方法研究施肥与地膜覆盖对玉米光合碳分配的影响[J]. 土壤学报, 2013, 50(5): 948-955.
- 12. 陈展, 王效科, 尚鹤. 利用13C同位素示踪方法测定O3对水稻C固定和迁移的影响[J]. 生态学杂志, 2014, 33(7): 1983-1988.
- 13. 霍莉莉, 邹元春, 郭佳伟, 等. 垦殖对湿地土壤有机碳垂直分布及可溶性有机碳截留的影响[J]. 环境科学, 2013, 34(1): 283-287.
- 14. Huo, L., Zhou, Y., Yu, X., et al. (2015) Effect of Reclamation on Microbial Biomass and Activity in Peat Mire Soil around Xingkai Lake in Northeast China. Fresenius Environmental Bulletin, 24, 1098-1107.
- 15. Kuzyakov, Y. and Cheng, W. (2001) Photosynthesis Controls of Rhizosphere Respiration and Organic Matter Decomposition. Soil Biology and Biochemistry, 33, 1915-1925. https://doi.org/10.1016/S0038-0717(01)00117-1
- 16. Kuzyakov, Y., Siniakina, S.V., Ruehlmann, J., et al. (2002) Effect of Nitro-Gen Fertilization on Below-Ground Carbon Allocation in Lettuce. Journal of the Science Food and Agriculture, 82, 1432-1441. https://doi.org/10.1002/jsfa.1202
- 17. 齐鑫, 王敬国. 应用13C脉冲标记方法研究不同施氮量对冬小麦净光合碳分配及其向地下输入的影响[J]. 农业环境科学学报, 2008, 27(6): 2524-2530.
- 18. 邓扬悟, 唐纯, 袁红朝, 等. 13C脉冲标记法:不同生育期水稻光合碳在植物——土壤系统中的分配[J]. 生态学报, 2017, 37(9): 6466-6471.
- 19. 陈珊, 祝贞科, 袁红朝, 等. 拔节期水稻光合碳输入的动态变化及其对施氮的响应: 13C-CO2脉冲标记[J]. 环境科学, 2018, 39(1): 331-338.
- 20. Gregory, P.J. and Atwell, B.J. (1991) The Fate of Carbon in Pulse Labelled Crops of Barley and Wheat. Plant and Soil, 136, 205-213. https://doi.org/10.1007/BF02150051
- 21. Swinnen, J., Veen, J.A.V. and Merckx, R. (1994) 14C Pulse-Labelling of Field-Grown Spring Wheat: An Evaluation of Its Use in Rhizosphere Carbon Budget Estimation. Soil Biology & Biochemistry, 26, 161-170. https://doi.org/10.1016/0038-0717(94)90159-7
- 22. 余培培. 互花米草光合碳在植物——土壤系统中的分配研究[D]: [硕士学位论文]. 南京: 南京师范大学, 2016.
- 23. 杨世超, 邓波, 张蕴薇, 等. 中苜一号紫花苜蓿碳同化分配与转移速率的研究[J]. 草地学报, 2012, 20(4): 679-685.
- 24. 于晓燕, 池丽娟, 毛艳玲. 应用脉冲标记法对杉木富集13C技术的初步研究[J]. 核农学报, 2014, 28(8): 1473-1477.
- 25. 高唤唤, 王姣娇, 周丕生, 等. 利用13C和15N示踪碳、氮在栓皮栎幼苗各器官中的分配[J]. 上海交通大学学报(农业科学版), 2017, 35(6): 67-73.
- 26. 谢柠桧. 玉米不同部位残体碳在土壤中的分配与固定[D]: [硕士学位论文]. 沈阳: 沈阳农业大学, 2016.
- 27. 石元豹, 曹兵, 宋丽华. 用13C示踪研究CO2浓度倍增对枸杞光合产物积累的影响[J]. 农业工程学报, 2016, 32(10): 201-206.
- 28. 张林海, 曾从盛, 胡伟芳. 氮输入对植物光合固碳的影响研究进展[J]. 生态学报, 2017, 37(1): 147-155.
- 29. Vogel, J.G., Bond-Lamberty, B.P., Schuur, E.A.G., et al. (2008) Carbon Allocation in Boreal Black Spruce Forests across Regions Varying in Soil Temperature and Precipitation. Global Change Biology, 14, 1503-1516. https://doi.org/10.1111/j.1365-2486.2008.01600.x
NOTES
*通讯作者。