Hans Journal of Medicinal Chemistry
Vol.
08
No.
03
(
2020
), Article ID:
36860
,
13
pages
10.12677/HJMCe.2020.83008
Advances in Research of Dihydroartemisinin Derivative
Yang Li1*, Kangping Huang2*, Xuemei Tang1, Zechao Zhang1, Dacheng Yang1#
1School of Chemistry and Chemical Engineering, Southwest University, Chongqing
2Chongqing No. 8 Secondary School, Chongqing

Received: Jul. 13th, 2020; accepted: Jul. 28th, 2020; published: Aug. 4th, 2020

ABSTRACT
Artemisinin is a sesquiterpene compound extracted from the Chinese traditional medicinal herb Artemisia annua. Artemisinin has excellent antimalarial activity, especially potent for chloroquine-resistant falciparum malaria. Dihydroartemisinin (DHA) is the most important derivative of artemisinin, which is not only a better antimalarial drug than artemisinin, but also developed successfully the first generation drugs such as artemether and artesunate originated from it. Until now, global researchers have not only found DHA derivatives with better antimalarial activity, but also found that some derivatives have anti-tumor, anti-leishmaniasis, anti-blood schistosomiasis, anti-virus, antibacterial, anti-inflammatory, and lipid-lowering and so on. Our laboratory has also carried out researches on DHA derivatives and found many highly active molecules with new biological activities. This article collected and summarized the research advances with respect of the synthesis and biological activity of DHA derivatives at home and abroad, trying to provide clues for the future research of DHA.
Keywords:Artemisinin, Dihydroartemisinin, Dihydroartemisinin Derivatives, Synthesis, Antimalarial Activity, Multi-Active Activity

双氢青蒿素衍生物研究进展
李洋1*,黄康平2*,唐雪梅1,张泽朝1,杨大成1#
1西南大学化学化工学院,重庆
2重庆市第八中学校,重庆

收稿日期:2020年7月13日;录用日期:2020年7月28日;发布日期:2020年8月4日

摘 要
青蒿素是从中国传统药用草本植物青蒿中提取得到的倍半萜类化合物。青蒿素具有优异的抗疟活性,对耐氯喹恶性疟效果更加显著。双氢青蒿素(dihydroartemisinin, DHA)是青蒿素的最重要衍生物,不仅是比青蒿素更好的抗疟药物,而且以此出发获得了蒿甲醚、青蒿琥酯等第一代上市药物。迄今为止,全球研究人员不仅发现了抗疟活性更好的DHA衍生物,而且发现某些衍生物具有抗肿瘤、抗利什曼虫病、抗吸血虫病、抗病毒、抗菌、抗炎、降脂等生物活性。本研究室也开展了DHA衍生物的研究,发现了很多高活性分子及新的生物活性。本文收集整理了国内外关于DHA衍生物合成及生物活性的研究情况,试图为DHA的后续研究提供线索。
关键词 :青蒿素,双氢青蒿素,双氢青蒿素衍生物,合成,抗疟活性,多生物活性

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 青蒿素的发现及药用情况
青蒿是一种药用草本植物,广泛分布于中国吉林、河南、四川、云南等10余省,在朝鲜、日本及东南亚诸国也有分布。在马王堆出土的帛书《五十二病方》中便有其用于牡痔的记载,在《神农本草经》中也有其治疗“瘙痂痒恶疮”的记载。但是,作为一种抗疟用药则最早记录于东晋葛洪的《肘后备急方》中:“青蒿一握,以水二升渍,绞取法,尽服之” [1]。
疟疾,我国古时称之为瘴气,是经按蚊叮咬或输入带疟原虫者的血液而感染疟原虫所引起的虫媒传染病。其发病主要表现为周期性规律发作,全身发冷、发热、多汗,长期多次发作后,可引起贫血和脾肿大。2017年,大约有2.19亿人感染疟疾,其中大约92%发生在非洲地区,5%发生在东南亚地区,超过43万人死于疟疾,其中非洲地区占93% [2]。第一种对疟疾有效的治疗药物是奎宁(见图1),又称为金鸡纳碱,由法国化学家Pelletier于1820年从金鸡纳树树皮中分离得到,在1920年以前奎宁都是抗疟的首选药物。随后,以奎宁为基础优化合成了一系列喹啉类药物,其中以1930年代开发的氯喹(见图1)药性最好,成为了当时治疗疟疾的一线药物。1960年代,抗氯喹恶性疟疾开始出现在东南亚和我国南方部分地区并广泛流行,每年约有1000万人感染疟疾,在1970年甚至增加到3000万,各国政府开展了大量的防治工作但是收效甚微。此时正是越南抗美战争时期,耐氯喹恶性疟在美越双方流行,造成了空前的非战场减员。中国政府应越南领导人的请求,于1967年5月23日成立“五二三项目”,以全国大协作的方式展开新型抗疟药物的研发工作。青蒿素(见图1)是由屠呦呦为首的科学家于1972年11月用乙醚从青蒿中提取分离得到,其对鼠疟、猴疟的疟原虫抑制率接近100%,1973年经临床确定为青蒿中的抗疟有效成分 [3]。
青蒿素是一种白色针状结晶,分子式为C15H22O5,经林启寿教授指导分析确定其为倍半萜内酯类化合物。经X衍射分析,屠呦呦与中国科学院生物物理所于1975年11月30日确定了青蒿素的立体结构(见图1)。青蒿素是一种高度氧化的化合物,结构中包含串联的过氧基团、缩酮、缩醛和内酯基团,因此它对酸和碱都比较敏感,但因其特有的环状结构,青蒿素比一般的过氧化合物具有较高的热稳定性,即便是在156℃~157℃熔解时也未观察到明显的分解现象 [1] [4]。

Figure 1. Chemical structures of three antimalarial drugs
图1. 三种抗疟药物的化学结构
青蒿素主要作用于疟原虫的膜系结构,疟原虫在红细胞中通过胞吞作用吞入血红蛋白后会对其进行分解并释放出自身所用的氨基酸和血红素,游离的血红素则会激活青蒿素,从而阻断疟原虫摄取血红蛋白,使得疟原虫无法分解血红蛋白获得足够的氨基酸导致氨基酸饥饿,最终出现自噬泡从而死亡 [5] [6]。研究表明,青蒿素与氯喹的作用方式及作用机制完全不同 [7],青蒿素对耐氯喹恶性疟的治疗有突出的疗效更说明了这一特点。在随后的临床研究中,全国协作验证2099例,除4例有效外全部得以治愈,平均退热时间和转阴时间均明显快于氯喹,确认了青蒿素具有“高效、速效、低毒”的特点,可以有效治疗抗氯喹恶性疟 [1]。1986年,中国中医研究院中药研究所获得青蒿素一类新药证书(栓剂和片剂),青蒿素成为继氯喹后又一疟疾新药。但是,青蒿素水溶性比较低,对抢救危重患者造成了困难;用药剂量大,青蒿素片服用总剂量为4 g/5days;复燃率较高,治疗恶性疟复燃率45.8%,复燃天数为(18.6 ± 4.6)天,治疗间日疟复燃率34.8%,平均复燃天数17.0天 [4]。因此如何在保证青蒿素治疗效果的同时去克服它的缺点成为了青蒿素研究的下一个目标。
2. 第一代青蒿素抗疟药
青蒿素分子独有的结构,使其具有非常好的发展前景,但是青蒿素分子本身不具备直接修饰的位点。大量研究表明,青蒿素的骨架结构是它具有高效抗疟活性的保证,骨架结构的改变导致抗疟活性降低或消失,这就更加限制了青蒿素的发展。直至1973年,中国科学家以硼氢化钾还原青蒿素制得青蒿素的还原产物–双氢青蒿素(见图2,dihydroartemisinin,DHA)。研究表明,DHA的抗疟活性明显高于青蒿素,更为重要的是引入了可修饰的反应位点羟基,因而打开了新型青蒿素衍生物的研究大门。
1976年2月,523办公室下达了青蒿素结构改造的任务。各研究小组从DHA出发,合成了大量的DHA衍生物,最终发现抗鼠疟药效是青蒿素6倍的蒿甲醚(见图2)。蒿甲醚油溶性大、性质稳定,具有很好的成药性。在蒿甲醚315例恶性疟I期和II期临床试验中,临床治愈率为100%,28天复燃率为7.4%,效果显著。1987年9月上海药物所和昆明制药厂获得蒿甲醚原料药和蒿甲醚注射剂新药证书,蒿甲醚成为著名的抗疟药物。与此同时,桂林制药厂展开了对青蒿琥酯(见图2)的研究,其注射剂在临床中表现优异(5天疗程的28天复燃率仅为4.4%),于1987年获新药证书和生产批文 [4],其后成为瞩目的疟疾抢救药物。中国中医研究院中药研究所开展的临床试验发现,DHA药效高于青蒿素近10倍,复燃率则低至1.95% [1],即便是与当时已上市的青蒿琥酯钠注射剂和蒿甲醚注射剂相比也具备更为突出的疗效,DHA于1992年获颁新药证书。目前DHA被公认为是一个里程碑式化合物。

Figure 2. The first generation of artemisinin antimalarial drugs
图2. 第一代青蒿素抗疟药
3. DHA衍生物的抗疟活性
青蒿素、DHA、蒿甲醚和青蒿琥酯,是中国科学家对疟疾治疗的重要贡献。以青蒿素类化合物为基础的联合治疗方案(artemisinin based combination therapies, ACTs)自2001年被WHO选为疟疾一线治疗方案以来 [8],青蒿素类化合物已经挽救了不计其数患者的生命,其高效低毒的特点被广泛认可。但是,研制更好的青蒿素类抗疟药物的追求从来没有间断。南非西北大学的N'Da DD将DHA通过哌嗪与二茂铁相连得到的化合物1 (见图3),其抑制PfK1和PfK2的IC50分别为0.86 nM和1.4 nM,均强于蒿甲醚、青蒿琥酯与DHA [9];同样是N'Da DD,他将DHA 12位碳上羟基酯化得到的化合物2和3 (见图3)抗疟活性较青蒿琥酯高了3倍和22倍 [10]。

Figure 3. Highly active antimalarial DHA derivatives
图3. 高活性抗疟DHA衍生物
也有人合成青蒿素的聚合物。青蒿素聚合物是通过一个Linker将两个、三个甚至更多的青蒿素分子连接起来,其目的是为了获得抗疟活性更高的化合物。DHA聚合物最早是由李英等 [11] 通过DHA分子间脱水得到的,其后Tsogoeva SB [12] 、Thebtaranonth Y [13] 、Jung M [14] [15] 等研究者也做过此方面的研究。活性测试证明,DHA聚合物具有比青蒿素更高的抗疟活性,但是很难超过蒿甲醚的抗疟活性。
4. DHA衍生物的其它生物活性
除抗疟活性以外,DHA类化合物的其它生物活性也在不断研究中。1993年,Woerdenbag HJ [16] 首次发现DHA衍生物对艾氏腹水瘤细胞有抑制作用(IC50 = 29.8 ± 4.5 µM)。Tsogoeva SB [12] 发现DHA二聚体4 (见图4)对人非小细胞肺癌的抑制活性达到IC50 = 80 nM;Renard P [17] 所合成的氰基取代化合物5 (见图4)对白血病细胞L1210的IC50为10 nM,抑制能力非常强。此外中国药科大学余伯阳教授 [18] 、沈阳药科大学的宫平教授 [19] 、Dehaen W [20] 等发现了抗肿瘤活性很好的DHA衍生物。Arav-Boger R [21] 和Tsogoeva SB [22] 发现DHA衍生物6 (见图4)具有抗巨细胞病毒的能力;Thornfeldt [23] 和Dehaen W [24] 发现DHA衍生物7 (见图4)具有抗HIV的能力;Marin JJ [25] 发现青蒿琥酯具有非常好的抗HBV活性;Porter NA [26] 则发现蒿甲醚和青蒿琥酯具有降低7-脱氢胆固醇(7-DHC)进而有治疗脑肝肾综合征的能力。这些研究结果,显示了DHA衍生物的多活性特性。

Figure 4. Multi-active DHA derivatives
图4. 多活性的二氢青蒿素衍生物
5. DHA的结构多样化修饰
药物研究者已经合成了众多青蒿素衍生物,数量最多的是DHA 12-位碳进行修饰的衍生物;按其修饰方式,主要分为三种结构形式,分别为O-苷类、N-苷类和C-苷类 [27]。
O-苷类衍生物主要包括DHA的醚、羧酸酯和碳酸酯,最早合成的蒿甲醚和青蒿琥酯便属于此类,由于O-苷类衍生物具有较好的活性、油溶性和合成上的简便性,一直受到科研工作者的热爱。1992年Lin AJ [28] 便将糖类和DHA通过氧原子相连,所合成的化合物8 (见图5)的抗疟活性高于青蒿素;2000年Dive D [29] 首次将二茂铁通过Linker与DHA相连,合成了一系列化合物9 (见图5)并测试了它们的抗疟活性;2003年李英 [30] 将Mannich碱片段引入了DHA分子中得到化合物10 (见图5);2006年Singh C [31] 将大体积高亲脂性的金刚烷片段和芴环片段引入DHA分子中得到化合物11和12 (见图5),并且显示很好的抑制耐氯喹疟原虫的活性;2014年Yang PH [32] 报道了DHA-Ge类O-苷类化合物13 (见图5)并对它们的抗肿瘤活性进行了测试;2016年Verma RK [33] 和Liu JH [34] 分别报道了将查尔酮和苯硫醚基团引入DHA分子中得到化合物14和15 (见图5);2019年Sun J [35] 将吲哚与DHA相连合成了一系列化合物16 (见图5)并研究了它们的抗肿瘤活性。
N-苷类衍生物是由Lin AJ [36] 1990年最先报道的,是以DHA为原料经三步反应制得DHA-NHAr类衍生物(反应路线A,见图6);1995年,李英等 [37] 同样以DHA为原料在硫酸吡啶盐存在下与苯胺类化合物一步反应制得了DHA-NHAr类衍生物(反应路线B,见图6);N'Da DD [9] [38] 以DHA、草酰氯、哌嗪为原料,一步制得中间体DHA-Piperazine (反应路线C,见图6)。
1990年Jung M [39] 最先报道了C-苷类衍生物,在由青蒿酸为原料经过4步反应合成了C-12的丁基衍生物17 (见图7)。随后在1995年,Ziffer H [40] 报道了以DHA为原料在三氟化硼乙醚络合物存在下经一步反应制得C-12的2-烯丙基DHA (反应路线D,见图7),但是收率仅为25%。O'Neill PM [41] 在此基础上继续优化,在2009年报道了以DHA为原料经两步反应制得C-12的2-烯丙基DHA (反应路线E,见
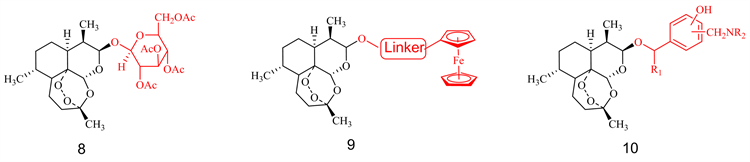


Figure 5. Examples of O-glycoside DHA derivatives

图5. O-苷类DHA衍生物示例

Figure 6. Examples of preparing N-glycoside DHA derivatives
图6. N-苷类DHA衍生物的制备示例

Figure 7. Examples of synthetic routes for C-glycoside DHA derivatives
图7. C-苷类DHA衍生物合成路线示例
图7),总收率为92%。但是,很多基团(例如苯基、炔烃基等)无法通过这三种方法引入到DHA分子中。2002年,Lee S [42] 报道了一种新的合成方法(反应路线F,见图7),克服了上述困难,扩展了C-苷类衍生物的种类。此外,Sasaki T [43] 、Zhang A [44] 、Fousteris MA [45] 等也做过相关研究。
对DHA的修饰也涉及其它的位点。其基本思路是合适的原料出发,经过多步反应制得目标化合物,例如Liu JH和Yu, BY [17] 在2016年报道了他们在青蒿素2位碳上引入了羟基并合成了一系列2位烷氧化的O-苷类化合物 (见图8)。

Figure 8. Other DHA derivatives
图8. 其它DHA衍生物
6. 本实验室部分研究工作
从目前DHA衍生物的研究情况来看,其研究热点包括两个方面:一是结构改造,一般是在保留青蒿素基本骨架的基础上引入其它结构单元,以提高生物活性包括抗疟活性。二是扩展生物活性,既有针对上市的DHA衍生物开展其它生物活性研究的报道,也有针对新合成的DHA衍生物探索新的生物活性的努力。经过多年的研究,除了证实大多数DHA衍生物具有抗肿瘤活性外,国内外的药物学家还相继发现了DHA衍生物具有抗病毒、抗炎、抗血吸虫病、抗菌、调节人体免疫系统等多种生物活性,尤其是近年DHA衍生物在治疗红斑狼疮方面的作用更是引起了医药界的广泛关注。
本实验室开展DHA研究,是从2009级研究生刘建开始的。研究之初,设定了目标分子如下设计原则:新分子结构简单,新分子合成容易,新分子具有较好的水溶性,新分子可能拥有良好或优秀的生物活性。为此,刘建尝试性地将含有N、O原子的某些分子引入DHA分子中,首先挑选了胺类(链状胺、环状胺等)、哌嗪类、唑类(二唑、三唑和四唑)等类型分子,同时选取了当时已有大量文献报道的1-溴乙醇和3-溴-1-丙醇作为Linker试剂,设计了100多个分子,挑选并合成了58个分子;与第三军医大学合作,从中发现了具有协同增敏活性的DHA衍生物,初战告捷 [46]。随后,扩大了分子片段范围,选择了嘧啶类、磺胺类、取代酚类、含杂环砜类/亚砜类分子,设计了200多个分子,挑选并合成得到67个目标分子。至此合成得到9类(见图9)共125个目标化合物,其中114个为新物质。


Figure 9. The molecular types designed and synthesized by Liu Jian
图9. 刘建设计合成的分子类型
美国礼来制药公司的创新药物研究(Open Innovation Drug Discovery Program, OIDD) 平台进行了这些分子的活性测试,得到了K-ras/Wnt合成致死(Kras-Wnt SL)、Wnt 信号通道(Wnt Pathway Activator)、抗肿瘤血管生成(Anti-angiogenesis)、抗结核活性(Anti-tuberculosis)以及促胰岛素分泌(Insulin Secretion)、胰高血糖素样肽分泌(GLP-1 Secretion)、糖化血浆蛋白受体激动剂(GPR 119 Receptor Agonist)、代谢型谷氨酸受体拮抗剂(mGlu2R Antagonist)、降钙基因相关肽受体拮抗剂(CGRP Receptor Antagonist)、Apelin受体拮抗剂以及己糖激酶抑制剂(Hexokinase 2 Inhibitor)等生物活性。发现有15个化合物表现出多靶点和高生物活性,其中5个化合物表现最好:LJ TM6b-2在Anti-Angiogenesis、Cell Cycle G-2M、Kras-Wnt SL、Wnt Pathway Activator方面有突出的活性,IC50/EC50值分别为0.67 µM、0.21 µM、3.99 µM、0.21 µM;LJ TM6b-3在Anti-Angiogenesis、Kras-Wnt SL方面有显著的活性,其IC50值分别为0.67 µM、0.011 µM;LJ TM6b-4在Anti-angiogenesis、Cell Cycle G-2M、Kras-Wnt SL、Wnt Pathway Activator方面有突出的活性,IC50/EC50值分别为0.52 µM、0.46 µM、0.20 µM、0.46 µM;LJ TM7a-4在Anti-angiogenesis、Kras-Wnt SL、Wnt Pathway Activator方面有突出的活性,IC50/EC50值分别为0.67 µM、0.060 µM、1.27 µM;LJ TM8a-7在Anti-angiogenesis、Kras-Wnt SL方面有显著的活性,其IC50值分别为0.30 µM、0.19 µM (见图10)。这些结果证明,所合成的部分分子具有多靶点和高生物活性,开创了本实验室研究青蒿素及其衍生物的先河 [47] [48] [49] [50]。

Figure 10. The active molecular structures synthesized by Liu Jian
图10. 刘建设计合成的活性分子结构
本实验室第二个从事青蒿素研究的是2011级研究生周福委,其率先用Lipinski成药五规则来指导青蒿素类衍生物的分子设计。由于DHA分子结构的限制,所以在选取连接基团时优选分子量尽可能小、氢键受体尽量少且具备一定亲水性的分子片段;为了保证所设计的目标化合物具有较好的活性,周福委从已上市的药物分子或具有多种生物活性的小分子中选取了氟喹诺酮、磺胺、酚类等引入到DHA分子中,设计了9类目标分子(见图11)、合成得到206个目标分子。通过Lilly公司的OIDD平台测试这些分子的生物活性,发现了许多高活性目标分子。6个分子的前蛋白转化酶枯草溶菌素9型(Proprotein convertase subtilisin/kexin type 9, PCSK9)抑制活性较好,IC50值均小于1 µM,活性最高分子的IC50 = 0.272 µM,这是首次发现DHA衍生物具有PCSK9抑制活性 [51] [52] [53];也有分子在抑制吲哚胺-2,3-双加氧酶1 (Indoleamine 2,3-dioxygenase 1, IDO-1)方面表现优异,IC50 = 0.8978 µM,这是首次发现青蒿素衍生物具有IDO-1抑制活性 [54];ZFW TM1系列分子(DHA-氟喹诺酮衍生物)拥有较好的抗结核活性,其中6个分子表现极为优异,在20 µM浓度下抑制率接近或超过100% [55];在Wnt信号通道活性测试中,ZFW TM1和ZFW TM2系列(DHA-磺胺衍生物)中的8个分子的EC50值小于1 µM,活性最高者EC50 = 0.0105 µM [56];在白细胞介素-17 (IL-17)抑制活性方面,8个分子的IC50小于1 µM,活性最好的为者IC50 = 0.1341 µM (见图12) [53] [57]。
周福委不仅合成了众多的分子而且其中的很多分子具有优异的生物活性。需要特别提及的是,ZFW TM1系列分子不仅具有非常优异的抗结核活性,而且在降血酯、激活Wnt信号通路方面表现出了极高的活性,是一类多靶点高活性DHA衍生物,这吸引了2013级研究生孙晓丽的注意。孙晓丽是本实验室第三位从事DHA研究的研究生。她在周福委ZFW TM1系列分子的基础上选取了更多氟喹诺酮,获得了一系列双药效团的偶联化合物 (SXL TM9~SXL TM11);在分子设计,她首次选择了手性氨基酸L-丝氨酸、L-苏氨酸和L-高丝氨酸作为Linker,设计并合成了8个系列共64个化合物。在20 μM样品测试浓度下,结核抑制率大于90%的化合物有5个;在PCSK9抑制活性测试中有2个分子表现优秀,IC50值分别为0.4781 μM和0.3134 μM (见图12) [58] [59] [60] [61]。

Figure 11. The molecular types designed by Zhou Fuwei
图11. 周福委设计的分子类型
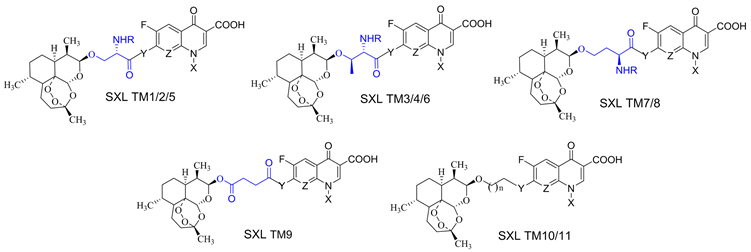
Figure 12. The molecular types designed by Sun Xiaoli
图12. 孙晓丽设计的分子类型
7. 总结
青蒿素及其衍生物具有高效、快速和低毒的抗疟活性,在全世界范围内得到广泛应用。随着对青蒿素及其衍生物的研究不断深入,人们发现青蒿素类抗疟药物还表现出许多其它的生物活性:如抗病毒、抗炎、抗血吸虫病、抗菌、调节人体免疫系统等多种生物活性。目前对青蒿素的研究主要集中在提高活性、拓宽药效、增加稳定性和溶解性等方面。本实验室对青蒿素衍生物的研究已持续了近10年。在文献调研的基础上,基于药物设计的基本原理和新思路,本实验室通过Linker将DHA与某些药物片段或成药性基团(如磺胺类、氟喹诺酮类、脂肪胺、唑类、酚类、芳杂环类等)连接到一起,合成了数十个系列500多个新分子,发现了高活性分子和新的生物活性,为青蒿素及其衍生物的合成及生物活性研究提供新的方向。
致谢
在此特别感谢第三军医大学周红教授和吴翀、李斌博士以及美国Lilly公司陈界豪博士及其同事们;衷心感谢西南大学生科院谢建平教授和药学院徐兴然博士及他们的学生在抗菌活性测试方面的帮助。
基金项目
重庆市中小学创新人才培养工程项目(重庆教委)。明星分子二氢青蒿素的新衍生物及其生物活性研究(CY190230),2019.11.15~2020.06.30。
文章引用
李洋,黄康平,唐雪梅,张泽朝,杨大成. 双氢青蒿素衍生物研究进展
Advances in Research of Dihydroartemisinin Derivative[J]. 药物化学, 2020, 08(03): 66-78. https://doi.org/10.12677/HJMCe.2020.83008
参考文献
- 1. 屠呦呦. 青蒿及青蒿素类药物[M]. 北京: 化学工业出版社, 2009.
- 2. World Health Organization. World Malaria Report 2018. https://www.who.int/malaria/publications/world-malaria-report-2018/en/
- 3. 张大庆, 黎润红, 饶毅. 继承与创新: 五二三任务与青蒿素研发[M]. 北京: 中国科学技术出版社, 2017.
- 4. 李国桥, 李英, 李泽琳, 曾美怡. 青蒿素类抗疟药[M]. 北京: 科学出版社, 2015.
- 5. Wang, J., Zhang, C.J., Chia, W.N., et al. (2015) Haem-Activated Pro-miscuous Targeting of Artemisinin in Plasmodium falciparum. Nature Communications, 6, Article No. 10111. https://doi.org/10.1038/ncomms10111
- 6. Klonis, N., Crespo-Ortiz, M.P., Bottova, I., et al. (2011) Artemisinin Activity against Plasmodium falciparum Requires Hemoglobin Uptake and Digestion. PNAS, 108, 11405-11410. https://doi.org/10.1073/pnas.1104063108
- 7. 胡友梅. 几种常用抗疟药的抗疟作用机理[J]. 第三军医大学学报, 1979, 1(4): 114-120.
- 8. World Health Organization. Global Report on Antimalarial Drug Efficacy and Drug Re-sistance: 2000-2010. https://www.who.int/malaria/publications/atoz/9789241500470/en
- 9. De Lange, C., Coertzen, D., Smit, F.J., et al. (2018) Synthesis, Antimalarial Activities and Cytotoxicities of Amino-artemisinin-1,2-disubstituted Ferrocene Hybrids. Bioorganic & Medicinal Chemistry Letters, 28, 3161-3163. https://doi.org/10.1016/j.bmcl.2018.08.037
- 10. Cloete, T.T., Krebs, H.J., Clark, J.A., et al. (2013) Antimalarial Activity of 10-Alkyl/Aryl Esters and Aminoethyl Ethers of Artemisinin. Bioorganic Chemistry, 46, 10-16. https://doi.org/10.1016/j.bioorg.2012.10.002
- 11. Li, Y., Yu, P.L., Chen, Y.X., et al. (1981) Study on Artemisinin Analogs-Synthesis of Reduced Artemisinin’s Ethers, Carboxylates and Carbonate Derivatives. Acta Pharmaceutica Sinica, 16, 429-439.
- 12. Fröhlich, T., Çapcı Karagöz, A., Reiter, C., et al. (2016) Artemisinin-Derived Dimers: Potent Antimalarial and Anticancer Agents. Journal of Medicinal Chemistry, 59, 7360-7388. https://doi.org/10.1021/acs.jmedchem.5b01380
- 13. Ekthawatchai, S., Kamchonwongpaisan, S., Kongsaeree, P., et al. (2001) C-16 Artemisinin Derivatives and Their Antimalarial and Cytotoxic Activities: Syntheses of Artemisinin Monomers, Dimers, Trimers, and Tetramers by Nucleophilic Additions to Artemisitene. Journal of Medicinal Chemistry, 44, 4688-4695. https://doi.org/10.1021/jm0103007
- 14. Jung, M., Lee, S., Ham, J., et al. (2003) Antitumor Activ-ity of Novel Deoxoartemisinin Monomers, Dimers, and Trimer. Journal of Medicinal Chemistry, 46, 987-994. https://doi.org/10.1021/jm020119d
- 15. Mankil, J., Kyunghoon, L., Hanjo, K., et al. (2004) Recent Advances in Artemisinin and Its Derivatives as Antimalarial and Antitumor Agents. Current Medicinal Chemistry, 11, 1265-1284. https://doi.org/10.2174/0929867043365233
- 16. Woerdenbag, H.J., Moskal, T.A., Pras, N., Malingré, T.M., et al. (1993) Cytotoxicity of Artemisinin-Related Endoperoxides to Ehrlich Ascites Tumor Cells. Journal of Natural Products, 56, 849-856. https://doi.org/10.1021/np50096a007
- 17. Li, Y., Wu, J.M., Shan, F., et al. (2003) Synthesis and Cytotoxicity of Dihydroartemisinin Ethers Containing Cyanoaryl-Methyl Group. Bioorganic & Medicinal Chemistry, 11, 977-984. https://doi.org/10.1016/S0968-0896(02)00538-2
- 18. Xu, C.C., Deng, T., Fan, M.-L., et al. (2016) Synthesis and in Vitro Antitumor Evaluation of Dihydroartemisinin- Cinnamic Acid Ester Derivatives. European Journal of Medicinal Chemistry, 107, 192-203. https://doi.org/10.1016/j.ejmech.2015.11.003
- 19. Liu, Y., Liu, Z., Shi, J., et al. (2013) Synthesis and Cytotoxicity of Novel 10-Substituted Dihydroartemisinin Derivatives Containing N-arylphenylethane Sulfonamide Groups. Molecules, 18, 2864-2877. https://doi.org/10.3390/molecules18032864
- 20. Jana, S., Iram, S., Thomas, J., et al. (2017) Synthesis and Anti-cancer Activity of Novel Aza-Artemisinin Derivatives. Bioorganic & Medicinal Chemistry, 25, 3671-3676. https://doi.org/10.1016/j.bmc.2017.04.041
- 21. Roy, S., He, R., Kapoor, A., et al. (2015) Inhibition of Human Cy-tomegalovirus Replication by Artemisinins: Effects Mediated through Cell Cycle Modulation. Antimicrobial Agents and Chemotherapy, 59, 3870-3879. https://doi.org/10.1128/AAC.00262-15
- 22. Capci Karagoz, A., Reiter, C., Seo, E.J., et al. (2018) Access to New Highly Potent Antileukemia, Antiviral and Antimalarial Agents via Hybridization of Natural Products (Homo) Egonol, Thymoquinone and Artemisinin. Bioorganic & Medicinal Chemistry, 26, 3610-3618. https://doi.org/10.1016/j.bmc.2018.05.041
- 23. Thornfeldt, C.R. (1990) Treatment of Acouired Immunodeficiency Syndrome. WO, 90/10442, 1990-09-20. https://doi.org/10.1108/eb059309
- 24. Jana, S., Iram, S., Thomas, J., et al. (2017) Application of the Triazolization Reaction to Afford Dihydroartemisinin Derivatives with Anti-HIV Activity. Molecules, 22, 303-316. https://doi.org/10.3390/molecules22020303
- 25. Romero, M.R., Efferth, T., Serrano, M.A., et al. (2005) Effect of Artemisinin/Artesunate as Inhibitors of Hepatitis B Virus Production in an “in Vitro” Replicative System. Antiviral Re-search, 68, 75-83. https://doi.org/10.1016/j.antiviral.2005.07.005
- 26. Korade, Z., Kim, H.Y., Tallman, K.A., et al. (2016) The Effect of Small Molecules on Sterol Homeostasis: Measuring 7-Dehydrocho-lesterol in dhcr7-deficient Neuro 2a Cells and Human Fibroblasts. Journal of Medicinal Chemistry, 59, 1102-1115. https://doi.org/10.1021/acs.jmedchem.5b01696
- 27. 李英. 青蒿素研究[M]. 上海: 上海科学技术出版社, 2007.
- 28. Lin, A.J., Li, L.Q., Andersen, S.L., et al. (1992) Antimalarial Activity of New Dihydroartemisinin Deriva-tives. 5. Sugar Analogs. Journal of Medicinal Chemistry, 35, 1639-1642. https://doi.org/10.1021/jm00087a021
- 29. Delhaes, L., Biot, C., Berry, L., et al. (2000) Novel Ferrocenic Artemis-inin Derivatives: Synthesis, in Vitro Antimalarial Activity and Affinity of Binding with Ferroprotoporphyrin IX. Bioor-ganic & Medicinal Chemistry, 8, 2739-2745. https://doi.org/10.1016/S0968-0896(00)00206-6
- 30. Li, Y., Yang, Z.S., Zhang, H., et al. (2003) Artemisinin De-rivatives Bearing Mannich Base Group: Synthesis and Antimalarial Activity. Bioorganic & Medicinal Chemistry, 11, 4363-4368. https://doi.org/10.1016/S0968-0896(03)00499-1
- 31. Singh, C., Chaudhary, S. and Puri, S.K. (2006) New Orally Active Derivatives of Artemisinin with High Efficacy against Multidrug-Resistant Malaria in Mice. Journal of Medicinal Chemistry, 49, 7227-7233. https://doi.org/10.1021/jm060826x
- 32. Lu, P., Yao, S., Cai, J., et al. (2014) Synthesis and Synergetic Anti-Tumor Activity Evaluation of Dihydroartemisinin-Organogermanium(IV) Compound. Bioorganic & Medicinal Chemistry Let-ters, 24, 5294-5297. https://doi.org/10.1016/j.bmcl.2014.09.048
- 33. Gaur, R., Pathania, A.S., Malik, F.A., et al. (2016) Synthesis of a Series of Novel Dihydroartemisinin Monomers and Dimers Containing Chalcone as a Linker and Their Anticancer Activ-ity. European Journal of Medicinal Chemistry, 122, 232-246. https://doi.org/10.1016/j.ejmech.2016.06.035
- 34. Xu, C.C., Wu, J.J., Xu, T., et al. (2016) Synthesis and Cytotoxi-city of Novel Artemisinin Derivatives Containing Sulfur Atoms. European Journal of Medicinal Chemistry, 123, 763-768. https://doi.org/10.1016/j.ejmech.2016.08.015
- 35. Hu, Y., Li, N., Zhang, J., Wang, Y., et al. (2019) Ar-temisinin-Indole and Artemisinin-Imidazole Hybrids: Synthesis, Cytotoxic Evaluation and Reversal Effects on Multidrug Resistance in MCF-7/ADR Cells. Bioorganic & Medicinal Chemistry Letters, 29, 1138-1142. https://doi.org/10.1016/j.bmcl.2019.02.021
- 36. Lin, A.J., Li, L.Q., Klayman, D.L., et al. (1990) Antimalarial Ac-tivity of New Water-Soluble Dihydroartemisinin Derivatives. 3. Aromatic Amine Analogs. Journal of Medicinal Chem-istry, 33, 2610-2614. https://doi.org/10.1021/jm00171a041
- 37. Yang, Y.H., Li, Y., Shi, Y.L., et al. (1995) Artemisinin Derivatives with 12-Aniline Substitution: Synthesis and Antimalarial Activity. Bioorganic & Medicinal Chemistry Letters, 5, 1791-1794. https://doi.org/10.1016/0960-894X(95)00297-7
- 38. De Lange, C., Coertzen, D., Smit, F.J., et al. (2017) Synthesis, in Vitro Antimalarial Activities and Cytotoxicities of Amino-Artemisinin-Ferrocene Derivatives. Bioorganic & Medicinal Chemistry Letters, 28, 289-292. https://doi.org/10.1016/j.bmcl.2017.12.057
- 39. Jung, M., Bustos, D.A., ElSohly, H.N., et al. (1990) A Concise and Stereoselective Synthesis of (+)-12-n-butyldeoxo- artemisinin. Synlett, 12, 743-744. https://doi.org/10.1055/s-1990-21234
- 40. Pu, Y.M. and Ziffer, H. (1995) Synthesis and Antimalarial Activities of 12. Beta-allyldeoxoartemisinin and Its Derivatives. Journal of Medicinal Chemistry, 38, 613-616. https://doi.org/10.1021/jm00004a007
- 41. Chadwick, J., Mercer, A.E., Park, B.K., et al. (2009) Synthesis and Bi-ological Evaluation of Extraordinarily Potent C-10 Carba Artemisinin Dimers against P. falciparum Malaria Parasites and HL-60 Cancer Cells. Bioorganic & Medicinal Chemistry, 17, 1325-1338. https://doi.org/10.1016/j.bmc.2008.12.017
- 42. Lee, S. and Oh, S. (2002) A Simple Synthesis of C-10 Substituted Deoxoartemisinin and 9-epi-deoxoartemisinin with Various Organozinc Reagents. Tetrahedron Letters, 43, 2891-2894. https://doi.org/10.1016/S0040-4039(02)00458-6
- 43. Wang, S. and Sasaki, T. (2013) Synthesis of Artemisinin Dimers Using the Ugi Reaction and Their in Vitro Efficacy on Breast Cancer Cells. Bioorganic & Medicinal Chemistry Letters, 23, 4424-4427. https://doi.org/10.1016/j.bmcl.2013.05.057
- 44. Liu, G., Xue, D., Yang, J., et al. (2016) Design, Dynthesis, and Pharmacological Evaluation of 2-(2,5-Dimethyl- 5,6,7,8-tetrahydro quinolin-8-yl)-N-aryl Propanamides as Novel Smoothened (Smo) Antagonists. Journal of Medicinal Chemistry, 59, 11050-11068. https://doi.org/10.1021/acs.jmedchem.6b01247
- 45. Letis, A.S., Seo, E.J., Nikolaropoulos, S.S., et al. (2017) Syn-thesis and Cytotoxic Activity of New Artemisinin Hybrid Molecules against Human Leukemia Cells. Bioorganic & Me-dicinal Chemistry, 25, 3357-3367. https://doi.org/10.1016/j.bmc.2017.04.021
- 46. Wu, C., et al. (2013) Design, Synthesis and Evaluation of the An-tibacterial Enhancement Activities of Amino Dihydroartemisinin Derivatives. Molecules, 18, 6866-6882. https://doi.org/10.3390/molecules18066866
- 47. 刘建. 新型二氢青蒿素衍生物的设计、简易合成与生物活性研究[D]: [硕士学位论文]. 重庆: 西南大学化学化工学院, 2012.
- 48. 范莉, 杨大成, 刘建, 张书虹, 唐雪梅. 二氢青蒿素衍生物在制备抗肿瘤药物中的应用[P]. 中国专利, 201910786538.2. 2019-08-23.
- 49. 杨大成, 刘建, 范莉, 张书虹, 唐雪梅, 孟然然. 二氢青蒿素嘧啶类衍生物及其应用[P]. 中国专利, 201910918524.1. 2019-09-26.
- 50. 杨大成, 张书虹, 范莉, 刘建, 唐雪梅, 孟然. 二氢青蒿素的硫醚、亚砜与砜衍生物及其应用[P]. 中国专利, 201910919541.7. 2019-09-26
- 51. 杨大成, 范莉, 唐雪梅, 罗鹏, 周福委, 孙晓丽, 潘建芳. 双氢青蒿素与喹诺酮偶联物在制备降血脂药物中的应用[P]. 中国专利, 201910786500.5. 2019-08-23.
- 52. 杨大成, 周福委, 潘建芳, 范莉, 刘建, 唐雪梅. 二氢青蒿素的简单酚类偶联物、合成方法及应用[P]. 中国专利, 201910803254.X. 2019-08-28.
- 53. 杨大成, 潘建芳, 范莉, 刘建, 唐雪梅, 周福委, 杨龙. 二氢青蒿素含羧基酚/酯基酚/酰胺基酚偶联物、合成方法及应用[P]. 中国专利, 201910804369.0. 2019-08-28.
- 54. 杨大成, 潘建芳, 范莉, 唐雪梅, 周福委, 周礼江. 二氢青蒿素含缩氨脲/缩氨硫脲酚类衍生物、合成方法及应用[P]. 中国专利, 201910803271.3. 2019-08-28.
- 55. 杨大成, 周福委, 雷皇书, 范莉, 刘建, 何志琴, 邹艳冶, 赵雪晶. 双氢青蒿素与喹诺酮类化合物的偶联物及其制备方法和应用[P]. 中国专利, ZL201310388357.7. 2016-06-08.
- 56. 杨大成, 周福委, 范莉, 潘建芳, 唐雪梅, 刘滨. 二氢青蒿素磺胺类衍生物、合成方法与应用[P]. 中国专利, 201910803251.6. 2019-08-28.
- 57. 周福委. 新型双氢青蒿素衍生物的进一步设计、合成及其生物活性研究[D]: [硕士学位论文]. 重庆: 西南大学化学化工学院, 2014.
- 58. 孙晓丽. 手性氨基酸连接双氢青蒿素及氟喹诺酮片段的新型化合物研究[D]: [硕士学位论文]. 重庆: 西南大学化学化工学院, 2016.
- 59. 杨大成, 罗鹏, 孙晓丽, 范莉, 徐兴然, 唐雪梅, 黄敏, 冯计周, 刘晋宇. L-高丝氨酸连接的双氢青蒿素–氟喹诺酮偶联物及其中间体、制备方法与用途[P]. 中国专利, 201910785602.5. 2019-08-23.
- 60. 杨大成, 范莉, 罗鹏, 孙晓丽, 唐雪梅, 徐兴然, 蔚建勇, 刘洁, 陈菲菲. L-苏氨酸连接的双氢青蒿素–氟喹诺酮偶联物及其中间体、制备方法与用途[P]. 中国专利, 201910785630.7. 2019-08-23.
- 61. 范莉, 孙晓丽, 杨大成, 罗鹏, 唐雪梅, 徐兴然, 于治梅, 席松. L-丝氨酸连接的双氢青蒿素–氟喹诺酮偶联物及其中间体、制备方法与用途[P]. 中国专利, 201910786502.4. 2019-08-23.
NOTES
*同等贡献。
#通讯作者。