Hans Journal of Medicinal Chemistry
Vol.
09
No.
02
(
2021
), Article ID:
41353
,
14
pages
10.12677/HJMCe.2021.92003
氨基噻唑合成研究进展
于丽杰,Rajendran Satheeshkumar,王文龙*
江南大学,江苏 无锡
收稿日期:2021年3月16日;录用日期:2021年3月23日;发布日期:2021年3月30日

摘要
噻唑类化合物具有广泛的生物活性,其中,氨基噻唑作为重要结构单元在药物和药物化学领域中广泛存在。然而原有的Hantzsch合成法存在许多弊端,研究者对其进行了一系列改进,并发现了一些新的合成方法。本文主要从非均相纳米催化合成氨基噻唑,光催化合成氨基噻唑,未使用催化剂合成氨基噻唑,使用绿色溶剂合成氨基噻唑,熔融法合成氨基噻唑,硫氰酸根参与的氨基噻唑合成,其他等方面阐述近几年氨基噻唑的合成研究进展。
关键词
噻唑,氨基噻唑,Hantzsch方法

Study on the Synthesis of Aminothiazole Derivatives
Lijie Yu, Rajendran Satheeshkumar, Wenlong Wang*
School of Pharmaceutical Science, Jiangnan University, Wuxi Jiangsu
Received: Mar. 16th, 2021; accepted: Mar. 23rd, 2021; published: Mar. 30th, 2021

ABSTRACT
Thiazole compounds have a wide range of biological activities. Among of them, 2-aminothiazoles are one of the most important classes of heterocycles in the field of pharmaceutical and medicinal chemistry such as antifungal, insecticidal, radioprotective, bactericidal, antiviral, and anesthetic activities. The original Hantzsch synthesis has many disadvantages, and researchers have made a series of improvements. This article mainly describes the progress of the synthesis of aminothiazole in recent years.
Keywords:Thiazole, 2-Aminothiazole, Hantzsch Synthesis

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
氨基噻唑在合成和药物化学中具有重要地位,在抗HIV、抗糖尿病、抗菌、抗氧化、消炎、抗高血压、神经保护、抗癌、抗真菌和抗结核药物中具有良好的应用前景 [1]。许多带有氨基噻唑核心的化合物已被批准作为治疗药物或处于临床试验中(见图1)。由于氨基噻唑在药物化学中是特殊的骨架结构,因此科学家已经开发出多种氨基噻唑合成方法,其中Hantzsch合成法即利用α-卤代酮和硫脲反应生成噻唑的方法是最早提出的合成氨基噻唑的方法,也是最经典的氨基噻唑合成方法,但其存在操作复杂,反应时间长,对环境不友好,产率低,后处理繁琐等问题,所以研究者对其进行了一系列改造,并发现了一些新的合成方法。本文主要从非均相纳米催化合成氨基噻唑,光催化合成氨基噻唑,未使用催化剂合成氨基噻唑,使用绿色溶剂合成氨基噻唑,熔融法合成氨基噻唑,硫氰酸根参与的氨基噻唑合成,其他等方面阐述近几年氨基噻唑的合成研究进展。
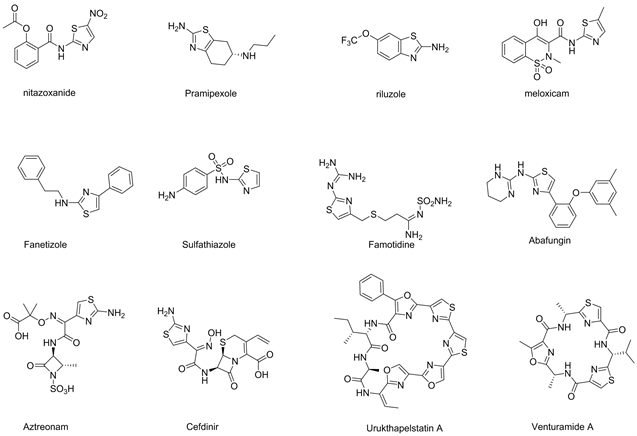
Figure 1. Drug Molecules Containing the Aminothioazole Moiety
图1. 含有氨基硫唑部分的药物分子
2. 氨基噻唑合成研究
2.1. 非均相纳米催化合成氨基噻唑
近年来,开发针对广泛使用的可循环利用的催化剂和无害溶剂的生态友好,高效的化学工艺或方法一直是有机化学家面临的主要挑战之一 [2]。由于吸附的化合物的良好活化,反应速率的提高以及便宜易得,金属氧化物纳米颗粒作为非均相纳米催化剂已被广泛研究。此外,由于纳米催化剂的结构特征(例如小尺寸和高表面积/体积比),其表现出高活性和选择性以及出色的稳定性 [3]。然而,这些微小的纳米颗粒由于尺寸小,很难将它们从反应混合物中分离出来并在催化过程中重复使用。因此,已经进行了许多尝试来克服上述缺点,方法是将纳米颗粒固定在具有高表面积的载体上,例如二氧化硅,碳,沸石,金属氧化物,聚合物和纳米复合材料。
TiO2纳米颗粒作为一种无毒,廉价,水分稳定,可重复使用且可商购的材料,引起了许多科学家的极大兴趣。但是,很难将这些微小的二氧化钛颗粒从反应混合物中分离出来并再次使用。因此,制备具有高活性和有效分离能力的二氧化钛基催化剂是当前催化研究的关键问题之一。2015年Zahra等人 [4] 介绍了负载在Fe3O4 @ SiO2纳米复合材料上的纳米TiO2作为新型催化剂,用于在室温下绿色介质PEG-200中环境中合成2-氨基噻唑的方法(见图2)。该催化剂容易被外部磁体分离,并且回收的催化剂被重复使用几次而没有任何明显的活性损失,且反应操作简单,时间短,产率高达98%,易于纯化。
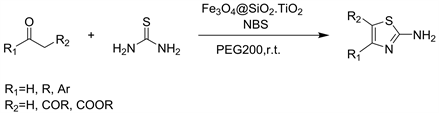
Figure 2. Synthesis of 2-aminothiazoles catalyzed Fe3O4@SiO2_TiO2
图2. Fe3O4@SiO2_TiO2催化的2-氨基噻唑合成
近来,生物聚合物如壳聚糖(CS),淀粉和纤维素在化学转化中已用作多相绿色催化剂。壳聚糖可以作为化学反应中的基本多相催化剂探索。壳聚糖中同时存在羟基和氨基,使得该聚合物成为碱催化反应的有效催化剂。壳聚糖作为天然材料已被用作Ullmann反应,Suzuki交联和Knoevenagel反应,Heck反应和哒嗪合成的固体催化剂。纳米颗粒由于其纳米尺寸,大表面积,可生物降解和良好的生物相容性而受到了广泛的关注。这些特性有利于纳米壳聚糖在各种应用中的广泛应用,包括药物输送系统,传感器,蛋白质载体,污染消除和催化剂。2015年,Zahra等人 [5] 使用壳聚糖纳米粒子在温和条件下通过酮和硫脲的一锅反应来合成2-氨基噻唑。壳聚糖纳米粒子作为可降解的绿色催化剂使该反应更具有优势。
近年来,使用淀粉(或一般而言的碳水化合物)作为催化剂已引起人们的广泛关注。引起关注的主要原因是碳水化合物的成本,可获得性和可生物降解性。淀粉纳米颗粒因其纳米尺寸,许多报告介绍了其在有机反应中的用途。然而,淀粉纳米粒子在有机反应中没有类似的催化剂应用,2016年Masoud等人 [6] 又使用绿色,可生物降解廉价的纳米淀粉作为催化剂合成2-氨基噻唑(见图3)。
近年来,诸如Fe3O4 NPs的磁性纳米结构作为理想的载体和纳米催化剂,由于其纳米尺度尺寸,高活性,低成本,高表面积,无毒,易于与反应介质分离,以及与生俱来的特性而备受催化过程的关注。2016年Javad等人 [7] 以Fe3O4纳米颗粒-1,3-二氯-5,5-二甲基乙内酰脲(DCDMH)为催化系统合成2-氨基噻唑(见图4)。Fe3O4纳米颗粒-DCDMH是一种活性高,可重复使用的,高度稳定的磁性催化剂。这种有效方法的优点包括更绿色,更清洁的条件,更短的反应时间,收率高(89%~99%),使用简单的外部磁场即可轻松分离,成本低廉且操作简便。
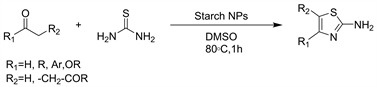
Figure 3. Starch NPs catalyzed synthesis of 2-aminothiazoles
图3. 淀粉纳米颗粒催化的2-氨基噻唑合成
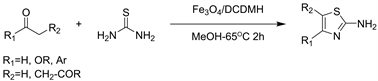
Figure 4. The synthesis of 2-aminothiazole using chlorinating reagent
图4. 氯化试剂合成2-氨基噻唑
开发具有分子多样性和结构复杂性的医用支架的多组分反应(MCR)的开发被认为是现代有机合成中最有效的策略之一。MCR具有几个优点,包括后处理简单,选择性更高,原子经济性更高,副产物更少,合成步骤最少。2018年Sharma等人 [8] 通过NiFe2O4纳米颗粒催化的一锅三组分反应在乙醇-水绿色溶剂中合成嘧啶-噻唑衍生物,该催化剂催化效率高,反应条件绿色环保,产率高,操作做简单(见图5)。此外,已发现最终化合物对不同的癌细胞系(A375,HeLa和MCF-7)具有良好的抗增殖活性。在这些化合物中,与参考药物厄洛替尼相比,化合物4b,4c,4f,4 g和4 h对A375细胞系具有良好的抑制活性,对MCF-7癌细胞系具有中等抑制活性。化合物4h显示出与所有三种癌细胞系A375,HeLa和MCF-7相当的抗癌活性(见图6)。
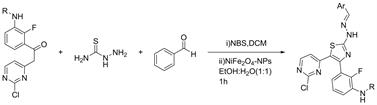
Figure 5. Facile nano-NiFe2O4 catalyzed synthesis of multi-functional bioactive pyrimidine-thiazole-base derivatives
图5. 便捷的纳米NiFe2O4催化合成多功能生物活性嘧啶-噻唑基衍生物
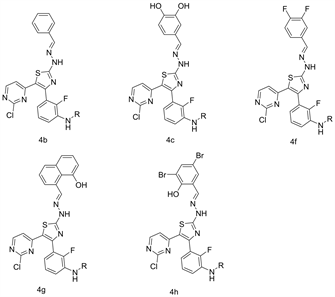
Figure 6. Active compound
图6. 活性化合物
氧化铝(Al2O3)纳米颗粒用于工业和化学领域的各种应用。例如炼油,陶瓷复合材料,光电,电子,加氢,汽车排放控制,冶金,耐火材料,和磨损保护。近年氨基酸被广泛用于有机转化中,例如迈克尔反应中的脯氨酸和罗宾逊环化,比吉内利二氢嘧啶酮合成中的各种氨基酸,缬氨酸用于取代吡咯烷的合成,色氨酸曼尼希反应和羟醛反应,咪唑啉合成中的苯丙氨酸等。然而,在均相催化条件下,由于它们难以与反应环境分离,因而限制了它们的应用。近年来,非均相有机催化剂由于其可回收利用和环境友好的特性而引起了广泛关注。2019年Zohre等人 [9] 以天冬酰胺官能化的氧化铝纳米粒子(Asp-Al2O3)为催化剂一步合成2-氨基噻唑(见图7)。这是首个报道的氨基酸官能化的Al2O3纳米颗粒作为有机转化的催化体系。这种改进方法的优势包括更高的纯度和优异的产品收率,更绿色,更清洁的条件,易于分离的产品以及方便的操作。此外,在催化反应条件下将有机催化剂固定在Al2O3表面上是稳定的,因此可以有效地重复使用。
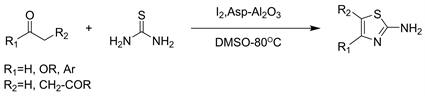
Figure 7. The synthesis of 2-aminothiazole using Asp-Al2O3
图7. 用Asp-Al2O3合成2-氨基噻唑
2.2. 光催化合成氨基噻唑
光触媒PHOTOCATALYST是光Photo = Light + 触媒(催化剂) catalyst的合成词。光触媒是一种在光的照射下,自身不起变化,却可以促进化学反应的物质,光触媒是利用自然界存在的光能转换成为化学反应所需的能量,来产生催化作用,使周围的氧气及水分子激发成极具氧化力的自由负离子。几乎可分解所有对人体和环境有害的有机物质及部分无机物质,不仅能加速反应,亦能运用自然界的定侓,不造成资源浪费与附加污染形成。近几年光催化因其环保特性备研究者广泛关注。
2017年Dastageer等人 [10] 开发出一种新颖的无离去基团的方案,用于1,3-二羰基和硫脲的自由基偶联,可用于合成各种氨基噻唑(见图8)。使用光子能量代替需要的离去基团和热能,构成绿色和原子经济合成。使用四碘荧光素作为光氧化还原催化剂以从硫脲原位产生硫自由基,然后将其添加到烯醇互变异构体中,在一系列级联步骤中形成氨基噻唑骨架。
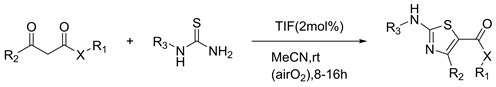
Figure 8. Visible light-mediated coupling of thioureas and 1,3-dicarbonyls: towards a leaving group-free synthesis of aminothiazoles
图8. 硫脲和1,3-二羰基化合物的可见光介导偶联:无离去集团合成氨基噻唑
2.3. 未使用催化剂合成氨基噻唑
从实验室的学术研究到化学工业,催化在化学过程中发挥着核心作用,并且是无数化学转化的核心。通过使用催化系统,可以降低化学反应的温度,减少基于试剂的废物,并提高转化率,从而可以避免导致绿色技术的有害副反应。均相催化过程是化学家的首选,因为它们具有高活性和选择性的化学转化以及优异的产品收率。这些催化剂的实例包括无机酸和碱以及过渡金属化合物和有机化合物。
2014年Telvekar等人 [11] 报道了一种在不含金属的水溶性NaICl2条件下使用易于获得的脂族和芳族酮合成取代的氨基噻唑的新颖,简便且高效的方法(见图9)。该条件是通用的,并且适用于各种药物中间体。该方法对于将底物如对氨基苯乙酮转化为相应的氨基噻唑也是有用的。
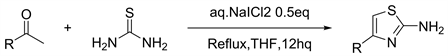
Figure 9. Synthesis of 2-aminothiazole derivatives from easily available thiourea and alkyl/arylketones using aqueous NaICl2
图9. 使用NaICl2水溶液由易于获得的硫脲和烷基/芳基酮合成2-氨基噻唑衍生物
2016年总之,Sadeghi等人 [12] 开发了一种简单方便的程序,用于在温和条件下以NEt3为均相催化剂存在下合成2-氨基噻唑(见图10)。该方法学具有非常吸引力,例如产品容易分离,条件温和和清洁,纯度和产率更高(80%~98%)以及后处理程序更容易。这种简单的方法与廉价的均相催化剂相结合,使该方案经济,有益,并且是用于合成1,3-噻唑的无废化学方法。

Figure 10. Synthesis of 2-aminothiazoles in the presence of NEt3
图10. 三乙胺存在下2-氨基噻唑的合成
文献综述表明,研究人员正在考虑将HBr/DMSO作为一种新型卤化系统。Majetich等公开了使用HBr/DMSO的第一种亲电溴化芳族化合物。迄今为止,已有各种报道使用HBr/DMSO作为各种化合物的原位卤代反应的良好来源。2018年Javad等人 [13] 报道了了使用HX/DMSO系统从不同的羰甲基底物合成各种2-氨基噻唑衍生物的绿色的,新颖的方案(见图11)。该方法简便,绿色,并且避免使用重金属或有毒金属以及恶劣的条件,并能获得令人满意的产率并易于进行后处理。
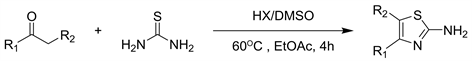
Figure 11. Synthesis of 2-aminothiazoles via Csp3-H bond functionalization using HX-DMSO
图11. HX-DMSO下通过Csp3-H键官能化合成2-氨基噻唑
叔丁基氢过氧化物(TBHP)作为强氧化剂,已在各种氧化反应中得到了广泛的应用。与各种催化剂(例如碘),溴代丁二酰亚胺(NBS),碘代丁二酰亚胺(NIS),四丁基碘化铵(TBAI),和金属催化剂(Co,Cu,Fe,Ti,Ru,K),已被用于实现C-C,C-N,C-O,C-S和N-N键形成。2018年Sun等人 [14] 首次报道了由TBHP和AIBN组成的新的有效氧化系统,该系统允许通过新型,无金属的方案从酮衍生物和硫脲成功合成取代的2-氨基噻唑(见图12)。该反应的机理包括通过自由基过程形成氧化的C-S键,随后通过分子间缩合反应形成C-N键。
2.4. 使用绿色溶剂合成氨基噻唑
绿色化学是当今化学发展的一个重要理念,其中绿色溶剂是绿色化学研究的重点之一。在医药研究和化工生产中,反应介质、分离过程和配方中都会大量使用挥发性有机溶剂,如石油醚、苯等芳烃、醇、酮卤代烃等。挥发性有机溶剂进入空气中后,在太阳光的照射下,容易在地面附近形成光化学烟烃雾,引起和加剧肺气肿、支气管炎等多种呼吸系统疾病;增加癌症的发病率;导致谷物减产、橡胶老化和织物褪色等;挥发性有机溶剂还会污染海洋、食品和饮用水毒害水生物;氟氯能破坏臭氧层。因此,溶剂绿色化是实现清洁生产的核心技术之一。目前备受关注的绿色溶剂是水、超临界流体、离子液体。水是地球上自然丰度最高的溶剂,价廉易得,无毒无害,不燃不爆,其优势不言而喻。但水对大部分有机物的溶解能力较差,许多场合都不能用水代替挥发性有机溶剂。

Figure 12. TBHP/AIBN-mediated synthesis of 2-aminothioazoles
图12. TBHP/AIBN介导的2-氨基噻唑合成
2017年Netankar等人 [15] 开发了一锅法,在80℃~85℃的PEG(聚乙二醇)-400和水中作为绿色反应介质,在微波辐射下,由芳族酮,NBS(N-溴代琥珀酰亚胺)和硫脲反应,合成4-芳基-2-氨基噻唑,在28~32分钟内以84%~89%的产率获得了产品(见图13)。该方法具有多种优点,例如使用绿色溶剂,易于后处理,优异的收率并且避免使用有毒溶剂。使用绿色溶剂的同时使用微波催化,大大降低了反应时间,符合现在绿色化学的理念。
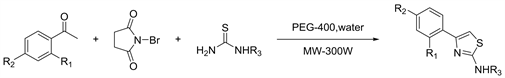
Figure 13. One-pot synthesis of 4-aryl-2-aminothiazoles
图13. 一锅合成4-芳基-2-氨基噻唑
离子液体由含氮、磷的有机正离子和大的无机负离子组成,在室温或低温下为液体,离子液体作溶剂的优点:① 无味、不燃,其蒸气压极低,因此可用在高真空体系中,同时可减少因挥发而产生的环境污染问题。② 对有机物和无机物都有良好的溶解性能,可使反应在均相条件下进行,同时可减小设备体积。③ 可操作温度范围宽(−40℃~300℃),具有良好的热稳定性和化学稳定性,易与其他物质分离,可以循环使用。④ 表现出Brǒnsted、Lewis、Franklin 酸的酸性,且酸强度可调。因其以上优点而被用于分离工程中作气体吸收剂和液体萃取剂;在化学反应中作反应介质或作为催化剂;在电化学中作电解质等。离子液体符合绿色化学的原则,因而被称为绿色溶剂。2014年Zhao等人 [16] 报道了以离子液体和水为溶剂,使用分子氧作为绿色氧化剂通过KI/NH4NO3催化的酮和硫脲的氧化环化反应合成2-氨基噻唑的有效方法(见图14)。
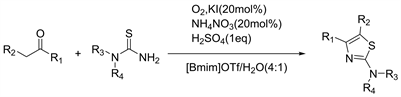
Figure 14. Synthesis of 2-aminothiazoles through KI/NH4NO3 catalyzed aerobic oxidative cyclization of ketones and thioureas
图14. 通过KI/NH4NO3催化酮和硫脲的需氧氧化环化反应合成2-氨基噻唑
深共熔溶剂(DES)作为一种低共熔混合物,由于具有廉价易得、蒸汽压低、无毒性、不易燃、可生物降解、可调控以及易循环使用等优点,逐渐成为一种新型的绿色溶剂或催化剂。近年来DES作为溶剂或催化剂广泛应用于常见的加成、取代、偶联、缩合、环化、酯化、多组分及解聚等有机反应。2014年Zahra等人 [17] 发现氯化胆碱-脲基深共熔溶剂(DES)是一锅合成2-氨基噻唑和2-氨基恶唑衍生物的高效催化剂和反应介质。活性亚甲基化合物,脲或硫脲与N-溴代琥珀酰亚胺NBS在深共熔溶剂中的三组分反应在温和的反应条件和较短的反应时间下提供了结构多样的2-氨基恶唑和2-氨基噻唑,产率高至优异。 DES价格便宜,可生物降解,并且在任何实验室和行业中都更容易获得(见图15)。
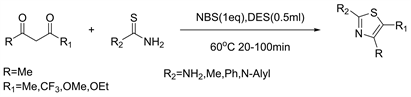
Figure 15. Synthesis of substituted 2-aminothiazoles in a one-pot three-component reaction
图15. 三组分一锅法合成2-氨基噻唑
乙醇作为绿色降解的化合物,被广泛应用于化学合成。2018年Julien等人 [18] 可以通过快速有效的一锅法,以乙醇为绿色溶剂轻松地制备带有各种取代基的高度官能化的5-溴-2-氨基-1,3-噻唑。该方法避免了使用金属催化剂和有毒试剂(见图16)。
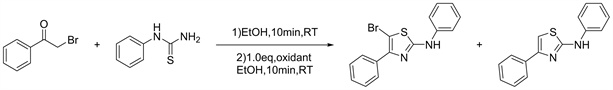
Figure 16. One-pot formation of highly functionalized 5-bromo-2-aminothiazoles
图16. 一锅合成高度官能化的5-溴-2-氨基噻唑
2.5. 熔融法合成氨基噻唑
无溶剂化能避免使用大量毒害性和挥发性的有机化合物,不仅减少污染,简化了实验操作和后处理过程,缩短反应时间和降低生产成本,而且往往还具有收率高选择性强等优点。因此无溶剂法成为实现绿色化学的一个重要途径。2015年Facchinetti等人 [19] 报告了一种简单,快速且环保的无溶剂方案,可通过Hantzsch缩合反应合成2-氨基噻唑,而无需使用催化剂。反应在几秒内可完成,且后处理简单,产率高(见图17)。
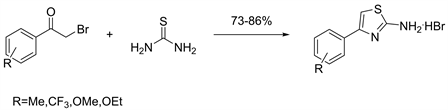
Figure 17. Solvent-free synthesis of 2-aminothiazoles
图17. 无溶剂法合成2-氨基噻唑
2016年Hassan等人 [20] 又开发出一种新的一步三组分无溶剂合成多种噻唑衍生物的方法。该方法使用便宜且容易获得的起始原料构建噻唑,无溶剂合成,微波加速反应,使用无毒无味的硫源,反应混合物的后处理简单以及最终产物易于分离和纯化等(图18)。
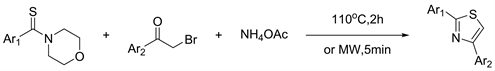
Figure 18. Synthesis of thiazole derivatives by reaction of tertiary thioamides, α-haloketones, and NH4OAc
图18. 通过叔硫酰胺,α-卤代酮和NH4OAc反应合成噻唑衍生物
2017年Ramin等人 [21] 报道了TBBDA与MNP @ SiO2-Pr-AP的结合可在无溶剂条件下有效催化取代的苯乙酮与硫脲的反应,从而以高收率和较短的反应时间获得2-氨基-4-芳基噻唑衍生物。这种方法的优势包括催化剂的可回收性(MNP @ SiO2-Pr-AP),反应物的可用性以及反应步骤简单(见图19)。

Figure 19. One-pot synthesis of 2-amino-4-arylthiazole derivatives
图19. 一锅合成2-氨基-4-芳基噻唑衍生物
2.6. 硫氰酸根参与的氨基噻唑合成
随着氨基噻唑类化合物应用的不断拓展,除了在传统方法上的改进,研究者还进一步研究和发现更加允许底物结构多样性以及高选择性的合成方法。
除了传统的α-卤代酮和取代的硫脲一步反应外,α-卤代酮还可以通过先硫氰化,再与相应的胺环化成相应的氨基噻唑类化合物。2012年Meshram等人 [22] 在水-酒精介质中,N-甲基咪唑与硫氰酸铵催化α-卤代酮羰基的环化反应,获得了取代的2-氨基噻唑衍生物。所描述的方法首次利用硫氰酸铵作为氨和硫氰酸根离子的来源,在水-醇介质中以一个锅反应顺序合成2-氨基噻唑。除了其简单性外,温和的反应条件外,广泛的底物适用性是该方案的显着特征(见图20)。
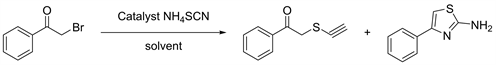
Figure 20. The synthesis of 4-phenyl-2-aminothiazole
图20. 4-苯基-2-氨基噻唑的合成
2014年Samimi等人 [23] 描述了在RuCl3存在下,在回流的乙腈中,使用硫氰酸铵与酮-氮丙啶环扩环成相应的2-氨基噻唑(54%~67%)。这是酮-氮丙啶化合物第一次应用于氨基噻唑的合成,扩大了氨基噻唑的合成途径(见图21)。
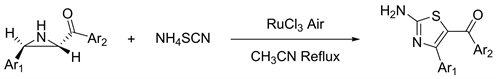
Figure 21. The reaction oftrans-2-benzoyl-3-phenylaziridines with ammonium thiocyanate in the presence of different catalysts
图21. 在不同催化剂存在下反式-2-苯甲酰基-3-苯基氮丙啶与硫氰酸铵的反应
如今,乙烯基叠氮化物已成为重要的合成子,尽管在很长一段时间内它们曾经被视为反应性叠氮基物种的“沉睡者”。2014年Zhang等人 [24] 报道了以七水合硫酸亚铁为催化剂,乙烯基叠氮化物和可商购的硫氰酸钾为原料,通过C-N键形成合成多取代的2-氨基噻唑衍生物的方法。该方法底物适用性广,使用无毒的试剂和催化剂,比传统的方法更环保(见图22)。
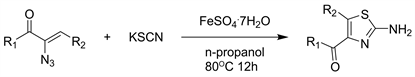
Figure 22. Synthesis of 2-aminothiazoles via C_N bond formation from vinyl azides and potassium thiocyanate
图22. 由乙烯基叠氮化物和硫氰酸钾通过C_N键合成2-氨基噻唑
2015年Tang等人 [25] 通过乙酸肟与异硫氰酸酯的铜催化偶联,在温和的反应条件下平稳地形成了各种4-取代和4,5-二取代的2-氨基噻唑。该过程涉及铜催化的N-O键断裂,乙烯基sp2 C-H键的活化和C-S/C-N键的形成(见图23)。
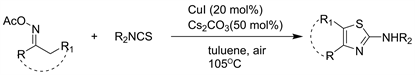
Figure 23. Cu(I)-catalyzed synthesis of 2-aminothiazoles from various oxime acetates and phenyl isothiocyanate
图23. Cu(I)催化从各种肟肟和苯基异硫氰酸酯合成2-氨基噻唑
2018年等人 [26] 报告了通过高效,无催化剂的多组分序列合成高度取代的2-氨基-1,3-噻唑的方法。与其他一锅法相反,此方法展示了真正的多组分反应的真实步骤,因为所有反应物都需要同时存在。该方法能够在杂环的4位和5位产生各种取代模式,这是由于亲核加成环化加成反应或Diels-Alder环加成多米诺序列引起的(见图24)。
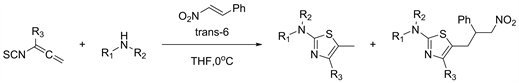
Figure 24. Synthesis of highly substituted 2-aminothiazoles
图24. 高度取代的2-氨基噻唑的合成
2019年Zhu等人 [27] 报道了通过α-硝基环氧化物,硫氰酸钾和伯胺的一锅三组分反应合成多取代的2-氨基噻唑的合成方法,该反应不需要任何添加剂高效且环保(见图25)。
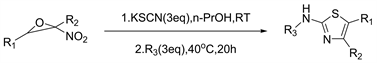
Figure 25. New synthesis of polysubstituted 2-aminothiazoles
图25. 新的多取代2-氨基噻唑合成方法
2019年Chen等人 [28] 已经开发了分别由乙酸钯(II)和溴化铁(III)催化以叠氮化乙烯基酯和硫氰酸钾为原料得到4-取代2-氨基噻唑和4-取代5-硫氰基-2-氨基噻唑的反应(见图26)。
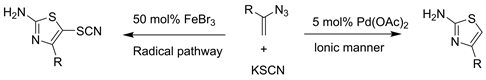
Figure 26. Selective access to 4-substituted 2-aminothiazoles and 4-substituted 5-thiocyano-2-aminothiazoles from vinyl azides and potassium thiocyanate switched by palladium and iron catalysts
图26. 从钯和铁催化剂转换得到的乙烯基叠氮化物和硫氰酸钾中选择性取代4-取代的2-氨基噻唑和4-取代的5-硫氰基-2-氨基噻唑
2.7. 其他
2014年Wang等人 [29] 报道了在多组分反应中实现了第一个两性离子控制的C-N键断裂,以炔硫醇锂,庞大的碳二亚胺和酰氯为原料合成N-酰基2-氨基噻唑的方法。N-酰基2-氨基噻唑是重要的药物中间体,一般合成是通过2-氨基噻唑与酰氯耦联。该方法一步合成,操作简单,产率高(见图27)。N-酰基2-氨基噻唑由于具有良好的生物活性,因此被认为是药物和药物化学领域中的一小类重要分子。17特别是当N-取代基为甲基时,N-酰基-N-甲基-2-氨基噻唑已被广泛使用。据报道是癌细胞抑制剂,抗pr病毒分子和正电子发射断层扫描(PET)成像的配体。N-酰基2-氨基噻唑的合成通常是通过2-氨基噻唑与羧酸衍生物的反应18或2-硫脲基乙酸与硫代乙酸的反应而获得的。1然而,已报道的N-酰基2-氨基噻唑的范围氨基噻唑类物质由于原料的缺乏而受到限制。本方法具有广泛的底物范围,是对现有N-酰基2-氨基噻唑合成库的宝贵补充。
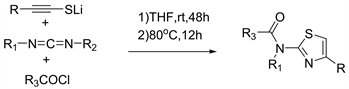
Figure 27. Substituent-controlled selective synthesis of N-Acyl 2-aminothiazoles
图27. N-酰基2-氨基噻唑的取代基控制的选择性合成
2017年Zhao等人 [30] 报道通过了α-硝基环氧化物,氰胺和硫化钠一锅三组分反应合成多取代的2-氨基噻唑的合成方法(见图28),并具有良好或优异的收率。
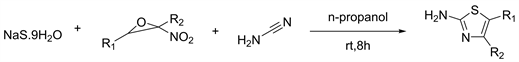
Figure 28. One-pot three-component protocol for the synthesis of substituted 2-aminothiazoles
图28. 一锅法三组分合成多取代2-氨基噻唑
2018年Ma等人 [31] 报道了通过1,3-二溴-5,5-二甲基尿囊素(DBH)介导的苯乙烯和硫脲的氧化环化合成2-氨基噻唑的有效方法。该方法条件温和,操作简单,使用试剂低毒。以苯乙烯为起始原料合成抗炎药fanetizole证明了该方法的成功应用(见图29)。
3. 小结与展望
氨基噻唑及其衍生物是药物和有机化学中重要的杂环化合物,大量的药物分子中含有氨基噻唑,因此氨基噻唑的合成研究受到广泛关注。在这些氨基噻唑衍生物合成方法中,Hantzsch合成法简单、底物适用性广,目前应用最多。但该合成方法仍存在不足,如溶剂不环保,催化剂价格昂贵,产率低,后处理困难等。因此,研究者从以下四方面进行改造,优化反应条件。
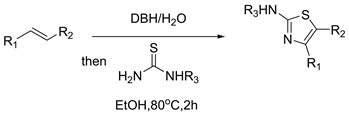
Figure 29. Transformation of alkenes to 2-aminothiazoles promoted by DBH
图29. DBH促进烯烃向2-氨基噻唑的转化
1) 选择高效的催化剂。有效的催化剂能够大大提高反应效率,缩短反应时间,提高产率。因此探寻高效的催化剂对于优化反应条件尤为重要。
2) 选择绿色溶剂,使用绿色溶剂一直是化学界所倡导追求研究的,研究绿色溶剂能够更好地促进绿色化学的发展。
3) 选择简单可行的外部条件。如微波能大大减少所需时间,提高产率等。还有一些未被深入探究的外部条件,如光化学、电化学合成,超声波合成等。
4) 探索新的合成方法,扩展底物多样性。
探索绿色、环保经济的氨基噻唑合成方法将是今后科研工作者的努力方向。
基金项目
江苏省自然科学基金BK20190608;江苏省研究生科研与实践创新计划项目(KYCX20-1965)。
文章引用
于丽杰,Rajendran Satheeshkumar,王文龙. 氨基噻唑合成研究进展
Study on the Synthesis of Aminothiazole Derivatives[J]. 药物化学, 2021, 09(02): 14-27. https://doi.org/10.12677/HJMCe.2021.92003
参考文献
- 1. Gouda, M.A., Berghot, M.A., Baz, E.A., et al. (2012) Synthesis, Antitumor and Antioxidant Evaluation of Some New Thiazole and Thiophene Derivatives Incorporated Coumarin Moiety. Medicinal Chemistry Research, 21, 1062-1070. https://doi.org/10.1007/s00044-011-9610-8
- 2. Simmons, M.S. (1996) The Role of Catalysts in Environmentally Benign Synthesis of Chemicals. In: Anastas, P.T. and Williamson, T.C., Eds., Green Chemistry, ACS Symposium Se-ries Volume 626, American Chemical Society, Washington DC, 116-130.
- 3. Abdolmohammadi, S. (2013) Simple Route to Indeno[1,2-b]quinoline Derivatives via a Coupling Reaction Catalyzed by TiO2 Nanoparticles. Chinese Chemi-cal Letters, 24, 318-320.
- 4. Safari, J., Abedi-Jazini, Z., Zarnegar, Z., et al. (2015) TiO2 Nanoparticles Supported on the Fe3O4@SiO2 Nanocomposites: A Novel Magnetic Nanocatalyst for the Synthesis of 2-Aminothiazoles. Journal of Nanoparticle Research, 17, 495. https://doi.org/10.1007/s11051-015-3298-5
- 5. Safari, J., Abedi-Jazini, Z., Zarnegar, Z., et al. (2016) Nanochitosan: A Biopolymer Catalytic System for the Synthesis of 2-Aminothiazoles. Cataly-sis Communications, 77, 108-112. https://doi.org/10.1016/j.catcom.2016.01.007
- 6. Safari, J. and Sadeghi, M. (2017) Nanostarch: A Novel and Green Catalyst for Synthesis of 2-Aminothiazoles. Monatshefte für Chemie Chemical Monthly, 148, 745-749. https://doi.org/10.1007/s00706-016-1805-8
- 7. Sadeghi, M., Safari, J. and Zarnegar, Z. (2016) Synthesis of 2-Aminothiazoles from Methylcarbonyl Compounds Using a Fe3O4 Nanoparticle-N-Halo Reagent Catalytic System. RSC Advances, 6, 64749-64755. https://doi.org/10.1039/C6RA11175K
- 8. Sharma, A., Gudala, S., Ambati, S.R., et al. (2018) On-Water NiFe2O4 Nanoparticle-Catalyzed One-Pot Synthesis of Biofunctionalized Pyrimidine-Thiazole Derivatives: In Silico Binding Af-finity and in Vitro Anticancer Activity Studies. Chemistry Select, 3, 11012-11019. https://doi.org/10.1002/slct.201801414
- 9. Zarnegar, Z., Shokrani, Z. and Safari, J. (2019) Asparagine Function-alized Al2O3 Nanoparticle as a Superior Heterogeneous Organocatalyst in the Synthesis of 2-Aminothiazoles. Journal of Molecular Structure, 1185, 143-152. https://doi.org/10.1016/j.molstruc.2019.02.080
- 10. Roslan, I.I., Ng, K.H., Gondal, M.A., et al. (2018) Visible Light-Mediated Coupling of Thioureas and 1,3-Dicarbonyls: Towards a Leaving Group-Free Synthesis of Aminothia-zoles. Advanced Synthesis & Catalysis, 360, 1584-1589. https://doi.org/10.1002/adsc.201701565
- 11. Ghodse, S.M. and Telvekar, V.N. (2015) Synthesis of 2-Aminothiazole Derivatives from Easily Available Thiourea and Alkyl/Aryl Ketones Using Aqueous NaICl2. Tetrahe-dron Letters, 56, 472-474. https://doi.org/10.1016/j.tetlet.2014.11.140
- 12. Abedi-Jazini, Z., Safari, J., Zarnegar, Z., et al. (2018) A Simple and Efficient Method for the Synthesis of 2-Amino- thiazoles under Mild Conditions. Polycyclic Aromatic Compounds, 38, 231-235. https://doi.org/10.1080/10406638.2016.1200104
- 13. Zarnegar, Z., Sadeghi, M., Alizadeh, R., et al. (2018) HX-DMSO: A Novel Liquid Halogenating System for Synthesis of 2-Aminothiazoles via Csp3H Bond Functionaliza-tion. Journal of Molecular Liquids, 255, 76-79. https://doi.org/10.1016/j.molliq.2018.01.119
- 14. Sun, J., Ge, H., Zhen, X., et al. (2018) TBHP/AIBN-Mediated Synthesis of 2-Amino-Thioazoles from Active Methylene Ketones and Thiourea under Metal-Free Conditions. Tetrahe-dron, 74, 2107-2114. https://doi.org/10.1016/j.tet.2018.02.064
- 15. Wagare, D.S., Netankar, P.D., Shaikh, M., et al. (2017) Highly Effi-cient Microwave-Assisted One-Pot Synthesis of 4-aryl-2-aminothiazoles in Aqueous Medium. Environmental Chemistry Letters, 15, 475-479. https://doi.org/10.1007/s10311-017-0619-1
- 16. Zhao, J., Xu, J., Chen, J., et al. (2015) Potassium Iodide and Ammonium Nitrate Catalyzed Aerobic Oxidative Cyclization of Ketones with Thioureas in Ionic Liquid: An Access to 2-Aminothiazoles. Tetrahedron, 71, 539-543. https://doi.org/10.1016/j.tet.2014.12.044
- 17. Azizi, N., Rahimi, Z. and Alipour, M. (2015) Deep Eutectic Sol-vent-Assisted One-Pot Synthesis of 2-Aminothiazole and 2-Aminoxazole Derivatives. Comptes Rendus Chimie, 18, 626-629. https://doi.org/10.1016/j.crci.2014.10.001
- 18. Prevost, J.R.C., Kozlova, A., Saadi, B.E., et al. (2018) Convenient One-Pot Formation of Highly Functionalized 5-Bromo-2-aminothiazoles, Potential Endocannabinoid Hydro-lase MAGL Inhibitors. Tetrahedron Letters, 59, 4315-4319. https://doi.org/10.1016/j.tetlet.2018.10.055
- 19. Facchinetti, V., Avellar, M.M., Nery, A.C.S., et al. (2016) An Eco-Friendly, Hantzsch-Based, Solvent-Free Approach to 2-Aminothiazoles and 2-Aminoselenazoles. Synthesis, 48, 437-440. https://doi.org/10.1055/s-0035-1560534
- 20. Zali-Boeini, H. and Mansouri, S.G. (2016) One-Step Three-Component and Solvent-Free Synthesis of Thiazoles from Tertiary Thioamides. Journal of the Iranian Chemical Society, 13, 1571-1577. https://doi.org/10.1007/s13738-016-0873-3
- 21. Ghorbani-Vaghei, R., Alavinia, S., Merati, Z., et al. (2018) MNPs@ SiO2-Pr-AP: A New Catalyst for the Synthesis of 2-Amino-4-aryl Thiazole Derivatives. Applied Organometal-lic Chemistry, 32, e4127. https://doi.org/10.1002/aoc.4127
- 22. Meshram, H.M., Thakur, P.B., Babu, B.M., et al. (2012) Convenient and Simple Synthesis of 2-Aminothiazoles by the Reaction of α-Halo Ketone Carbonyls with Ammo-nium Thiocyanate in the Presence of N-Methylimidazole. Tetrahedron Letters, 53, 5265-5269. https://doi.org/10.1016/j.tetlet.2012.07.080
- 23. Samimi, H.A. and Mohammadi, S. (2014) New One-Pot Approach to Regio-Synthesis of Substituted 2-Aminothiazoles from the Corresponding Keto-Aziridines. Journal of the Iranian Chemical Society, 11, 69-73. https://doi.org/10.1007/s13738-013-0276-7
- 24. Zhang, G., Chen, B., Guo, X., et al. (2015) Iron (II)-Promoted Synthesis of 2-Aminothiazoles via C-N Bond Formation from Vinyl Azides and Potassium Thiocyanate. Advanced Syn-thesis & Catalysis, 357, 1065-1069. https://doi.org/10.1002/adsc.201400856
- 25. Tang, X., Zhu, Z., Qi, C., et al. (2016) Copper-Catalyzed Coupling of Oxime Acetates with Isothiocyanates: A Strategy for 2-Aminothiazoles. Organic Letters, 18, 180-183. https://doi.org/10.1021/acs.orglett.5b03188
- 26. Richter, F., Seifert, J., Korb, M., et al. (2018) Real Multicompo-nent Reactions: Synthesis of Highly Substituted 2-Aminothiazoles. European Journal of Organic Chemistry, 2018, 4673-4682. https://doi.org/10.1002/ejoc.201800701
- 27. Zhu, Y., Chen, W., Zhao, D., et al. (2019) One-Pot Three-Component Strategy for Polysubstituted 2-Aminothiazoles via Ring Opening of α-Nitro Epoxides. Synthesis, 51, 2023-2029. https://doi.org/10.1055/s-0037-1612101
- 28. Chen, B., Guo, S., Guo, X., et al. (2015) Selective Ac-cess to 4-Substituted 2-Aminothiazoles and 4-Substituted 5-Thiocyano-2-aminothiazoles from Vinyl Azides and Potas-sium Thiocyanate Switched by Palladium and Iron Catalysts. Organic Letters, 17, 4698-4701. https://doi.org/10.1021/acs.orglett.5b02152
- 29. Wang, Y., Zhao, F., Chi, Y., et al. (2014) Substituent-Controlled Selective Synthesis of N-acyl 2-Aminothiazoles by Intramolecular Zwitterion-Mediated C-N Bond Cleavage. The Journal of Organic Chemistry, 79, 11146-11154. https://doi.org/10.1021/jo502123k
- 30. Guo, S., Zhao, D., Zhu, Y., et al. (2017) One-Pot Three-Component Pro-tocol for the Synthesis of Substituted 2-Aminothiazoles. Synthetic Communications, 47, 1758-1764. https://doi.org/10.1080/00397911.2017.1350275
- 31. Ma, C., Miao, Y., Zhao, M., et al. (2018) Synthesis of 2-Aminothiazoles from Styrene Derivatives Mediated by 1,3-Dibromo-5,5-dimethylhydrantoin (DBH). Tetrahedron, 74, 3602-3607. https://doi.org/10.1016/j.tet.2018.05.021
NOTES
*通讯作者。