Advances in Clinical Medicine
Vol.
12
No.
04
(
2022
), Article ID:
50103
,
9
pages
10.12677/ACM.2022.124369
仑伐替尼对比索拉非尼在不可切除性肝癌患者中的有效性和安全性的Meta分析
郑小丽,李晓雅,张莉*
新疆医科大学第一附属医院内科,新疆 乌鲁木齐
收稿日期:2022年3月6日;录用日期:2022年3月29日;发布日期:2022年4月11日

摘要
目的:系统评价和分析分子靶向治疗药物仑伐替尼和索拉非尼在不可切除性肝癌中的有效性和安全性。方法:计算机检索中国期刊全文数据库(CNKI)、SCOPUS、万方数据库、Embase、Pubmed、Web of science等数据库搜索仑伐替尼和索拉非尼治疗不可切除肝癌的相关临床研究,由2位评价员独立筛选文献,整个过程隐藏作者姓名、期刊名称、年份和国家,提取数据并纳入评估研究的质量后,采用Revman5.4软件进行分析。结果:根据纳入标准和排除标准,最终纳入7篇文献,其中3篇为随机性对照试验(RCTs),4篇为回顾性的队列研究,共计2603例肝癌患者,其中索拉非尼组1311名患者,仑伐替尼组1292名患者。通过进行Meta分析得出试验组仑伐替尼患者的PFS优于对比组索拉非尼[HR = 0.68, 95% CI (0.57~0.81), P < 0.05];但是仑伐替尼组和索拉非尼组在OS的比较差异上无统计学意义[HR = 0.90, 95% CI (0.82~1.00), P > 0.05];仑伐替尼组与索拉非尼组在ORR方面的比较差异有统计学意义[OR = 6.85, 95% CI (3.34~ 14.04), P < 0.05]。仑伐替尼组与索拉非尼组在不良反应方面主要有高血压、手足综合征、腹泻、体重下降、食欲下降、蛋白尿、皮疹及血液系统不良反应等,通过Meta分析得出二者严重不良反应的差异无统计学意义[HR = 1.36, 95% CI (0.85~2.17), P > 0.05]。结论:与索拉非尼相比,试验组仑伐替尼明显延长了不可切除性肝癌患者的无进展生存期,但总的生存时间无明显差别。仑伐替尼组和索拉非尼组的不良反应主要为高血压。
关键词
仑伐替尼,索拉非尼,肝癌,有效性,安全性

A Meta-Analysis of the Efficacy and Safety of Lenvatinib versus Sorafenib in Patients with Unresectable Liver Cancer
Xiaoli Zheng, Xiaoya Li, Li Zhang*
Department of Internal Medicine, First Affiliated Hospital of Xinjiang Medical University, Urumqi Xinjiang
Received: Mar. 6th, 2022; accepted: Mar. 29th, 2022; published: Apr. 11th, 2022

ABSTRACT
Objective: To systematically evaluate and analyze the efficacy and safety of molecularly targeted therapy drugs lenvatinib and sorafenib in unresectable liver cancer. Methods: The computer retrieved the Chinese Journal Full-Text Database (CNKI), SCOPUS, Wanfang Database, Embase, Pubmed, Web of science and other databases to search for relevant clinical studies of resectable liver cancer in the treatment of lenvatinib and sorafenib, and the literature was independently screened by two reviewers, and the author’s name, journal name, year and country were hidden in the whole process, and after extracting the data and including the quality of the assessment study, it was analyzed by Revman5.4 software. Results: According to the inclusion criteria and exclusion criteria, seven literature articles were finally included, including 3 randomized controlled trials (RCTs) and 4 retrospective cohort studies, totaling 2603 patients with liver cancer, including 1311 patients in the sorafenib group and 1292 patients in the lenvatinib group. Meta-analysis showed that the PFS of patients with lenvatinib in the experimental group was superior to that of sorafenib in the comparison group [HR = 0.68, 95% CI (0.57~0.81), P < 0.05]; however, the difference in OS between the lenvatinib group and the sorafenib group was not statistically significant [HR = 0.90, 95% CI (0.82~1.00), P > 0.05]; the difference in ORR between the lenvatinib group and the sorafenib group was statistically significant [OR = 6.85, 95% CI (3.34~14.04), P < 0.05]. In terms of adverse reactions, the lenvatinib group and the sorafenib group mainly had hypertension, hand-foot syndrome, diarrhea, weight loss, decreased appetite, proteinuria, rash and hematologic adverse reactions, etc. The difference in serious adverse reactions between the two was not statistically significant by Meta-analysis [HR = 1.36, 95% CI (0.85~2.17), P > 0.05]. Conclusion: Compared with sorafenib, the trial group of lenvatinib significantly prolonged the progression-free survival of patients with unresectable liver cancer, but there was no significant difference in overall survival time. Hypertension was mainly observed in the lenvatinib and sorafenib groups.
Keywords:Lenvatinib, Sorafenib, Liver Cancer, Effectiveness, Safety

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
据2018年全球癌症相关统计,肝癌居全球恶性肿瘤死亡原因第四位 [1]。肝癌早期症状多不明显,绝大多数患者在被诊断时均处于不可手术切除的晚期阶段 [2]。虽然肝癌的治疗方法颇多,但许多晚期患者却无法获得明显生存获益。随着肿瘤研究的深入,许多驱动基因被发现,靶向治疗正全面展开。仑伐替尼属于口服多激酶抑制剂,可选择性抑制酪氨酸激酶(如VEGFR1、VEGFR2、VEGFR3)、成纤维细胞生长因子受体(FGFR1、FGFR2、FGFR3、FGFR4)、PDGFR2、FGF和RET来抑制肿瘤血管生成和生长 [3]。直至2018年一项发表在Lancet杂志上的研究得出结论,仑伐替尼非劣效于索拉非尼 [4],可以给晚期肝癌患者带来生存获益,并被FDA批准用于晚期肝癌患者的一线治疗,此外还被批准用于分化型甲状腺癌 [5] 的治疗。然而,对于仑伐替尼和索拉非尼治疗肝癌的临床应用中仍具有一些争议,本研究通过系统性评价二者在晚期肝癌治疗方面的有效性及安全性,为临床实践提供循证医学证据。
2. 资料与方法
2.1. 纳入标准及排除标准
2.1.1. 纳入标准
1) RCT或回顾性队列研究,可检索到全文,语种为中文或英文;2) 研究对象为经过病理明确诊断的既往未曾接受过系统性全身治疗的晚期肝癌患者;3) 干预措施试验组为仑伐替尼,对照组为索拉非尼;4) 能获得用于诊断及预后评价的原始数据的文献。
2.1.2. 排除标准
1) 研究方法不健全,质量较差的研究;单个队列的非比较性研究;2) 分子靶向治疗与其他治疗相结合、缺乏生存数据的文章;3) 在二线环境下(即索拉非尼进展后)进行的研究;4) 重复发表的文章;5) 无法获得全文的会议摘要、评论、个案报道和综述类文章;6) 其他不符合纳入标准的研究。
2.2. 干预措施
试验组使用仑伐替尼,给药剂量:口服仑伐替尼12 mg/day (体重≥60 kg)或8 mg/day (体重<60 kg),对照组使用索拉非尼,给药剂量:口服400 mg,每日两次。直至出现肿瘤进展或无法耐受治疗相关的不良反应。
2.3. 结局指标
主要包括疗效性指标和安全性指标。疗效指标包括总生存期(OS)、无进展生存期(PFS)、客观反应率(ORR)。次要结果是无进展生存率(PFS),客观反应率(ORR)。安全性指标是指在治疗期间分子靶向治疗药物引起的相关毒副反应发生率等。
2.4. 检索策略
检索中国期刊全文数据库(CNKI)、SCOPUS、万方数据库、Embase、Pubmed、Web of science数据库。中文检索词包括:肝癌,肝恶性肿瘤,肝细胞肝癌,肝细胞癌,原发性肝癌,仑伐替尼,乐伐替尼,索拉非尼等。英文检索词包括:Liver Neoplasm, Hepatocellular cancer, Hepatic cancer, Liver Cancer, sorafenib, lenvatinib等。
2.5. 文献筛选与资料提取
资料提取内容包括:1) 纳入研究的基本信息:研究名称、第一作者、发表杂志及发表时间;2) 研究对象的基线特征,包括各组的样本数、性别、EOCG评分、Child-Pugh分级等;3) 干预措施的具体细节;4) 主要的结局指标。按照PICO原则由2位评审员独立进行筛选文件和提取资料,如果意见不一致,征求第三方意见,并讨论解决办法,缺乏信息的应尽量与作者联系予以补充。
2.6. 研究方法学质量评价
本研究纳入的7篇文献中(表1),有3篇为RCT,4篇为回顾性队列研究。对于RCT研究按照Cochrane系统评价手册对纳入的研究进行方法学质量评价,主要内容包括:1) 采用随机方法的种类及其正确性,2) 是否采用盲法;3) 盲法结果评估;4) 随机分配方法是否采用隐藏措施;5) 是否为不完整结果数据;6) 是否存在选择性数据报告;7) 其他偏倚来源。应用Cochrane系统评价手册对纳入3篇文献进行评价,在随机分配方案的产生、分配隐藏描述完整方面均进行评估,均未实施盲法,其中一项研究对退出和失访做了描述,余2项未进行描述,其他偏倚情况均不清楚(表2),并运用Revman5.4软件进行偏倚风险评估(图1)。
对纳入的4篇回顾性队列研究,属于观察性研究,则需要通过Newcastle Ottawa scale (NOS)进行评价。评价项目包括对象选择(Selection)、可比性(Comparability)、结局(Outcome)。本文对纳入4篇回顾性队列研究进行了质量评估(表3)。在倾向得分匹配研究的情况下,只考虑匹配后的数据。
2.7. 统计学处理
采用Revman5.4软件进行meta分析,对于生存指标的分析依据PARMAR [6] 和Jayne [7] 等推荐的方法,通过计算风险比(LogHR)值和标准误(SE),并应用方差倒数法估计和合并HR及95% CI。若为二分类变量则采用相对危险度(RR)及95% CI为效应分析统计量。纳入研究结果间的异质性采用(x2)卡方检验,若各研究之间具有良好的同质性,如P > 0.10,I2 < 50%,则使用固定效应模型进行合并分析,反之,若各研究之间存在统计学异质性,如P < 0.10,I2 > 50%,采用随机效应模型进行分析。以P < 0.05或P < 0.01表示差异有统计学意义。
3. 结果
3.1. 纳入的文献
通过最初数据库检索共获得147篇文献,其中CNKI数据库检索到20篇文献,万方数据库检索到10篇文献,Embase数据库检索到16篇文献,Pubmed检索到13篇文献,Web of science检索到25篇文献,SCOPUS检索到63篇文献,经过剔除重复、阅读文题和摘要并排除综述、会议等,初筛后获得9篇文献,阅读全文复筛,最终纳入共7篇文献,其中3篇为RCT,其余4篇为回顾性队列研究。
3.2. 纳入研究的基本特征和方法学质量评价
Kudo [4]、Yamashita [8]、Briggs [9]、Kim [10]、KUZUYA [11]、Nakano [12]、Tomonari [13] 等7项研究共有2603例肝癌患者随机分组,其中试验组仑伐替尼组1292例,索拉非尼组1311例。纳入研究的基本信息包括:纳入研究的名称、第一作者、研究时间、EOCG评分、Child-Pugh分级、研究干预措施等(见表1)。纳入研究方法学质量评价结果(见表2,表3及图1)。纳入RCT研究的偏倚风险比例及偏倚风险总结情况(见图2,图3)。
Table 1. Basic features of the included literature
表1. 所纳入文献的基本特征
Table 2. Include methodological quality assessments of studies
表2. 纳入研究方法学质量评估
Table 3. NOS scores of the included studies
表3. 纳入研究的NOS评分

Figure 1. Summary of the RCT risk bias
图1. RCT风险偏倚总结
4. Meta分析结果
4.1. 仑伐替尼组对比索拉非尼组明显延长了晚期肝癌患者的PFS
纳入的6个研究有报告了PFS,各研究结果间有异质性(P = 0.01, I2 = 63%),需要用随机效应模型进行Meta分析,结果如图2显示,仑伐替尼组肝癌患者的PFS显著长于索拉非尼组[HR = 0.68, 95% CI (0.57~0.81), P < 0.05]。
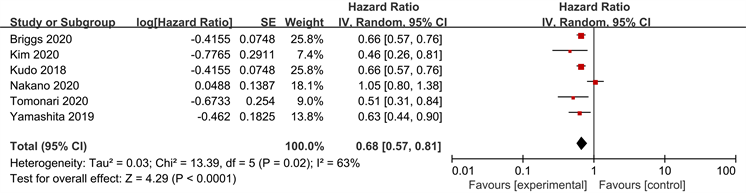
Figure 2. Meta-analysis forest plot of PFS in both groups
图2. 两组患者PFS的Meta分析森林图
4.2. 仑伐替尼组和索拉非尼组在延长患者OS方面无明显差异
纳入的研究中有6个报告了OS,各研究结果见无统计学异质性(P = 0.31, I2 = 16%),应用固定效应模型进行Meta分析结果如图3显示,仑伐替尼组肝癌患者的OS和索拉非尼组的患者OS之间没有明显的统计学差异[HR = 0.90, 95% CI (0.82~1.00), P > 0.05]。

Figure 3. Meta-analysis forest plot of OS in both groups
图3. 两组患者OS的Meta分析森林图
4.3. 仑伐替尼组和索拉非尼组治疗肝癌患者的客观反应率(ORR)
纳入的研究中有5个报告了ORR,各研究结果间存在统计学异质性(P = 0.02, I2 = 66%),应用随机效应模型进行Meta分析结果如图4显示,仑伐替尼组和索拉非尼组对比有统计学意义[HR = 6.85, 95% CI (3.34~14.04), P < 0.05]。
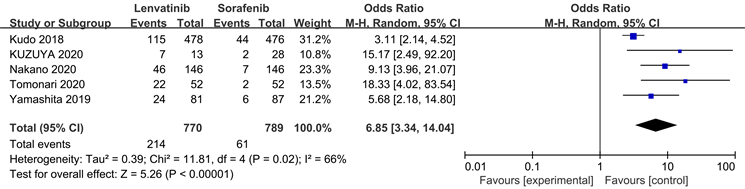
Figure 4. Meta-analysis forest plot of the objective response rates of patients in both groups
图4. 两组患者客观反应率的Meta分析森林图
4.4. 仑伐替尼组和索拉非尼组治疗晚期肝癌的不良反应
纳入的相关研究中有6项对治疗相关的严重不良反应进行了相关报道,最常发生的不良反应主要为高血压、手足综合征和腹泻,其他不良反应有蛋白尿、体重下降、食欲下降、肝功能异常、甲状腺相关疾病及血液系统反应等。对相关不良反应进行Meta分析结果如图5显示仑伐替尼组和索拉非尼组在严重不良反应(≥III级)方面无差异性统计学意义[HR = 1.36, 95% CI (0.85~2.17), P < 0.05]。
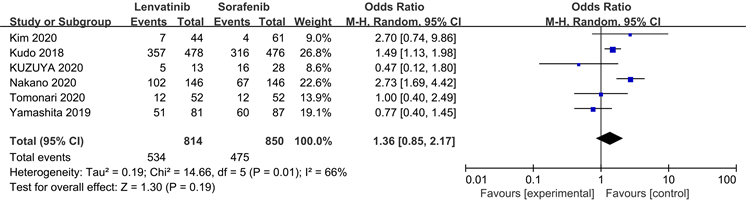
Figure 5. Meta-analysis of forest plots of the incidence of adverse effects in both groups
图5. 两组患者不良反应发生率的Meta分析森林图
高血压
纳入的研究中有6篇报道了III~IV级高血压的发生,试验组即仑伐替尼组814名患者中有185例发生III~IV级高血压,索拉非尼组850名患者中有101例发生III~IV级高血压。各研究组之间存在统计学异质性(P = 0.02, I2 = 66%)。应用随机效应模型进行Meta分析结果显示(如图6)仑伐替尼组对比索拉非尼组之间有统计学意义。结果提示治疗可能会引起高血压,需要在治疗过程中进行密切监测。
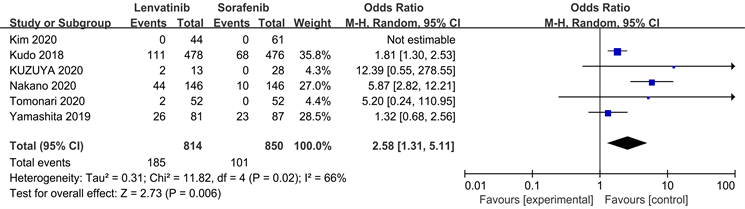
Figure 6. Meta-analysis of forest plots of hypertensive adverse effects in both groups
图6. 两组患者发生高血压不良反应的Meta分析森林图
5. 讨论
肝癌的发生发展、转移与多种基因突变和细胞信号传导密切相关 [14] [15],在多酪氨酸激酶抑制剂索拉非尼取得前所未有的成功之前,对HCC患者一直没有有效的药物治疗。直到一项REFLECT研究,即III期随机、多中心、开放标签、非劣效性试验纳入了954例患者,并比较了仑伐替尼与索拉非尼对不可切除的HCC患者一线治疗的疗效 [2] 才显示出阳性和有希望的结果。仑伐替尼是另一种口服小分子多激酶抑制剂,已被证明具有很强的抗血管生成和抗肿瘤作用,并被批准用于分化型甲状腺癌 [5] 的治疗。该研究最终达到其主要终点(OS),仑伐替尼的HR为0.92 (95% CI, 0.79~1.06),中位OS为13.6个月,索拉非尼为12.3个月。基于此仑伐替尼被NCCN指南2.2019推荐作为晚期HCC的第二个一线靶向分子治疗药物并成为晚期HCC患者一线治疗的一种替代方案 [4]。但在现实实践中关于其实际有效性和安全性的证据仍然有限,因此需要更多循证医学证据。所以本研究通过仑伐替尼对比索拉非尼的临床研究的Meta分析,我们进行了几个比较关键的观察,得出了一些结论。
本研究共纳入了7篇研究,Meta分析显示两种治疗方法确定了可比性的总生存结果。与索拉非尼组相比,仑伐替尼延长了无进展生存期[HR = 0.68, 95% CI (0.57~0.81), P < 0.05],仑伐替尼组和索拉非尼组对比ORR有统计学意义[HR = 6.85, 95% CI (3.34~14.04), P < 0.05]。总的生存期方面并没有明显的差别(HR = 0.90, 95% CI (0.82~1.00), P > 0.05]。安全性方面,二者并没有明显的统计学差异[HR = 1.36, 95% CI (0.85~ 2.17), P < 0.05],最严重的不良反应是高血压。我们的结论与REFLECT研究结果是一致的。
本次的Meta分析也有一些局限性:1) 仑伐替尼是刚批准不久的药物,临床研究不多,所以纳入的文献较少,样本量可能不太足够。2) 各研究中纳入人群特征分布存在差异,同时缺乏一些相关数据,例如肿瘤阶段和基线甲胎蛋白,因此无法调查几个变量对最终结果的影响。3) 纳入的研究随机对照试验数量有限和招募的患者不允许进行特定的亚组和敏感性分析。随访时间不足和不均匀可能高估了临床结果。4) 在一些比较中存在异质性,但是对主要结果的分析给予了证据支持。5) 因为纳入的研究多数来源于国外的相关研究,中国人群的实验数据尚不足,需要进一步研究。
综上所述,仑伐替尼在治疗不可切除性肝癌方面具有一定优势,然而由于纳入研究的数量和质量限制,需要更多的高质量、多中心和前瞻性研究来证实,从而为临床循证提供更多证据。
文章引用
郑小丽,李晓雅,张 莉. 仑伐替尼对比索拉非尼在不可切除性肝癌患者中的有效性和安全性的Meta分析
A Meta-Analysis of the Efficacy and Safety of Lenvatinib versus Sorafenib in Patients with Unresectable Liver Cancer[J]. 临床医学进展, 2022, 12(04): 2559-2567. https://doi.org/10.12677/ACM.2022.124369
参考文献
- 1. Bray, F., Ferlay, J., Soerjomataram, I., Siegel, R.L., Torre, L.A. and Jemal, A. (2018) Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians, 68, 394-424. https://doi.org/10.3322/caac.21492
- 2. Zou, H., Zhu, C.Z., Wang, C., et al. (2017) Recurrence of Barcelona Clinic Liver Cancer Stage a Hepatocellular Carcinoma after Hepatectomy. The American Journal of the Medical Sciences, 354, 262-267. https://doi.org/10.1016/j.amjms.2017.05.014
- 3. Zhu, A.X., Park, J.O., Ryoo, B.Y., et al. (2015) Ramucirumab versus Placebo as Second-Line Treatment in Patients with Advanced Hepatocellular Carcinoma Following First-Line Therapy with Sorafenib (REACH): A Randomised, Double-Blind, Multicentre, Phase 3 Trial. The Lancet Oncology, 16, 859-870. https://doi.org/10.1016/S1470-2045(15)00050-9
- 4. Kudo, M., Finn, R.S., Qin, S., et al. (2018) Lenvatinib ver-sus Sorafenib in First-Line Treatment of Patients with Unresectable Hepatocellular Carcinoma: A Randomised Phase 3 Non-Inferiority Trial. The Lancet, 391, 1163-1173. https://doi.org/10.1016/S0140-6736(18)30207-1
- 5. Abou-Alfa, G.K., Niedzwieski, D., Knox, J., et al. (2016) Phase III Randomized Study of Sorafenib plus Doxorubicin versus Sorafenib in Patients with Advanced Hepatocellular Carcinoma (HCC): CALGB 80802 (Alliance). Journal of Clinical Oncology, 34, 192. https://doi.org/10.1200/jco.2016.34.4_suppl.192
- 6. Parmar, M.K.B., Torri, V. and Stewart, L. (1998) Extracting Summary Statistics to Perform Meta-Analyses of the Published Literature for Survival Endpoints. Statistics in Medicine, 17, 2815-2834. https://doi.org/10.1002/(SICI)1097-0258(19981230)17:24<2815::AID-SIM110>3.0.CO;2-8
- 7. Tierney, J.F., Stewart, L.A., Ghersi, D., Burdett, S. and Sydes, M.R. (2007) Practical Methods for Incorporating Summary Time-to-Event Data into Meta-Analysis. Trials, 8, 16. https://doi.org/10.1186/1745-6215-8-16
- 8. Yamashita, T., Kudo, M. and Ikeda, K. (2019) REFLECT—A Phase 3 Trial Comparing Efficacy and Safety of Lenvatinib to Sorafenib for the Treatment of Unresectable Hepatocellular Carcinoma: An Analysis of Japanese Subset. Journal of Gastroenterology, 55, 113-122. https://doi.org/10.1007/s00535-019-01642-1
- 9. Briggs, A., Daniele, B. and Dick, K. (2013) Covariate-Adjusted Analysis of the Phase 3 REFLECT Study of Lenvatinib versus Sorafenib in the Treatment of Unresectable Hepatocellular Carcinoma. British Journal of Cancer, 122, 1754-1759. https://doi.org/10.1038/s41416-020-0817-7
- 10. Kim, S., Kim, K.H., Kim, B.K., Park, J.Y., Ahn, S.H., Kim, D.Y. and Kim, S.U. (2020) Lenvatinib Is Independently Associated with the Reduced Risk of Progressive Disease When Compared to Sorafenib in Patients with Advanced Hepatocellular Carcinoma. Journal of Gastroenterology and Hepatology, 36, 1317-1325. https://doi.org/10.1111/jgh.15355
- 11. Kuzuya, T., Ishigami, M., Ito, T., Ishizu, Y., Honda, T., Ishikawa, T. and Fujishiro, M. (2020) Sorafenib vs. Lenvatinib as First-Line Therapy for Advanced Hepatocellular Carcinoma with Portal Vein Tumor Thrombosis. Anticancer Research, 40, 2283-2290. https://doi.org/10.21873/anticanres.14193
- 12. Nakano, M., Kuromatsu, R., Niizeki, T., Okamura, S., Iwamoto, H., Shimose, S., Shirono, T., Noda, Y., Kamachi, N., Koga, H. and Torimura, T. (2020) Primary Treatment with Mo-lecular-Targeted Agents for Hepatocellular Carcinoma: A Propensity Score Matching Analysis. Hepatology Commu-nications, 4, 1218-1228. https://doi.org/10.1002/hep4.1535
- 13. Tomonari, T., Sato, Y., Tani, J., Hirose, A., Ogawa, C., Morishita, A., Tanaka, H., Tanaka, T., Taniguchi, T., Okamoto, K., Sogabe, M., Miyamoto, H., Muguruma, N., Uchida, K., Masaki, T. and Takayama, T. (2020) Comparison of Therapeutic Outcomes of Sorafenib and Lenvatinib as Primary Treatments for Hepatocellular Carcinoma with a Focus on Molecular-Targeted Agent Sequential Therapy: A Propensity Score-Matched Analysis. Hepatology Research, 51, 472-481. https://doi.org/10.1111/hepr.13597
- 14. Abou-Alfa, G.K., Meyer, T., Cheng, A.L., et al. (2018) Cabozantinib in Patients with Advanced and Progressing Hepatocellular Carcinoma. The New England Journal of Medicine, 379, 54-63. https://doi.org/10.1056/NEJMoa1717002
- 15. Zhu, A.X., Kang, Y.K., Yen, C.J., et al. (2018) REACH-2: A Randomized, Double-Blind, Placebo-Controlled Phase 3 Study of Ramucirumab versus Placebo as Second-Line Treatment in Patients with Advanced Hepatocellular Carcinoma (HCC) and Elevated Baseline Alpha-Fetoprotein (AFP) Following First-Line Sorafenib. Journal of Clinical Oncology, 36, 4003. https://doi.org/10.1200/JCO.2018.36.15_suppl.4003
NOTES
*通讯作者。
