Traditional Chinese Medicine
Vol.
13
No.
01
(
2024
), Article ID:
79943
,
10
pages
10.12677/TCM.2024.131021
基于网络药理学探讨血府逐瘀汤治疗甲状腺功能减退症的作用机制
张强*,蔡萧君#
黑龙江省中医药科学院,黑龙江 哈尔滨
收稿日期:2023年12月4日;录用日期:2024年1月15日;发布日期:2024年1月26日

摘要
目的:基于网络药理学探讨血府逐瘀汤治疗甲状腺功能减退症的作用机制。方法:运用中医药系统药理学数据库与分析平台(TCMSP)、本草组鉴(HERB)平台筛选出血府逐瘀汤组成药物的活性成分,利用有机小分子生物活性数据库(PubChem)查找活性成分的化学结构,根据化学结构在SwissTargetPrediction数据库预测活性成分的潜在靶点。在Genecards数据库及Disgenet数据库中检索甲状腺功能减退症的相关靶点。利用韦恩图获得药物靶点及疾病靶点的交集靶点基因。利用STRING数据库对药物与疾病交集靶点进行蛋白质相互作用网络构建,获得血府逐瘀汤治疗甲状腺功能减退症的关键靶点。利用David数据库对交集靶点进行基因组百科全书(KEGG)信号通路与基因本体论(GO)功能富集分析。结果:得到药物有效成分208个,药物靶点1066个,甲状腺功能减退症靶点1386个,最终取交集靶点195个,KEGG信号通路20条。血府逐瘀汤治疗甲状腺功能减退症的关键靶点为STAT3、EP300、AKT1、MAPK1。关键的信号通路包括:肿瘤信号通路、糖尿病并发症中的AGE-RAGE信号通路等。结论:本研究初步揭示了血府逐瘀汤多成分、多靶点、多途径治疗甲状腺功能减退症的机制,为血府逐瘀汤的临床开发利用提供了依据。
关键词
网络药理学,血府逐瘀汤,甲状腺功能减退症

Discussion on the Mechanism of Xuefu Zhuyu Decoction in Treating Hypothyroidism Based on Network Pharmacology
Qiang Zhang*, Xiaojun Cai#
Heilongjiang Academy of Traditional Chinese Medicine, Harbin Heilongjiang
Received: Dec. 4th, 2023; accepted: Jan. 15th, 2024; published: Jan. 26th, 2024

ABSTRACT
Objective: To explore the mechanism of Xuefu Zhuyu decoction in treating hypothyroidism based on network pharmacology. Methods: The active components of Xuefu Zhuyu Decoction were screened by TCM Pharmacology Database and Analysis Platform (TCMSP) and HERB Platform, and the chemical structure of the active components was found by PubChem, and the potential targets of the active components were predicted in SwissTargetPrediction database according to the chemical structure. Searching the related targets of hypothyroidism in Genecards database and Disgenet database, the intersection target genes of drug targets and disease targets were obtained by Wayne diagram. Protein interaction network was constructed for the intersection targets of drugs and diseases by using STRING database, and the key targets of Xuefuzhuyu decoction in treating hypothyroidism were obtained. Using David database, the signal pathway of KEGG and the function enrichment of GO were analyzed. Results: 208 active ingredients, 1066 drug targets and 1386 hypothyroidism targets were obtained. Finally, 195 intersecting targets and 20 KEGG signal pathways were selected. The key targets of Xuefu Zhuyu decoction in treating hypothyroidism are STAT3, EP300, AKT1 and MAPK1. Key signal pathways include: tumor signal pathway, AGE-RAGE signal pathway in diabetic complications, etc. Conclusion: This study initially revealed the mechanism of Xuefu Zhuyu Decoction in treating hypothyroidism with multi-components, multi-targets and multi-channels, which provided a basis for the clinical development and utilization of Xuefu Zhuyu Decoction.
Keywords:Network Pharmacology, Xuefu Zhuyu Decoction, Hypothyroidism

Copyright © 2024 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 前言
甲状腺功能减退症(简称甲减)是由多种原因引起的甲状腺激素(TH)合成、分泌或生物效应不足所致的全身性低代谢综合征。根据甲状腺、垂体或下丘脑或外周组织的病变,甲状腺功能减退分别被分为原发性、中枢性和外周性。大多数情况下,甲状腺功能减退症的发病是隐性的,症状可能在疾病过程中相对较晚出现。临床表现和甲状腺功能减退症状的出现有很大差异,尤其是在妊娠期和儿童中。因此,检测高TSH和低FT4水平是诊断的标志。甲状腺功能减退症常见症状和体征包括浮肿、甲状腺肿大、体重增加、疲劳、抑郁症、月经不规律或月经过多、性欲减退、生育能力降低。甲状腺功能减退症不太常见的症状包括皮肤干燥(严重时为称为粘液性水肿的非凹陷性水肿)、贫血、血栓形成风险增加和各种神经系统、肌肉骨骼和代谢症状。在美国,国家健康和营养调查数据显示甲状腺功能减退的患病率为4.6%。美国的一项筛查研究显示,临床显性甲状腺功能减退和亚临床甲状腺功能减退的患病率分别为0.4%和9%,而后者在75岁或以上的女性中增加到20%以上。在一项来自欧洲的荟萃分析中,临床甲状腺功能减退和亚临床甲状腺功能减退的患病率分别为0.37%和3.8%,估计甲状腺功能减退的发病率为每年每10万人226例 [1] 。2020年来自中国31个省的甲减流行病学调查显示:临床甲减的发病率为1.02%,亚临床甲减的发病率为12.93%。而且甲减的发病率与年龄成正相关 [2] 。左旋甲状腺素(LT4)是治疗的主要手段,是全世界最常用的处方药之一,是治疗甲状腺功能减退症的主要手段,是美国第三大常用处方药,有超过1亿张处方 [3] 。来自商业保险患者的数据显示,估计有7%的人拥有有效的LT4处方,其中30%的患者在开始治疗时显示出正常的甲状腺功能值 [4] [5] 。
甲状腺功能减退症在中医学中无特定的病名,但根据其症状及体征,可将其归于“虚劳”“瘿病”“水肿”等范畴。其最早记载于《素问·奇病论》和《灵枢·水胀篇》,其记载的症状与甲状腺功能减退症的粘液性水肿相似,如“有病庞然如有水状”、“寒气客于皮肤之间,空空然不坚,腹大,身尽肿,皮厚”。治疗方法主要是以温补肾阳、利水消肿为主。在此后的发展中,不断的完善了甲状腺功能减退症的病因病机、临床表现、辨证论治以及治疗方法。现代中医医家在古代医家的众多理论基础上进行总结概括,并参照临床实践进行总结。认为本病的病位主要在肝、心、脾、肾四脏。其病因主要为先天禀赋不足,饮食不节,情志因素,劳逸过度,脾肾阳虚。病机主要为肝郁气滞、气血亏虚、阳虚水泛、痰湿瘀血阻滞。治疗主要以疏肝健脾,温补肾阳,益气活血化瘀,燥湿化痰散结等 [6] - [19] 。
网络药理学是将系统生物学、现代药理学、生物信息学和计算机科学等领域的理念、技术、操作充分交叉,整合利用前人研究积累和网络数据资源,通过构建生物信息网络将药物、靶点、通路、疾病相连接,经拓扑结构分析来探索药物与疾病之间的关联 [20] 。强调从整体系统水平和生物网络的角度分析药物和治疗对象之间的分子相关性,主要从多靶点的相互作用来研究疾病的治疗,广泛用于医学领域。本研究旨在通过网络药理学探索血府逐瘀汤治疗甲状腺功能减退症的作用机制,为进一步深入研究奠定理论基础。
2. 方法
2.1. 血府逐瘀汤主要活性成分及作用靶点筛选
利用中医药系统药理学平台(TCMSP)、本草组鉴平台(HERB)查找血府逐瘀汤中的11味中药:红花、桃仁、当归、生地黄、川芎、赤芍、牛膝、桔梗、柴胡、枳壳、甘草的活性成分。以口服利用度(OB) ≥ 30%且类药性(DL) ≥ 0.18为标准对每一味中药的活性成分进行筛选,根据活性成分在有机小分子生物活性数据库(PubChem)搜索活性成分化学式,根据化学式,在SwissTargetPrediction数据库平台查找相关靶点信息,并筛选可能性 > 0的靶点。对于在PubChem查找不到化学式的,复制TCMSP平台中的Related targets信息,并根据uniport转化为基因名。将所有的靶点信息汇总,筛重。
2.2. 甲状腺功能减退症的相关靶点筛选
以“hypothyroidism”为关键词,在Genecards数据库及Disgenet数据库中检索甲状腺功能减退症的相关潜在靶点。在Genecards数据库中检索的靶点,以Relevance score > 1为标准,进行筛选。最后再将两个数据库检索的靶点汇总,筛重。
2.3. 构建血府逐瘀汤与甲状腺功能减退症交集靶点蛋白质相互作用网络图
将血府逐瘀汤的活性成分靶点与甲状腺功能减退症靶点导入Venny中绘制韦恩图进行分析,即可得到血府逐瘀汤治疗甲状腺功能减退症的相关靶点。将交集靶点导入STRING11.5数据库,设定物种为Homosapiens,组合打分combined score > 0.9,删除无连接的靶点,构建PPI网络模型,将上述PPI关系导入Cytoscape3.9.1软件中进行可视化分析,绘制PPI关系图。
2.4. 靶点通路分析
将上述筛选得到的疾病与药物的共同靶点导入DAVID数据库中进行生物功能(GO)和通路(KEGG)的富集分析。将上述结果导入微生信中进行代谢途径整合和可视化分析。
2.5. 构建中药–靶点–通路网络
将血府逐瘀汤组成药物、方药疾病共同靶点、主要通路等数据进行整合处理,利用Cytoscape3.9.1软件进行可视化处理,构建“药物–靶点–通路”网络图。
3. 结果
3.1. 血府逐瘀汤主要活性成分及作用靶点筛选
利用TCMSP数据库及HERB数据库,以OB ≥ 30%和DL ≥ 0.18为筛选条件,检索得到血府逐瘀汤活性化学成分共208个。利用PubChem数据库及SwissTargetPrediction数据库对检索到的化学成分进行靶点检索,得到血府逐瘀汤靶点1066个。其中红花活性成分22个,靶点338个;桃仁活性成分23个,靶点207个;当归活性成分2个,靶点44个;生地黄活性成分49个,靶点484个;川芎活性成分7个,靶点309个;赤芍活性成分29个,靶点309个;牛膝活性成分20个,靶点388个;桔梗活性成分7个,靶点167个;柴胡活性成分17个,靶点373个;枳壳活性成分5个,靶点164个;甘草活性成分92个,靶点746个。
3.2. 甲状腺功能减退症的相关靶点筛选
利用Genecards数据库及Disgenet数据库,检索甲状腺功能减退症疾病的潜在靶点。汇总两个数据库的疾病靶点并筛重,最终得到甲状腺功能减退症关键靶点1386个。
3.3. 血府逐瘀汤与甲状腺功能减退症交集靶点筛选
利用Venny2.1 (https://bioinfogp.cnb.csic.es/tools/venny/)平台,得到血府逐瘀汤与甲状腺功能减退症的交集靶点195个,并绘制韦恩图,见图1。

Figure 1. Wayne diagram of Xuefu Zhuyu decoction and hypothyroidism target
图1. 血府逐瘀汤与甲状腺功能减退症靶点韦恩图
3.4. 构建血府逐瘀汤与甲状腺功能减退症交集靶点蛋白质相互作用网络图
将交集靶点导入STRING11.5数据库,设定物种为Homosapiens,组合打分combined score > 0.9,删除无连接的靶点,获取PPI网络图,见图2。网络图中,表示交集靶点蛋白的节点有195个,表示交集蛋白相互作用的边有534条,平均节点度值为5.48。将PPI结果导入Cytoscape3.9.1软件中进行可视化分析,绘制PPI关系图,见图3,图中每个节点代表一个靶点,节点的颜色及大小表示度值大小。按Degree值降序排列,筛选出血府逐瘀汤治疗甲状腺功能减退症排名前4的关键靶点为:STAT3、EP300、AKT1、MAPK1。
3.5. GO生物功能注释
利用DAVID数据库平台,对上述交集靶点进行GO (包括生物学过程BP:biological process、分子功能CC:cellular component、细胞组成MF:molecular function)及KEGG富集分析。选取-log10 (P-value)值排名前20的结果进行可视化分析。利用微生信平台将BP、CC、MF的结果绘制条形图,见图4。潜在的生物学过程为:对RNA聚合酶II启动子的转录进行正向调节、基因表达的正向调控、对细胞增殖的正向调节等。在分子功能中主要为:受体复合体、细胞表面、内质网腔体等。在细胞组成中主要的条目为:RNA聚合酶II转录因子活性,配体激活的序列特异性DNA结合、酶的结合、转录辅助因子的结合等。

Figure 2. Xuefu Zhuyu Decoction-PPI network diagram of hypothyroidism target (STRING)
图2. 血府逐瘀汤–甲状腺功能减退症靶点PPI网络图(STRING)
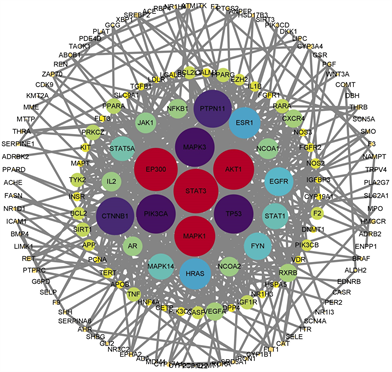
Figure 3. Xuefu Zhuyu Decoction-PPI network diagram of hypothyroidism target (CytoScape3.9.1)
图3. 血府逐瘀汤–甲状腺功能减退症靶点PPI网络图(CytoScape3.9.1)
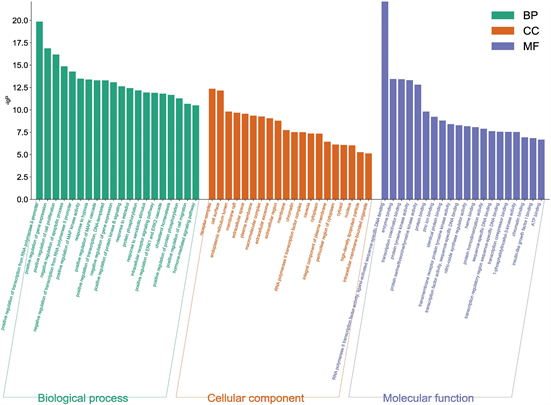
Figure 4. GO function enrichment analysis diagram of Xuefu Zhuyu decoction in treating hypothyroidism
图4. 血府逐瘀汤治疗甲状腺功能减退症作用靶点的GO功能富集分析图
3.6. KEGG通路分析
通过DAVID数据库平台对疾病和药物的交集基因进行KEGG富集分析,得到的富集通路有173条,
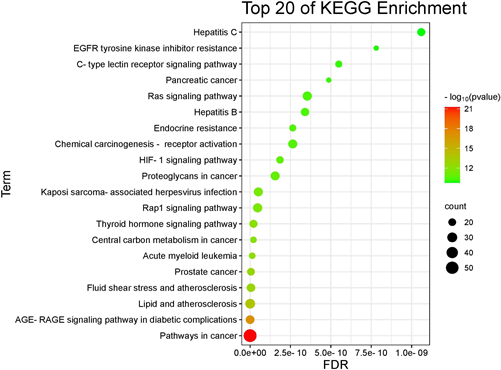
Figure 5. KEGG enrichment analysis diagram of Xuefu Zhuyu decoction in treating hypothyroidism
图5. 血府逐瘀汤治疗甲状腺功能减退症作用靶点的KEGG富集分析图
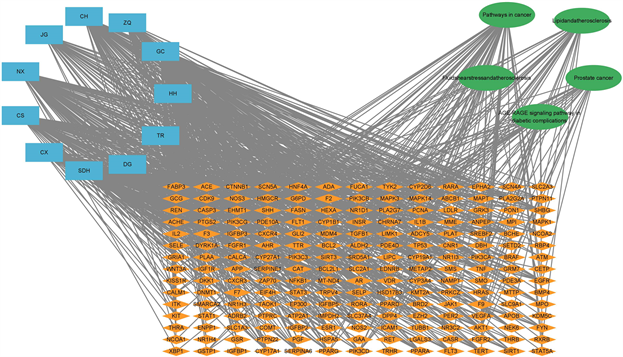
Figure 6. Drug-target-pathway network diagram
图6. 药物–靶点–通路网络图
选取-log10 (P-value)值排名前20的结果进行可视化分析,如图5。富集显示主要涉及以下几个信号通路:癌症中的通路、糖尿病并发症中的AGE-RAGE信号通路等。
3.7. 构建中药–靶点–通路网络
将血府逐瘀汤组成药物、方药疾病共同靶点、主要通路等数据进行整合处理,利用Cytoscape3.9.1软件进行可视化处理,构建“药物–靶点–通路”网络图,见图6。
4. 讨论
甲状腺功能减退症在中医学中无特定的病名,但根据其乏力、怕冷、浮肿、发育延迟等临床表现,可将其归于“虚劳”“瘿病”“水肿”等范畴。中医认为甲减的病因可能与先天不足、后天摄养失调、手术、药物损伤等因素有关。主要病机为脾肾阳虚,肾阳不足,病变常涉及心脾两脏,可兼夹痰浊、瘀血等病理改变。甲减的常用中医治法为健脾化湿、益气温阳、温补脾肾兼顾活血化瘀、化痰、祛湿、理气等。
血府逐瘀汤由清代著名医家王清任所创的活血化瘀名方。方中有当归、生地、桃仁、红花、枳壳、赤芍、牛膝、川芎、柴胡、桔梗、甘草11种中药。方中以桃仁、红花、赤芍、川芎为君,活血化瘀,畅通血脉。中医认为气为血之帅,因此方中桔梗、柴胡、枳壳、牛膝为臣,理气行滞,其中桔梗开胸膈,宣肺气,以行上焦气滞;柴胡、枳壳疏肝理气,以畅中焦气滞;牛膝导瘀下行,以通下焦气滞。生地、当归为佐,养血和血,活血而不伤血,理气而不伤阴;甘草为使,调和诸药,防止他药伤胃。诸药相配,从而达到活血化瘀、理气行滞、调畅气血、化痰祛湿之功效。
将195个交互靶点按Degree值降序排列,获得血府逐瘀汤治疗甲减排名前四的关键靶点为:STAT3、EP300、AKT1、MAPK1。STAT3是一种信号转导和转录激活因子,它可以响应细胞因子和生长因子的刺激,调节细胞的增殖、存活、分化和血管生成等多种生物学过程。STAT3属于STAT转录因子家族。STAT转录因子的激活主要依赖于其酪氨酸残基的磷酸化,这一过程由JAK激酶介导,JAK激酶又受到多种细胞因子和生长因子的刺激,如IL-6、IL-10、IL-21、EGF、PDGF等。磷酸化的STAT转录因子通过SH2结构域形成同源二聚体或异源二聚体,然后转运到细胞核,在特定的基因启动子区域结合到GAS (gamma-activated sequence)元件,从而调节下游基因的表达。STAT3的功能受到多种因素的影响,包括其上游信号的刺激、其翻译后修饰的状态、其与其他转录因子的相互作用等。STAT3的异常激活或失活与多种疾病的发生和发展有关,如癌症、免疫缺陷、自身免疫性疾病等 [21] [22] [23] 。目前STAT3在甲状腺功能减退症的确切作用关系目前尚不明确,但目前的一些研究表明,STAT3可能与炎症反应和免疫调节有关 [24] 。研究表明,自身免疫性甲状腺炎和甲状腺功能减退症以基因特异性方式影响STAT3的表达 [25] 。还有研究表明,通过STAT3可以抑制甲状腺功能减退症的发展 [26] 。EP300是一种组蛋白乙酰转移酶,可以通过乙酰化组蛋白和其他蛋白质,调节基因的转录和表达。EP300与另一种类似的酶CBP有高度的同源性,它们可以与多种转录因子结合,参与不同的信号通路和生物学过程,包括甲状腺激素受体的靶基因。ep300可以与甲状腺激素受体结合,增强其转录活性,从而影响甲状腺激素的信号传导 [27] 。AKT1是一种丝氨酸/苏氨酸激酶,参与细胞生长、代谢和存活的调节。研究发现,AKT1在甲减患者的甲状腺组织中的表达水平显著降低,在外周血单核细胞中的表达也显著降低,AKT1的表达水平与甲状腺激素水平呈正相关 [28] 。MAPK1是一种丝裂原活化蛋白激酶,属于MAPK信号通路的一员。MAPK信号通路在细胞的增殖、分化、凋亡、迁移等活动中发挥重要的作用。有研究表明,促甲状腺激素释放激素受体主要表达在垂体,通过PKC-MAPK通路发挥作用,而促甲状腺激素释放激素受体的多个关键基因的突变会影响其与促甲状腺激素释放激素的结合,从而造成中枢性甲状腺功能减退以及家族性甲状腺功能疾病 [29] 。以上研究得出的STAT3、EP300、AKT1、MAPK1等关键靶点是否参与了血府逐瘀汤治疗甲减的作用机制,还有待于进一步动物实验进行验证,为后续研究提供了新方向。
GO富集分析中,生物过程主要涉及对RNA聚合酶II启动子的转录进行正向调节、基因表达的正调控、积极调节细胞增殖等。细胞成分主要涉及受体复合体、细胞表面、内质网腔等方面。分子功能主要涉及RNA聚合酶II转录因子活性,配体激活的序列特异性DNA结合、酶结合、转录激活子结合等。KEGG富集分析显示血府逐瘀汤治疗甲状腺功能减退症主要涉及以下几个信号通路:癌症信号通路、糖尿病并发症中的AGE-RAGE信号通路。目前已知的癌症信号通路有多种,如NF-κB、PI3K/AKT、MAPK、JAK-STAT和TGF-β等。研究发现甲减导致睾丸功能障碍的机制可能与抑制睾丸组织雌激素受体ER和GPR30蛋白的表达,进而抑制ERK1/2和PI3K/AKT信号通路相关蛋白的表达,最终导致细胞周期蛋白cyclin D1表达下降,激活线粒体介导的凋亡通路有关 [30] 。有学者发现,在甲减性心衰大鼠心脏组织中,PI3K/AKT通路被激活 [31] 。艾灸可以激活甲减大鼠PI3K/AKT通路 [28] 。糖基化终末产物–受体(AGE-RAGE)信号通路是指由高血糖引起的蛋白质糖基化产物(AGEs)与其受体(RAGE)结合,进而引发一系列反应的信号传导通路。这些化合物可以通过与RAGE结合来激活多种信号通路,如NF-κB、MAPK和PI3K-AKT-mTOR等,从而导致炎症反应、氧化应激、血管内皮细胞功能异常、细胞凋亡等不良影响。研究发现AGES能够诱导RAGE和核因子激活的B细胞的k-轻链增强表达增加,晚期糖基化终末产物受体(RAGE)下调或沉默调节蛋白1和核因子相关因子上调可直接逆转人正常甲状腺滤泡上皮细胞的形态学损伤,降低存活率,升高活性氧,降低甲状腺激素水平 [32] 。以上的研究均是甲减合并有并发症,若仅仅是单纯甲减疾病模型,是否PI3K-AKT通路、AGE-RAGE通路参与发病呢,我们尚不知晓,提示以上两个通路可能在甲减疾病发生过程中发挥作用,也为我们后续研究提供方向。
5. 结论
综上所述,血府逐瘀汤治疗甲状腺功能减退症的关键靶点为STAT3、EP300、AKT1、MAPK1。涉及的关键通路为癌症信号通路、糖尿病并发症中的AGE-RAGE信号通路。通过网络药理学证实血府逐瘀汤是通过多成分、多靶点、多通路来治疗甲减,结果表明血府逐瘀汤可能在以上方面发挥作用,但由于本研究结果是由大量数据进行交叉、富集化分析后得出的一个理论性趋势结果,因此未来仍需进一步动物实验验证,充分阐释活血化瘀汤干预甲减的效应机制,也为该有效方剂的新药开发提供数据支持。
文章引用
张 强,蔡萧君. 基于网络药理学探讨血府逐瘀汤治疗甲状腺功能减退症的作用机制
Discussion on the Mechanism of Xuefu Zhuyu Decoction in Treating Hypothyroidism Based on Network Pharmacology[J]. 中医学, 2024, 13(01): 123-132. https://doi.org/10.12677/TCM.2024.131021
参考文献
- 1. Garmendia, M.A., Santos, P.S., Guillén-Grima, F. and Galofré, J.C. (2014) The Incidence and Prevalence of Thyroid Dysfunction in Europe: A Meta-Analysis. The Journal of Clinical Endocrinology & Metabolism, 99, 923-931. https://doi.org/10.1210/jc.2013-2409
- 2. Li, Y., Teng, D., Ba, J., et al. (2020) Efficacy and Safety of Long-Term Universal Salt Iodization on Thyroid Disorders: Epidemiological Evidence from 31 Provinces of Mainland China. Thy-roid, 30, 568-579. https://doi.org/10.1089/thy.2019.0067
- 3. Kantor, E.D., Rehm, C.D., Haas, J.S., Chan, A.T. and Giovannucci, E.L. (2015) Trends in Prescription Drug Use among Adults in the United States from 1999-2012. JAMA, 314, 1818-1831. https://doi.org/10.1001/jama.2015.13766
- 4. ClinCalc Drug Stats Database (2021) Levothyroxine: Drug Usage Statistics, U.S., 2013-2019. https://clincalc.com/DrugStats/Drugs/Levothyroxine
- 5. Brito, J.P., Ross, J.S., El Kawkgi, O.M., et al. (2021) Levo-thyroxine Use in the United States, 2008-2018. JAMA Internal Medicine, 181, 1402-1405. https://doi.org/10.1001/jamainternmed.2021.2686
- 6. 余桂枝, 喻远霞, 范建民, 张稳. 王行宽辨证治疗甲状腺功能减退症经验[J]. 中国中医药信息杂志, 2021, 28(3): 117-119. https://doi.org/10.19879/j.cnki.1005-5304.201909290
- 7. 赵鹏云, 郭俊杰. 郭俊杰治疗桥本甲状腺炎伴甲状腺功能减退症经验[J]. 湖南中医杂志, 2018, 34(11): 25-26. https://doi.org/10.16808/j.cnki.issn1003-7705.2018.11.011
- 8. 王丽丹, 张广德. 魏子孝活用经方辨治甲状腺功能减退症经验[J]. 世界中西医结合杂志, 2021, 16(3): 446-449+453. https://doi.org/10.13935/j.cnki.sjzx.210310
- 9. 俞烨晨, 杨帆, 王旭. 浅析王旭教授治疗桥本甲状腺炎甲状腺功能减退临床经验[J]. 四川中医, 2021, 39(3): 3-6.
- 10. 房璁璁, 陈如泉. 陈如泉教授治疗甲状腺功能减退症合并贫血经验[J]. 世界中医药, 2017, 12(4): 853-856.
- 11. 任永丽, 任明, 牟蛟, 张曾譻. “心脑血脉宁”治疗甲状腺功能减退症的临床观察[J]. 天津中医药, 2017, 34(6): 373-376.
- 12. 李秋莲, 刘海鹏, 王颜琦, 范源. 基于数据挖掘的近10年中医辨治甲状腺功能减退症用药规律探讨[J]. 云南中医学院学报, 2020, 43(6): 79-84. https://doi.org/10.19288/j.cnki.issn.1000-2723.2020.06.013
- 13. 贾锡莲. 甲状腺功能减退症的中医治疗与实验研究进展[J]. 医学综述, 2007, 13(9): 716-718.
- 14. 徐锦平, 徐德凤. 徐德凤辨治甲状腺功能减退症经验[J]. 辽宁中医杂志, 2006, 33(2): 149-150. https://doi.org/10.13192/j.ljtcm.2006.02.25.xujp.010
- 15. 徐蓉娟, 葛芳芳, 李红. 中医辨治甲状腺功能减退症[J]. 上海中医药大学学报, 2007, 21(6): 42-43. https://doi.org/10.16306/j.1008-861x.2007.06.008
- 16. 李静, 高天舒. 高天舒教授治疗原发性甲状腺功能减退症经验介绍[J]. 新中医, 2007, 39(11): 8-9. https://doi.org/10.13457/j.cnki.jncm.2007.11.005
- 17. 温志歌, 黄一珊, 赵林华. 补肾健脾法治疗肥胖合并甲状腺功能减退验案一例[J]. 环球中医药, 2023, 16(6): 1211-1214.
- 18. 吴天强. 桥本甲状腺炎合并甲减的中医证型分布及相关因素分析[D]: [硕士学位论文]. 哈尔滨: 黑龙江中医药大学, 2023. https://doi.org/10.27127/d.cnki.ghlzu.2023.000350
- 19. 徐波. 中医药治疗桥本甲状腺炎的研究进展[J]. 中医研究, 2022, 35(10): 91-96.
- 20. Lee, M., Shin, H., Park, M., Kim, A., Cha, S. and Lee, H. (2022) Systems Pharmacol-ogy Approaches in Herbal Medicine Research: A Brief Review. BMB Reports, 55, 417-428. https://doi.org/10.5483/BMBRep.2022.55.9.102
- 21. O’Shea, J.J. and Plenge, R. (2012) JAK and STAT Signaling Molecules in Immunoregulation and Immune-Mediated Disease. Immunity, 36, 542-550. https://doi.org/10.1016/j.immuni.2012.03.014
- 22. Zhang, Q., Lenardo, M.J. and Baltimore, D. (2017) 30 Years of NF-κB: A Blossoming of Relevance to Human Pathobiology. Cell, 168, 37-57. https://doi.org/10.1016/j.cell.2016.12.012
- 23. Li, J., Yin, Z., Huang, B., Xu, K. and Su, J. (2022) Stat3 Signaling Pathway: A Future Therapeutic Target for Bone-Related Diseases. Frontiers in Pharmacology, 13, Article ID: 897539. https://doi.org/10.3389/fphar.2022.897539
- 24. Philips, R.L., Wang, Y., Cheon, H., et al. (2022) The JAK-STAT Pathway at 30: Much Learned, Much More to Do. Cell, 185, 3857-3876. https://doi.org/10.1016/j.cell.2022.09.023
- 25. Kamyshna, I. and Kamyshnyi, A. (2022) Transcription Factors and Regulators Pathway-Focused Genes Expression Analysis in Patients with Different Forms of Thyroid Pathology. Cur-rent Pharmaceutical Biotechnology, 23, 1396-1404. https://doi.org/10.2174/1389201023666220217123454
- 26. Xiu, L., Xing, Q., Mao, J., Sun, H., Teng, W. and Shan, Z. (2018) miRNA-125b-5p Suppresses Hypothyroidism Development by Targeting Signal Transducer and Acti-vator of Transcription 3. Medical Science Monitor, 24, 5041-5049. https://doi.org/10.12659/MSM.907510
- 27. Durbin, A.D., Wang, T., Wimalasena, V.K., et al. (2022) EP300 Se-lectively Controls the Enhancer Landscape of MYCN-Amplified Neuroblastoma. Cancer Discovery, 12, 730-751. https://doi.org/10.1158/2159-8290.CD-21-0385
- 28. 康春嵋, 李山, 郭志玲. 基于调控PI3K-AKT通路探讨艾灸关元穴治疗甲状腺功能减退的作用机制[J]. 世界中西医结合杂志, 2021, 16(10): 1831-1835. https://doi.org/10.13935/j.cnki.sjzx.211012
- 29. Xu, Y., Cai, H., You, C., et al. (2022) Structural Insights into Ligand Binding and Activation of the Human Thyrotropin-Releasing Hormone Receptor. Cell Research, 32, 855-857. https://doi.org/10.1038/s41422-022-00641-x
- 30. Yao, Y., Chang, X., Wang, D., et al. (2018) Roles of ERK1/2 and PI3K/AKT Signaling Pathways in Mitochondria-Mediated Apoptosis in Testes of Hypothyroid Rats. Toxicological Research (Cambridge), 7, 1214-1224. https://doi.org/10.1039/C8TX00122G
- 31. 刘小娜. β1肾上腺素受体、PI3K/AKT通路在甲减大鼠心力衰竭形成中的作用研究[D]: [硕士学位论文]. 石家庄: 河北医科大学, 2017.
- 32. Chen, X.J., Gong, X.H., Jie, J.P., et al. (2019) Receptor for Advanced Glycation End Products Reveals a Mechanism Regulating Thyroid Hormone Secretion through the SIRT1/Nrf2 Pathway. Journal of Cellular Biochemistry, 120, 4582-4598. https://doi.org/10.1002/jcb.27747