Advances in Clinical Medicine
Vol.
13
No.
04
(
2023
), Article ID:
64750
,
9
pages
10.12677/ACM.2023.134945
预测最大径≤2 cm胆囊良恶性息肉指标的筛选及模型构建
彭杰超,王玉冰,曾建阁,孙鹏,曹景玉,胡维昱*
青岛大学附属医院肝胆胰外科,山东 青岛
收稿日期:2023年3月26日;录用日期:2023年4月21日;发布日期:2023年4月28日

摘要
目的:通过联合超声影像学表现、血液检验及患者一般情况等相关指标,探讨上述指标在影像学表现≤2 cm的胆囊息肉性质的诊断价值。方法:收集2012年~2022年在青岛大学附属医院386例≤2 cm的胆囊息肉样病变患者临床资料,包括术前超声、血液肿瘤标记物、性别、基础信息、既往史、代谢综合征等指标,分析胆囊癌的危险因素及多指标联合早期诊断的准确性。通过Logistic回归方程,计算出各个指标的个体预测概率值,比较其ROC曲线下面积,并建立预测模型Y,绘制联合指标ROC曲线下面积,同单独指标比较其预测及应用价值,并以术后病理结果检验预测模型的准确性。结果:通过多因素分析,得到与胆囊癌相关的危险因素:超声息肉大小、胆囊壁厚、CEA、CA199、性别、年龄。联合上述指标得到预测模型为Y = −12.761 − 1.873性别(女) + 0.116年龄 + 6.558胆囊壁厚 + 2.724息肉大小 + 0.198CEA + 0.029CA199。对预测模型进行评价:联合预测指标Y的ROC曲线下面积为0.933,95%置信区间为(0.887, 0.979)。当Y > 0.1047557时模型预测息肉为恶性可能的灵敏度为93.6%,特异度为86.4%。结论:基于上述相关指标构建的预测模型,经内部验证具有良好的预测效能,灵敏度和特异度较高,有助于预测术前≤2 cm的胆囊息肉的性质,减少术中意外胆囊癌的发生,具有一定的临床使用价值。
关键词
胆囊息肉,胆囊癌,超声,血液指标,预测模型

Index Screening and Model Construction for Predicting Benign and Malignant Gallbladder Polyps with Maximum Diameter ≤2 cm
Jiechao Peng, Yubing Wang, Jiange Zeng, Peng Sun, Jingyu Cao, Weiyu Hu*
Department of Hepatobiliary and Pancreatic Surgery, Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Mar. 26th, 2023; accepted: Apr. 21st, 2023; published: Apr. 28th, 2023

ABSTRACT
Objective: To explore the diagnostic value of the above indexes in gallbladder polyps with imaging manifestations ≤2 cm by combining ultrasound imaging findings, blood tests and general conditions of patients. Methods: The clinical data of 386 patients with gallbladder polypoid lesions ≤2 cm in the Affiliated Hospital of Qingdao University from 2012 to 2022 were collected, including preoperative ultrasound, blood tumor markers, gender, basic information, past history, metabolic syndrome and other indicators. The risk factors of gallbladder cancer and the accuracy of multiple indicators combined early diagnosis were analyzed. The area under the ROC curve of each index was compared and the prediction model Y was established. The area under the ROC curve of the combined index was plotted to compare its prediction and application value with that of the single index. The accuracy of the prediction model was tested by postoperative pathological results. Results: Through multivariate analysis, the risk factors related to gallbladder cancer were obtained: ultrasonic polyp size, gallbladder wall thickness, CEA, CA199, gender and age. Combined with the above indicators, the prediction model was Y = −12.761 − 1.873 gender (female) + 0.116 age + 6.558 gallbladder wall thickness + 2.724 polyp size + 0.198CEA + 0.029CA199. The prediction model was evaluated: the area under the ROC curve of the combined predictor Y was 0.933, and the 95% confidence interval was (0.887, 0.979). When Y > 0.1047557, the sensitivity and specificity of the model to predict the possibility of malignant polyps were 93.6% and 86.4% respectively. Conclusions: The prediction model constructed based on the above related indicators has good prediction efficiency, high sensitivity and specificity, which is helpful to predict the nature of gallbladder polyps ≤2 cm before operation, reduce the occurrence of accidental gallbladder cancer during operation, and has certain clinical application value.
Keywords:Gallbladder Polyp, Gallbladder Carcinoma, Ultrasound, Blood Index, Predictive Model

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 前言
胆囊息肉样病变(Polypoid Lesions of Gallbladder, PLG)包括良性息肉和恶性息肉。良性息肉包括非肿瘤性息肉如胆固醇息肉、炎症性息肉等和肿瘤性息肉如胆囊腺瘤性息肉等;恶性息肉包含最常见的胆囊腺癌及罕见的鳞状细胞癌、粘液性囊腺瘤等病变。胆囊癌(Gallbladder cancer, GBC)对于胆道系统肿瘤来讲是一种较为罕见的恶性疾病,但其恶性程度及致命性却相对较高。Hueman等人 [1] 通过调查发现胆囊癌发病率为胃肠道肿瘤的第六位,胆囊癌患者中位生存期只有3~6个月。据统计,GBC患者的总体预后较差,5年平均存活率仅为5%~10% [2] 。目前手术切除是治疗胆囊癌的有效手段,但是往往发现胆囊癌时都是晚期或术中意外胆囊癌,许多患者发生肝转移及腹腔转移,只有25%的患者有资格接受潜在的根治手术 [3] 。因此,早期发现诊断,及时地治疗是很有必要的,准确的术前评估可以避免患者行不必要的手术。超声是目前胆囊疾病的首选检查方法,目前指南建议直径超过1 cm的息肉应当行手术治疗。但是依据此结果切除的胆囊术后病理回报绝大部分为良性息肉。有学者通过肿瘤指标预测术前胆囊息肉的性质,但其灵敏度和特异度也都不尽人意。因此,我们将患者的一般情况、超声表现及血液结果同时结合,并联合相关预测指标构建模型,以便临床医生在获取组织病理学结果之前,通过此模型对术前≤2 cm的胆囊息肉的性质进行初步判断,从而减少术中意外胆囊癌的发生。
2. 资料与方法
2.1. 一般资料
本研究患者共386例,男性患者130例,女性患者256例,年龄22~87岁,平均年龄(54.8 ± 13.5)岁。将术后病理诊断作为分组标准,术后病理诊断为良性息肉样病变的为良性病变组,共339例,术后病理为诊断胆囊腺癌的为胆囊癌组,共47例。收集患者的基本资料,包括年龄、性别、入院临床症状、既往史(高血压、糖尿病、吸烟史、饮酒史等)、术前肿瘤标记物、超声指标等,探讨超声联合血液指标及患者一般情况对息肉病变的性质进行术前评估。
本研究经青岛大学附属医院伦理委员会审核批准。研究者均签订了知情同意书。
2.2. 纳排标准
纳入标准:1) 行手术切除胆囊的患者;2) 病理证实为胆囊息肉(包括胆固醇息肉、胆囊腺肌病、炎症性息肉、增生性息肉)和胆囊腺癌的患者;3) 年龄在20~90岁之间的患者;4) 息肉最大径≤2 cm的患者;5) 无其他原发性恶性肿瘤的患者;6) 排除合并感染,急性炎症等疾病,如急性胆囊炎等。
排除标准:1) 存在其他原发及继发恶性肿瘤的患者;2) 息肉最大径>2 cm的患者;3) 术前已知胆囊癌晚期或发生淋巴结及远处转移的患者;4) 合并感染,急性炎症等疾病,如急性胆囊炎等;5) 临床资料不完整的患者
2.3. 超声检查
消化系统超声采用mindray Resona7S型号。患者空腹8小时后于青岛大学附属医院超声科行腹部超声或消化系统超声检查,仔细观察并记录胆囊壁厚及息肉大小及是否合并结石。
2.4. 血液指标的测定
抽取每位患者术前1周的清晨空腹血液,将血液标本送检青岛大学附属医院检验科进行专业化验,通过医院His系统查询相关结果并记录。
2.5. 统计学方法
数据运用SPSS26.0软件进行分析,单因素分析中,分类变量采用卡方检验或Fisher精确概率检验;连续变量用均值 ± 标准差表示,先检验正态性,对于符合正态性分布的检验指标采用独立样本t检验,不服从正态性检验的检验指标采用Mann-Whitney U非参数检验。将P < 0.05的指标纳入多因素分析。多因素分析采用Logistic回归分析(强制进入法),得到最终的危险因素。计算出各个指标的个体预测概率值,比较其ROC曲线下面积,并建立联合指标Y,绘制联合指标ROC曲线下面积,计算出各指标及联合指标的灵敏度、特异度以及准确性,采用约登指数(Youden指数)比较单一指标与预测模型的应用价值。
3. 结果
3.1. 单因素分析
良性息肉与胆囊癌组指标比较:单因素分析,分类变量中性别(以男性为参照)、有无腹痛、既往吸烟史、饮酒史的比较,差异有统计学意义(P < 0.05)。连续变量中年龄、胆囊壁厚、息肉大小、淋巴细胞计数(L)、血小板计数(Plt)、中性粒细胞与淋巴细胞计数比值(NLR)、CEA、CA19-9、纤维蛋白原与白蛋白比值(FAR)、纤维蛋白原(Fbg,正态分布)之间的比较,差异有统计学意义(P < 0.05)。见表1及表2。
Table 1. Univariate analysis of categorical variables
表1. 分类变量的单因素分析
Table 2. Univariate analysis of continuous variables
表2. 连续变量的单因素分析
注:N为中性粒细胞计数;L为淋巴细胞计数;PLT为血小板计数;NLR为中性粒细胞计数与淋巴细胞计数比值;PLR为血小板计数与淋巴细胞计数比值;TG为甘油三酯;TC为总胆固醇;HDL为高密度脂蛋白;LDL为低密度脂蛋白;Glu为空腹血糖水平;CEA为癌胚抗原;CA19-9为糖类抗原19-9。
3.2. 多因素分析
将单因素分析中差异有统计学意义的因素指标纳入多因素Logistic分析,最终确定性别、年龄、胆囊壁厚、息肉大小、CEA、CA19-9为胆囊息肉样病变偏向恶性的独立危险因素。上述指标对胆囊息肉性质的影响为:患者为男性,年龄越大,胆囊壁越厚,息肉大小越大,CEA和CA19-9越高,则病变的性质偏向恶性的可能性越大。见表3。
3.3. 预测模型建立
经过Logistic回归分析得出联合预测因子:Y = −12.761 − 1.873性别(女) + 0.116年龄 + 6.558壁厚 + 2.724息肉大小 + 0.198CEA + 0.029CA199。
Table 3. Multifactor analysis of benign and malignant gallbladder lesions
表3. 胆囊良恶性病变的多因素分析
注:性别中以男性为参照。
Table 4. Area under the curve (AUC)
表4. 曲线下面积(AUC)
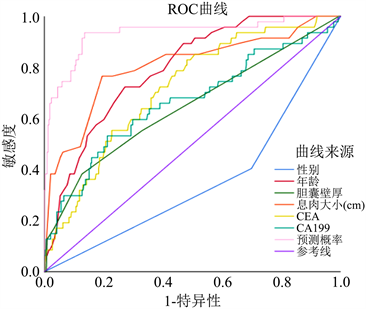
Figure 1. ROC curve of each index and combined index
图1. 各个指标及联合指标的ROC曲线
3.4. 预测模型评价
模型系数的全局性Omnibus检验具有统计学意义(c2 = 146.417, P < 0.001)。根据年龄、性别、胆囊壁厚、息肉大小、CEA、CA19-9及联合预测因子Y绘制ROC曲线。在曲线中,上述指标都具有显著意义,其中联合预测因子Y的ROC曲线下面积(AUC)最大,为0.933,说明其预测价值最高。见表4和图1。计算约登指数,约登指数最大时对应的Y值为0.1047557,所以当Y大于0.1047557时模型预测息肉为恶性可能的灵敏度为93.6%,特异度为86.4%。
4. 讨论
胆囊癌是胆道系统较为罕见的恶性疾病。根据2018年全球癌症统计数据库统计,胆囊癌占所有新发癌症患者的1.2%,占癌症死亡人数的1.7% [2] 。虽然其发病率较肝癌等其他胆道系统肿瘤低,但其较低的5年生存率及较差的生活质量使其成为了人类健康史上的一大难题。病理结果显然是帮助确定治疗方案和预测预后的最有力的因素 [4] ,然而,这一因素只能在手术后获得,因此需要一种能够在术前预测息肉性质的方法。对于未行手术治疗的患者,我们无法获取其组织病理学结果,因而术前超声评估及术前血液相关检验显得尤为重要。Koga等人 [5] 认为息肉直径>2 cm的病变确诊为恶性的概率近乎100%,但是对于直径≤2 cm的息肉的性质却并没有一个明确的定论 [6] ,所以本研究中我们收集了386例最大径≤2 cm的胆囊息肉的患者,通过收集患者的一般基础信息、血液相关指标以及超声检查等指标,得出患者的性别、年龄、胆囊息肉大小、胆囊壁厚、CEA、CA19-9指标为独立危险因素,将上述指标联合构建预测模型,通过预测模型预测患者术前胆囊息肉的良恶性,为手术方式的选择及降低术中意外胆囊癌的风险提供帮助。此预测模型具有较好的灵敏度及特异度。有研究者通过肿瘤标记物或只联合血液肿瘤指标来预测息肉性质,或者只通过超声检查所见预测,灵敏度及特异度都不如此预测模型高。
超声检查是胆囊疾病初步筛查及动态随访观察的首选检查方法 [7] 。目前指南建议手术患者的指征为超声息肉大小超过1 cm,但依据此指标而行胆囊切除的患者术后病理提示良性息肉与恶性息肉之比为3:1甚至更多 [8] ,这说明单纯依据超声指标判断息肉性质是远远不够的。当患者有多个息肉病变时,选择最大直径作为评估直径。本研究中息肉大小的曲线下面积为0.805,cut-off值对应的指标数值为1.45,敏感度为76.6%,特异度为80.5%。一些学者认为胆囊壁增厚是怀疑恶性肿瘤的一个因素。胆囊壁增厚的定义是胆囊壁的厚度为3 mm或更多。Wiles R等人发现胆囊壁厚度大于4 mm与癌症风险相关 [9] 。本研究中得出的胆囊壁厚曲线下面积为0.646,cut-off对应的临界值为0.4 cm,这与之前的研究大致相同,灵敏度为38.3%,特异度为87.3%。
目前有许多研究都在寻找合适的GBC肿瘤标记物。异常升高的癌胚抗原(CEA)和糖类抗原19-9 (CA19-9)增加了诊断胆囊癌的怀疑 [10] 。Yun等人 [11] 通过分析胆囊癌患者和健康对照组患者证明了上述结论:胆囊癌组的CA19-9水平高于对照组(P < 0.01)。一些学者研究肿瘤标记物水平与病灶性质之间的联系。在这些研究中,这些标记物的临界值有所不同,这些分界值可用于检测胆囊恶性肿瘤的存在 [12] [13] 。CA19-9是一种由癌细胞表达的糖脂。CA19-9已被证实在胰腺和胆道肿瘤中具有很好的预测性 [14] [15] ,有些报道也有证实CA19-9已作为应用于胆囊癌的诊断和预后的指标之一 [12] [16] 。本研究中也证实了CA19-9为胆囊癌的独立危险因素之一,其作为单独检测指标曲线下面积为0.633,cut-off值对应的指标数值为16.39,敏感度为53.2%,特异度为78.8%。癌胚抗原(CEA)是一种参与细胞黏附的糖蛋白,许多胃肠道恶性肿瘤都有表达,CEA在结直肠癌中的检测效果较好 [15] 。CEA的曲线下面积为0.716,cut-off值对应的指标数值为1.38,敏感度为83.0%,特异度为51.9%。
考虑到经济花费的问题,要全面检测患者的每个肿瘤相关指标是不太现实的。虽然许多肿瘤标记物已被广泛应用于不同类型的癌症(比如胃癌、胰腺癌、结直肠癌等)的诊断,然而,单独应用这些肿瘤标记物诊断胆囊癌时,得到的结果并不一致 [17] [18] 。肿瘤标记物的联合应用比单一指标应用效果更好 [19] ,因此联合检测相关的肿瘤标志物具有重要意义。此外,仅仅通过测定血液的肿瘤标记物来评估病变的性质是不准确的,因为有相当多的胆囊癌患者术前肿瘤标记物无明显异常。因此,我们结合了超声相关指标综合评估病灶性质。当然,这些肿瘤标记物不仅可以起到补充的作用,还能为患者接下来的治疗提供更好的指导 [20] 。
此外,亦有文献报道胆囊息肉恶性风险及预后与年龄的增长及性别有关 [6] [21] 。本文中也将这些因素纳入考虑研究,得出年龄的曲线下面积为0.794,cut-off值对应的指标数值为62.5岁,敏感度为72.3%,特异度为72.9%。既往文献中表述女性胆囊癌发病率是男性的2~6倍 [22] ,可能与女性体内雌、孕激素高表达水平相关。值得注意的是,在本研究中女性为保护性因素,这可能与胆囊癌的病例数较少或是男性更可能出现复杂性胆囊疾病导致男性住院患者比例要比女性高有关 [23] 。
本研究中综合预测因子Y的曲线下面积为0.933,cut-off值对应的指标数值为0.1047557,敏感度为93.6%,特异度为86.4%。根据结果可以看出综合预测因子Y的曲线下面积最大,灵敏度和特异度最高。本研究证明了术前胆囊息肉的性质与患者的一般情况、超声影像学表现及肿瘤标记物有关。多因素分析得出性别、年龄、息肉大小、胆囊壁厚及CEA、CA19-9为独立危险因素,并将上述指标联合成预测模型,通过比较预测因子Y与其他各指标单独对最大径≤2 cm的胆囊息肉性质的术前预测,证实了此预测模型具有更为准确的灵敏度及特异度,对于息肉性质的诊断更为准确,极大地减少了术中意外胆囊癌的发生。本研究中也存在一定的局限性,如本研究为单中心回顾性研究,还需要多中心、大样本的数据进行验证。
综上所述,胆囊息肉良恶性的诊断目前存在一定程度的困难。术后病理结果是当前明确胆囊良恶性疾病的金标准,但是并非所有的病人适合手术治疗。因此寻找术前能够初步诊断胆囊息肉良恶性的指标及超声表现是很有意义的。本研究最终分析出胆囊息肉良恶性与性别、年龄、胆囊息肉大小、胆囊壁厚、CEA和CA19-9有关,通过构建相关方程式,得到预测模型为Y = −12.761 − 1.873性别(女) + 0.116年龄 + 6.558胆囊壁厚 + 2.724息肉大小 + 0.198CEA + 0.029CA199。得到最终界限数值Y为0.1047557,超过此数值时提示我们病变偏向恶性可能性大。因此,对于最大径≤2 cm的胆囊息肉的预测模型可应用于临床,预测价值较单一指标价值高且较为准确。
利益冲突
所有作者均声明不存在利益冲突。
文章引用
彭杰超,王玉冰,曾建阁,孙 鹏,曹景玉,胡维昱. 预测最大径≤2 cm胆囊良恶性息肉指标的筛选及模型构建
Index Screening and Model Construction for Predicting Benign and Malignant Gallbladder Polyps with Maximum Diameter ≤2 cm[J]. 临床医学进展, 2023, 13(04): 6757-6765. https://doi.org/10.12677/ACM.2023.134945
参考文献
- 1. Hueman, M.T., Vollmer Jr., C.M. and Pawlik, T.M. (2009) Evolving Treatment Strategies for Gallbladder Cancer. An-nals of Surgical Oncology, 16, 2101-2115. https://doi.org/10.1245/s10434-009-0538-x
- 2. Bray, F., Ferlay, J., Soerjomataram, I., et al. (2018) Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians, 68, 394-424. https://doi.org/10.3322/caac.21492
- 3. Aloia, T. A., Járufe, N., Javle, M., et al. (2015) Gallbladder Cancer: Expert Consensus Statement. HPB, 17, 681-690. https://doi.org/10.1111/hpb.12444
- 4. Kim, H.S., Park, J.W., Kim, H., et al. (2018) Optimal Surgical Treatment in Patients with T1b Gallbladder Cancer: An International Multicenter Study. Journal of Hepato-Biliary-Pancreatic Sciences, 25, 533-543. https://doi.org/10.1002/jhbp.593
- 5. Koga, A., Watanabe, K., Fukuyama, T., Takiguchi, S. and Nakayama, F. (1988) Diagnosis and Operative Indications for Polypoid Lesions of the Gallbladder. Archives of Surgery, 123, 26-29. https://doi.org/10.1001/archsurg.1988.01400250028003
- 6. Donald, G., Sunjaya, D., Donahue, T. and Hines, O.J. (2013) Polyp on Ultrasound: Now What? The Association between Gallbladder Polyps and Cancer. The American Sur-geon™, 79, 1005-1008. https://doi.org/10.1177/000313481307901010
- 7. 中华医学会外科学分会胆道外科学组, 中国医师协会外科医师分会胆道外科专业委员会. 胆囊癌诊断和治疗指南(2019版) [J]. 中华外科杂志, 2020, 58(4): 243-251.
- 8. Akatsu, T., Aiura, K., Shimazu, M., et al. (2006) Can Endoscopic Ultrasonography Differentiate Nonneoplastic from Neoplastic Gallbladder Polyps? Digestive Diseases and Sciences, 51, 416-421. https://doi.org/10.1007/s10620-006-3146-7
- 9. Wiles, R., Thoeni, R.F., Barbu, S.T., et al. (2017) Management and Follow-up of Gallbladder Polyps: Joint Guidelines between the European Society of Gastrointestinal and Abdominal Radiology (ESGAR), European Association for Endoscopic Surgery and Other Interventional Techniques (EAES), In-ternational Society of Digestive Surgery—European Federation (EFISDS) and European Society of Gastrointestinal En-doscopy (ESGE). European Radiology, 27, 3856- 3866. https://doi.org/10.1007/s00330-017-4742-y
- 10. Kim, M., Kim, H., Han, Y., et al. (2021) Prognostic Value of Carcinoembryonic Antigen (CEA) and Carbohydrate Antigen 19-9 (CA 19-9) in Gallbladder Cancer; 65 IU/mL of CA 19-9 Is the New Cut-off Value for Prognosis. Cancers, 13, Article No. 1089. https://doi.org/10.3390/cancers13051089
- 11. Wang, Y.-F., Feng, F.-L., Zhao, X.-H., et al. (2014) Combined Detection Tumor Markers for Diagnosis and Prognosis of Gallbladder Cancer. World Journal of Gastroen-terology, 20, 4085-4092. https://doi.org/10.3748/wjg.v20.i14.4085
- 12. 鲍建亨, 尚海涛, 郝成飞, 等. 术前中性粒细胞-淋巴细胞比及CA19-9对胆囊癌根治术预后判断价值[J]. 肝胆外科杂志, 2019, 27(5): 374-379.
- 13. Myongjin, K., Hongbeom, K., Youngmin, H., et al. (2021) Prognostic Value of Carcinoembryonic Anti-gen (CEA) and Carbohydrate Antigen 19-9 (CA 19-9) in Gallbladder Cancer; 65 IU/mL of CA 19-9 Is the New Cut-Off Value for Prognosis. Cancers, 13, 1089. https://doi.org/10.3390/cancers13051089
- 14. 张定富, 吴秋芳, 戈长征. 肿瘤标记物CA19-9、CA242对胰腺癌转移和预后预测价值的分析[J]. 现代肿瘤医学, 2017, 25(8): 1258-1260.
- 15. Dolscheid-Pommerich, R.C., Manekeller, S., Walgenbach-Brünagel, G., et al. (2017) Clinical Perfor-mance of CEA, CA19-9, CA15-3, CA125 and AFP in Gastrointestinal Cancer Using LOCI™-Based Assays. Anticancer Research, 37, 353-359. https://doi.org/10.21873/anticanres.11329
- 16. 袁波, 傅晓辉, 尹磊, 等. 联合检测肿瘤标志物对胆囊癌诊断及患者预后的价值[J]. 中华肝胆外科杂志, 2019, 25(10): 746-750.
- 17. Zhang, D., Yu, M., Xu, T. and Xiong, B. (2013) Predictive Value of Serum CEA, CA19-9 and CA125 in Diagnosis of Colorectal Liver Me-tastasis in Chinese Population. Hepato-Gastroenterology, 60, 1297-1301.
- 18. 劳富娟. 肿瘤标志物联合测定在胆囊癌患者中的诊断效果及对预后的影响研究[J]. 世界最新医学信息文摘, 2017, 17(96): 178.
- 19. 张永东. 血清CA199、CA242、CA125联合检测对胆囊癌患者诊断的临床价值研究[J]. 肝胆外科杂志, 2016, 24(2): 106-110.
- 20. Ma, W., Li, W., Wang, J., et al. (2020) The Clinical Role of Preoperative Serum CA19-9 and Carcinoem-bryonic Antigen (CEA) Levels in Evaluating the Resectability of Advanced Gallbladder Cancer. Medical Science Monitor, 26, e925017. https://doi.org/10.12659/MSM.925017
- 21. 李皇保, 周俊, 吴晓俊, 等. 胆囊腺癌术后患者预后影响因素[J]. 中华肝胆外科杂志, 2019, 25(8): 587-591.
- 22. Hundal, R. and Shaffer, E. (2014) Gallbladder Cancer: Epidemiology and Outcome. Clinical Epidemiology, 6, 99-109. https://doi.org/10.2147/CLEP.S37357
- 23. Bailey, K.S., Marsh, W., Daughtery, L., Hobbs, G. and Borgstrom, D. (2022) Sex Disparities in the Presentation of Gallbladder Disease. The American Surgeon™, 88, 201-204. https://doi.org/10.1177/0003134821989044
- 24. Hueman, M.T., Vollmer Jr., C.M. and Pawlik, T.M. (2009) Evolving Treatment Strategies for Gallbladder Cancer. An-nals of Surgical Oncology, 16, 2101-2115. https://doi.org/10.1245/s10434-009-0538-x
- 25. Bray, F., Ferlay, J., Soerjomataram, I., et al. (2018) Global Cancer Statistics 2018: GLOBOCAN Estimates of Incidence and Mortality Worldwide for 36 Cancers in 185 Countries. CA: A Cancer Journal for Clinicians, 68, 394-424. https://doi.org/10.3322/caac.21492
- 26. Aloia, T. A., Járufe, N., Javle, M., et al. (2015) Gallbladder Cancer: Expert Consensus Statement. HPB, 17, 681-690. https://doi.org/10.1111/hpb.12444
- 27. Kim, H.S., Park, J.W., Kim, H., et al. (2018) Optimal Surgical Treatment in Patients with T1b Gallbladder Cancer: An International Multicenter Study. Journal of Hepato-Biliary-Pancreatic Sciences, 25, 533-543. https://doi.org/10.1002/jhbp.593
- 28. Koga, A., Watanabe, K., Fukuyama, T., Takiguchi, S. and Nakayama, F. (1988) Diagnosis and Operative Indications for Polypoid Lesions of the Gallbladder. Archives of Surgery, 123, 26-29. https://doi.org/10.1001/archsurg.1988.01400250028003
- 29. Donald, G., Sunjaya, D., Donahue, T. and Hines, O.J. (2013) Polyp on Ultrasound: Now What? The Association between Gallbladder Polyps and Cancer. The American Sur-geon™, 79, 1005-1008. https://doi.org/10.1177/000313481307901010
- 30. 中华医学会外科学分会胆道外科学组, 中国医师协会外科医师分会胆道外科专业委员会. 胆囊癌诊断和治疗指南(2019版) [J]. 中华外科杂志, 2020, 58(4): 243-251.
- 31. Akatsu, T., Aiura, K., Shimazu, M., et al. (2006) Can Endoscopic Ultrasonography Differentiate Nonneoplastic from Neoplastic Gallbladder Polyps? Digestive Diseases and Sciences, 51, 416-421. https://doi.org/10.1007/s10620-006-3146-7
- 32. Wiles, R., Thoeni, R.F., Barbu, S.T., et al. (2017) Management and Follow-up of Gallbladder Polyps: Joint Guidelines between the European Society of Gastrointestinal and Abdominal Radiology (ESGAR), European Association for Endoscopic Surgery and Other Interventional Techniques (EAES), In-ternational Society of Digestive Surgery—European Federation (EFISDS) and European Society of Gastrointestinal En-doscopy (ESGE). European Radiology, 27, 3856- 3866. https://doi.org/10.1007/s00330-017-4742-y
- 33. Kim, M., Kim, H., Han, Y., et al. (2021) Prognostic Value of Carcinoembryonic Antigen (CEA) and Carbohydrate Antigen 19-9 (CA 19-9) in Gallbladder Cancer; 65 IU/mL of CA 19-9 Is the New Cut-off Value for Prognosis. Cancers, 13, Article No. 1089. https://doi.org/10.3390/cancers13051089
- 34. Wang, Y.-F., Feng, F.-L., Zhao, X.-H., et al. (2014) Combined Detection Tumor Markers for Diagnosis and Prognosis of Gallbladder Cancer. World Journal of Gastroen-terology, 20, 4085-4092. https://doi.org/10.3748/wjg.v20.i14.4085
- 35. 鲍建亨, 尚海涛, 郝成飞, 等. 术前中性粒细胞-淋巴细胞比及CA19-9对胆囊癌根治术预后判断价值[J]. 肝胆外科杂志, 2019, 27(5): 374-379.
- 36. Myongjin, K., Hongbeom, K., Youngmin, H., et al. (2021) Prognostic Value of Carcinoembryonic Anti-gen (CEA) and Carbohydrate Antigen 19-9 (CA 19-9) in Gallbladder Cancer; 65 IU/mL of CA 19-9 Is the New Cut-Off Value for Prognosis. Cancers, 13, 1089. https://doi.org/10.3390/cancers13051089
- 37. 张定富, 吴秋芳, 戈长征. 肿瘤标记物CA19-9、CA242对胰腺癌转移和预后预测价值的分析[J]. 现代肿瘤医学, 2017, 25(8): 1258-1260.
- 38. Dolscheid-Pommerich, R.C., Manekeller, S., Walgenbach-Brünagel, G., et al. (2017) Clinical Perfor-mance of CEA, CA19-9, CA15-3, CA125 and AFP in Gastrointestinal Cancer Using LOCI™-Based Assays. Anticancer Research, 37, 353-359. https://doi.org/10.21873/anticanres.11329
- 39. 袁波, 傅晓辉, 尹磊, 等. 联合检测肿瘤标志物对胆囊癌诊断及患者预后的价值[J]. 中华肝胆外科杂志, 2019, 25(10): 746-750.
- 40. Zhang, D., Yu, M., Xu, T. and Xiong, B. (2013) Predictive Value of Serum CEA, CA19-9 and CA125 in Diagnosis of Colorectal Liver Me-tastasis in Chinese Population. Hepato-Gastroenterology, 60, 1297-1301.
- 41. 劳富娟. 肿瘤标志物联合测定在胆囊癌患者中的诊断效果及对预后的影响研究[J]. 世界最新医学信息文摘, 2017, 17(96): 178.
- 42. 张永东. 血清CA199、CA242、CA125联合检测对胆囊癌患者诊断的临床价值研究[J]. 肝胆外科杂志, 2016, 24(2): 106-110.
- 43. Ma, W., Li, W., Wang, J., et al. (2020) The Clinical Role of Preoperative Serum CA19-9 and Carcinoem-bryonic Antigen (CEA) Levels in Evaluating the Resectability of Advanced Gallbladder Cancer. Medical Science Monitor, 26, e925017. https://doi.org/10.12659/MSM.925017
- 44. 李皇保, 周俊, 吴晓俊, 等. 胆囊腺癌术后患者预后影响因素[J]. 中华肝胆外科杂志, 2019, 25(8): 587-591.
- 45. Hundal, R. and Shaffer, E. (2014) Gallbladder Cancer: Epidemiology and Outcome. Clinical Epidemiology, 6, 99-109. https://doi.org/10.2147/CLEP.S37357
- 46. Bailey, K.S., Marsh, W., Daughtery, L., Hobbs, G. and Borgstrom, D. (2022) Sex Disparities in the Presentation of Gallbladder Disease. The American Surgeon™, 88, 201-204. https://doi.org/10.1177/0003134821989044
NOTES
*通讯作者Email: huweiyucn@126.com
