Advances in Clinical Medicine
Vol.
13
No.
12
(
2023
), Article ID:
78360
,
13
pages
10.12677/ACM.2023.13122855
泛癌中FXYD3预后和免疫浸润分析
秦瑞泽,王永华*
青岛大学附属医院泌尿外科,山东 青岛
收稿日期:2023年11月27日;录用日期:2023年12月21日;发布日期:2023年12月29日

摘要
FXYD3作为一种跨膜蛋白,具有离子通道或离子通道调节的作用。目前已有相关研究提示FXYD3与某些肿瘤关系密切。在这项研究中,我们旨在探索FXYD3在泛癌中的作用,从加州大学圣克鲁兹西纳分校(UCSC)和癌症基因组图谱(TCGA)下载数据,分别对TCGA_GTEx、TCGA和TCGA配对样本中FXYD3的表达进行研究。随后,我们对TCGA数据库中肿瘤进行Kaplan-Meier分析,并对FXYD3影响预后的肿瘤进行临床相关性分析和单因素Cox回归分析。我们构建并评估膀胱尿路上皮癌(BLCA)、头颈鳞状细胞癌(HNSC)和肾透明细胞癌(KIRC)的列线图模型,以证明FXYD3在肿瘤中预测患者预后的价值。此外,我们证实FXYD3与免疫细胞浸润也有关系。通过功能富集分析,我们探索FXYD3相关基因参与的生物学功能及潜在信号通路。我们的研究发现FXYD3在多种肿瘤中存在差异表达,并与多种肿瘤的临床结局及免疫微环境相关,可能通过P53信号通路及免疫相关通路影响肿瘤的发生发展。总之,我们认为FXYD3可以作为潜在的预后生物标志物和有效的癌症免疫治疗靶点。
关键词
FXYD3,泛癌,预后,免疫浸润,富集分析

Prognostic and Immune Infiltration Analysis of FXYD3 in Pan-Cancer
Ruize Qin, Yonghua Wang*
Department of Urology, Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Nov. 27th, 2023; accepted: Dec. 21st, 2023; published: Dec. 29th, 2023

ABSTRACT
FXYD3, as a transmembrane protein, has a role in ion channel or ion channel regulation. There have been studies suggesting that FXYD3 is closely related to certain tumors. In this study, we aimed to explore the role of FXYD3 in pan-cancer by downloading data from the University of California Santa Cruz (UCSC) Xena and The Cancer Genome Atlas (TCGA) to investigate the expression of FXYD3 in TCGA_GTEx, TCGA and TCGA paired samples, respectively. Subsequently, we performed Kaplan-Meier analyses of tumors in the TCGA database and performed clinical correlation and univariate Cox regression analyses of tumors in which FXYD3 affected prognosis. We constructed and evaluated nomogram models for bladder uroepithelial carcinoma (BLCA), head and neck squamous cell carcinoma (HNSC), and renal clear cell carcinoma (KIRC) to demonstrate the value of FXYD3 in tumors for predicting patient prognosis. In addition, we confirmed that FXYD3 was also associated with immune cell infiltration. Through functional enrichment analysis, we explored the biological functions and potential signaling pathways involved in FXYD3-related genes. Our study revealed that FXYD3 was differentially expressed in a variety of tumors and correlated with the clinical outcome and immune microenvironment of a variety of tumors, and may influence tumor development through the P53 signaling pathway and immune-related pathways. In conclusion, we believe that FXYD3 can be used as a potential prognostic biomarker and an effective target for cancer immunotherapy.
Keywords:FXYD3, Pan-Cancer, Prognosis, Immune Infiltration, Enrichment Analysis

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
随着人们生活水平的不断提高,肿瘤的发病率呈逐年上升趋势,肿瘤已经成为一个全球性的公共卫生问题。尽管肿瘤诊疗水平不断提高,但仍有部分患者5年生存率偏低,这给人们日常生活和身体健康带来了很大的困扰 [1] [2] 。于是,寻找肿瘤诊疗的新手段,成了人们迫切需要解决的问题。近年来,肿瘤标记物在诊断和治疗某些恶性肿瘤方面取得了长足的进步,例如PD-1/PD-L1抗体药物已被批准用于恶性黑色素瘤、非小细胞肺癌、肾癌、膀胱癌、头颈部鳞癌等肿瘤以及所有微卫星不稳定的实体瘤,使部分癌症的预后得到明显的改善 [3] 。在多种癌症中寻找有效的肿瘤标记物对临床上癌症的靶向治疗具有重要意义 [4] 。FXYD3 (FXYD domain-containing ion transport regulator 3 precursor)是FXYD蛋白家族中的一员,作为跨膜蛋白,具有离子通道或离子通道调节作用 [5] 。目前,已经有部分文献报道FXYD3的表达与某些肿瘤发生发展及预后的关系 [6] [7] 。我们的研究旨在探讨FXYD3在泛癌中作用以及与免疫微环境相关性,并初步探索其在肿瘤中的机制。
本研究通过差异表达分析显示FXYD3在大多数肿瘤中均有差异表达,并且与膀胱癌(BLCA)、结肠癌(COAD)、头颈癌(HNSC)、肾透明细胞癌(KIRC)、肺鳞状细胞癌(LUSC)的预后密切相关。进一步地,免疫浸润分析表明FXYD3的表达与多种免疫细胞有关,可能通过改变免疫微环境来影响肿瘤的预后 [8] 。此外,富集分析显示FXYD3可能通过调控P53相关信号通路参与肿瘤的发生和发展。
总体而言,FXYD3在泛癌中扮演着重要角色,可以影响特定癌症的预后和免疫微环境,这说明FXYD3可作为一种有效的肿瘤标志物和治疗靶点。
2. 材料与方法
2.1. 数据收集和处理
33种肿瘤的基因表达数据和临床数据下载自Cancer Genome Atlas (TCGA, https://portal.gdc.cancer.gov/),而TCGA_GTEx数据集包含TCGA中的样本和来自加州大学圣克鲁兹分校(UCSC) Xena (https://xenabrowser.net/datapages/)的正常样本。人体正常组织和肿瘤组织的免疫组化图像来自Human Protein Atlas (HPA, https://www.proteinatlas.org/)。此外,利用基因表达谱交互分析数据库(GEPIA2, http://gepia2.cancer-pku.cn/#index)从TCGA数据集中提取与FXYD3最相关的100个基因。本研究符合TCGA和UCSC已公布的指南,无需患者的伦理批准和知情同意。
2.2. FXYD3的差异表达分析
分别比较在TCGA_GTEx数据库、TCGA数据库以及TCGA数据库配对样本中的正常组织和肿瘤组织中FXYD3 mRNA的表达情况。此外,在HPA数据库中探索正常组织和肿瘤组织中FXYD3的蛋白水平。
2.3. 预后分析
采用Kaplan-Meier分析和log-rank检验评估在TCGA数据库中FXYD3的基因表达与肿瘤总生存期(OS)、无进展间期(PFI)、疾病特异性生存期(DSS)等临床结果的相关性,p < 0.05代表有统计学意义。此外,绘制与预后相关的肿瘤的受试者工作特征曲线(ROC)。
2.4. FXYD3表达与临床特征的相关性分析
在FXYD3表达影响预后的肿瘤中进一步探索其与T分期、N分期、M分期以及病理分期的相关性,并通过箱式图展示有统计学意义的结果。
2.5. 列新图模型的建立与评估
我们的研究对FXYD3表达影响预后的肿瘤(包括OS、PFI和DSS)进行OS的单因素Cox回归分析,并选择p < 0.05的和样本量大于400的肿瘤分别构建列线图模型 [9] ,此外,绘制校正曲线来评估患者预后1年、3年和5年的预测模型的精准度。
2.6. 免疫浸润分析
利用Tumor Immune Estimation Resource 2.0 数据库(TIMER2.0, http://timer.cistrom.org/)并结合多种算法如TIMER、EPIC、TIDE、CIBERSORT、CIBERSORT-abs、QUANTISEQ、XCELL、MCPCOUNTER以此来评估TCGA数据库中各肿瘤表达与免疫细胞的相关性,包括B细胞、巨噬细胞、CD4+T细胞、CD8+T细胞 [10] 。
2.7. 功能富集和蛋白质互作网络分析
从GEPIA2数据库中获得与FXYD3表达最相似的100个相关基因。对其相关基因进行研究,通过生物途径(BP)、细胞成分(CC)和分子功能(MF)为主的基因本体(GO)分析和京都基因与基因组百科全书(KEGG)分析,进一步探索FXYD3的潜在功能。此外,将100个FXYD3相关基因在Retrieval of Interacting Genes (STRING)数据库(https://cn.string-db.org/)中建立PPI网络,将最小相互作用阈值设置为0.4。
2.8. 差异表达分析和基因集富集分析
使用DESeq R包对FXYD3与预后相关的肿瘤进行差异表达分析。接下来,根据EFXYD3在肿瘤中的差异表达分析结果,利用clusterProfiler R包进行Gene Set Enrichment Analysis (GSEA)富集分析 [11] 。
2.9. 数据分析
两组间差异比较采用Wilcoxon秩和检验,两组间相关性比较使用Spearman秩和检验。采用单因素和多因素Cox比例风险回归筛选影响预后的因素。生存分析采用Kaplan-Meier分析和log-rank检验。使用R(4.1.2版)进行统计学分析,以p < 0.05为差异有统计学意义(*p < 0.05, **p < 0.01, ***p < 0.001, ****p < 0.0001)。
3. 结果
3.1. FXYD3在泛癌组织中的表达
为探索FXYD3在泛癌中的表达差异,我们发现在TCGA数据库中FXYD3在许多肿瘤中表达存在差异(图1(A))。进一步,我们发现此结果与在TCGA_GTEx数据库的分析相一致(图1(B))。我们能够明显

(A) TCGA_GTEx数据库中33个肿瘤FXYD3的mRNA表达情况。(B) TCGA数据库中33个肿瘤FXYD3的mRNA表达情况。(C) TCGA数据库中23个肿瘤配对样本FXYD3的表达。ACC,肾上腺皮质癌;BLCA,膀胱尿路上皮癌;BRCA,乳腺浸润癌;CESC,宫颈鳞癌和腺癌;CHOL,胆管癌;COAD,结肠癌;淋巴样肿瘤弥漫性大b细胞淋巴瘤;ESCA,食管癌;GBM,多形性胶质母细胞瘤;HNSC,头颈部鳞状细胞癌;KICH,肾嫌色细胞癌;KIRC,肾透明细胞癌;KIRP,肾乳头状细胞癌;LAML,急性髓系白血病;LGG,低级别脑胶质瘤;LIHC,肝细胞癌;LUAD,肺腺癌;LUSC,肺鳞状细胞癌;MESO间皮瘤;OV,卵巢浆液性囊腺癌;PAAD,胰腺腺癌;PCPG,嗜铬细胞瘤、副神经节瘤;PRAD,前列腺腺癌;READ,直肠腺癌;SARC,肉瘤;SKCM,皮肤黑色素瘤;STAD,胃腺癌;TGCT,睾丸生殖细胞肿瘤;THCA,甲状腺癌;THYM,胸腺瘤;UCEC,子宫内膜癌;UCS,子宫癌肉瘤;UVM,葡萄膜黑色素瘤。(ns, p > 0.05, *p < 0.05, **p < 0.01, ***p < 0.001)。
图1. 泛癌组织中FXYD3 mRNA的表达
的观察到,在膀胱、结肠、肺、头颈这几种器官中,FXYD3基因表达在肿瘤组织中明显高于正常组织。相反地,在肾脏中,FXYD3基因表达在肿瘤组织中低于正常组织。此外,我们还对TCGA数据库配对样本中多种肿瘤的FXYD3表达进行了分析(图1(C))。接下来我们通过HPA数据库研究FXYD3在人体各器官中正常组织和肿瘤组织中的蛋白表达,并获得膀胱、结肠、肺、头颈和肾脏多种器官的正常组织和肿瘤组织的具有代表性免疫组化(IHC)图像(图2)。我们发现在膀胱、结肠、头颈部、肺脏中肿瘤组织的FXYD3蛋白表达高于正常组织,然而在肾脏中结果相反。

Figure 2. The IHC images of FXYD3 in normal and tumor tissues extracted from the HPA
图2. 从HPA获得的正常组织和肿瘤组织FXYD3蛋白表达的免疫组化图像
3.2. 泛癌中EXOC3L1表达与预后的关系
为探讨FXYD3在泛癌中的预测预后的价值,我们采用Kaplan-Meier生存分析来评估FXYD3的表达与临床结局的相关性。我们研究33种肿瘤中FXYD3表达与OS的相关性,结果发现FXYD3表达与BLCA、HNSC、KIRC患者的OS密切相关(图3A)。在BLCA、HNSC中FXYD3的高表达与较短的OS相关,而在KIRC中FXYD3的高表达则与较长的OS相关(图3(C)、图3(D))。
然后,我们又研究FXYD3的表达与DSS的相关性,结果显示FXYD3的表达与BLCA、HNSC、KIRC、LUSC患者的DSS密切相关(图4(A))。类似地,在BLCA、HNSC以及LUSC中FXYD3的高表达与较差的DSS相关,而在KIRC中FXYD3的高表达则与较好的DSS相关(图4(B)~(D))。
同样地,我们又探究FXYD3的表达与PFI的关系,结果表明FXYD3的表达与BLCA、COAD以及KIRC患者的PFI具有相关性(图5(A))。在BLCA和COAD中,FXYD3的高表达表现为较差的PFI。相反在KIRC中,FXYD3高表达表现为较好的PFI (图5(B)、图5(C))。此外,我们还绘制出5种预后与FXYD3表达相关肿瘤的诊断ROC曲线以显示FXYD3在这几种肿瘤中的诊断预测价值(图6(A)~(E)),结果显示FXYD3表达在这几种肿瘤中均有良好的诊断预测效能。
3.3. FXYD3的表达与临床特征的相关性
通过上述分析我们知道在TCGA数据库中,BLCA、COAD、HNSC、KIRC以及LUSC与FXYD3表达是密切相关的。因此,我们进一步研究在这几种肿瘤中FXYD3表达与临床特征的关系,包括年龄、性别、TNM分期、病理分期。我们通过箱式图展示了具有临床意义的结果,结果显示FXYD3的表达与BLCA的T分期及病理分期相关。同样,FXYD3的表达与HNSC的病理分期及LUSC的T分期相关(图7(A)~(D))。
3.4. 列线图模型的建立以及评估
基于FXYD3表达与OS相关的单因素COX回归分析结果,我们分别构建了BLCA、HNSC及KIRC列线图模型来预测生存预后,并通过校正曲线评估列线图模型在1年、3年、5年的预测精度。从构建的列线图中我们可以得出结论,在BLCA、HNSC及KIRC中FXYD3表达对患者预后具有重要作用且有良好的预测效能(图8(A)、图8(C)、图8E)。校准后的1年、3年、5年生存预测曲线表明,列线图对OS具有良好的预测精度(图8(B)、图8(D)、图8(F)),这有望为癌症患者提供一种新型且可靠的生存期预测手段。
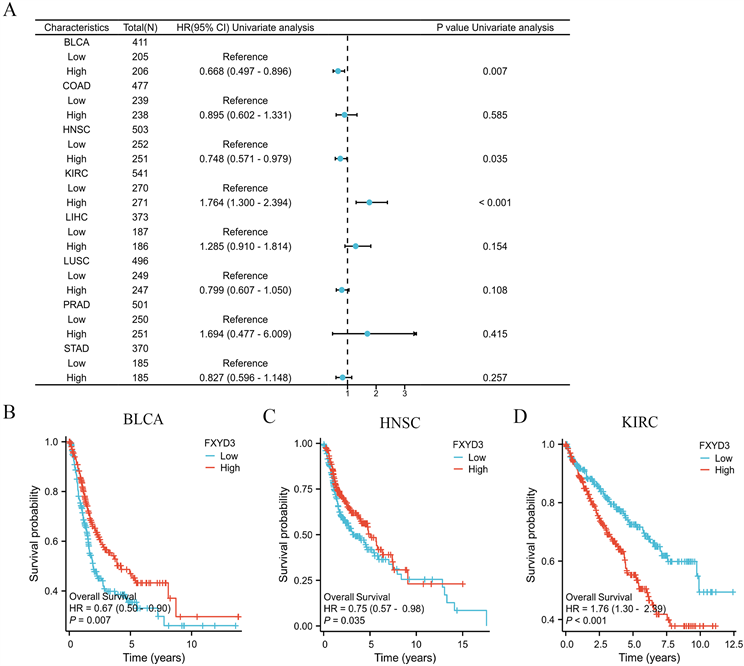 (A) 森林图显示FXYD3表达与各肿瘤OS的相关性。(B)~(D) 通过KM曲线展示FXYD3表达分别与BLCA、HNSC和KIRC患者的OS的关系。
(A) 森林图显示FXYD3表达与各肿瘤OS的相关性。(B)~(D) 通过KM曲线展示FXYD3表达分别与BLCA、HNSC和KIRC患者的OS的关系。
Figure 3. The association between FXYD3 expression and OS in pan-cancer
图3. 泛癌中FXYD3表达与OS的关系
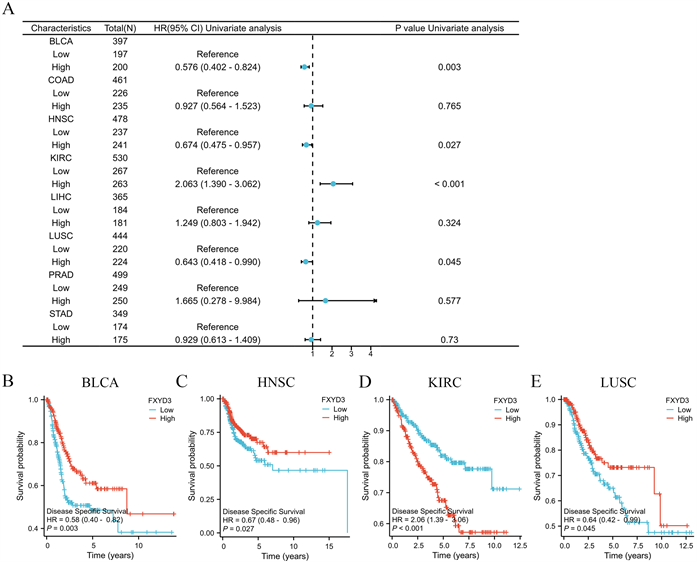 (A) 森林图显示FXYD3表达与各肿瘤DSS的相关性。(B)~(E) 通过KM曲线展示FXYD3表达分别与BLCA、HNSC、KIRC和LUSC患者的DSS的关系。
(A) 森林图显示FXYD3表达与各肿瘤DSS的相关性。(B)~(E) 通过KM曲线展示FXYD3表达分别与BLCA、HNSC、KIRC和LUSC患者的DSS的关系。
Figure 4. The association between FXYD3 expression and DSS in pan-cancer
图4. 泛癌中FXYD3表达与DSS的关系
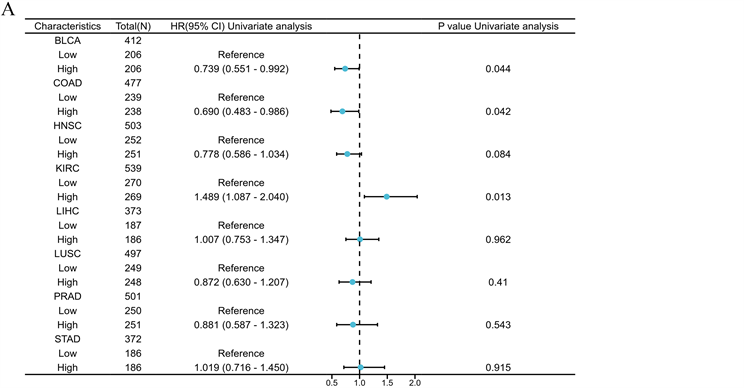
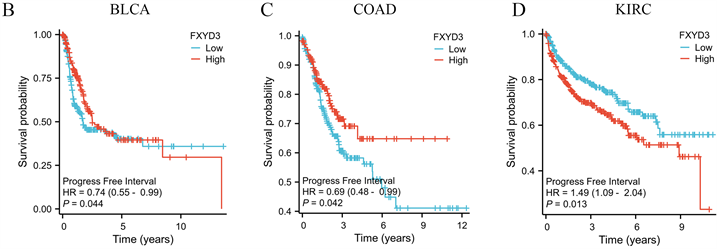 (A) 森林图显示FXYD3表达与各肿瘤PFI的相关性。(B)~(D) 通过KM曲线展示FXYD3表达分别与BLCA、COAD和KIRC患者的PFI的关系。
(A) 森林图显示FXYD3表达与各肿瘤PFI的相关性。(B)~(D) 通过KM曲线展示FXYD3表达分别与BLCA、COAD和KIRC患者的PFI的关系。
Figure 5. The association between FXYD3 expression and PFI in pan-cancer
图5. 泛癌中FXYD3表达与PFI的关系
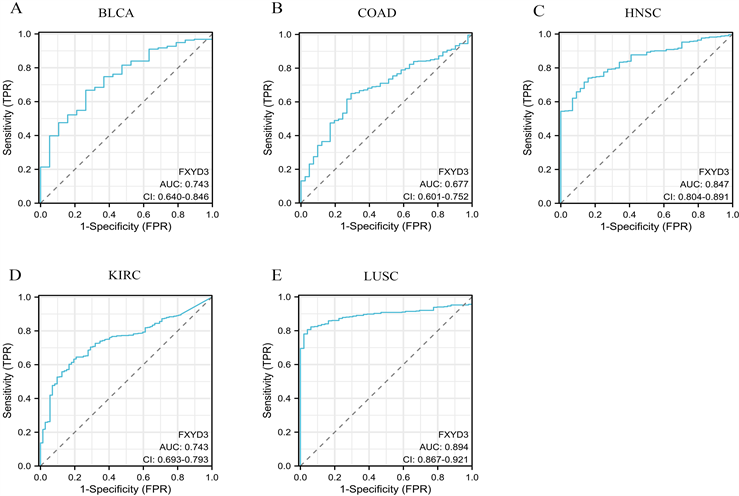 (A)~(E) 分别展示BLCA、COAD、HNSC、KIRC和LUSC的诊断ROC曲线。
(A)~(E) 分别展示BLCA、COAD、HNSC、KIRC和LUSC的诊断ROC曲线。
Figure 6. The diagnostic predictive efficacy of FXYD3 in 5 tumors was evaluated by diagnostic ROC curve
图6. 通过诊断ROC曲线来表现FXYD3在这5种肿瘤中的诊断预测效能
3.5. FXYD3表达与肿瘤免疫微环境的关系
免疫微环境在肿瘤发生发展以及抗肿瘤免疫中起着至关重要的作用。为研究泛癌组织中FXYD3与免疫微环境的关系,我们利用GEPIA2数据库对泛癌组织中FXYD3的表达与免疫细胞的相关性进行研究并绘制处FXYD3表达与B细胞、CD4 T细胞、CD8 T细胞和巨噬细胞的相关热图(图9(A)~(D))。
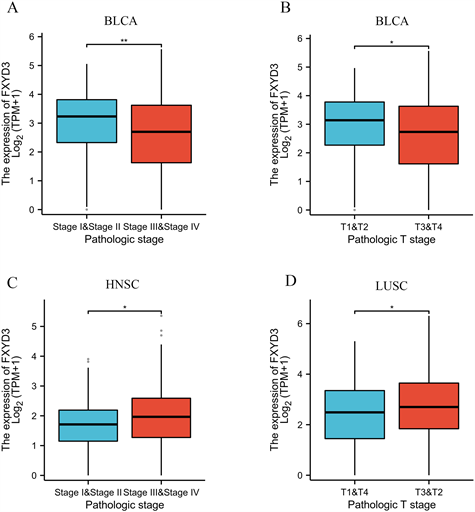 (A) (B) BLCA中FXYD3表达分别与T分期和病理分期相关。(C) HNSC中FXYD3表达与病理分期相关。(D) LUSC中FXYD3表达与T分期相关。
(A) (B) BLCA中FXYD3表达分别与T分期和病理分期相关。(C) HNSC中FXYD3表达与病理分期相关。(D) LUSC中FXYD3表达与T分期相关。
Figure 7. The correlation between FXYD3 expression and clinicopathological features
图7. FXYD3表达与临床病理特征的关系
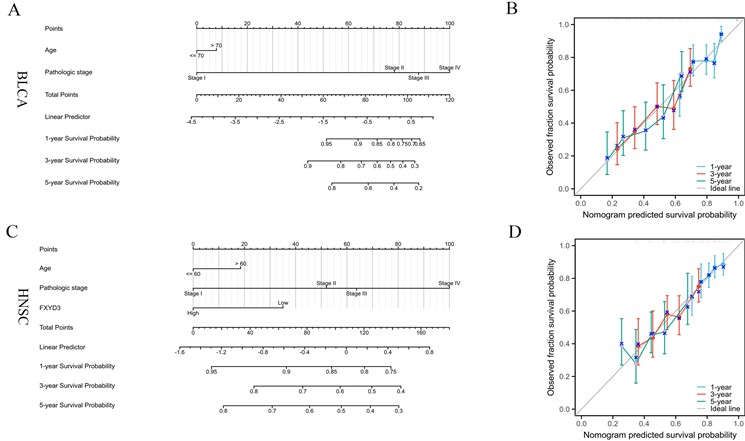
 (A) (C) (E) 在BLCA、HNSC和KIRC中分别构建包含FXYD3表达的列线图。(B) (D) (F) 利用1年、3年和5年的校准曲线来分别评价列线图模型在BLCA、HNSC和KIRC中的预测精度。
(A) (C) (E) 在BLCA、HNSC和KIRC中分别构建包含FXYD3表达的列线图。(B) (D) (F) 利用1年、3年和5年的校准曲线来分别评价列线图模型在BLCA、HNSC和KIRC中的预测精度。
Figure 8. Nomogram models were established and evaluated in BLCA、HNSC and KIRC
图8. 在BLCA、HNSC和KIRC中构建列线图并进行评估
 (A)~(D) FXYD3表达与TIMER2数据库中B细胞、CD4+T细胞和CD8+T细胞以及巨噬细胞的相关性热图。
(A)~(D) FXYD3表达与TIMER2数据库中B细胞、CD4+T细胞和CD8+T细胞以及巨噬细胞的相关性热图。
Figure 9. The correlation of FXYD3 expression and immune cell in filtration
图9. FXYD3表达与免疫细胞浸润的相关性
3.6. FXYD3相关基因功能富集及蛋白互作分析
为了进一步探索FXYD3在肿瘤中的生物学功能,我们从GEPIA2数据库中获取了100个与FXYD3最密切相关的基因。通过GO分析,我们发现FXYD3相关基因可能参与内皮细胞生长发育、细胞间连接、钙黏着蛋白结合等生物学功能(图10(A))。KEGG通路分析显示FXYD3相关基因与p53信号通路密切相关(图10(B))。此外,利用100个FXYD3相关基因在STRING网站上生成PPI网络(图11)。为了进一步阐明FXYD3的功能机制,我们基于其差异表达分析使用GSEA方法研究上述5种与预后相关的肿瘤中FXYD3相关基因的生物学功能。结果显示FXYD3与免疫相关通路、细胞外基质相互作用以及三羧酸循环等通路密切相关(图10(C)~(G))。
 (A) 100个FXYD3相关基因的GO富集分析,包括BP、CC和MF。(B) 100个FXYD3相关基因的KEGG通路分析。(C)~(G)基于BLCA、COAD、HNSC、KIRC、LUSC的差异表达分析的GSEA富集分析。
(A) 100个FXYD3相关基因的GO富集分析,包括BP、CC和MF。(B) 100个FXYD3相关基因的KEGG通路分析。(C)~(G)基于BLCA、COAD、HNSC、KIRC、LUSC的差异表达分析的GSEA富集分析。
Figure 10. Functional enrichment analysis of FXYD3-related genes
图10. FXYD3相关基因的功能富集分析
4. 讨论
癌症严重危害人类健康,尽管目前已有一些肿瘤相关的生物标记物被发现,但是仍然有很多肿瘤缺乏有效的诊疗靶标。因此,挖掘有效的肿瘤标记物对于许多癌症的诊疗具有重要作用 [12] 。目前仍然缺乏关于FXYD3表达在泛癌中的研究,因此我们对此进行了深入的探索。
通过利用公共数据库中的样本,我们探索FXYD3在33种癌症中正常组织和肿瘤组织的差异表达。

Figure 11. A PPI network generated on the STRING website using 100 FXYD3-related genes was demonstrated
图11. 展示利用100个FXYD3相关基因在STRING网站上生成的PPI网络
总体来讲,利用三种数据集得出的结论基本一致,表明在多种肿瘤中FXYD3基因表达具有差异。此外,蛋白表达在肿瘤组织和正常组织的差异情况与TCGA数据库中基因表达情况相一致,这提示FXYD3或许能作为一种有效的肿瘤标志物。进一步地,我们包括OS、DSS和PFI在内的多个预后指标探索在泛癌中FXYD3表达与生存结局的相关性。有趣的是,我们发现在BLCA和KIRC中FXYD3表达均与这几种预后指标密切相关,这提示在BLCA和KIRC中FXYD3的表达具有重要意义。我们还对FXYD3的表达与临床特征的关系进行深入的探索,发现FXYD3表达与某些肿瘤的个别临床特征密切相关,其中包括T分期以及病理分期,这提示FXYD3在某些肿瘤的发生发展具有重要作用。
肿瘤微环境是肿瘤发生和生长的环境,其中免疫微环境对于肿瘤患者的生存结局以及临床特征具有重要影响 [13] [14] ,因此我们对FXYD3的表达与免疫浸润的相关性在泛癌中进行探索。通过热图,我们可以观察到在泛癌中FXYD3表达与B细胞、CD4+T细胞、CD8+T细胞和巨噬细胞四种免疫细胞的相关性,这对于今后我们具体深入的研究FXYD3在抗肿瘤免疫中扮演的角色具有重要参考意义。已有研究表明,基因表达的差异可导致机体免疫微环境的变化,这为肿瘤免疫治疗提供了潜在的可能性 [15] 。我们的研究表明FXYD3可能具有调控肿瘤免疫微环境的作用,这为探索新型肿瘤免疫治疗靶点提供理论依据。
我们的研究发现FXYD3的表达与某些肿瘤的T期及病理分期有关,这使得我们猜测FXYD3在肿瘤生长、增殖、迁移、侵袭中起重要作用。这与后续我们对FXYD3功能富集分析的研究结果一致,富集分析结果显示FXYD3在内皮细胞生长发育、细胞间连接、钙黏着蛋白结合、细胞外基质相互作用等发挥重要作用。同样,FXYD3在肿瘤免疫微环境中所发挥的作用也得到了富集分析结果的印证。
然而,我们的研究仍存在局限性。一方面,我们获取的样本量较小,结果存在误差。另一方面,我们的研究主要通过生物信息学技术进行研究,需要进一步的体内体外实验进行验证。此外,我们缺乏对于相关机制通路深入的研究。
综上所述,我们发现FXYD3在多种肿瘤中差异表达且与预后密切相关,这可能是通过调节细胞免疫微环境发挥作用。我们的研究为今后FXYD3在各个肿瘤的机制探索提供一定的理论基础及新方向。
文章引用
秦瑞泽,王永华. 泛癌中FXYD3预后和免疫浸润分析
Prognostic and Immune Infiltration Analysis of FXYD3 in Pan-Cancer[J]. 临床医学进展, 2023, 13(12): 20278-20290. https://doi.org/10.12677/ACM.2023.13122855
参考文献
- 1. 陈万青, 李霓, 石菊芳, 等. 中国城市癌症早诊早治项目进展[J]. 中国肿瘤, 2019, 28(1): 23-25.
- 2. 邹小农, 贾漫漫, 王鑫, 等. 《2020全球癌症报告》要点解读[J]. 中国胸心血管外科临床杂志, 2021, 28(1): 11-18.
- 3. 艾超, 冀召帅, 唐蕾, 等. PD-1/PD-L1抑制剂抗肿瘤临床研究进展[J]. 临床药物治疗杂志, 2021, 19(9): 8-13.
- 4. Lee, Y.T., Tan, Y.J. and Oon, C.E. (2018) Molecular Targeted Therapy: Treating Cancer with Specificity. European Journal of Pharmacology, 834, 188-196. https://doi.org/10.1016/j.ejphar.2018.07.034
- 5. Morrison, B.W. and Leder, P. (1994) Neu and Ras Initiate Murine Mammary Tumors That Share Genetic Markers Generally Absent in c-myc and int-2-Initiated Tumors. Oncogene, 9, 3417-3426.
- 6. 史海达, 史宪杰. FXYD3蛋白与肿瘤的相关性研究进展[J]. 世界最新医学信息文摘, 2017, 17(34): 62-63.
- 7. 马学玲, 蔡海瑜, 车艳红, 等. FXYD3在宫颈鳞癌患者组织中的表达及与临床病理参数的关系[J]. 临床检验杂志, 2021, 39(9): 662-667.
- 8. 白日兰, 崔久嵬. 从肿瘤免疫微环境角度看免疫治疗疗效预测标志物[J]. 中国癌症防治杂志, 2022, 13(6): 585-593.
- 9. 李伟栋, 杨丽, 邹兴文, 等. 基于列线图的肿瘤风险预测及其效果评价[J]. 肿瘤预防与治疗, 2019, 32(4): 305-310.
- 10. 耿辉, 田国祥, 王亚军, 等.肿瘤浸润性免疫细胞分析数据库TIMER2.0的应用介绍[J]. 中国循证心血管医学杂志, 2020, 12(11): 1283-1286.
- 11. Yu, G., Wang, L.G., Han, Y. and He, Q.Y. (2012) clusterProfiler: An R Package for Comparing Bio-logical Themes among Gene Clusters. Omics: A Journal of Integrative Biology, 16, 284-287. https://doi.org/10.1089/omi.2011.0118
- 12. Lokshin, A., Bast, R.C. and Rodland, K. (2021) Circulating Cancer Biomarkers. Cancers (Basel), 13, 802. https://doi.org/10.3390/cancers13040802
- 13. 张百红, 岳红云. 免疫微环境促进肿瘤发生发展的机制研究进展[J]. 现代肿瘤医学, 2015, 23(6): 862-864.
- 14. 张赟, 王小凡. 肿瘤微环境调控癌症发生发展的研究概述[J]. 生命科学, 2022, 52(9): 1377-1390.
- 15. 赵喆, 白桦, 王志杰, 段建春, 等. 肿瘤微环境与免疫治疗耐药的关系及应对[J]. 现代肿瘤医学, 2020, 28(22): 3985-3989.