Advances in Clinical Medicine
Vol.
13
No.
04
(
2023
), Article ID:
64913
,
7
pages
10.12677/ACM.2023.134977
卡介苗热休克蛋白70基因修饰的树突状细胞 疫苗体内抗瘤作用的研究
吴晓娟1,刘春雷2,李晓玲1*
1临沂市人民医院儿内科三病区,山东 临沂
2临沂市人民医院网络与信息部,山东 临沂
收稿日期:2023年3月26日;录用日期:2023年4月21日;发布日期:2023年4月29日

摘要
目的:探讨卡介苗热休克蛋白70 (BCG HSP70)基因修饰的树突状细胞(DCs)疫苗体内抗瘤效应。方法:从急性白血病患儿骨髓中培养未成熟树突状细胞(imDCs),形态学观察及流式细胞术鉴定后,利用脂质体2000将BCG HSP70基因转入imDCs细胞表面,免疫荧光单克隆抗体进行细胞表面修饰鉴定。取健康BALB/C裸鼠,第0天皮下接种HL-60细胞,第7~10天可形成皮下结节的白血病裸鼠模型,将其随机分为6组,移植瘤内分别接种PBS液、不做任何处理的imDC (imDC组);空载体(pDisplay)转染的imDC (imDC-neo组);重组载体(pDisplay-HSP70)转染的imDC (HSP70组);rhTNF-α (20 ng/ml)诱导的imDC (TNF-α组);以及pDisplay-HSP70转染 + rhTNF-α (20 ng/ml)诱导的imDC (HSP70 + TNF-α组)。每周1次,共2次,于给药第14天处死裸鼠。观察各组肿瘤体积变化,绘制肿瘤生长曲线;计算裸鼠体重的变化情况;以及HE染色观察肿瘤组织切片。结果:1) 骨髓培养的细胞形态特点及细胞表面标志均符合imDCs特征。共聚焦显微镜观察检测证实BCG HSP70表达在转染后的imDCs细胞表面。2) HSP70 + TNF-α组HLA-DR、CD80、CD86阳性率分别为(78.42 ± 8.01)%,(83.00 ± 6.75)%和(88.51 ± 4.44)%,明显高于HSP70组((55.13 ± 4.84)%,(59.93 ± 3.88)%和(62.33 ± 5.42)%)、TNF-α组((57.28 ± 5.63)%,(60.31 ± 6.20)%和(63.70 ± 3.78)%);HSP70组与TNF-α组比较无明显差异(p > 0.05)。3) 体内杀瘤效应:HSP70-DC组肿瘤体积变化(40.94)明显小于PBS对照组、imDC组及imDC-neo组(185.72,181.16和180.18),但大于HSP70 + TNF-α组(17.60) (p < 0.05)。HSP70-DC组、TNF-α组及HSP70 + TNF-α组肿瘤切片染色可见不同程度的核固缩、碎裂及溶解、空泡现象,以HSP70 + TNF-α组最明显。结论:BCG HSP70基因修饰的DC疫苗在小鼠体内可诱导出较强的杀瘤效应,且与细胞因子联合作用更强。
关键词
卡介苗,热休克蛋白70,基因转染,树突状细胞,肿瘤疫苗

Antitumor Effects of Dendritic Cell Vaccine Modified by BCG HSP70 Gene in Vivo
Xiaojuan Wu1, Chunlei Liu2, Xiaoling Li1*
1Department of the Third Pediatrics, Linyi People’s Hospital, Linyi Shandong
2Department of Network and Information, Linyi People’s Hospital, Linyi Shandong
Received: Mar. 26th, 2023; accepted: Apr. 21st, 2023; published: Apr. 29th, 2023

ABSTRACT
Objective: To investigate anti-tumor effects of dendritic cells (DCs) vaccines modified by heat shock protein 70 of BCG (BCG HSP70) gene. Methods: The immature DCs (imDCs) were cultured from bone marrow in children with acute leukemia and identified by the morphological observation and flow cytometry. Then BCG HSP70 gene was transfected onto the surface of imDCs by lipofectamine 2000 and detected by fluorescence microscope. All of BALB/C nude mice were inoculated with HL-60 cells subcutaneously on day 0. After 7 to 10 days, leukemia xenografts in nude mice with formation of subcutaneous nodules were randomly divided into six groups: PBS, imDC (imDC without special processing), imDC-neo (imDCs transfected with pDisplay vector), HSP70 (imDCs transfected with pDisplay-HSP70 vector), TNF-α (imDCs induced with rhTNF-α), and HSP70 + TNF-α respectively. The DCs activated by different agents were intratumorally administered into nude mice. The changes in tumor volume were observed, the changes of mice weight rate were calculated and tumor sections were assessed by hematoxylin-eosin staining. Results: 1) The cultured cells exhibited typical characteristics of surface markers and cell morphology consistent with imDCs. After BCG HSP70 gene transfection, the yellow-green fluorescence on the cells surface was observed under the confocal microscope. 2) The positive rates of HLA-DR, CD80 and CD86 of HSP70 + TNF-α group, which were (78.42 ± 8.01)%, (83.00 ± 6.75)% and (88.51 ± 4.44)%, were significantly higher than HSP70 group ((55.13 ± 4.84)%, (59.93 ± 3.88)% and (62.33 ± 5.42)%) and TNF-α group ((57.28 ± 5.63)%, (60.31 ± 6.20)% and (63.70 ± 3.78)%). There was no difference between HSP70 group and TNF-α group (p > 0.05). 3) Antitumor effects: The changes of tumor volume in HSP70-DC group (40.94) were significantly smaller than PBS group, imDC group and imDC-neo group (185.72, 181.16 and 180.18), but greater than HSP70 + TNF-α group (17.60). The tumor cells in HSP70-DC group, TNF-α group and HSP70 + TNF-α group showed a large number of nuclear condensation, fragmentation and dissolution, among which HSP70 + TNF-α group was the most obvious. Conclusion: DC vaccine modified by BCG HSP70 gene could induce a stronger anti-tumor effect in vivo, and the combined application effect with cytokines is more obvious.
Keywords:BCG, Heat Shock Protein 70, Gene Transfection, Dendritic Cell, Tumor Vaccine

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
免疫细胞治疗是继化疗、骨髓移植(bone marrow transplantation, BMT)后治疗急性白血病的一种新方法,在清除微小残留病(minimal residual disease, MRD)中被寄予很大希望 [1] [2] 。树突状细胞(dendritic cells, DCs)是目前所知抗原提呈能力最强的抗原提呈细胞(antigen presenting cells, APCs),在体内外均可以诱导特异性细胞毒性T淋巴细胞(Cytotoxicity T lymphocyte, CTL)的生成,使机体得以抵御肿瘤的入侵或消灭现存的肿瘤 [3] 。白血病患儿自身DCs数量减少和/或功能缺陷,不能有效递呈肿瘤抗原,是白血病细胞逃避机体免疫攻击的重要机制之一。
卡介苗(Bacille Calmette-Guérin, BCG)能直接诱导DCs的成熟,有效激活DCs为主的APCs对肿瘤抗原的递呈能力增强,进而激活细胞毒性T淋巴细胞(Cytotoxicity T lymphocytes, CTLs)针对肿瘤细胞的特异性免疫反应 [4] 。然而,严重的不良反应阻碍了BCG的临床应用;而且BCG在传代和减毒过程中因发生菌株变异导致免疫效果不稳定。热休克蛋白70 (heat shock protein70, HSP70)是BCG的主要抗原成分,具有免疫优势抗原特性,可强烈刺激免疫系统针对肿瘤抗原的免疫反应,而不需要其他的免疫佐剂 [5] [6] 。现本文就BCG HSP70基因转染到急性白血病儿童骨髓来源的未成熟DCs (immature DCs, imDCs)细胞表面,观察其体内抗瘤作用。
2. 材料和方法
2.1. 材料
重组人粒细胞–巨噬细胞集落刺激因子(recombinant human granulocyte-macrophage colony-stimulating factor, rhGM-CSF) (Peprotech Asia公司,150 μg,Catalog#: 300-03);重组人肿瘤坏死因子-α (recombinant human tumor necrosis factor-α, rhTNF-α) (Peprotech Asia公司,100 μg,Catalog#: 300-01);重组人白细胞介素(Recombinant human interleukin, rhIL)-2 (Peprotech Asia公司,50 μg,Catalog#: 200-02),rhIL-4 (Peprotech Asia公司,100 μg,Catalog#: 200-04);FITC anti-human CD80 (BioLegend公司,20 μg,Catalog#: 305303);FITC anti-human HLA-DR (BioLegend公司,20 μg,Catalog#: 307603);FITC anti-human CD86 (Bioscience公司,20 μg,Catalog#: 305306);HSP70 mAb (mouse) (Cambridge bioscience (GmbH)公司,20ug,Catalog#: ABIN457460)。
重组载体pDisplay-HSP70已由本课题组成功构建并进行基因序列测定,鉴定正确 [7] 。
2.2. 方法
2.2.1. 骨髓imDCs的分离和培养
急性淋巴细胞性白血病患儿诊断和疗效均按血液病诊断及疗效标准,所有患儿均顺利完成化疗并完全缓解达6个月以上,无复发及其它并发症。住院当日无菌采集骨髓5 ml,肝素抗凝(20 U/ml),Ficoll-paque法分离单个核细胞(mononuclear cells, MNCs),含10%胎牛血清(fetal calf serum,FCS)的RPMI1640培养液调整细胞浓度,37℃、5% CO2孵箱中贴壁3 h。吸弃上清液,加入含GM-CSF (100 ng/ml)、IL-4 (100 ng/ml)的10% FCS RPMI1640培养液继续培养,隔天半量换液及全量补充细胞因子。
第6天收集所有悬浮细胞,倒置显微镜观察imDCs细胞形态。调整细胞浓度至少为1 × 106/ml后分别加入抗HLA-DR、抗CD80、抗CD86及阴性对照(鼠抗人IgG1/FITC),4℃避光静置30分钟,离心洗涤后1%多聚甲醛固定,流式细胞术分析荧光强度。
2.2.2. 基因转染及细胞表面修饰鉴定
按照说明书,利用lipofectamine2000将重组载体pDisplay-HSP70转染到上述imDCs细胞表面。收集转染后的细胞,先后加入一抗HSP70 mAb (mouse)和二抗羊抗鼠IgG/FITC,DAPI染色液作用后,取1滴滴于载玻片,盖玻片轻盖后于共聚焦显微镜下观察。
2.2.3. 移植性人白血病小鼠模型建立
60只BALB/c裸鼠(3周龄,雄性,体重10~12 g),购于中国科学院上海实验动物中心,饲养于PF (specific pathogen free condition)动物实验室。人早幼粒细胞性白血病胞标准细胞株HL-60细胞购自ATCC细胞库,以含10% FBS的RPMI1640培养液于37℃、5% CO2、饱和湿度培养箱中孵育,隔天半量换液。
收集对数生长期的HL-60细胞悬液,生理盐水调整细胞浓度1 × 107/0.2 ml。裸鼠右侧肩背部皮肤用碘伏消毒后,在无菌条件下采用皮下注射方式将HL-60活细胞注入裸鼠皮下,隔日观察体重增减、皮下瘤节形成情况。约接种后7~10天于注射部位皮下可触及直径约4~5 mm × 4~5 mm小瘤节,成瘤率可达100%。
2.2.4. DCs疫苗体内抑制瘤试验
分组:1组:PBS对照组;2组:不做任何处理的imDC (imDC组);3组:空载体(pDisplay)转染的imDC (imDC-neo组);4组:重组载体(pDisplay-HSP70)转染的imDC (HSP70-DC组);5组:rhTNF-α (20 ng/ml)诱导的imDC (TNF-α组);6组:pDisplay-HSP70转染 + rhTNF-α (20ng/ml)诱导的imDC (HSP70 + TNF-α组)。各组细胞均在37℃、5% CO2孵箱中培养,第8天收集所有悬浮细胞,倒置显微镜观察DCs细胞形态,流式细胞术分析HLA-DR、CD80及CD86阳性率。
肿瘤表面局部消毒后,分别瘤内注射上述6组细胞(1 × 107/0.2ml/只),每周一次,共两次,继续严格无菌饲养,给药后第14天均处死。
2.2.5. 观察指标
1) 肿瘤体积的动态变化
隔2天测量皮下移植瘤的长度及宽度,根据V (mm3) = 0.4 × 长(mm) × 宽2 (mm2)计算肿瘤体积,绘制移植瘤生长曲线。实验结束时剥离瘤体,测量肿瘤长度及宽度,计算肿瘤体积同上,根据以下等式计算肿瘤体积变化。
体积变化 = (V14 − V1)/V1,其中V14为给药后第14天处死裸鼠时肿瘤体积;V1为给药当天的肿瘤体积。
2) 裸鼠体重的变化情况
实验开始及结束时称重,期间每隔2天称量体重,了解瘤内注射后裸鼠体重变化情况。体重增加幅度 = 结束时体重 − 开始时体重;净体重增加幅度 = 体重增加幅度 − 瘤重。
3) 病理标本的处理及观察
所有裸鼠处死后,剥离局部移植瘤,常规HE染色,显微镜下观察肿瘤内细胞形态和凋亡情况。
2.2.6. 统计学处理
应用SPSS17.0统计学软件进行数据处理,数据用均数 ± 标准差( ± S)表示,多组比较采用方差分析,组间比较采用t检验。p < 0.05为差异有统计学意义。
3. 结果
3.1. 细胞形态学观察
所有细胞均呈悬浮生长,imDCs细胞呈圆形或类圆形,表面有少量突起,且突起的长度短细;mDCs细胞形态不规则,表面伸出多量树枝样突起,粗细不均,较长。
3.2. 基因转染imDCs
共聚焦显微镜下观察,转染后的细胞核呈蓝色,表面呈黄绿色荧光,提示BCG HSP70成功转染到细胞膜表面,见图1。
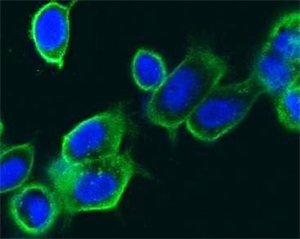
Figure 1. Fluorescene microscopy of imDCs transfected by HSP70 gene (400×)
图1. 荧光显微镜下观察膜表面表达HSP70的细胞疫苗(400×)
3.3. 细胞免疫表型测定
培养d6的imDCs:HLA-DR、CD80及CD86阳性率分别为11.2%、9.6%及8.3%,符合其特点。
培养d8的各组细胞:HSP70 + TNF-α组HLA-DR、CD80、CD86阳性率分别为(78.42 ± 8.01)%,(83.00 ± 6.75)%和(88.51 ± 4.44)%,明显高于HSP70组((55.13 ± 4.84)%,(59.93 ± 3.88)%和(62.33 ± 5.42)%) (F = 38.63,p < 0.01);(t = 8.05、3.86、16.27,p < 0.05)和TNF-α组((57.28 ± 5.63)%,(60.31 ± 6.20)%和(63.70 ± 3.78)%) (t = 5.14、6.05、10.36,p < 0.05);HSP70组与TNF-α组比较无明显差异(t = 1.00、0.08、0.50,p > 0.05)。
3.4. 肿瘤体积变化
计算肿瘤体积,绘制移植瘤生长曲线(图2)。瘤内注射前,所有裸鼠肿瘤体积无显著性差异;注射后,HSP70-DC组肿瘤体积变化明显小于PBS对照组、imDC组及imDC-neo组,但大于HSP70 + TNF-α组;HSP70组与TNF-α组比较无明显差异。

Figure 2. Change in size of tumor following the time
图2. 移植瘤生长曲线
给药后第14天处死裸鼠时各组肿瘤体积分别为(9336.17 ± 872.77) mm3,(9108.83 ± 844.62) mm3,(9059.25 ± 852.38) mm3,(2097.58 ± 554.87) mm3,(2060.92 ± 521.03) mm3,(930.58 ± 368.17) mm3,HSP70-DC组明显小于PBS组、imDC组及imDC-neo组,但大于HSP70 + TNF-α组;HSP70组与TNF-α组比较无明显差异(F = 138.72,p < 0.01)。HSP70-DC组、TNF-α组及HSP70 + TNF-α组肿瘤体积变化分别为40.94,40.20,17.60,明显低于PBS组、imDC组及imDC-neo组(分别为185.72,181.16,180.18),以HSP70 + TNF-α组的变化最小。
3.5. 裸鼠体重的变化情况
从实验开始至结束,所有组的裸鼠体重均增加,但无一定规律。但体重增加幅度减去瘤重后,显示:HSP70 + TNF-α组平均净体重增加幅度最大(1.78 g),以下依次为TNF-α组(0.72 g),HSP70-DC组(0.69 g),而PBS组、imDC组及imDC-neo组均约0.2 g~0.3 g。
3.6. 移植瘤病理学变化
3.6.1. 移植瘤大体形态学变化
瘤体早期表现为圆形或椭圆形,后期表面凹凸不平呈多个结节融合。剥离瘤体时,与皮下组织分界较清楚,浸润性粘连较少,质地坚硬,瘤体剖面血管丰富。
3.6.2. HE染色
光学显微镜下观察,对照组肿瘤细胞呈多角形或圆形,大小不一,排列紊乱,分裂像多见;而HSP70-DC组、TNF-α组及HSP70 + TNF-α组可见不同程度的核固缩、碎裂及溶解、空泡现象,以HSP70 + TNF-α组最明显。
4. 讨论
白血病复发的根源主要在于MRD,是当前治愈白血病的主要障碍 [8] 。通过相关的技术方法增强白血病细胞的免疫原性,进而诱导机体产生肿瘤特异性的细胞免疫应答消除肿瘤细胞,可望达到治愈白血病的目的。在机体的抗肿瘤免疫反应中,细胞免疫发挥主要的效应,CTLs是有效的抗肿瘤细胞免疫的核心。研究表明,肿瘤细胞无法被 T 细胞识别、杀伤是由于荷瘤宿主的DCs数量减少和/或功能缺陷,无法有效提呈肿瘤抗原、激发特异性CTL反应所致 [9] [10] [11] [12] [13] 。
DCs是目前所知抗原提呈能力最强的APCs,具有独特的抗原递呈和激活功能,作为免疫反应的核心和关键,在肿瘤细胞和T淋巴细胞的相互作用中起桥梁和枢纽作用,其表面HLA和共刺激因子(如CD80,CD86等)的表达增强,自身合成并分泌重要的细胞因子如IL-12、IFN-γ等,激活多种免疫相关细胞,由此启动MHC-I类限制的CTL和MHC-II类限制的CD4 + Th1反应。大量实验证明,mDCs可以诱导机体特异性免疫反应的发生,使机体得以抵御肿瘤的入侵或消灭机体现存的肿瘤 [9] [10] 。BCG能有效增强DCs对肿瘤抗原的递呈能力,进而激活CTLs针对肿瘤细胞的特异性免疫反应;诱导肿瘤细胞和局部免疫细胞产生IL-1、IL-6、IL-8、IL-12、INF-γ等细胞因子,发挥直接抗肿瘤作用、免疫细胞网络调节效应和放大免疫细胞抗肿瘤活性 [14] [15] [16] 。但是其对白血病的治疗缺乏特异性。要实现针对所有类型急性白血病的个体化、特异性免疫治疗问题的最佳途径是采用基因修饰的细胞疫苗。HSP70是BCG的重要抗原成分,免疫原性强,具有分子佐剂和载体效应,能够与细胞表面的CD40分子结合,诱导和增强机体体液免疫和细胞免疫的发生,进而激发强大的特异性免疫反应 [5] [6] 。
本实验首先将BCG HSP70基因转染到急性白血病儿童骨髓来源的imDCs细胞表面,随后建立裸鼠皮下HL-60移植瘤模型,瘤内多点注射不同诱导方式获得的DCs悬液,了解基因修饰DC疫苗体内抗肿瘤作用。结果表明:1) HSP70基因转染后能诱导出成熟的DCs,且HSP70成功表达于细胞表面。2) HSP70基因修饰的DCs疫苗在小鼠体内可诱导出较强的杀瘤效应,表现为肿瘤生长受到显著抑制,小鼠净体重增加幅度提高,以及肿瘤切片中可见核固缩、碎裂及溶解、空泡现象。上述作用与细胞因子联合作用更强。
因此,BCG HSP70基因修饰可有效激活DCs对肿瘤抗原的递呈能力增强,产生有效的体内抗白血病特异性免疫反应,为提高急性白血病患儿长期无瘤生长提供了最佳治疗途径。
基金项目
山东省医药卫生科技发展计划项目(202106010569)。
文章引用
吴晓娟,刘春雷,李晓玲. 卡介苗热休克蛋白70基因修饰的树突状细胞疫苗体内抗瘤作用的研究
Antitumor Effects of Dendritic Cell Vaccine Modified by BCG HSP70 Gene in Vivo[J]. 临床医学进展, 2023, 13(04): 6986-6992. https://doi.org/10.12677/ACM.2023.134977
参考文献
- 1. Hoffman, L.M. and Gore, L. (2014) Blinatumomab, a Bi-Specific Anti-CD19/CD3 BiTE® Antibody for the Treatment of Acute Lymphoblastic Leukemia: Perspectives and Current Pediatric Applications. Frontiers in Oncology, 4, Article 63. https://doi.org/10.3389/fonc.2014.00063
- 2. Lambert, J., Nibourel, O., Pautas, C., et al. (2014) MRD Assessed by WT1 and NPM1 Transcript Levels Identifies Distinct Outcomes in AML Patients and Is Influenced by Gemtuzumab Ozogamicin. Oncotarget, 5, 6280-6288. https://doi.org/10.18632/oncotarget.2196
- 3. Durrieu, L., Lemieux, W., Dieng, M.M., et al. (2014) Implication of Different Effector Mechanisms by Cord Blood-Derived and Peripheral Blood-Derived Cytokine-Induced Killer Cells to Kill Precursor B Acute Lymphoblastic Leukemia Cell Lines. Cytotherapy, 16, 845-856. https://doi.org/10.1016/j.jcyt.2013.12.010
- 4. Pizzurro, G.A. and Barrio, M.M. (2015) Dendritic Cell-Based Vac-cine Efficacy: Aiming for Hot Spots. Frontiers in Immunology, 6, Article 91. https://doi.org/10.3389/fimmu.2015.00091
- 5. 李晓玲, 刘春雷, 孙立荣. 卡介苗热休克蛋白70基因转染人原代白血病细胞瘤苗的制备及其抗瘤机制[J]. 中华实用儿科临床杂志, 2015, 30(3): 216-220. https://doi.org/10.3760/j.issn.2095-428X.2015.03.014
- 6. 李晓玲, 孙立荣. 卡介苗HSP70基因转染对小鼠淋巴细胞白血病细胞免疫原性的影响[J]. 临床儿科杂志, 2015, 33(2): 174-176. https://doi.org/10.3969/j.issn.1000-3606.2015.02.21
- 7. Li, X.-L., Zhao, Y.-X., Sun, L.-R., Yang, J. and Xu, H.-J. (2012) Preparation of HL-60 Cells Vaccine Expressing BCG- HSP70 and Anti-Leukemia Effect. Human Vaccines & Immunotherapeutics, 8, 1376-1381. https://doi.org/10.4161/hv.21321
- 8. Pui, C.-H., Carroll, W.L., Meshinchi, S. and Arceci, R.J. (2011) Biology, Risk Stratification, and Therapy of Pediatric Acute Leukemias: An Update. Journal of Clinical Oncology, 29, 551-565. https://doi.org/10.1200/JCO.2010.30.7405
- 9. Anguille, S., Smits, E.L., Lion, E., van Tendeloo, V.F. and Berne-man, Z.N. (2014) Clinical Use of Dendritic Cells for Cancer Therapy. The Lancet Oncology, 15, e257-e267. https://doi.org/10.1016/S1470-2045(13)70585-0
- 10. Holko, P. and Kawalec, P. (2014) Economic Evaluation of Sipuleucel-T Immunotherapy in Castration-Resistant Prostate Cancer. Expert Review of Anticancer Therapy, 14, 63-73. https://doi.org/10.1586/14737140.2014.856270
- 11. Dillman, R.O., MoClay, E.F., Barth, N.M., et al. (2015) Den-dritic versus Tumor Cell Presentation of Autologous Tumor Antigens for Active Specific Immunotherapy in Metastatic Melanoma: Impact on Long-Term Survival by Extent of Disease at the Time of Treatment. Cancer Biotherapy & Radio-pharmaceuticals, 30, 187-194. https://doi.org/10.1089/cbr.2015.1843
- 12. Radford, K.J., Tullett, K.M. and Lahoud, M.H. (2014) Dendritic Cells and Cancer Immunotherapy. Current Opinion in Immunology, 27, 26-32. https://doi.org/10.1016/j.coi.2014.01.005
- 13. Datta, J., Terhune, J.H., Lowenfeld, L., et al. (2014) Optimizing Dendritic Cell-Based Approaches for Cancer Immunotherapy. The Yale Journal of Biology and Medicine, 87, 491-518.
- 14. Pen, J.J., Keersmaecker, B.D., Heirman, C., et al. (2014) Interference with PD-L1/PD-1 Co-Stimulation during Antigen Presentation Enhances the Multifunctionality of Antigen-Specific T Cells. Gene Therapy, 21, 262-271. https://doi.org/10.1038/gt.2013.80
- 15. 杨静, 孙立荣, 庞秀英, 卢愿, 李学荣, 宋爱琴. 卡介苗对白血病患儿外周血树突状细胞扩增的影响[J]. 中国实验血液学杂志, 2010, 18(5): 1240-1243.
- 16. Ahn, Y.-H., Hong, S.-O., Kim, J.H., et al. (2015) The siRNA Cocktail Targeting Interleukin 10 Receptor and Transforming Growth Factor-β Re-ceptor on Dendritic Cells Potentiates Tumour Antigen-Specific CD8+ T Cell Immunity. Clinical and Experimental Immunology, 181, 164-178. https://doi.org/10.1111/cei.12620
NOTES
*通讯作者。