Hans Journal of Agricultural Sciences
Vol.08 No.04(2018), Article ID:24669,9
pages
10.12677/HJAS.2018.84062
Effects of Cu2+ on SOD and POD Enzymatic Activities in Danio rerio
Jingjun Guo
Qingdao No. 2 Middle School of Shandong Province, Qingdao Shandong

Received: Apr. 7th, 2018; accepted: Apr. 21st, 2018; published: Apr. 28th, 2018

ABSTRACT
Effects of Cu2+ on the body weight, body length, SOD and POD enzyme activities of Danio rerio under different water hardness were studied. Results showed that there was no significant effect of different Cu2+ concentrations on body length and weight either at water hardness of 50 mg/L or 250 mg/L. However, there were effects of Cu2+ concentrations on SOD and POD enzymatic activities of Danio rerio. SOD enzymatic activity was induced at low Cu2+ concentrations and was inhabited at high Cu2+ concentrations after 2-day exposure. POD enzymatic activity was first inhabited, then induced and then inhabited at low concentrations, while it was first inhabited and then induced at high concentrations.
Keywords:Cu2+, Danio rerio, Enzymatic Activity, SOD, POD
Cu2+对斑马鱼SOD及POD酶活的影响研究
郭京君
山东省青岛第二中学,山东 青岛

收稿日期:2018年4月7日;录用日期:2018年4月21日;发布日期:2018年4月28日

摘 要
以斑马鱼(Danio rerio)为研究对象,研究了不同硬度条件下Cu2+对斑马鱼体长体重、SOD和POD酶活性的影响。结果表明,在硬度为50 mg/L与250 mg/L条件下,不同的Cu2+浓度,对斑马鱼的体长体重无明显影响。另一方面,Cu2+对斑马鱼SOD和POD活性有不同的影响,其中斑马鱼SOD活性在暴露2天后呈现低浓度诱导高浓度抑制的状态。POD活性表现为低浓度为抑制-诱导-抑制效应,高浓度为抑制-诱导效应。
关键词 :铜,斑马鱼,酶活,SOD,POD

Copyright © 2018 by author and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
重金属铜是生命必需的微量元素,作为氧化还原催化剂或氧的载体参与生物体内30多种酶的组成,但超过一定浓度就会产生毒性 [1] [2] 。在淡水中的背景值一般为0.20~0.30 μg/L,但其进入水环境的途径相当多,在水产养殖中常使用硫酸铜防治疾病及灭杀藻类 [3] [4] ,如鱼类养殖中常用0.7 mg/kg CuSO4防治车轮虫、口丝虫等原生动物疾病并可杀死复口吸虫、甲壳类等寄生虫,蛙类养殖中也常用0.7 mg/kg CuSO4防治体表寄生虫病等 [5] 。
铜是水产养殖中常用的药物,可以防治鱼病,也可作除藻剂,杀死除去丝状藻等浮游植物。同时,较多的鱼用药物添加了铜以增加药效,且以硫酸铜为主要形式,研究表明溶解态铜对水生生物的毒性最强 [6] 。铜导致鱼类产生行为回避反应,这主要是由于铜可损害鱼类的神经生理功能,破坏嗅觉上皮结构,减少嗅觉中受体数目。同时铜也可影响鱼类的血液生理,这进一步影响了耗氧率 [7] 。
目前,水环境的污染日趋严重,引起了人们的广泛重视 [8] 。水环境重金属污染的来源除了自然因素之外,更主要的是人类活动造成的。污染重金属可以通过积累作用蓄积在水生动、植物体内,并通过食物链最终传递给人类 [9] 。尽管被铜污染的水体,很少导致水生生物急性中毒 [10] 。但慢性中毒会经常发生而影响水生生物的生长、繁殖和抗病能力。研究重金属对水生生物的活性胁迫作用,对于水产品养殖及环境治理乃至人类自身都具有重要的意义 [11] 。本文以标准试验材料斑马鱼为试验生物,Cu作为目标污染物,进行斑马鱼的21天延长试验,研究其SOD、POD酶活变化,为揭示Cu的毒性机理提供科学依据。
2. 材料与方法
2.1. 实验材料
试验用鱼为斑马鱼(Danio rerio),为国际上公认的标准试验鱼,已被广泛应用于药物毒理学、生态毒理学、环境监测以及疾病研究等科研领域 [12] [13] 。本实验用鱼体长为2.71 ± 0.81 cm,体重为0.11 ± 0.10 g。
硫酸铜(CuSO4·5H2O,AR)为北京化学试剂三厂生产。配制时,先用蒸馏水配制成质量浓度为320 mg/L的Cu2+的母液,在实验中所用的质量浓度由其稀释而成。
缓冲液:含0.25 mol/L蔗糖、6 mmol/L EDTA-Na2,10 mmol/L Tris,pH值为7.14。
超氧化物歧化酶(SOD)、过氧化物酶(POD)酶活力检测试剂盒购自南京建成生物工程研究所。BCA蛋白浓度测定试剂盒为北京鼎国昌盛生物技术有限责任公司生产。
实验用水为标准稀释水,由CaCl2、MgSO4、NaHCO3、KCl和去离子水配置而成。实验水温为(22 ± 1)℃。
2.2. 实验方法
2.2.1. 预实验
选定4个间隔较大的质量浓度范围进行预实验,与此同时,设不加毒物的空白组对照,观察24、48、72、96 h斑马鱼反应,并按50 mg/L和250 mg/L两种硬度设置每组不同的浓度梯度。
具体浓度设计如下:1) 50 mg/L:2,8,32,128 μg/L;2) 250 mg/L:8,32,128,512 μg/L。根据半静态生物试验法,实验期间每24 h更换一次实验液,每浓度放5尾斑马鱼,在实验中观察其行为和中毒症状。中毒后,经多次刺激无反应则判断为死亡,将死亡斑马鱼从水中捞出并记录死亡数。根据预实验所得出的质量浓度范围来确定正式实验的质量浓度。
2.2.2. 正式实验
本实验参考鱼类14天延长毒性试验的标准方法 [14] ,分别在硬度为50 mg/L和250 mg/L条件下,按1.5倍浓度梯度设置6个质量浓度组。Cu2+质量浓度设计如下:1) 50 mg/L:2,3,4.5,6.75,10.13,15.19 μg/L;2) 250 mg/L:6,9,13.5,20.25,30.38,45.56 μg/L。每组设1个空白对照组,同时设3个平行组,试验温度22 ± 1℃。试验容器为2 L烧杯(盛试液1.6 L),随机放入大小均一的斑马鱼10条,每隔24 h换试液一次,试验开始时连续观察供试斑马鱼的中毒症状,记录死亡数量并及时清出死亡个体。同时加设一套同样的试验,检测不同暴露时间的鱼体酶活。实验期间每日喂食1次,试验光暗比为12 h:12 h。分别在暴露2、4、8、14与21 d时,每个梯度各平行组烧杯中随机选取3尾幼鱼,用预冷双蒸水洗净,滤纸吸干后,于−20℃保存。测定各暴露时间下斑马鱼的SOD和POD酶活。21天试验完毕后,用游标卡尺测出不同硬度下不同浓度组的每条鱼的体长,用纸吸干鱼身上的水分后用分析天平测出斑马鱼体重。
2.2.3. 酶液制备
取整条斑马鱼,用预冷蒸馏水(0~4℃)洗净,滤纸吸干。按每克组织加9 mL冰冷酶提取液(0.125 mmol/L蔗糖,6 mmol/L EDTA-Na2,10 mmol/L Tris,pH = 7.14),用玻璃匀浆器在冰浴中匀浆。匀浆液在高速冷冻离心机中于10,000 r/ min 离心20 min,取上清,测定酶活力。多余酶液−20℃冷冻保存。
2.2.4. 酶活力的测定
样品上清液中蛋白含量的测定采用考马斯亮蓝比色法,SOD测定采用黄嘌呤氧化法改进的方法-羟胺法,POD测定采用一般分光光度法。酶活检测试剂盒按照操作说明进行 [15] 。
SOD活性单位定义为每mg组织蛋白在1 mL反应液中,SOD抑制率达到50%时所对应的SOD量为1个活性单位(U) [16] ;POD酶活性单位定义为,在37℃条件下,每毫克组织蛋白每分钟催化1 μg底物的酶量定义为1个酶活力单位(U) [17] 。酶蛋白含量用BCA蛋白浓度测定试剂盒测定。SOD酶活力单位采用U/(mg pr)表示,POD酶活力单位采用U/(mg pr)表示。
2.2.5. 数据处理
所有数据分析均采用单因素方差分析(One-factor analysis of variance)。数据分析与作图软件为SPSS18.0与Origin 9.0。
3. 结果与分析
3.1. 斑马鱼的中毒症状
斑马鱼在不同质量浓度Cu2+中表现出不同程度的中毒症状,在最高浓度组,斑马鱼暴露24 h后开始出现异常现象,喜欢在水面附近活动,开始剧烈水平游动然后逐渐变得缓慢,最后躺卧死于水面,死亡个体有轻微浮肿。
3.2. 对斑马鱼体长体重的影响
表1显示,各Cu2+处理组,斑马鱼体长与体重与对照组相比,无显著性差异(p > 0.05)。说明在水体硬度50 mg/L且长期暴露于Cu2+条件下,Cu2+对斑马鱼体长与体重的影响不显著。
表2显示,各Cu2+处理组,斑马鱼体长与体重与对照组相比,无显著性差异(p > 0.05)。说明在水体硬度250 mg/L且长期暴露于Cu2+条件下,Cu2+对斑马鱼体长与体重的影响不显著。
由以上可知,Cu2+对斑马鱼的体长体重无明显影响。
3.3. Cu2+对斑马鱼SOD活力的影响
图1显示,当水体硬度为50 mg/L时,斑马鱼的Cu2+各处理组在2 d内组织SOD活性变化不明显,但随着时间的延长,到4 d后,Cu2+各处理组的变化趋于显著,且低浓度组SOD 的活性提高,高浓度组SOD活性得到抑制。其中浓度为2.00 μg/L和3.00 μg/L的Cu2+处理组,SOD活性在开始均表现为增强,后表现出抑制;浓度为4.50 μg/L组在2~8 d时间段呈现缓慢上升趋势,14 d后开始呈现显著下降趋势。10.13 μg/L和15.19 μg/L组在2~8 d期间呈现下降趋势,8 d之后有上升趋势,14 d后趋于平稳。
图2表明,当水体硬度为250 mg/L时,整体上在前4 d内,所有浓度组SOD活性均处于被抑制状态,然后SOD活性逐渐上升。6.00 μg/L和9.00 μg/L Cu2+浓度组在8 d之后趋于稳定,并且略有下降。而其他浓度组在8 d到14 d内有所下降,14 d后逐渐上升。
Table 1. Effects of Cu2+ on body length and body weight of zebrafish at the hardness of 50 mg/L
表1. 50 mg/L硬度下Cu2+对斑马鱼体长与体重的影响
Table 2. Effects of Cu2+ on body length and body weight of zebrafish at the hardness of 250 mg/L
表2. 250 mg/L硬度下Cu2+对斑马鱼体长与体重的影响

Figure 1. Relationship of SOD activities and exposure time of Cu2+ at the hardness of 50 mg/L
图1. 水体硬度50 mg/L下斑马鱼SOD活性与Cu2+暴露时间关系
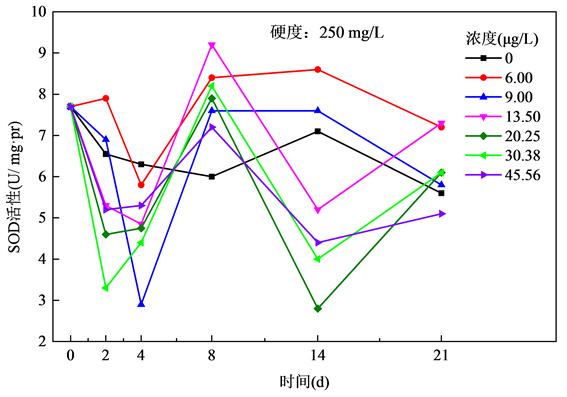
Figure 2. Relationship of SOD activities and exposure time of Cu2+ at the hardness of 250 mg/L
图2. 水体硬度250 mg/L下斑马鱼SOD活性与Cu2+暴露时间关系
3.4. Cu2+对斑马鱼POD酶活的影响
Cu2+对斑马鱼POD酶活影响的数据见图3和图4,在50 mg/L硬度组中,Cu2+浓度为2.00 μg/L和3.00 μg/L时,POD活性在2 d内受到抑制,在2~4 d内逐渐增强,4 d后又开始受到抑制,8 d之后趋于稳定。Cu2+浓度为4.50 μg/L和6.75 μg/L组在2~8 d呈现缓慢下降趋势,8 d之后逐渐上升。10.13 μg/L和15.19 μg/L组从第2 d到14 d呈现下降趋势,14 d后10.13 μg/L浓度组趋于平稳,15.19 μg/L浓度组略有上升。
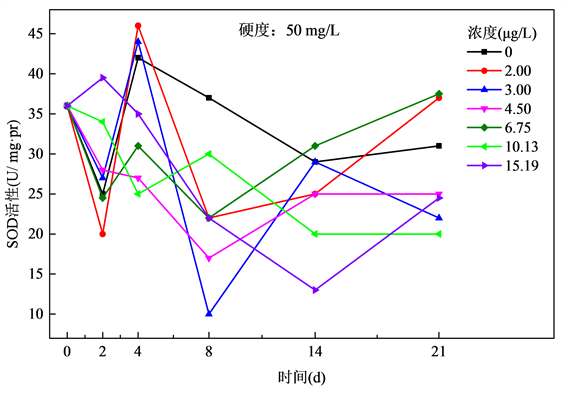
Figure 3. Relationship of POD activities and exposure time of Cu2+ at the hardness of 50 mg/L
图3. 水体硬度50 mg/L下斑马鱼POD活性与Cu2+暴露时间关系
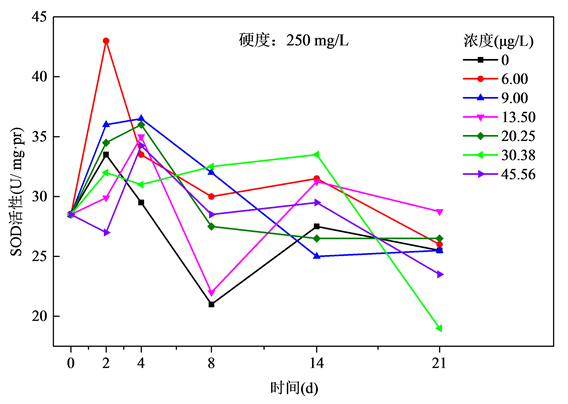
Figure 4. Relationship of SOD activities and exposure time of Cu2+ at the hardness of 250 mg/L
图4. 水体硬度250 mg/L下斑马鱼POD活性与Cu2+暴露时间关系
图4表明,在250 mg/L硬度组中,浓度为6.00 μg/L组的POD活性在2 d增强,其余浓度组2 d内基本无明显变化。2 d后6.00 μg/L组的POD活性开始受到抑制,其后逐渐下降,8 d之后趋于稳定。9.00 μg/L组4 d后开始受到抑制,POD活性随时间逐步降低。13.50 μg/L 4 d内趋于平稳,4 d后呈现抑制诱导状态,14天又趋于平稳。20.35 μg/L,30.38 μg/L和45.56 μg/L组4 d后呈现抑制状态。
4. 讨论
动物体在新陈代谢过程中,产生的超氧阴离子自由基(OH−、 等)可引发脂质过氧化,破坏膜的结构,进而引发DNA断裂、酶蛋白失活,甚至导致细胞、机体死亡。由于脂质过氧化物最终分解产物中有丙二醛(MDA),所以MDA含量可以作为自由基中毒损伤的指标。鱼体中SOD是一类金属酶,含Cu、Zn原子,能催化超氧阴离子自由基(
等)可引发脂质过氧化,破坏膜的结构,进而引发DNA断裂、酶蛋白失活,甚至导致细胞、机体死亡。由于脂质过氧化物最终分解产物中有丙二醛(MDA),所以MDA含量可以作为自由基中毒损伤的指标。鱼体中SOD是一类金属酶,含Cu、Zn原子,能催化超氧阴离子自由基(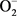 )转化为过氧化物,POD等酶类又进一步催化组织中低浓度的过氧化物氧化其他底物,清除过氧化物和H2O2,从而降低自由基对机体的损害作用。因此,SOD和POD的活性也可以用来评价污染物对水生生物的影响 [1] 。
)转化为过氧化物,POD等酶类又进一步催化组织中低浓度的过氧化物氧化其他底物,清除过氧化物和H2O2,从而降低自由基对机体的损害作用。因此,SOD和POD的活性也可以用来评价污染物对水生生物的影响 [1] 。
4.1. Cu2+对斑马鱼SOD酶活的影响
SOD是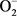 的清除剂,它能专一清除生物经氧化产生的超氧阴离子自由基,将其歧化为H2O2和O2,是机体防御过氧化损害的关键酶之一。在正常生理状态下,由代谢产生的活性氧可为抗氧化防御系统所控制,但当某些污染物在体内进行生物转化时,同时产生氧化还原循环,生成大量活性氧,从而引起机体氧化应激反应,在这些活性氧的产生和转化中,SOD起着非常重要的作用 [18] 。
的清除剂,它能专一清除生物经氧化产生的超氧阴离子自由基,将其歧化为H2O2和O2,是机体防御过氧化损害的关键酶之一。在正常生理状态下,由代谢产生的活性氧可为抗氧化防御系统所控制,但当某些污染物在体内进行生物转化时,同时产生氧化还原循环,生成大量活性氧,从而引起机体氧化应激反应,在这些活性氧的产生和转化中,SOD起着非常重要的作用 [18] 。
对于斑马鱼,Cu2+各处理组在2 d内,组织SOD活性的变化不明显,但随着时间的延长,Cu2+各处理组的变化趋于显著。低浓度组提高了SOD的活性,高浓度组SOD活性得到抑制。
在低浓度或短时间内,鱼暴露在重金属中,鱼体内产生过量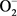 ,诱导鱼体SOD活性提高。重金属是离子通道的阻碍物,能阻碍各种离子通道,从而影响细胞内信号传导而导致体内各种酶活性的变化,对生物体产生毒害作用。当大量重金属离子进入体内,随着时间的延长,鱼体产生大量
,诱导鱼体SOD活性提高。重金属是离子通道的阻碍物,能阻碍各种离子通道,从而影响细胞内信号传导而导致体内各种酶活性的变化,对生物体产生毒害作用。当大量重金属离子进入体内,随着时间的延长,鱼体产生大量 ,超过鱼体SOD清除能力时,就会对组织细胞造成损伤,影响鱼体的正常生理活动,使SOD活性降低和丧失,甚至导致细胞死亡 [5] 。高浓度显示出被抑制的趋势,这可能是由于铜离子浓度较低时,产生少量的
,超过鱼体SOD清除能力时,就会对组织细胞造成损伤,影响鱼体的正常生理活动,使SOD活性降低和丧失,甚至导致细胞死亡 [5] 。高浓度显示出被抑制的趋势,这可能是由于铜离子浓度较低时,产生少量的 ,在O2–的诱导下,SOD的合成能力增强。但SOD清除
,在O2–的诱导下,SOD的合成能力增强。但SOD清除 的能力总是有限度的。
的能力总是有限度的。
SOD清除 的能力与其含量和活性有关,许多研究表明,当生物体受到轻度逆境胁迫时,SOD活性往往升高;而当受到重度逆境胁迫时,SOD活性通常降低,使生物体内积累过量的活性氧,从而导致生物体受到伤害。本实验结果同样发现,低浓度铜胁迫下,斑马鱼体内的SOD活性升高 [19] .
的能力与其含量和活性有关,许多研究表明,当生物体受到轻度逆境胁迫时,SOD活性往往升高;而当受到重度逆境胁迫时,SOD活性通常降低,使生物体内积累过量的活性氧,从而导致生物体受到伤害。本实验结果同样发现,低浓度铜胁迫下,斑马鱼体内的SOD活性升高 [19] .
毒物在低浓度下出现的这种现象,是其在无毒情况下的应激反应,这一现象称为“毒物兴奋效应”。到目前为止,许多研究证明,“毒物兴奋效应”具有普遍性;高浓度Cu2+胁迫下,斑马鱼体内SOD性极显著性下降,因此,Cu2+胁迫下SOD活性的降低,造成斑马鱼的活性氧伤害很可能是Cu2+对斑马鱼形成毒害的重要原因之一 [20] 。
4.2. Cu2+对斑马鱼POD活力的影响
POD存在于真核生物细胞的过氧化物酶体中,以铁卟啉为辅基,能催化过氧化氢、氧化酚类等有毒物质和调节氧含量使细胞免受高浓度氧毒害。它利用H2O2氧化供氢体,它对H2O2要求专一而对供氢体要求广泛,能够反映生物体产生和消除自由基的能力以及细胞代谢的强度。SOD是生物体防御氧化损伤的重要酶类,它能催化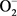 发生歧化反应,生成H2O2和O2 [21] 。
发生歧化反应,生成H2O2和O2 [21] 。
有研究表明生物在轻度逆境胁迫时,POD会升高来抵御外界刺激,但在重度逆境胁迫下超过机体抵御能力,POD会降低,生物积累大量活性氧自由基导致机体受损。
Cu2+暴露对斑马鱼POD活性表现为低浓度为抑制-诱导-抑制效应,高浓度为抑制-诱导。暴露初期斑马鱼机体产生POD清除含氧自由基,抵抗外界刺激机体增强自身防御,但此时POD产生和清除含氧自由基平衡已打破,表现为POD活性降低。而Cu2+随暴露时间增加,POD活性降低。这是因为斑马鱼机体受到损伤,含氧自由基浓度增大,超出POD清除能力,机体清除含氧自由基机制严重失衡的表现,导致POD活性急剧下降 [22] 。
Cu2+各处理组中低浓度组Cu2+暴露时,对斑马鱼体长体重无显著影响,而短期内斑马鱼SOD活性变化不明显,但随着时间的延长,SOD活性提高,导致“毒物兴奋效应”。高浓度Cu2+曝露时,随着时间的延长和浓度的增加,SOD的活力抑制明显。而POD活性表现为低浓度为抑制-诱导-抑制效应,高浓度为抑制-诱导。
5. 结论
Cu2+对斑马鱼体长体重无显著影响,Cu2+各处理组SOD活性表现为低浓度诱导-抑制,高浓度抑制。而POD活性表现为低浓度为抑制-诱导-抑制效应,高浓度为抑制-诱导。
基金项目
青岛二中教师发展基金项目(EZ2016010)资助。
文章引用
郭京君. Cu2+对斑马鱼SOD及POD酶活的影响研究
Effects of Cu2+ on SOD and POD Enzymatic Activities in Danio rerio[J]. 农业科学, 2018, 08(04): 397-405. https://doi.org/10.12677/HJAS.2018.84062
参考文献
- 1. 柳敏海, 罗海忠, 陈波, 等. 铜、镉对鮸鱼幼鱼鳃丝Na+-K+-ATPase和肝脏SOD酶活性的影响[J]. 安全与环境学报, 2007, 7(4): 5-8.
- 2. 周新文, 朱国念, Mwalilino J., 等. Cu、Zn、Pb、Cd及其混合重金属离子对鲫鱼(Carassius auratus) DNA甲基化水平的影响[J]. 中国环境科学, 2001, 21(6): 549-552.
- 3. Flemming, C.A. and Trevors, J.T. (1989) Copper Toxicity and Chemistry in the Environment: A Review. Water, Air and Soil Pollution, 44, 143-158. https://doi.org/10.1007/BF00228784
- 4. 王振, 金小伟, 王子健. 铜对水生生物的毒性:类群特异性敏感度分析[J]. 生态毒理学报, 2014, 9(4): 640-646.
- 5. 鲁双庆, 刘少军, 刘红玉, 等. Cu2+对黄鳝肝脏保护酶SOD、CAT、GSH-PX活性的影响[J]. 中国水产科学, 2002, 9(2): 138-141.
- 6. 周剑, 杜军, 刘光迅, 等. 4种常用药物对长薄鳅幼鱼的急性毒性试验研究[J]. 西南农业学报, 2012, 25(5): 1920-1924.
- 7. Linder, M.C. and Hazeghazam, M. (1996) Copper Bio-chemistry and Molecular Biology. American Journal of Clinical Nutrition, 63, 797S.
- 8. 吴寅, 吴永贵, 马岚, 等. 水体酸化条件下Cu(II)对斑马鱼胚胎的毒性效应[J]. 生态毒理学报, 2013, 8(3): 389-394.
- 9. 聂志娟, 徐钢春, 张守领, 等. 铜对刀鲚幼鱼的急性毒性及对肝抗氧化酶活性与组织结构的影响[J]. 中国水产科学, 2014, 21(1): 161-168.
- 10. 韩建, 彭维兵, 韩利文, 等. 铜、汞和铅对斑马鱼仔鱼肝脏发育的影响[J]. 山东科学, 2016, 29(5): 54-59.
- 11. Mcgeer, J.C., Szebedinszky, C., McDonald, D.G. and Wood, C.M. (2000) Effects of Chronic Sublethal Exposure to Waterborne Cu, Cd or Zn in Rainbow Trout. 1: Iono-Regulatory Disturbance and Metabolic Costs. Aquatic Toxicology, 50, 231-243. https://doi.org/10.1016/S0166-445X(99)00105-8
- 12. Dai, Y.J., Jia, Y.F., Chen N., et al. (2014) Zebrafish as a Model System to Study Toxicology. Environmental Toxicology & Chemistry, 33, 11-17. https://doi.org/10.1002/etc.2406
- 13. 任文娟, 汪贞, 王蕾, 等. 双酚A及其类似物对斑马鱼胚胎及幼鱼的毒性效应[J]. 生态毒理学报, 2017, 12(1): 184-192.
- 14. OECD (1984) Test No. 204: Fish, Prolonged Toxicity Test: 14-Day Study. Organization for Economic Co-Operation and Development.
- 15. 张鼎元, 曹潇, 郭春阳, 等. 乙酸铜对银鲳幼鱼急性毒性及抗氧化酶活性的影响[J]. 生态毒理学报, 2016, 11(4): 280-286.
- 16. 袁勤生. 超氧化物歧化酶的分析测定[J]. 中国医药工业杂志, 1989, 20(10): 473-477.
- 17. 张薇, 徐长君, 吴杨, 等. 采油污水对斑马鱼POD酶的影响[J]. 浙江农业科学, 2015, 56(2): 285-287.
- 18. 吴红松. 长期铈喂养对鲤鱼肝胰脏、肾脏抗氧化酶活性的影响[J]. 核农学报, 2017, 31(1): 201-207.
- 19. 孔强, 赵岩, 付荣恕. 3种重金属联合对孔雀鱼肝脏抗氧化酶系统的影响[J]. 供水技术, 2010, 4(6): 10-13.
- 20. 姚志峰, 章龙珍, 庄平, 等. 铜对中华鲟幼鱼的急性毒性及对肝脏抗氧化酶活性的影响[J]. 中国水产科学, 2010, 17(4): 731-738.
- 21. 张贵生. 稀土元素对鲤鱼肝胰脏多种酶及MDA含量的影响[J]. 生物技术, 2008, 18(2): 36-38.
- 22. 张贵生. 镧对鲤鱼肾和鳃抗氧化性和酯酶同工酶的影响[J]. 生态学杂志, 2008, 27(8): 1337-1340.
