Advances in Clinical Medicine
Vol.
14
No.
03
(
2024
), Article ID:
83741
,
12
pages
10.12677/acm.2024.143930
外周血Th1型细胞因子与TIL对乳腺癌新辅助 化疗效果的预测价值
孙裕1,2,韩寅烁1,2,王海波1,2*
1青岛大学青岛医学院,山东 青岛
2青岛大学附属医院乳腺病诊疗中心,山东 青岛
收稿日期:2024年2月27日;录用日期:2024年3月22日;发布日期:2024年3月29日

摘要
背景:新辅助化疗(NAC)是乳腺癌的重要治疗手段,治疗后达到病理完全缓解(pCR)预示着长期生存的改善。然而,NAC效果因个体差异而异,预测NAC效果对制定治疗方案具有重要意义。患者的免疫系统状态是NAC成功的关键,Th1型细胞因子和TIL与抗肿瘤免疫反应密切相关,可能影响NAC的效果。目的:本研究旨在探讨新辅助化疗前外周血Th1型细胞因子与TIL对乳腺癌新辅助化疗效果的预测价值。方法:收集乳腺癌患者化疗前的血清样本,检测外周血Th1型细胞因子水平,并对肿瘤间质组织进行TIL水平评估。通过统计分析,评估Th1型细胞因子和TIL与NAC疗效的关系。结果:根据手术后的病理结果将患者分为pCR组和非pCR组。在治疗前,外周血高水平Th1型细胞因子的患者在接受NAC后表现出更高的病理缓解率。治疗后达到pCR的患者中,TIL的增加与外周血Th1型细胞因子的升高呈正相关。结论:在新辅助化疗开始前,外周血Th1型细胞因子可作为预测NAC效果的生物标志物,Th1型细胞因子水平还可以作为高TIL的代替标志物,与TIL一起更好地预测新辅助化疗的疗效。
关键词
Th1型细胞因子,TIL,新辅助化疗,乳腺癌,病理完全缓解

Predictive Value of TIL and Th1-Type Cytokines in Peripheral Blood on the Efficacy of Neoadjuvant Chemotherapy for Breast Cancer
Yu Sun1,2, Yinshuo Han1,2, Haibo Wang1,2*
1Qingdao Medical College of Qingdao University, Qingdao Shandong
2Breast Center, The Affiliated Hospital of Qingdao University, Qingdao Shandong
Received: Feb. 27th, 2024; accepted: Mar. 22nd, 2024; published: Mar. 29th, 2024

ABSTRACT
Background: Neoadjuvant chemotherapy (NAC) is an important treatment for breast cancer, and achieving pathologic complete response (pCR) after treatment indicates improved long-term survival. However, the effect of NAC varies from individual to individual, and predicting the effect of NAC is of great significance in formulating treatment plans. The immune system status of patients is the key to the result of NAC. Th1-type cytokines and TIL are closely related to anti-tumor immune response, which may affect the effect of NAC. Objective: The purpose of this study was to investigate the predictive value of TIL and Th1-type cytokines in peripheral blood before neoadjuvant chemotherapy on the effect of neoadjuvant chemotherapy in breast cancer. Method: Serum samples from breast cancer patients before chemotherapy were collected to detect the levels of Th1-type cytokines in peripheral blood, and TIL levels in tumor stromal tissue were evaluated. Through statistical analysis, the relationship between Th1-type cytokines, TIL, and the efficacy of NAC was assessed. Result: Based on the pathological results after surgery, patients were divided into pCR group and non-pCR group. Before treatment, patients with high levels of Th1-type cytokines in peripheral blood showed a higher pCR rate after receiving NAC. Among patients who achieved pCR after treatment, the increase in TIL was positively correlated with the elevation of Th1-type cytokines in peripheral blood. Conclusion: Before the neoadjuvant chemotherapy, Th1-type cytokines in peripheral blood can serve as biomarkers for predicting the efficacy of NAC. The level of Th1-type cytokines can also be used as surrogate biomarkers for high TIL, together with TIL to better predict the efficacy of neoadjuvant chemotherapy.
Keywords:Th1-Type Cytokines, TIL, Neoadjuvant Chemotherapy, Breast Cancer, pCR

Copyright © 2024 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
乳腺癌是全球女性最常见的恶性肿瘤之一 [1] 。新辅助化疗(NAC)是治疗乳腺癌的重要手段之一,在局部晚期乳腺癌患者的治疗中,新辅助化疗可以缩小肿瘤体积,减少淋巴结阳性率,从而提高手术切除成功率 [2] 。然而,由于个体差异的存在,NAC的效果难以预测,从而影响了治疗效果和患者的生存率。新辅助化疗获得pCR的患者复发风险低,总生存期(OS)更长 [3] 。更好地预测哪些患者对治疗有反应的能力将极大地帮助临床医生判断预后并指导治疗决策。特别是,基于血液的全身预测生物标志物在临床环境中最常用,因为它们侵入性较小,易于收集并快速返回结果。
最近的研究表明,肿瘤浸润淋巴细胞(TIL)增加与乳腺癌患者更好的预后和新辅助治疗反应相关,TILs增加10%即可延长TNBC和HER2阳性乳腺癌患者的无进展存活期(TNBC:危险比[HR] 0.93 [95% CI 0.87~0.98],p = 0.011;HER2阳性:0.94 [0.89~0.99],p = 0.017) [4] 。细胞毒性CD8+ T细胞和Th1型CD4+ T细胞的肿瘤浸润与良好预后相关,而CD4+ Treg和CD4+ Th2与不良临床结果相关 [5] 。CD4+ T细胞可以通过向CD8+ T细胞提供帮助来发挥抗癌作用,直接识别癌症表面呈现的内源性加工抗原,分泌1型细胞因子或直接杀死肿瘤 [6] 。
Th1型细胞因子是一类在免疫反应中起重要作用的细胞因子,它们能够激活机体免疫系统,增强对乳腺癌细胞的免疫应答 [7] 。这些细胞因子包括干扰素-γ (IFN-γ)、白细胞介素-2 (IL-2)和白细胞介素-12 (IL-12)等,通过以内分泌、旁分泌或自分泌的方式与微环境交流,激活和调节免疫系统的细胞,促进细胞免疫应答和抗肿瘤免疫 [8] 。外周血免疫标志物可以反映局部TME成分,还可以根据循环可溶性因子提供临床相关信息。因此,患者开始治疗前血浆中存在的细胞因子可能反映当前的免疫系统状态,并提供潜在的生物标志物来预测治疗反应和临床结果。
本研究探讨了Th1型细胞因子与肿瘤浸润淋巴细胞(TIL)对新辅助化疗(NAC)效果的预测价值。通过检测乳腺癌患者化疗前的Th1型细胞因子水平及穿刺病理标本的TIL水平,评估其与NAC疗效的关系。结果显示,高水平Th1型细胞因子的患者在接受NAC后表现出更高的病理缓解率,且TIL的增加与Th1型细胞因子的升高呈正相关。因此,Th1型细胞因子与TIL可作为预测NAC效果的指标,筛选从新辅助化疗中获得最大益处的患者,有助于制定更个性化的治疗方案。
2. 材料和方法
2.1. 患者和分类
我们纳入了42名被首次诊断为乳腺癌的女性患者,她们的免疫功能良好且均接受了术前新辅助化疗(HER-2阳性病人同时联合靶向治疗)。所有患者均于2023年3月1日至2023年8月31日期间在青岛大学附属医院乳腺病诊疗中心招募。将空心针穿刺活检的乳腺肿瘤组织福尔马林固定和石蜡包埋,对其切片进行苏木精–伊红(H & E)染色,保存在青岛大学附属医院病理科。肿瘤分期(TNM分期系统)从病历中获取。患者的临床、病理、辅助检查和检验数据从患者的电子临床档案中获取。在患者开始任何治疗前采集空腹血液样本,送检青岛大学附属医院检验科,评估患者外周血IL-2、IL-12及IFN-γ水平。
采用Miller-Payne 标准对入组病人进行病理学疗效评价(pCR定义为乳腺和腋窝淋巴结均没有浸润性癌组织)。新辅助化疗后获得pCR的患者在本研究中被定义为“应答者”,未达到pCR的患者定义为“无应答者”。
2.2. 肿瘤浸润淋巴细胞的评估
对42个样品的TILs水平进行了评估。根据国际TILs工作组标准 [9] ,在H & E染色的载玻片上对每位入组患者进行TIL的组织病理学测定。由不了解循环免疫介质水平和治疗结果的乳腺病理学家评估肿瘤间质TIL的水平,定义为单核炎症细胞(淋巴细胞和浆细胞)占据的肿瘤间质区域的百分比。
2.3. 统计分析
基线患者特征表示为定量变量的均值、最小值和最大值。为了比较有反应者和无反应者之间的免疫介质和TIL,我们使用了Student t检验,具体取决于正态性检验后的数据分布。使用Spearman相关性计算免疫介质水平与TIL之间的相关性,用Person相关性计算各免疫介质水平之间的相关性。此外,我们还通过绘制受试者工作曲线(ROC)曲线和计算ROC曲线下面积(AUC)评估其区分事件和非事件的能力。检验的显著性水平固定为0.05。采用SPSS 26软件进行数据分析。
3. 结果
3.1. 患者特征
我们的队列由42名首次诊断为乳腺癌的患者组成,她们均接受了新辅助化疗。其中19名化疗后达到病理完全缓解者(有反应组),23名化疗后未达到病理完全缓解(无反应组)。诊断时平均年龄为53.1岁,体表面积为1.54 m2,反应者与无反应者无明显差异,患者的一般特征列于表1。
Table 1. General characteristics of the patients
表1. 患者的一般特征
3.2. 与未达到pCR的患者相比,达到pCR的患者Th1型炎症因子水平更高
为了研究外周血中Th1型细胞因子与治疗反应之间可能存在的联系,我们对患者开始治疗前收集的血浆中IL-2、IL-12p70、IFN-γ进行了检测。我们观察到,在pCR组中IL-2和IL-12p70较非pCR组的患者更高,p值均小于0.05 (图1)。这些结果表明,新辅助化疗后达到pCR的患者具有更强烈的抗肿瘤免疫反应。
3.3. 外周血Th1型细胞因子与达到pCR患者的TIL水平呈正相关关系
人们普遍认为,高TIL水平可以预测乳腺癌新辅助化疗的反应,并与患者的有利结局有关。 [10] 鉴于达到pCR的患者外周血Th1型细胞因子水平更高,因此,我们进行了分析,以确定外周血Th1型细胞因子水平是否与肿瘤基质TIL水平有关。
首先我们评估了患者肿瘤基质TIL水平,以评估其与新辅助疗效的关系。我们发现,与未达到pCR的患者相比,达到pCR的患者具有更高的肿瘤间质TIL水平(p = 0.037,图2)。结果表明,在免疫学上更活跃的肿瘤微环境与更好的新辅助化疗疗效有关。
为了全面了解应答者和非应答者之间的免疫调节网络,我们分别绘制了应答者组与非应答者组中Th1型炎症因子与基质TIL的相关矩阵。我们观察到,与无反应者相比,反应者组中各Th1型细胞因子之间、细胞因子与TIL之间有更强的正相关关系,表现为一个相互作用的网络。相比之下,无反应组中各细胞因子与TIL之间的关系表现为较弱的正相关关系,缺乏特定炎症因子对肿瘤免疫的调控(图3)。
接下来,在免疫调节网络的基础上,我们对反应者组和无反应者组中个别细胞因子与肿瘤间质TIL
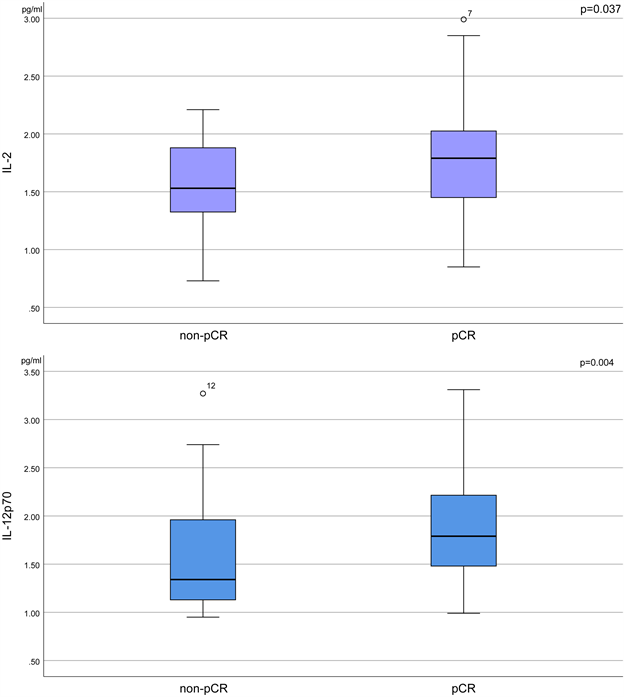
Figure 1. Patients who achieved pCR after neoadjuvant chemotherapy had higher levels of Th1 cytokines in their peripheral blood.
图1. 新辅助化疗后达到pCR的患者外周血Th1型细胞因子水平更高
进行了分析。我们观察到,在有反应者组中,IL-2、IL-12p70均与IFN-γ呈显著的正相关(图4),IL-12p70、IFN-γ与肿瘤间质TIL水平呈显著的正相关(图5),p值均小于0.05。而在无反应组中未观察到细胞因子与TIL之间显著的相关性。
总之,这些数据表明,在行新辅助化疗的乳腺癌患者中,对化疗有反应的患者表现为更协调的Th1型细胞因子谱,并与TIL的百分比呈正相关。与此相反,无反应组则缺乏与TIL有关的循环Th1型细胞因子。
3.4. 外周血Th1型细胞因子预测乳腺癌新辅助化疗的pCR
基于化疗疗效与外周血Th1型细胞因子和TIL水平具有一定的相关性,我们进行了进一步的探索,分析这些因素如何预测新辅助化疗疗效。使用Logistic回归,我们观察到IL-12p70是pCR的独立预测因素(表2)。
为了研究外周血Th1型细胞因子水平对化疗后pCR检验效力的灵敏度和特异性,我们绘制了一系列接受者操作特性曲线(ROC)曲线,在单独使用Th1型细胞因子的ROC曲线下面积(AUC)为0.491~0.756,

Figure 2. Patients in the response group had higher levels of tumor stromal TIL
图2. 反应组患者有更高的肿瘤间质TIL水平
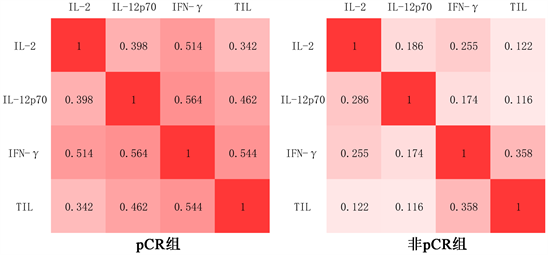
Figure 3. Immunomodulatory networks in the pCR group (left) versus the non-pCR group (right).
图3. pCR组(左)与非pCR组(右)的免疫调节网络

Figure 4. In the responder group, peripheral blood IL-2 and IL-12p70 were positively correlated with IFN-γ levels.
图4. 反应者组中外周血IL-2、IL-12p70均与IFN-γ水平呈正相关
其中IL-12p70的AUC值为0.756 (图6)。当我们将IL-12p70与TIL水平结合起来分析,在TIL ≥ 20%时,IL-12p70的AUC值提升到0.817 (图7)。
这些结果表明,治疗前外周血IL-12p70及肿瘤间质TIL水平较高的患者更有机会获得化疗后pCR。
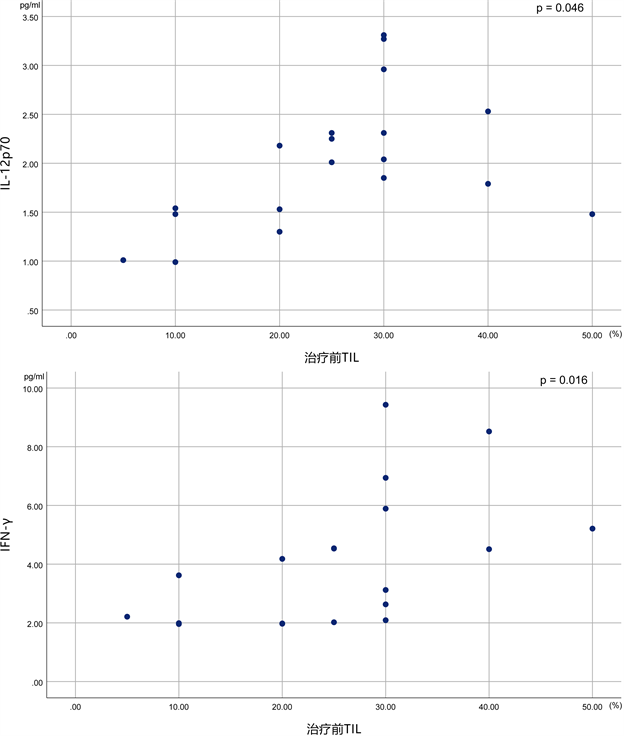
Figure 5. In the responder group, peripheral blood IL-12p70 and IFN-γ were positively correlated with the level of tumor interstitial TIL
图5. 反应者组中外周血IL-12p70、IFN-γ与肿瘤间质TIL水平呈正相关
4. 讨论
炎症在肿瘤发展的各个阶段都发挥着重要作用,并且炎症性TME的存在已被认为是癌症的重要标志。免疫细胞在癌症发生和进展过程中发挥双重作用,因为它们可以通过杀死免疫原性肿瘤细胞来防止
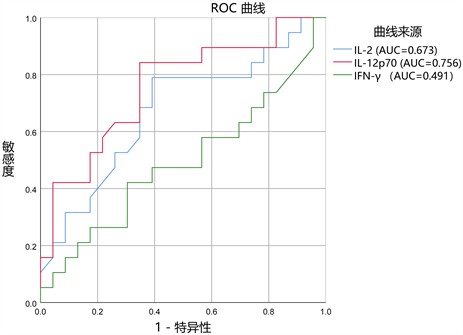
Figure 6. The predictive power of Th1 inflammatory actors on the efficacy of chemotherapy
图6. Th1型炎症因子对化疗疗效的预测能力
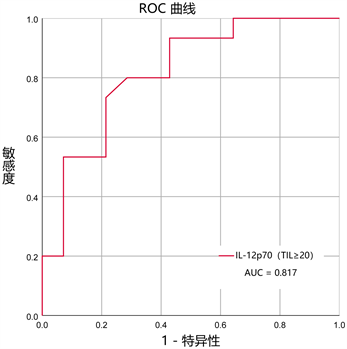
Figure 7. IL-12p70 has an increased predictive power for pCR at TIL ≥ 20
图7. TIL ≥ 20时,IL-12p70对pCR的预测能力增加
Table 2. Logistic regression analysis of the efficacy of Th1 cytokines versus neoadjuvant chemotherapy
表2. Th1型细胞因子与新辅助化疗疗效的Logistic回归分析
肿瘤进展,但同时也可以塑造肿瘤免疫原性,有助于肿瘤逃逸 [11] 。免疫细胞通过可溶性因子(如细胞因子或趋化因子)与邻近细胞进行通讯,以产生促肿瘤或抗肿瘤免疫反应 [12] 。这些可溶性因子也会释放到血液中,从而引发癌症诱导的全身炎症反应,并与远处的器官发生相互作用 [13] 。
近年来,肿瘤免疫治疗已成为我们治疗乳腺癌的重要策略之一。其中,肿瘤浸润淋巴细胞(TIL)在抗肿瘤免疫中发挥着至关重要的作用 [14] 。在乳腺癌中,TIL可以直接杀伤肿瘤细胞,也可以通过分泌细胞因子等物质激活其他免疫细胞,共同发挥抗肿瘤作用 [15] 。一方面,TIL可以通过直接杀伤肿瘤细胞、分泌细胞因子等方式抑制肿瘤的生长;另一方面,TIL还可以激活其他免疫细胞,如DC、巨噬细胞等,共同构成抗肿瘤免疫应答。在乳腺癌中,TIL的数量和活性与患者的预后密切相关。高数量的TIL预示着较好的生存率和较低的复发风险,而低数量的TIL则与患者的不良预后相关 [16] 。
外周血Th1型细胞因子水平的动态变化能够灵敏地反映患者全身抗肿瘤免疫反应的状态。研究表明,高水平的Th1型细胞因子能够促进乳腺癌细胞的凋亡和抑制肿瘤细胞的增殖。TH1细胞通过IFN-γ依赖性机制诱导树突状细胞发挥肿瘤杀伤活性 [17] 。多项研究还表明,Th1型细胞因子与乳腺癌患者的预后和生存率相关,乳腺癌组织中高水平的IL-2与患者的较好预后相关 [18] ,较高的IFN-γ/IL-4比率预示着乳腺癌患者的良好预后 [19] 。此外,抗肿瘤免疫反应还改变肿瘤细胞对激素和化疗药物的敏感性 [20] 。在化学疗法或放射疗法期间,树突状细胞通过Toll样受体4 (TLR4)及其衔接子MyD88进行信号传导,以有效处理和交叉呈递来自垂死肿瘤细胞的抗原。携带TLR4功能丧失等位基因的乳腺癌患者在放疗和化疗后比携带正常TLR4等位基因的患者复发更快 [21] 。因此,代表抗肿瘤免疫反应的Th1型细胞因子水平可能成为预测NAC效果的生物标志物。
在这里,我们研究了乳腺癌患者在新辅助治疗前的循环Th1型细胞因子水平,并通过对TIL的评估,我们证明了全身因素如何反映乳腺癌患者的TIL强度和新辅助化疗反应。在治疗开始前评估这些分子可以为了解与临床相关的免疫调节网络提供一个窗口,并深入了解与TME和治疗反应相关的免疫调节机制。
我们的结果显示,在化疗后达到pCR的患者中,我们观察到IL-2和IL-12p70较非pCR组的患者更高(图1)。其中,IL-2是一种典型的Th1型细胞因子,负责淋巴细胞的增殖、成熟和激活,增强机体的抗肿瘤免疫反应 [8] 。IL-12能够增强CD8+T细胞的细胞毒性能力,诱导向促炎Th1表型的极化 [22] 。此外,与未达到pCR的患者相比,达到pCR的患者具有更高的肿瘤间质TIL水平(图2),这与既往的研究结果相一致,更高水平的肿瘤间质TIL水平是乳腺癌新辅助化疗疗效强有力的预测因素。
相关矩阵显示,反应者组中各Th1型细胞因子之间、细胞因子与TIL之间有更强的正相关关系,而无反应组中各细胞因子与TIL之间的联系则并不紧密(图3)。先前的研究表明,较高的TIL与IL-2和IL-1β水平升高以及嗜酸细胞趋化因子水平降低相关 [23] 。相比研究单个细胞因子,研究细胞因子总体特征可能是更有益的,因为细胞因子之间的协调作用可能会提供更多的信息。因此,监测外周血Th1型细胞因子水平有助于明确肿瘤微环境的免疫浸润特征。
此外我们发现,治疗前外周血IL-12p70及肿瘤间质TIL水平较高的患者更有机会获得化疗后pCR。化疗不仅可以直接杀灭肿瘤细胞,还可以诱导的细胞凋亡可以有效引发抗肿瘤免疫反应 [24] 。凋亡的肿瘤细胞会释放特异的抗原和危险信号,激活树突状细胞(DC)等抗原提呈细胞,进而促进TIL的激活和扩增 [25] 。此外,凋亡的肿瘤细胞还可以促进T细胞的浸润和活化,增强TIL的抗肿瘤作用。新辅助化疗后残留病灶中高TIL与三阴性乳腺癌患者的预后更好相关,这一发现支持了化疗可以通过免疫系统部分发挥其抗肿瘤作用 [26] 。结合本文的结果提示我们,强有力的抗肿瘤免疫基础可以提升化疗药物与TIL之间的协同作用。
迄今为止,尚无研究表明全身免疫介质可作为乳腺癌患者新辅助治疗反应的生物标志物。如前所述,TIL可作为乳腺癌的预后因素,肿瘤中含有较高水平的Th1细胞的患者具有更长的无病生存期(DFS) [27] 。在这里,我们表明乳腺癌患者新辅助化疗前测量的外周血Th1型细胞因子可能作为预测pCR的独立生物标志物。并且,当外周血Th1型细胞因子联合肿瘤间质TIL水平进行评估时,对新辅助化疗疗效的预测能力会增加。同时,然而,本研究仍存在一定的局限性,如样本量较小、随访时间较短等,未来需要进一步扩大样本量、延长随访时间以验证本研究的结论。未来,我们可以更深入研究肿瘤微环境中的细胞因子对TIL功能的影响,探索化疗与免疫治疗的联合应用策略,以及发掘新的分子靶点用于增强TIL的抗肿瘤作用等,这也为深入探讨乳腺癌的新辅助治疗定制个体化方案提供了新的思路和方向。
5. 结论
本文揭示了外周血Th1型细胞因子与病理完全缓解(pCR)、肿瘤浸润淋巴细胞(TIL)强度之间存在紧密的相互关系,凸显了它们作为生物标志物在预测乳腺癌新辅助化疗效果中的潜在应用价值,为我们提供了深入理解乳腺癌发病机制和化疗响应机制的窗口,同时也揭示了全身免疫系统和局部肿瘤微环境之间复杂而微妙的交互作用。
文章引用
孙 裕,韩寅烁,王海波. 外周血Th1型细胞因子与TIL对乳腺癌新辅助化疗效果的预测价值
Predictive Value of TIL and Th1-Type Cytokines in Peripheral Blood on the Efficacy of Neoadjuvant Chemotherapy for Breast Cancer[J]. 临床医学进展, 2024, 14(03): 1961-1972. https://doi.org/10.12677/acm.2024.143930
参考文献
- 1. Siegel, R.L., Miller, K.D., Wagle, N.S. and Jemal, A. (2023) Cancer Statistics, 2023. Ca: A Cancer Journal for Clinicians, 73, 17-48. https://doi.org/10.3322/caac.21763
- 2. Wang, H. and Mao, X.Y. (2020) Evaluation of the Efficacy of Neoadjuvant Chemotherapy for Breast Cancer. Drug Design Development and Therapy, 14, 2423-2433. https://doi.org/10.2147/DDDT.S253961
- 3. Kong, X.N., Moran, M.S., Zhang, N., Haffty, B. and Yang, Q.F. (2011) Meta-Analysis Confirms Achieving Pathological Complete Response after Neoadjuvant Chemotherapy Predicts Favourable Prognosis for Breast Cancer Patients. European Journal of Cancer, 47, 2084-2090. https://doi.org/10.1016/j.ejca.2011.06.014
- 4. Denkert, C., Von Minckwitz, G., Darb-Esfahani, S., Lederer, B., Heppner, B.I., Weber, K.E., et al. (2018) Tumour-Infiltrating Lymphocytes and Prognosis in Different Subtypes of Breast Cancer: A Pooled Analysis of 3771 Patients Treated with Neoadjuvant Therapy. The Lancet Oncology, 19, 40-50. https://doi.org/10.1016/S1470-2045(17)30904-X
- 5. Savas, P., Virassamy, B., Ye, C.Z., Salim, A., Mintoff, C.P., Caramia, F., et al. (2018) Single-Cell Profiling of Breast Cancer T Cells Reveals a Tissue-Resident Memory Subset Associated with Improved Prognosis. Nature Medicine, 24, 986-993. https://doi.org/10.1038/s41591-018-0078-7
- 6. Hadrup, S., Donia, M. and Thor Straten, P. (2013) Effector CD4 and CD8 T Cells and Their Role in the Tumor Microenvironment. Cancer Microenvironment: Official Journal of the International Cancer Microenvironment Society, 6, 123-133. https://doi.org/10.1007/s12307-012-0127-6
- 7. Nishimura, T., Nakui, M., Sato, M., Iwakabe, K., Kitamura, H., Sekimoto, M., Ohta, A., Koda, T. and Nishimura, S. (2000) The Critical Role of Th1-Dominant Immunity in Tumor Immunology. Cancer Chemotherapy and Pharmacology, 46, S52-S61. https://doi.org/10.1007/PL00014051
- 8. Habanjar, O., Bingula, R., Decombat, C., Diab-Assaf, M., Caldefie-Chezet, F. and Delort, L. (2023) Crosstalk of Inflammatory Cytokines within the Breast Tumor Microenvironment. International Journal of Molecular Sciences, 24, Article No. 4002. https://doi.org/10.3390/ijms24044002
- 9. Salgado, R., Denkert, C., Demaria, S., Sirtaine, N., Klauschen, F., Pruneri, G., et al. (2015) The Evaluation of Tumor-Infiltrating Lymphocytes (TILs) in Breast Cancer: Recommendations by an International TILs Working Group 2014. Annals of Oncology: Official Journal of the European Society for Medical Oncology, 26, 259-271. https://doi.org/10.1093/annonc/mdu450
- 10. Stanton, S.E. and Disis, M.L. (2016) Clinical Significance of Tumor-Infiltrating Lymphocytes in Breast Cancer. Journal for Immunotherapy of Cancer, 4, 59. https://doi.org/10.1186/s40425-016-0165-6
- 11. Salemme, V., Centonze, G., Cavallo, F., Defilippi, P. and Conti, L. (2021) The Crosstalk between Tumor Cells and the Immune Microenvironment in Breast Cancer: Implications for Immunotherapy. Frontiers in Oncology, 11, Article ID: 610303. https://doi.org/10.3389/fonc.2021.610303
- 12. Orcutt-Jahns, B., Junior, J.R.L., Rockne, R.C., Matache, A., Branciamore, S., Hung, E., et al. (2023) Systems Profiling Reveals Recurrently Dysregulated Cytokine Signaling Responses in ER Breast Cancer Patients’ Blood. https://doi.org/10.1101/2023.10.31.564987
- 13. Aguilar-Cazares, D., Chavez-Dominguez, R., Marroquin-Muciño, M., Perez-Medina, M., Benito-Lopez, J.J., et al. (2022) The Systemic-Level Repercussions of Cancer-Associated Inflammation Mediators Produced in the Tumor Microenvironment. Frontiers in Endocrinology, 13, Article ID: 929572. https://doi.org/10.3389/fendo.2022.929572
- 14. Savas, P., Salgado, R., Denkert, C., Sotiriou, C., Darcy, P.K., Smyth, M.J. and Loi, S. (2016) Clinical Relevance of Host Immunity in Breast Cancer: From TILs to the Clinic. Nature Reviews. Clinical Oncology, 13, 228-241. https://doi.org/10.1038/nrclinonc.2015.215
- 15. Cianci, R., Pagliari, D., Pietroni, V., Landolfi, R. and Pandolfi, F. (2010) Tissue Infiltrating Lymphocytes: The Role of Cytokines in Their Growth and Differentiation. Journal of Biological Regulators and Homeostatic Agents, 24, 239-249.
- 16. Radosevic-Robin, N., Béguinot, M. and Penault-Llorca, F. (2017) Evaluation of the Immune Infiltrate in Breast Cancer. Bulletin Du Cancer, 104, 52-68. https://doi.org/10.1016/j.bulcan.2016.11.010
- 17. La Casse, C.J., Janikashvili, N., Larmonier, C.B., Alizadeh, D., Hanke, N., Kartchner, J., et al. (2011) Th-1 Lymphocytes Induce Dendritic Cell Tumor Killing Activity by an IFN-γ-Dependent Mechanism. Journal of Immunology (Baltimore, Md.: 1950), 187, 6310-6317. https://doi.org/10.4049/jimmunol.1101812
- 18. Nicolini, A., Carpi, A. and Rossi, G. (2006) Cytokines in Breast Cancer. Cytokine & Growth Factor Reviews, 17, 325-337. https://doi.org/10.1016/j.cytogfr.2006.07.002
- 19. Zhu, X., Du, L.B., Feng, J.G., Ling, Y.T. and Xu, S.H. (2014) Clinicopathological and Prognostic Significance of Serum Cytokine Levels in Breast Cancer. Clinical Laboratory, 60, 1145-1151. https://doi.org/10.7754/Clin.Lab.2013.130738
- 20. Mantovani, A., Allavena, P., Sica, A. and Balkwill, F. (2008) Cancer-Related Inflammation. Nature, 454, 436-444. https://doi.org/10.1038/nature07205
- 21. Apetoh, L., Ghiringhelli, F., Tesniere, A., Obeid, M., Ortiz, C., Criollo, A., et al. (2007) Toll-Like Receptor 4-Dependent Contribution of the Immune System to Anticancer Chemotherapy and Radiotherapy. Nature Medicine, 13, 1050-1059. https://doi.org/10.1038/nm1622
- 22. Yang, S.X., Wei, W.S., Ouyan, Q.W., Jiang, Q.H., Zou, Y.F., Qu, W., et al. (2016) Interleukin-12 Activated CD8+ T Cells Induces Apoptosis in Breast Cancer Cells and Reduces Tumor Growth. Biomedicine & Pharmacotherapy, 84, 1466-1471. https://doi.org/10.1016/j.biopha.2016.10.046
- 23. Kawaguchi, K., Sakurai, M., Yamamoto, Y., Suzuki, E., Tsuda, M., Kataoka, T.R., et al. (2019) Alteration of Specific Cytokine Expression Patterns in Patients with Breast Cancer. Scientific Reports, 9, Article No. 2924. https://doi.org/10.1038/s41598-019-39476-9
- 24. Huang, X.J., Ren, Q.H., Yang, L.X., Cui, D., Ma, C.Y., Zheng, Y.L. and Wu, J.J. (2023) Immunogenic Chemotherapy: Great Potential for Improving Response Rates. Frontiers in Oncology, 13, Article ID: 1308681. https://doi.org/10.3389/fonc.2023.1308681
- 25. Marciscano, A.E. and Anandasabapathy, N. (2021) The Role of Dendritic Cells in Cancer and Anti-Tumor Immunity. Seminars in Immunology, 52, Article ID: 101481. https://doi.org/10.1016/j.smim.2021.101481
- 26. Ogiya, R., Niikura, N., Kumaki, N., Bianchini, G., Kitano, S., Iwamoto, T., Hayashi, N., et al. (2016) Comparison of Tumor-Infiltrating Lymphocytes between Primary and Metastatic Tumors in Breast Cancer Patients. Cancer Science, 107, 1730-1735. https://doi.org/10.1111/cas.13101
- 27. Ruffell, B., DeNardo, D.G., Affara, N.I. and Coussens, L.M. (2010) Lymphocytes in Cancer Development: Polarization towards Pro-Tumor Immunity. Cytokine & Growth Factor Reviews, 21, 3-10. https://doi.org/10.1016/j.cytogfr.2009.11.002
NOTES
*通讯作者。
