Advances in Clinical Medicine
Vol.
11
No.
10
(
2021
), Article ID:
45802
,
8
pages
10.12677/ACM.2021.1110665
玛咖醇提取物促进大鼠骨髓间充质干细胞成骨分化的作用
何琴1,钟燕1,范苏苏1,朱振东2*,张旋1*
1昆明医科大学药学院暨云南省天然药物药理重点实验室,云南 昆明
2云南省第三人民医院心血管内科/云南中医药大学综合实践教学基地,云南 昆明
收稿日期:2021年9月13日;录用日期:2021年10月6日;发布日期:2021年10月18日

摘要
目的:初步探讨玛咖醇提取物(MAE)对大鼠骨髓间充质干细胞(BMSCs)向成骨细胞分化的影响。方法:黑玛咖用乙醇浸泡后旋转蒸发制备玛咖醇提取物浸膏。分离SD大鼠的股骨和胫骨利用全骨髓贴壁方法在体外培养BMSCs,通过细胞表面标志鉴定细胞;细胞传代培养至第3代,将浸膏用成骨诱导培养基稀释为不同浓度(0、1.25、2.5、5、10 mg/ml)作用于BMSCs,以不含药物的培养基作为空白对照,采用CCK-8法检测MAE对BMSCs增殖与毒性,利用茜素红染色观察钙化结节形成的数量,评价MAE对BMSCs成骨分化的影响。结果:MAE浸膏1 g相当于原材料5 g;大鼠BMSCs流式鉴定结果为CD45:4.53%,CD44:71.4%,CD90+:85.6%,细胞纯度较好;MAE对BMSCs的IC50是8.445 mg/ml,且MAE呈剂量依赖性抑制细胞增殖,药物浓度为2.5 mg/ml时细胞增殖最为明显,此时茜素红染色强度最强。结论:MAE能够诱导大鼠BMSCs向成骨细胞分化,且最佳作用浓度为2.5 mg/ml。
关键词
玛咖,骨髓间充质干细胞,成骨分化,骨质疏松

Effect of Maca Alcohol Extract Promotes Osteogenic Differentiation of Rat Bone Marrow Mesenchymal Stem Cells
Qin He1, Yan Zhong1, Susu Fan1, Zhendong Zhu2*, Xuan Zhang1*
1School of Pharmaceutical Sciences & Yunnan Key Laboratory of Pharmacology for Natural Products, Kunming Medical University, Kunming Yunnan
2Department of Cardiovascular Diseases, The Third People’s Hospital of Yunnan Province/Comprehensive Practical Teaching Base of Yunnan University of Traditional Chinese Medicine, Kunming Yunnan
Received: Sep. 13th, 2021; accepted: Oct. 6th, 2021; published: Oct. 18th, 2021

ABSTRACT
Objective: To investigate the effect of maca alcohol extract on osteogenic differentiation of rat bone marrow mesenchymal stem cells. Methods: Black maca was soaked in ethanol and then rotary evaporation was used to prepare maca alcohol extract (MAE). The bone marrow mesenchymal stem cells (BMSCs) were isolated from femur and tibia of SD rats. BMSCs were cultured in vitro by whole bone marrow adherent method and identified by cell surface markers. The cells were subcultured to the third generation, and MAE was diluted into different concentrations (0, 1.25, 2.5, 5, 10 mg/mL) in osteogenic induction medium to treat BMSCs. The drug-free medium was used as blank control, and the proliferation and toxicity of MAE on BMSCs were detected by CCK-8 method. Alizarin red staining was used to observe the number of calcified nodules and evaluate the effect of MAE on osteogenic differentiation of BMSCs. Results: 1 g MAE was equivalent to 5 g raw material; flow cytometric identification results were CD45: 4.53%, CD44: 71.4%, CD90+: 85.6%, the cell purity was good; the IC50 of stem cells was 8.445 mg/ml, and the MAE inhibits cell proliferation in a dose-dependent manner. The cell proliferation was most obvious when the drug concentration was 2.5 mg/ml. At this time, the intensity of Alizarin Red staining was the strongest. Conclusion: MAE can promote BMSCs to differentiate into osteoblasts, and the optimal concentration is 2.5 mg/ml.
Keywords:Maca, BMSCs, Osteogenic Differentiation, Osteoporosis

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 前言
骨质疏松症(osteoporosis, OP)是一种进行性全身性骨骼疾病,其主要特征为骨量降低、骨组织微结构恶化和骨孔隙增加,导致骨脆性增加 [1]。前期无明显临床表现,随着骨量进一步的丢失,患病者会出现腰背酸软疼痛,脊柱变形,严重者可发生骨折而致残,易发群体主要包括绝经后妇女以及中老年人 [2]。根据流行病学调查显示:在我国,50岁以上人群患有骨质疏松的总发病率为19.2%,而其中65岁以上女性发病率高达51.6%,因此骨质疏松症成为急需解决的影响中老年人健康的问题。对于此病的治疗目前临床首先药物治疗,但是抗骨质疏松的药物有许多不良反应,例如降钙素导致的恶心呕吐,双磷酸盐长期使用易发生反流性食管炎,停药后还会导致骨质降解率升高和骨量减少 [3]。于此开发安全有效用于预防和治疗骨质疏松症的新型药物十分必要。
玛咖属于十字花科植物,原产南美洲安第斯山脉,是传统的保健食品,除含有多种营养成分外,还含有玛咖酰胺、玛咖烯、芥子油苷及其衍生物、固醇等多种活性物质。研究表明,玛咖具有改善性功能、提高生育能力、抗骨质疏松等多种功效,且毒性小、食用安全 [4] [5]。目前关于玛咖醇提取物对骨髓间充质干细胞的研究较少,现以大鼠骨髓间充质干细胞(Bone marrow derived mesenchymal stem cells, BMSCs)为研究对象,初步观察玛咖醇提取物(Maca alcohol extract, MAE)对体外培养的BMSCs向成骨分化的影响。
2. 材料和方法
2.1. MAE的制备
本研究采用丽江黑玛咖(标本编号20200623),由昆明医科大学药学院陆露研究员鉴定为黑玛咖,将其制备成玛咖粉,称取适量的玛咖粉,按物料比1:10 (玛咖:乙醇)加入95%乙醇搅拌浸泡48 h,随后经过滤后收集上清液,剩余残渣用同等体积的95%乙醇继续搅拌浸泡48 h,过滤后混合两次收集的上清液。使用旋转蒸发仪制备MAE浸膏,待液体变粘稠鼓泡,停止旋蒸,加入少量甲醇除去水分,甲醇旋蒸完后收集浸膏,室温放置一夜后4℃保存备用。
2.2. SD大鼠BMSCs的原代提取培养与细胞表面标志物鉴定
选取昆明医科大学实验动物部提供的SPF级健康雄性大鼠,体重为80~100 g。首先麻醉处死,于75%乙醇中浸泡10 min后转移至超净台工作,在无菌的条件下取出大鼠两只后腿的股骨与胫骨,剔除附着在表面的多余组织并用PBS冲洗干净。将骨干两端的骨骺剪断随后暴露脊髓腔,用5 ml注射器吸取DMEM培养基轻轻冲洗脊髓腔,直至骨组织变得透明且里面无骨髓组织。将含有骨髓的培养基收集后吹匀,1000 r/min离心5 min。倒弃上清,加入1 ml含有15%胎牛血清的DMEM培养基进行重悬,每只大鼠所提取的细胞接种在1个T75细胞培养瓶中并与环境控制在37℃、5% CO2、饱和湿度条件下培养。48 h进行换液,以后每次3天进行后换液,细胞长满后进行传代,或者按照9:1 (血清:DMSO)进行冻存,后续实验选择第3~4代细胞。以上动物实验操作符合动物实验伦理规范,并经昆明医科大学动物实验伦理审查委员会批准。
将培养至第3代细胞加入胰酶消化,离心后收集转移至流式管中加入标记抗体,孵箱孵育30 min,再次离心收集细胞用4℃预冷PBS充分吹打漂洗。按照流式说明书加入PE标记的CD45、FITC标记的CD44、Cy5.5标记的CD90抗体,同时设立3个空白对照(PBS代替),于37℃、5% CO2避光条件孵育30 min,充分清洗后上机进行流式检测鉴定。
2.3. 实验分组及给药
将第3代大鼠BMSCs接种至6孔板,待细胞生长至70%~80%时进行药物干预。实验分为①:完全培养基(10% FBS + DMEM培养基 + 双抗);②:成骨诱导培养基(① + (10−8 mol/L地塞米松、50 mg/L抗坏血酸以及10 mmol/L β-甘油磷酸钠);③:② + 1.25 mg/ml MAE;④:② + 2.5 mg/ml MAE;⑤:② + 5 mg/ml MAE;⑤:② + 10 mg/ml MAE。按照分组每3天更换培养基。
2.4. CCK-8法检测MAE对大鼠BMSCs增殖与毒性
取生长状态良好的第3代BMSCs每孔100 µl按照1 × 104个/孔接种至96孔板中,每组设6个副孔,并在加液四周空白孔中补充生理盐水避免边缘效应,每3天依据分组换液1次。按照培养时间1、3、5、7、9天共接种5块板,在每次培养时间点后每孔加入10 µl CCK-8溶液,37℃孵箱孵育2 h后使用酶标仪在波长450 nm检测吸光度观察药物对细胞的增殖影响。分析细胞毒性时以相同分组以及细胞浓度接种至96孔板中,培养24 h后更换不同培养基,继续培养72 h后加入10 µl CCK-8,孵箱孵育2 h后酶标仪450 nm波长下检测吸光度计算细胞毒性IC50。
2.5. 茜素红染色
在6孔板中加入适量0.1%明胶覆盖培养皿,超净台放置30 min后弃去明胶。将第3代细胞按照2 × 104个/ml接种至附有明胶的培养皿中,每孔共2 ml。当细胞融合度达到60%~70%时,根据不同分组更换不同培养基,以后每3天换液一次,诱导2周后吸走六孔板中的液体,用PBS清洗2次,每孔加入2 ml 4%中性甲醛溶液,固定30 min后PBS冲洗,每孔中加入1 ml茜素红染色5 min,弃去液体,将培养板用PBS冲洗干净置于显微镜下观察。
2.6. 统计学方法
本次实验数据均采用SPSS22.0统计分析软件进行统计学分析,计量资料均以均数 ± 标准差表示。
3. 结果
3.1. MEA浸膏
将制备的MAE浸膏称重,用玛咖粉原重量/浸膏重量计算出1 g醇提取物相当于5 g原药材,浸膏如图1所示。
 (a) 丽江黑玛咖 (b) 玛咖粉(c) 玛咖醇提取物
(a) 丽江黑玛咖 (b) 玛咖粉(c) 玛咖醇提取物
Figure 1. Black maca morphology and MAE
图1. 黑玛咖形态及其玛咖醇提取物
3.2. 大鼠BMSCs形态学观察以及表型鉴定
如图2所示,利用全骨髓贴壁法提取分离培养结果:大鼠BMSCs原代培养48 h换液前观察到悬浮细胞数量多,成团率高。除去非贴壁的细胞,可见零散的贴壁细胞,细胞形态多为小圆形、扁平以及梭形。培养2~3天后可观察到部分集落形成,梭状细胞变多,随后每天观察到梭状集落细胞比例增多,8~10天后集落增长快,细胞逐渐变大融合成片。传至第2代时,细胞主要以梭状细胞生长为主,但依然有少许不规则细胞存在。到第3代时细胞形态统一为梭状细胞,细胞核明显,大量细胞汇集时呈平行排列或旋涡样生长并紧密堆积在一起。
第3代大鼠BMSCs通过流式细胞仪检测CD45、CD44以及CD90的表达情况。结果如图3所示:CD45的阳性率仅为4.53%,而CD44和CD90阳性率分别为71.4%和85.6%,这些抗体阳性率表达均符合BMSCs特性,表明本实验所用大鼠BMSCs符合规定。
3.3. CCK-8法检测MAE对大鼠BMSCs增殖与毒性
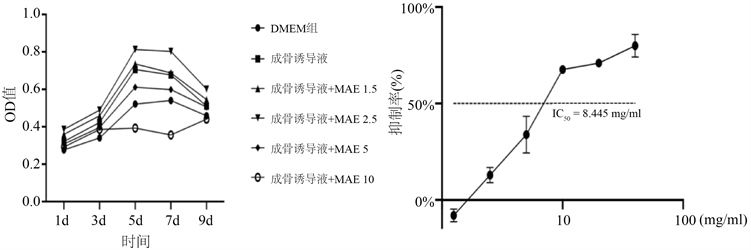
不同浓度MAE与对照组进行比较均可促进大鼠BMSCs增殖,其中在第5天为增殖高峰,如图4所示:随着时间的变化,各个组均使BMSCs不同程度地增殖其中在第5天为增殖高峰,当药物浓度 ≤ 2.5 mg/ml时,随着MAE浓度的增加,大鼠BMSCs增殖能力增强;当药物浓度 > 2.5 mg/ml时,随MAE浓度增加,细胞增殖作用降低。当MAE浓度为2.5 mg/ml时,细胞增殖作用最强,且根据吸光度计算出IC50 = 8.445 mg/ml。因此,当MAE浓度为2.5 mg/ml是该药物作用在大鼠BMSCs促进增殖的最佳浓度。
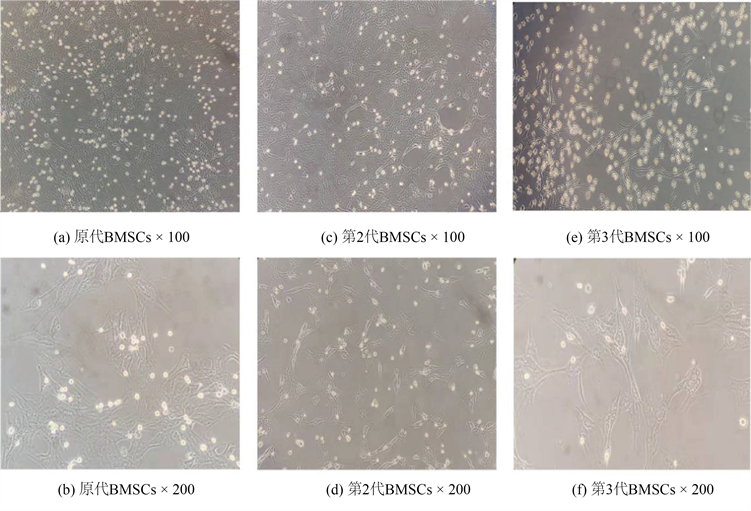
Figure 2. Morphological characteristics of BMSCs in SD rats
图2. SD大鼠BMSCs的形态特征
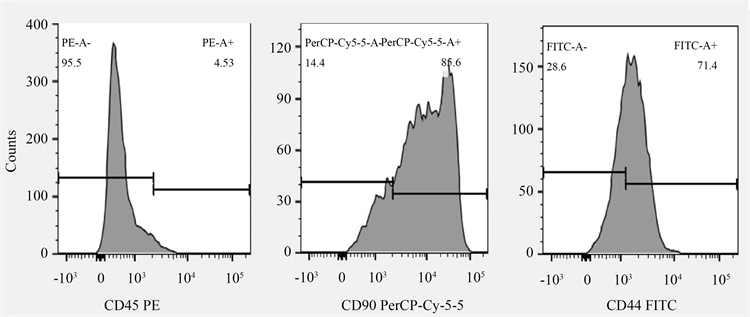
Figure 3. Flow cytometry identification
图3. 流式细胞鉴定BMSCs
 (a) (b)
(a) (b)
Figure 4. (a) Effects of MAE on BMSCs proliferation at different time points; (b) Effect of MAE on BMSCs proliferation in SD rats
图4. (a) 不同浓度MAE对BMSCs不同时间点增殖影响;(b) MAE对SD大鼠BMSCs增殖的影响
3.4. MEA对大鼠BMSCs成骨分化的影响
将不同浓度的MEA作用于第3代大鼠BMSCs培养至14天后进行茜素红染色,观察钙化结节形成情况评价BMSCs成骨分化情况。如图5所示经染色钙化结节主要呈橘红,在DMEM完培组中无茜素红染色结节;而随着成骨诱导液中MEA浓度增加,当浓度 ≤ 2.5 mg/ml,橘红色钙化结节颜色逐渐加深变多且体积增大,当浓度 > 2.5 mg/ml,橘红色钙化结节减少且颜色变浅。结果发现,当浓度为2.5 mg/ml时,钙化结节颜色最深,数量最多,与细胞增殖结果一致,表明2.5 mg/ml MEA能够明显促进BMSCs成骨分化。
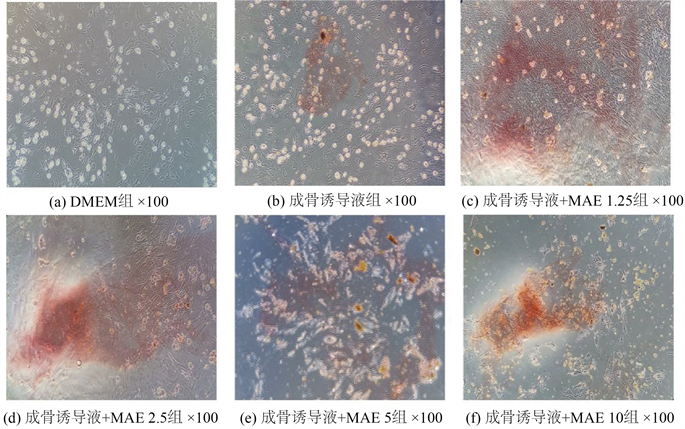
Figure 5. Effect of MAE on BMSCs osteogenic differentiation (alizarin red staining)
图5. 不同浓度MAE对BMSCs成骨分化的影响(茜素红染色)
4. 讨论
骨质疏松是以骨量减少以及损害性破坏骨组织微结构为特征的全身性系统性骨骼疾病,据2015年的统计该病居于我国常见疾病发病率中第五位,且骨质疏松的发病率具有逐年上升的趋势,与此同时在治疗骨质疏松时需要消耗巨大的公共保健资源 [6]。目前临床治疗所使用的西药副作用明显,给患者的身心带来伤病以外更大的伤害。BMSCs具有多向分化的特性,体外条件可经定向诱导分化为脂肪细胞、成骨细胞以及软骨细胞等多种组织细胞,因此BMSCs已经成为组织工程中治疗骨折和骨损伤的种子细胞 [7] [8]。利用BMSCs的贴壁性,通过定期更换培养基除去血细胞、白细胞等悬浮细胞,该方法操作简单,为BMSCs原代提取的经典方法。
玛咖含有玛咖酰胺、玛咖烯、芥子油等多种活性物质 [9]。经动物以及人体实验研究证实,玛咖具有改善性功能、抗疲劳、减少前列腺增生、抗骨质疏松等多种药理作用 [10]。有研究表明,水提取物中玛咖烯和玛咖酰胺类物质与玛咖粉基本相当,且有效物质有所上升,其中醇提取物中玛咖烯和玛咖酰胺类物质略多于水提取物 [11]。因此本实验将玛咖醇提取物作用于大鼠BMSCs,初步探明MAE是否能促进大鼠BMSCs向成骨细胞分化,考虑其抗骨质疏松活性以及是否可以作为抗骨质疏松药开发,同时为后续进一步实验提供MAE的最佳浓度。
在本次实验中,我们首先采用95%乙醇作为溶剂,将玛咖粉浸泡后滤液浓缩成MAE浸膏备用。随后采用全骨髓贴壁法提取分离大鼠BMSCs。通过定期换液以及传代不断纯化细胞,在第3代通过流式细胞表型鉴定发现本研究原代培养的大鼠骨髓间充质干细胞中CD45阳性率为4.53%,CD44阳性率为71.4%,CD90阳性率85.6%,符合BMSCs特征且纯度较高。同时通过显微镜观察到通过间断性换液到第3代时,细胞集落成片且基本呈单一梭形状,说明采用全骨髓贴壁法可分离出纯度好、细胞生物学稳定性以及活性好的BMSCs,证实本实验中所用大鼠骨髓间充质干细胞提取分离培养成功。
目前尚无文献报道MAE是否对大鼠骨髓间充质干细胞有增殖与毒性作用,故先进行MAE对细胞的增殖毒性试验,通过存活率计算出半数抑制浓度(IC50),IC50为细胞存活量为对照样本一半时的药物浓度,半数抑制浓度越高,说明药物的细胞毒性越低。CCK-8检测法是比MTT比色法检测线性范围更广,灵敏度更高,它的颜色深浅与细胞的增殖成正比,反之与毒性成反比。本实验通过设置不同浓度的MAE作用于大鼠BMSCs,根据实验结果可知MAE对大鼠BMSCs增殖抑制IC50为8.445 mg/ml,所以实验所选药物浓度应在8.445 mg/ml以下。同时在不同浓度组别MAE对BMSCs不同时间点增殖影响中发现,成骨诱导液中MAE的浓度为2.5 mg/ml对BMSCs增殖促进最为明显。
钙化结节的形成是由于成骨细胞在细胞外基质分泌胶原和钙盐结合,此指标是鉴定成骨细胞分化的重要指标,茜素红溶液与成骨细胞中的钙离子螯合形成橘色复合物,复合物的数量以及颜色的深浅可以鉴定大鼠BMSCs是否向成骨细胞分化 [12]。在本实验中,茜素红染色结果观察到与空白对照相比,当成骨诱导液中MAE浓度为2.5 mg/ml时,呈橘红色的钙化结节数量多且颜色深。基于以上结果,本研究初步发现体外细胞水平MAE能促进大鼠BMSCs向成骨细胞分化,有一定的抗骨质疏松的潜力,但MAE促进BMSCs成骨分化的具体作用机制如何,尚需进一步深入研究。
基金项目
云南省科学技术厅–云南中医学院应用基础研究联合专项基金资助项目(2017FF117-064)云南省中青年学术和技术带头人培养项目(2015HB042)。
文章引用
何 琴,钟 燕,范苏苏,朱振东,张 旋. 玛咖醇提取物促进大鼠骨髓间充质干细胞成骨分化的作用
Effect of Maca Alcohol Extract Promotes Osteogenic Differentiation of Rat Bone Marrow Mesenchymal Stem Cells[J]. 临床医学进展, 2021, 11(10): 4529-4536. https://doi.org/10.12677/ACM.2021.1110665
参考文献
- 1. Szekanecz, Z., Raterman, H.G., Petho, Z., et al. (2019) Common Mechanisms and Holistic Care in Atherosclerosis and Osteoporosis. Arthritis Research & Therapy, 21, 15. https://doi.org/10.1186/s13075-018-1805-7
- 2. 葛继荣, 王和鸣, 郑洪新, 等. 中医药防治原发性骨质疏松症专家共识(2020) [J]. 中国骨质疏松杂志, 2020, 26(12): 1717-1725.
- 3. 孟令仪, 周博宇, 张晶莹, 等. 骨质疏松发病机制及相关治疗药物研究进展[J]. 系统医学, 2019, 4(19): 193-195+198.
- 4. 周意, 栾洁, 储智勇. 玛咖化学成分及其药理作用的研究进展[J]. 海军医学杂志, 2015, 36(2): 188-190.
- 5. Gonzales, G.F. (2012) Ethnobiology and Ethnopharmacology of Lepidium meyenii (Maca), a Plant from the Peruvian Highlands. Evidence Based Complementary and Alternative Medicine, 193, 1-10. https://doi.org/10.1155/2012/193496
- 6. Si, L., Winzenberg, T.M., Jiang, Q., et al. (2015) Projection of Osteoporosis-Related Fractures and Costs in China: 2010-2050. Osteoporosis International, 26, 1929-1937. https://doi.org/10.1007/s00198-015-3093-2
- 7. Guo, L., Cai, T., Chen, K., et al. (2018) Kindlin-2 Regulates Mesenchymal Stem Cell Differentiation through Control of YAP1/TAZ. Journal of Cell Biology, 217, 1431-1451. https://doi.org/10.1083/jcb.201612177
- 8. Munsell, E.V., Kurpad, D.S., Freeman, T.A., et al. (2018) Histone-Targeted Gene Transfer of Bone Morphogenetic Protein-2 Enhances Mesenchymal Stem Cell Chondrogenic Differentiation. Acta Biomaterialia, 71, 156-167. https://doi.org/10.1016/j.actbio.2018.02.021
- 9. 王文琦. 玛咖的食品营养性与开发前景[J]. 食品安全导刊, 2017(Z2): 74.
- 10. Gonzales, C., Leiva Revilla, J., Rubio, J., et al. (2012) Effect of Red Maca on Prostate Zinc Levels in Rats with Testosterone-Induced Prostatic Hyperplasia. Andrologia, 44, 362-369. https://doi.org/10.1111/j.1439-0272.2011.01190.x
- 11. Wang, T., Teng, S., Zhang, Y., et al. (2017) Role of Mesenchymal Stem Cells on Differentiation in Steroid-Induced Avascular Necrosis of the Femoral Head. Experimental and Therapeutic Medicine, 13, 669-675. https://doi.org/10.3892/etm.2016.3991
- 12. 李丹青, 肖强兵. 巴戟天多糖通过p38 MAPK信号通路促间充质干细胞成骨分化的体外研究[J]. 中国中医骨伤科杂志, 2015, 23(5): 1-4+8.
NOTES
*通讯作者。