Advances in Clinical Medicine
Vol.
11
No.
12
(
2021
), Article ID:
47326
,
6
pages
10.12677/ACM.2021.1112858
原发CD5阳性弥漫大B细胞淋巴瘤一例 并文献复习
刘鹏1,许玥1,王彦丽2,李丽2,接贵涛2*
1潍坊医学院,山东 潍坊
2临沂市中心医院,山东 临沂
收稿日期:2021年11月21日;录用日期:2021年12月11日;发布日期:2021年12月21日

摘要
目的:探讨CD5阳性弥漫大B细胞淋巴瘤(DLBCL)的临床特点及治疗方案,提高对该病的认识。方法:回顾性分析临沂市中心医院2020年5月收治的1例CD5 (+) DLBCL患者资料,并结合相关文献进行讨论。结果:该患者相较于CD5 (−) DLBCL恶性程度更高,在接受R-CHOP方案、R-GDP方案以及泽布替尼 + BR方案治疗后,仍预后不良。结论:CD5 (+) DLBCL较少见,具有独特的临床特点,治疗反应差,在临床中我们应重视CD5在DLBCL中的表达。
关键词
弥漫大B细胞淋巴瘤,CD5,临床特点,治疗,预后

The Primary CD5 Positive Diffuse Large B-Cell Lymphoma: A Case Report and Literature Review
Peng Liu1, Yue Xu1, Yanli Wang2, Li Li2, Guitao Jie2*
1Weifang Medical University, Weifang Shandong
2Linyi Central Hospital, Linyi Shandong
Received: Nov. 21st, 2021; accepted: Dec. 11th, 2021; published: Dec. 21st, 2021

ABSTRACT
Objective: To explore the clinical characteristics and treatment options of CD5-positive diffuse large B-cell lymphoma (DLBCL) and to raise awareness of the disease. Methods: Retrospective analysis of the data of 1 CD5 (+) DLBCL patient admitted to Linyi Center Hospital in May 2020, and discussion in conjunction with relevant literature. Results: The patient had a higher malignancy degree than CD5 (−) DLBCL and still had poor prognosis after receiving treatment from R-CHOP, R-GDP, and Zanubrutinib + BR. Conclusion: CD5 (+) DLBCL is rare and has unique clinical characteristics, poor treatment response, in clinic, we should pay attention to CD5 expression in DLBCL.
Keywords:Diffuse Large B-Cell Lymphoma, CD5, Clinical Features, Therapy, Prognosis

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
弥漫大B细胞淋巴瘤(diffuse large B-cell lymphoma, DLBCL)是表达B细胞抗原的一类血液系统恶性肿瘤,在临床表现及预后方面异质性很大,R-CHOP方案的出现进一步提高了患者长期生存率,目前为DLBCL患者的一线治疗方案 [1]。WHO根据基因表达谱发现,不同细胞起源、MYC/BCL2/BCL6的表达及CD5的呈现情况均可影响患者预后。本文报道1例老年女性原发CD5阳性(CD5+)弥漫大B细胞淋巴瘤,结外病变,R-CHOP方案疗效不佳,后行R-GDP方案以及泽布替尼 + BR方案挽救化疗,仍未取得完全缓解。现报道如下。
2. 病例介绍
患者,女,71岁,主因“咽痛、吞咽困难3月,咳嗽1月余”于2020年5月14日就诊于我院呼吸科。查体:轻度贫血貌,浅表淋巴结未触及肿大,心肺听诊无明显异常,腹部查体无异常。ECOG评分0分。入院后行相关辅助检查,血常规:白细胞2.38 × 109/L,中性粒细胞计数1.61 × 109/L,血红蛋白111 g/L,血小板105 × 109/L;血生化:直接胆红素3.48 μmol/L,谷丙转氨酶58 IU/L,谷草转氨酶71 IU/L,钾2.99 mmol/L,钙1.92 mmol/L,乳酸脱氢酶612 U/L,羟丁酸脱氢377 U/L,余项大致正常;肿瘤指标:神经元特异性烯醇化酶测定17.75 ng/mL,糖类抗原CA15-334.20 U/ml,糖类抗原CA19-9 161.8 U/mL,甲状腺球蛋白 > 500.0 μg/l;病毒学检查:乙肝五项、HCV、MCV、HIV、EBV均阴性;免疫功能:体液免疫功能、自身抗体、风湿检验、血清蛋白电泳均阴性;心电图:窦性心律T波改变肢导低电压;心脏彩超:主动脉瓣退行性变并轻度主动脉瓣返流,左室充盈异常;颈部血管彩超:双侧颈动脉粥样硬化并斑块形成;咽喉部CT强化:1) 右侧下咽部占位可能性大;2) 双侧颈部多发小淋巴结;3) 双肺多发结节灶;4) 甲状腺占位;行喉镜检查取病理(右侧杓会厌皱襞、右侧咽侧壁):CD5阳性的弥漫大B细胞淋巴瘤,ABC亚型(见图1);免疫组化:肿瘤细胞CD20+++ (见图2)、CD79a+++、pax-5+++、CD19+、bcl-2+++、CD5+++ (见图3)、CD10−、mum-1−、bcl-6−、c-myc约10%+、CD3−、CD45ro−、CD56−、粒酶B−、tia−、CD30−、ck−、cyclinD1−、p53约50%、ki-67约70%;分子原位杂交:EBER−;骨髓染色体:46,XX [2];骨髓穿刺未见明显骨髓累及。于2020-05-25行PET-CT:1) 全身多发代谢增高淋巴结(较大者2.0 × 1.6 cm,SUVmax14.6);鼻咽、口咽周围软组织增厚,代谢增高(SUVmax14.3);甲状腺两叶混杂密度占位,代谢增高(SUVmax9.5);双肺多发代谢增高结节(SUVmax8.6);双侧乳腺多发代谢增高结节(SUVmax8.6);胃底部代谢增高结节(SUVmax10.8);肝、脾内多发代谢增高灶(SUVmax9.9);多发骨代谢增高灶(SUVmax8.9);结合病史,以上均考虑恶性淋巴瘤浸润灶,建议治疗后复查。2) 双侧上、下牙槽多发代谢增高(SUVmax10.6),炎性病变可能,建议专科检查除外淋巴瘤浸润。3) 支气管炎;左肺局限性肺气肿;右肺中下叶少许慢性炎症。4) 右肾错构瘤可能;左肾多发囊肿可考虑;建议增强CT检查。5) 脊柱退行性变。6) 双侧基底节区、放射冠区多发缺血灶;透明隔间腔扩大。诊断为弥漫大B细胞淋巴瘤(ABC亚型 Ann Arbor IV期B IPI评分 4分 高危),于2020年5月28日起给予R-CHOP21方案化疗4个疗程后行中期评估PET-CT:DLBCL化疗后,扫描野多发淋巴结数量减少、范围略缩小,仅余右肺门及纵隔4区淋巴结,仍存在高度FDG代谢活性(大者1.7 × 1.5 cm SUVmax20.4);甲状腺两叶混杂密度占位,范围略缩小,FDG代谢活性略减低(SUVmax6.8);胃底部代谢增高结节范围略缩小、FDG代谢活性略减低(SUVmax6.8)脾内仅余一代谢增高灶(SUVmax9.6);多发骨骼病变数量减少、范围缩小,仅余L1椎体病灶,存较高FDG代谢活性(SUVmax5.1);鼻咽、口咽、双肺、双侧乳腺及肝脏病灶未见明显显示。5PS评分5分,考虑疾病部分缓解(PR),于2020年9月11日选用二线治疗方案R-GDP方案(利妥昔单抗注射液600 mg d0,吉西他滨1.6 g d1,顺铂30 mg d1-3,甲泼尼龙琥珀酸钠60 mg d1-5),行3周期挽救治疗,治疗结束后于2020年12月1日行PET-CT:扫描野多发淋巴结数量较前增多,体积较前增大,FDG代谢较前升高(SUVmax29.2);胃底部代谢增高结节范围较前相仿、FDG代谢活性略减低;脾内病灶较前相仿增大,FDG代谢升高(SUVmax16.3);多发骨骼病变数量较前增多,存在较高FDG代谢活性(SUVmax6.1);双肺多发高代谢结节,较前新发;鼻咽、口咽、双侧乳腺及肝脏病灶仍未见明显显示;甲状腺两叶混杂密度占位、FDG代谢升高,较前相仿;小脑蚓部局限FDG代谢升高影(SUVmax23.6),建议结合临床除外淋巴瘤浸润;提示疾病进展(PD)。与患方沟通后,换用泽布替尼 + BR方案(利妥昔单注射液600 mg d1,苯达莫司汀125 mg d2-3,泽布替尼160 mg bid)化疗3疗程,于2021年2月16日行PET-CT:原扫描野多发淋巴结较前明显减少、减小,部分消失,仅纵膈内肺窗淋巴结代谢增高,SUVmax4.9;主动脉弓旁淋巴结较前相仿,代谢增高,SUVmax18.3;胃底部代谢增高较前相仿、FDG代谢活性略增高,SUVmax9.7原脾内、多发骨骼、双肺代谢增高灶此次显像未见明确显示;小脑蚓部局限FDG代谢升高影,SUVmax20.4建议结合临床除外淋巴瘤浸润。甲状腺两叶混杂密度占位、FDG代谢升高,SUVmax6.7 (上次SUVmax8.2),较前相仿,请结合穿刺活检除外原发肿瘤。5PS评分5分,提示疾病部分缓解(partial response, PR)。患者于2021年4月26日行胸部CT平扫检查时发现,左侧大量胸腔积液,后予以胸腔穿刺引流术,胸水流式细胞学检查示10.13%的细胞(占有核细胞)表达CD19、CD20、CD38,部分表达CD5,不表达CD10、kappa、lambada,考虑为恶性成熟B淋巴细胞,细胞较大。考虑淋巴瘤累及胸膜,疾病评效为(progressive disease, PD),患者拒绝行进一步治疗,于2021年5月11日办理自动出院。
3. 讨论
CD5是一种细胞表面的跨膜糖蛋白,其相对分子质量为67kD,常表达于T细胞及少部分B细胞。CD5在血液系统恶性肿瘤之中,常见于T细胞肿瘤、慢性淋巴细胞白血病以及套细胞淋巴瘤等疾病 [3]。CD5 (+) DLBCL为一种异质性的疾病,占所有DLBCL患者的5%~10% [2],临床中少见,与CD5 (−) DLBCL相比,CD5 (+) DLBCL患者多为老年女性,常伴有B症状、体能状态差、乳酸脱氢酶水平较高、国际预后指数(international prognostic index, IPI)评分高、Ki-67增殖指数高、常累及多个结外部位,其中骨髓、肝脾和中枢神经系统(central nervous system, CNS)最易受累,具有更高的侵袭性,总生存时间(overall survival, OS)和无进展生存时间(progression-free survival, PFS)明显更短 [4]。除此之外,CD5 (+) DLBCL易于侵袭中枢。一般情况下,DLBCL侵犯CNS的发生率小于5%,而CD5 (+) DLBCL患者侵犯CNS的发生率高达13% [5]。既往文献报道,多数CD5 (+) DLBCL为ABC亚型,且ABC亚型是CD5 (+) DLBCL的不良预后因素 [6]。本例患者为老年女性,结外病变,免疫分型为ABC亚型,伴有B症状,乳酸脱氢酶水平高,IPI评分4分,ki-67约70%,预后差,符合原发CD5 (+) DLBCL流行病学特点及临床特征。
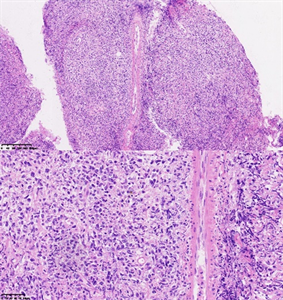
Figure 1. Hematoxylin-eosin staining
图1. HE染色

Figure 2. Immunocytochemistry: CD20+++
图2. 免疫组化:CD20+++
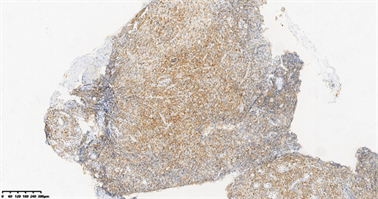
Figure3. Immunocytochemistry: CD5+++
图3. 免疫组化:CD5+++
CD5导致DLBCL不良结果的机制仍未完全了解。目前认为潜在的机制分为两种途径。一种途径是通过抑制B细胞受体(B cell antigen receptor, BCR)信号来阻止肿瘤细胞的凋亡,导致DLBCL的不良预后。另一个途径涉及白介素(IL)-10、Bcl-2、细胞周期蛋白D2和cxc基序趋化因子受体4 (chemokine receptor 4, CXCR4)的过表达 [7]。与CD5 (−) B细胞相比,IL-10在CD5 (+) B细胞中以更高水平产生。IL-10被认为直接促进B细胞存活,并且可能支持CD5相关的淋巴瘤细胞存活。此外,CD5阳性可激活STAT3通路,促进Bcl-2转录,从而促进肿瘤细胞存活。CD5可介导细胞周期蛋白D2过表达,这对细胞增殖很重要。同时CD5可以通过CXCR4的过表达,来促进DLBCL转移到骨髓和CNS并降低DLBCL患者的存活率。然而,上述机制尚未得到实验验证 [8]。最近一项研究证明 [9],tRNA源性小片段(tRFs)在CD5 (+) DLBCL患者与健康成人外周血中差异表达,提示tRFs可能与CD5 (+) DLBCL的发生相关。另外,生信分析发现PI3K/AKT和MAPK/ERK可能是与CD5 (+) DLBCL发生发展相关的信号通路。
CD5 (+) DLBCL呈现出独特的侵略性临床特征和不良预后,曾在2008年WHO血淋巴肿瘤分类中作为DLBCL的免疫表型亚组引入。但2016年修订版去除了CD5 (+)亚型。因此,根据国内DLBCL诊疗指南,CD5 (+) DLBCL的一线治疗仍然选用R-CHOP方案。但CD5 (+) DLBCL患者使用R-CHOP方案的疗效确实比CD5 (−) DLBCL患者较差。日本的一项大型回顾性研究 [10] 发现CD5 (+)与CD5 (−) DLBCL的2年无事件生存率分别为18%和45%,2年总生存率分别为73%和91%。两者之间显示出较大差异。本例采用R-CHOP方案化疗4疗程后仅获得PR,对R-CHOP方案敏感性较差。吉西他滨增能够增强利妥昔单抗介导的补体依赖性细胞毒性,联合受利妥昔单抗具有明显的抗肿瘤作用,另外吉西他滨在老年患者中显示出较高的安全性 [11] [12]。但R-GDP方案在本例CD5 (+) DLBCL患者中并未显示出理想的疗效。患者在更换二线治疗方案R-GDP方案后,疾病出现进展。复发难治性ABC-DLBCL中BTK处于异常活化状态,BTK抑制剂可以抑制B细胞肿瘤的促生存信号通路,促进凋亡并抑制肿瘤细胞增殖,靶向作用于BCR和趋化因子调控的细胞黏附和迁移,实现对肿瘤的抑制作用 [13]。因此,我们在疾病进展后换用泽布替尼 + BR方案,但仍未显示出有效的治疗效果。由此可见,对于这一特定的DLBCL患者群体,我们需要探索更加高效的新疗法。Cai等人 [14] 研究发现,对于CD5 (+) DLBCL患者,与单纯R-CHOP方案相比,基于R-CHOP的免疫化疗加全身大剂量甲氨蝶呤(HD-MTX)可提高CD5 (+)患者的5年总生存率。除此之外,最近的一项研究发现,剂量调整的依托泊苷,泼尼松,长春新碱,环磷酰胺,阿霉素和利妥昔单抗(DA-EPOCH-R)联合全身HD-MTX用于CD5 (+) DLBCL患者,其疗效优于历史对照中的R-CHOP方案 [15]。或许DA-EPOCH-R联合HD-MTX方案可以成为对CD5 (+) DLBCL更有效的化疗方案。
综上所述,CD5 (+) DLBCL具有独特的临床特点,治疗反应差,在临床中我们应重视CD5在DLBCL中的表达,可以将CD5 (+) DLBCL视为DLBCL的侵袭性亚型。CD5导致DLBCL不良结果的机制尚不明确,仍需要我们进行大量研究。CD5 (+) DLBCL目前尚无有效化疗方案,迫切需要我们探索更加有效的治疗方案改善患者预后。
文章引用
刘 鹏,许 玥,王彦丽,李 丽,接贵涛. 原发CD5阳性弥漫大B细胞淋巴瘤一例并文献复习
The Primary CD5 Positive Diffuse Large B-Cell Lymphoma: A Case Report and Literature Review[J]. 临床医学进展, 2021, 11(12): 5803-5808. https://doi.org/10.12677/ACM.2021.1112858
参考文献
- 1. Susanibar-Adaniya, S. and Barta, S.K. (2021) Update on Diffuse Large B Cell Lymphoma: A Review of Current Data and Potential Applications on Risk Stratification And Management. American Journal of Hematology, 96, 617-629. https://doi.org/10.1002/ajh.26151
- 2. Xu-Monette, Z.Y., Tu, M., Jabbar, K.J., Cao, X., Tzankov, A., Visco, C., Nagarajan, L., Cai, Q., Montes-Moreno, S., An, Y., Dybkaer, K., Chiu, A., Orazi, A., Zu, Y., Bhagat, G., Richards, K.L., Hsi, E.D., Choi, W.W., van Krieken, J.H., Huh, J., Young, K.H., et al. (2015) Clinical and Biological Significance of de Novo CD5+ Diffuse Large B-Cell Lymphoma in Western Countries. Oncotarget, 6, 5615-5633. https://doi.org/10.18632/oncotarget.3479
- 3. Lydyard, P.M., Jewell, A.P., Jamin, C. and Youinou, P.Y. (1999) CD5 B Cells and B-Cell Malignancies. Current Opinion in Hematology, 6, 30-36. https://doi.org/10.1097/00062752-199901000-00006
- 4. Na, H.Y., Choe, J.Y., Shin, S.A., Kim, H.J., Han, J.H., Kim, H.K., Oh, S.H. and Kim, J.E. (2019) Characteristics of CD5-Positive Diffuse Large B-Cell Lymphoma among Koreans: High Incidence of BCL2 and MYC Double-Expressors. PLoS ONE, 14, e0224247. https://doi.org/10.1371/journal.pone.0224247
- 5. Yamaguchi, M., Nakamura, N., Suzuki, R., Kagami, Y., Okamoto, M., Ichinohasama, R., Yoshino, T., Suzumiya, J., Murase, T., Miura, I., Ohshima, K., Nishikori, M., Tamaru, J., Taniwaki, M., Hirano, M., Morishima, Y., Ueda, R., Shiku, H. and Nakamura, S. (2008) De Novo CD5+ Diffuse Large B-Cell Lymphoma: Results of a Detailed Clinicopathological Review in 120 Patients. Haematologica, 93, 1195-1202. https://doi.org/10.3324/haematol.12810
- 6. Montalbán, C., Díaz-López, A., Martín, A., Baile, M., Sanchez, J.M., Sancho, J.M., García, O., Novelli, S., Monter-Rovira, A., Salar, A., Bastos, M., Gutiérrez, A., Bento, L., Córdoba, R., Arquero, T., González de Villambrosia, S., Barranco, G., De Oña, R., López Guillermo, A., Rodriguez Salazar, M.J., et al. (2018) Differential Prognostic Impact of GELTAMO-IPI in Cell of Origin Subtypes of Diffuse Large B Cell Lymphoma as Defined by the Hans Algorithm. British Journal of Haematology, 182, 534-541. https://doi.org/10.1111/bjh.15446
- 7. Xu, Y., Sun, W. and Li, F. (2020) De Novo CD5+ Diffuse Large B-Cell Lymphoma: Biology, Mechanism, and Treatment Advances. Clinical Lymphoma, Myeloma & Leukemia, 20, e782-e790. https://doi.org/10.1016/j.clml.2020.05.003
- 8. Durani, U. and Ansell, S.M. (2021) CD5+ Diffuse Large B-Cell Lymphoma: A Narrative Review. Leukemia & Lymphoma, 1-9. https://doi.org/10.1080/10428194.2021.1953010
- 9. Qu, Q., Li, Y., Fang, X., Zhang, L., Xue, C., Ge, X., Wang, X. and Jiang, Y. (2019) Differentially Expressed tRFs in CD5 Positive Relapsed & Refractory Diffuse Large B Cell Lymphoma and the Bioinformatic Analysis for Their Potential Clinical Use. Biology Direct, 14, 23. https://doi.org/10.1186/s13062-019-0255-8
- 10. Ennishi, D., Takeuchi, K., Yokoyama, M., Asai, H., Mishima, Y., Terui, Y., Takahashi, S., Komatsu, H., Ikeda, K., Yamaguchi, M., Suzuki, R., Tanimoto, M. and Hatake, K. (2008) CD5 Expression Is Potentially Predictive of Poor Outcome among Biomarkers in Patients with Diffuse Large B-Cell Lymphoma Receiving Rituximab plus CHOP Therapy. Annals of Oncology: Official Journal of the European Society for Medical Oncology, 19, 1921-1926. https://doi.org/10.1093/annonc/mdn392
- 11. Hayashi, K., Nagasaki, E., Kan, S., Ito, M., Kamata, Y., Homma, S. and Aiba, K. (2016) Gemcitabine Enhances Rituximab-Mediated Complement-Dependent Cytotoxicity to B Cell Lymphoma by CD20 Upregulation. Cancer Science, 107, 682-689. https://doi.org/10.1111/cas.12918
- 12. Aribi, M., Mesli, N., Remla, N., Sari, B.E., Taleb, A., Touhami, H., Bekadja, M.A., Zouaoui-Benhadji, Z., Bouzid, K. and Meguenni, K. (2010) Gemcitabine and Treatment of Diffuse Large B-Cell Lymphoma in Relapsed or Refractory Elderly Patients: A Prospective Randomized Trial in Algeria. Journal of Cancer Research and Therapeutics, 6, 41-46. https://doi.org/10.4103/0973-1482.63572
- 13. Lucas, F. and Woyach, J.A. (2019) Inhibiting Bruton’s Tyrosine Kinase in CLL and Other B-Cell Malignancies. Targeted oncology, 14, 125-138. https://doi.org/10.1007/s11523-019-00635-7
- 14. Cai, J., Tian, X., Ma, S., Zhong, L., Li, W., Wang, L., Guo, L., Li, Z., Wu, Y., Zhong, G., Huang, H., Xia, Z., Xia, Y., Liu, P., Su, N., Fang, Y., Zhang, Y. and Cai, Q. (2021) A Nomogram Prognostic Index for Risk-Stratification in Diffuse Large B-Cell Lymphoma in the Rituximab Era: A Multi-Institutional Cohort Study. British Journal of Cancer, 125, 402-412. https://doi.org/10.1038/s41416-021-01434-6
- 15. Miyazaki, K., Asano, N., Yamada, T., Miyawaki, K., Sakai, R., Igarashi, T., Nishikori, M., Ohata, K., Sunami, K., Yoshida, I., Yamamoto, G., Takahashi, N., Okamoto, M., Yano, H., Nishimura, Y., Tamaru, S., Nishikawa, M., Izutsu, K., Kinoshita, T., Suzumiya, J., et al. (2020) DA-EPOCH-R Combined with High-Dose Methotrexate in Patients with Newly Diagnosed Stage II-IV CD5-Positive Diffuse Large B-Cell Lymphoma: A Single-Arm, Open-Label, Phase II Study. Haematologica, 105, 2308-2315. https://doi.org/10.3324/haematol.2019.231076
NOTES
*通讯作者。