Advances in Clinical Medicine
Vol.
10
No.
08
(
2020
), Article ID:
37198
,
8
pages
10.12677/ACM.2020.108258
Analysis of Factors Influencing Viral Shedding Time in Severe and Critical COVID-19 Patients
Qihui Ran1, Hong Chen1, Ling Zhang1, Yucen Zhong2
1Department of Critical Care Medicine, The Public Health Clinical Center of Chengdu, Chengdu Sichuan
2Department of Clinical Medicine, North Sichuan Medical College, Nanchong Sichuan
Received: Aug. 1st, 2020; accepted: Aug. 17th, 2020; published: Aug. 24th, 2020

ABSTRACT
Objective: To investigate the factors influencing the time of viral shedding in severe and critical COVID-19 patients. Methods: Clinical data of 28 patients with severe and critical COVID-19 were collected retrospectively to analyze the factors affecting the time of viral shedding. Results: This study observed the mean duration of 2019-nCov RNA shedding was 24.0 ± 9.0 days in survivor patients, the longest and shortest observed duration of viral shedding were 41 days and 12 days. There were 13 and 15 patients with viral shedding time ≥ 24 and <24 days, respectively. Significant statistically differences were observed in blood glucose (P = 0.001), D-dimer (P = 0.025), lymphocyte count (P = 0.049), neutrophil rate (P = 0.019), clinical typing (P = 0.006), and number of patients with diabetes (P = 0.029) between the two groups. There was a positive correlation between fasting blood glucose and viral shedding time, with a correlation coefficient of 0.468, P = 0.012. Multivariate Logistic regression analysis suggested that high fasting blood glucose within the first 24 hours after the patients were transferred to intensive care unit was an independent risk factor which affects the time of viral shedding (OR = 1.680, 95% CI = 1.011~2.792, P = 0.045). According to ROC curve analysis, the area under the curve (AUC) for fasting blood glucose to predict viral shedding time ≥ 24 days was 0.887 (95% CI was 0.711~0.975, P < 0.001), the cut-off value was 7.33 mmol/L, and the sensitivity and specificity were 84.6% and 86.7%, respectively. Conclusion: High fasting blood glucose within 24 hours after the patients were transferred to intensive care unit is a risk factor affecting the viral shedding time, which should be paid attention in the clinical treatment of such patients.
Keywords:Corona Virus Disease-19, Viral Shedding, Influencing Factors, Fasting Blood Glucose

新型冠状病毒肺炎重型和危重型患者病毒转阴时间的影响因素分析
冉启惠1,陈红1,张玲1,钟雨岑2
1成都市公共卫生临床医疗中心重症医学科,四川 成都
2川北医学院临床医学系,四川 南充

收稿日期:2020年8月1日;录用日期:2020年8月17日;发布日期:2020年8月24日

摘 要
目的:探讨新型冠状病毒肺炎重型和危重型患者病毒转阴时间的影响因素。方法:回顾性收集28例新型冠状病毒肺炎重型和危重型患者的临床资料,分析影响患者病毒转阴时间的因素。结果:28例患者的病毒转阴平均时间为24.0 ± 9.0天,最长和最短转阴时间分别为41天和12天。病毒转阴时间 ≥ 24天和<24天患者分别为13例和15例,两组患者的空腹血糖(P = 0.001)、D-二聚体(P = 0.025)、淋巴细胞计数(P = 0.049)、中性粒细胞率(P = 0.019)、临床分型(P = 0.006)、糖尿病患者数(P = 0.029) 6项指标差异具有统计学意义。空腹血糖与病毒转阴时间正相关,相关系数为0.468,P = 0.012。多因素Logistic回归分析提示,患者转入重症24小时内的空腹血糖偏高是影响病毒转阴时间的独立危险因素(OR = 1.680, 95% CI为1.011~2.792,P = 0.045)。空腹血糖预测病毒转阴时间 ≥ 24天的曲线下面积(AUC)为0.887 (95% CI为0.711~0.975,P < 0.001),最佳截断值为7.33 mmol/L,敏感度和特异度分别为84.6%和86.7%。结论:新型冠状病毒肺炎重型和危重型患者转入重症24小时内空腹血糖高是影响病毒转阴时间的危险因素,临床救治该类患者时应该给予关注。
关键词 :新型冠状病毒肺炎,病毒转阴,影响因素,空腹血糖

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
新型冠状病毒肺炎是一种由2019年新型冠状病毒(2019-nCov)感染引起的冠状病毒病(Corona Virus Disease-19, COVID-19) [1]。自2019年12月,中国湖北省武汉市发生群发性新冠肺炎以来,该疾病已迅速蔓延至其它地区 [2]。截止2020年3月29日10时(中欧时间),全球已累计确诊634,835例患者,死亡29,957例 [3]。对于新冠肺炎患者的治疗,最主要的目标之一是让患者体内的病毒转阴。据文献报道,幸存者中病毒RNA检测转阴的中位时间为20.0 (17.0, 24.0)天,最长病毒转阴时间为37天 [4] [5]。本研究回顾性收集28例确诊新冠肺炎重型和危重型患者的临床资料,分析影响病毒转阴时间的因素,为临床救治提供参考。
2. 资料与方法
2.1. 研究对象
以2020年1月至2020年3月期间,成都市公共卫生临床医疗中心收治的新型冠状病毒肺炎重型和危重型患者作为研究对象。研究对象的纳入标准为:1) 患者满足新型冠状病毒肺炎诊疗方案(试行第七版) (以下简称“诊疗方案”)中关于重症和危重的诊断标准 [6];2) 临床治疗方案遵照诊疗方案中的相应推荐内容执行。排除标准:1) 结局为死亡的患者;2) 年龄 < 18岁的患者;3) 入院24小时内死亡的患者;4) 患者为孕妇或正处于哺乳期的妇女。除病毒转阴时间外,其它纳入统计分析的临床指标均在患者转入重症后24小时内完成检测或样本采集。
2.2. 诊断标准和定义
1) 新型冠状病毒肺炎确诊病例重型和危重型的诊断标准参照新型冠状病毒肺炎诊疗方案(试行第七版) [6],重型新型冠状病毒肺炎诊断标准为成人符合下列任何一条:① 出现气促,RR ≥ 30次/分;② 静息状态下,指氧饱和度 ≤ 93%;③ 动脉血氧分压(PaO2)/吸氧浓度(FiO2) ≤ 300 mmHg (1 mmHg = 0.133 kPa)。危重型新型冠状病毒肺炎诊断标准为成人符合以下情况之一者:① 出现呼吸衰竭,且需要机械通气;② 出现休克;③ 合并其他器官功能衰竭需ICU监护治疗。
2) 病毒转阴诊断标准:连续两次痰、鼻咽拭子等呼吸道标本实时荧光RT-PCR检测新型冠状病毒核酸阴性(两次采样时间至少间隔24小时)。
3) 病毒转阴时间定义:从患者出现发病症状到病毒转阴的时间,以天为单位,不足1天的记为1天。
2.3. 伦理学
本研究符合医学伦理学标准,并经过成都市公共卫生临床医疗中心伦理委员会的审批(审批号:PJ-K2020-12-01),所有治疗及检测均获得过患者或家属的知情同意。
2.4. 研究方法
回顾性收集入组患者的人口学资料、一般临床资料、实验室检查指标和病毒转阴时间,统计分析患者的一般临床特征。以患者病毒转阴的平均值作为分组依据,将患者分为病毒转阴时间小于和大于等于平均转阴时间两组,行多因素Logistic回归分析影响病毒转阴时间的因素。
2.5. 统计学方法
用Microsoft Excel软件收集和整理入组患者的临床数据,建立病例资料数据库,应用SPSS25.0统计软件对数据进行统计分析。正态分布的计量资料以均数 ± 标准差( )表示,组间比较用t检验;非正态分布的计量资料以中位数(四分位数) [M(QL, QU)]表示,组间比较用秩和检验(Mann-Whitney U);计数资料以例或率(%)表示,组间比较用c2检验;影响患者病毒转阴时间长的因素行Logistic多因素回归分析。用受试者工作特征曲线(ROC)分析影响因素对患者病毒转阴时间的预测价值。P < 0.05为差异有统计学意义。
3. 结果
3.1. 临床特征
研究期间共有28例新型冠状病毒肺炎重型和危重型患者入组,平均年龄59.4岁,最小34岁,最大87岁,以男性患者为主19 (19/28)。资料收集完成前,所有入组患者病毒核酸检测均转阴,平均转阴时间为24天,最长和最短转阴时间分别为41天和12天。其它临床特征见表1。
Table 1. Clinical characteristics of 28 patients with severe and critical COVID-19
表1. 28例新型冠状病毒肺炎重型和危重型患者的临床特征
注:APACHE II评分为急性生理学与慢性健康状况评分系统II评分;SOFA评分为序贯性脏器衰竭评分;“-”代表无此项。
3.2. 两组患者临床特征资料比较
为筛选出影响新型冠状病毒转阴时间的因素,以28例新型冠状病毒肺炎重型和危重型患者的平均病毒转阴时间(24天)为分组界限,将患者分为病毒转阴时间 ≥ 24天和<24天两组,其中≥24天组13例,<24天组15例。两组患者间的空腹血糖(P = 0.001)、D-二聚体(P = 0.025)、淋巴细胞计数(P = 0.049)、中性粒细胞率(P = 0.019)、临床分型(P = 0.006)、糖尿病患者数(P = 0.029) 6项指标差异具有统计学意义(P < 0.05)。其它比较结果见表2。
Table 2. Comparison of clinical characteristics of 28 patients with viral shedding time ≥ 24 days and < 24 days
表2. 28例患者病毒转阴时间 ≥ 24和<24天两组临床特征资料比较
注:APACHE II评分为急性生理学与慢性健康状况评分系统II评分;SOFA评分为序贯性脏器衰竭评分;“-”代表无此项;两组计数资料的比较选用Fisher确切概率法。
3.3. 影响患者病毒转阴时间的相关因素分析
将空腹血糖、D-二聚体、淋巴细胞计数、中性粒细胞率4项检查指标与患者的病毒转阴时间做相关性分析,结果显示患者的病毒转阴时间与空腹血糖正相关,相关系数为0.468,P = 0.012,与D-二聚体、淋巴细胞计数、中性粒细胞率不相关。
3.4. Logistic回归分析影响病毒转阴时间的因素
将病毒转阴时间(≥24天或<24天)作为因变量,空腹血糖、D-二聚体、淋巴细胞计数、中性粒细胞率、临床分型作为自变量,行多因素 Logistic 回归分析。结果提示,空腹血糖是新型冠状病毒肺炎重型和危重型患者病毒转阴时间 ≥ 24天的危险因素,OR = 1.680 (P = 0.045),见表3。
Table 3. Logistic regression analysis of factors influencing the time of viral shedding in severe COVID-19 patients
表3. 新型冠状病毒肺炎重症患者病毒转阴时间影响因素的Logistic回归分析
3.5. 空腹血糖预测新型冠状病毒肺炎重型和危重型患者病毒转阴时间的价值
ROC曲线分析结果显示,空腹血糖预测新型冠状病毒肺炎重型和危重型患者病毒转阴时间 ≥ 24天的曲线下面积(AUC)为0.887,P < 0.001,95%置信间为0.711~0.975。最佳截断值为7.33 mmol/L,敏感度和特异度分别为84.6%和86.7%。ROC曲线见图1。
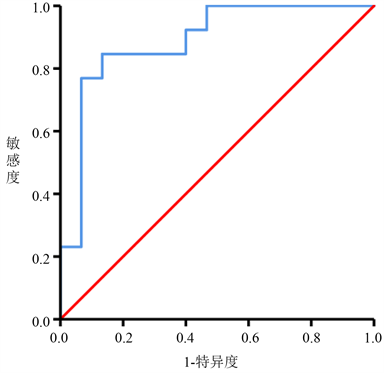
Figure 1. ROC curve of fasting blood glucose predicting novel coronavirus shedding time
图1. 空腹血糖预测新型冠状病毒转阴时间的ROC曲线
4. 讨论
目前,2019-nCov感染引起的新型冠状肺炎已经发展成为全球关注的重大公共卫生事件,影响了世界上多个国家,正对人类的健康和经济造成严重威胁。2019-nCov具有1~14天的潜伏期和人传人的特点 [7],使得及时发现和清除已感染者携带的病毒,对于疾病防控非常重要。有文献报道新冠肺炎患者病毒转阴的中位时间是20 (17, 24)天,最长为37天 [5],病毒转阴时间差异的原因目前尚不清楚,本研究通过对28例重型和危重型新冠肺炎患者临床资料和病毒转阴时间的统计分析,报道了影响病毒转阴时间的因素。
纳入本研究的28例患者主要发病症状与文献报道的结果相符 [8] [9] [10],以发热、咳嗽、气促为主。病毒转阴的时间平均为24.0天,最长和最短转阴时间分别为41天和12天,高于已报道的结果。将28例患者按照病毒转阴时间≥24天和<24天分为两组,比较两组患者的临床资料,结果两组患者间的病毒转阴平均时间(P < 0.001)、空腹血糖(P = 0.001)、D-二聚体(P = 0.025)、淋巴细胞计数(P = 0.049)、中性粒细胞率(P = 0.019)、病情临床分型(P = 0.006)、糖尿病患者数(P = 0.029) 6项指标差异具有统计学意义。≥24天组,空腹血糖为10.75 (8.22, 13.46) mmol/L,明显高于<24天组的5.76 (5.66, 7.21) mmol/L。相关性分析结果显示病毒转阴时间与空腹血糖正相关,相关系数为0.468,P = 0.012。进一步做多因素Logistic分析,结果空腹血糖是新型冠状病毒肺炎重型和危重型患者病毒转阴时间 ≥ 24天的危险因素,OR = 1.680,P = 0.045。考虑到两组患者中患糖尿病的数量有差异,将糖尿病引入Logistic回归方程,结果提示糖尿病不是患者病毒转阴时间 ≥ 24天的危险因素,P = 0.894。
由于本研究属于回顾性分析和样本量小的局限,空腹血糖高为什么是病毒转阴时间的长的危险因素,尚不能得出结论。推测原因可能有:1) 患者在感染新冠病毒前基础血糖偏高,但统计结果显示,两组患者的糖化血红蛋白分别为6.02%和5.38%,差异无统计学意义,提示在最近的8~12周患者的血糖都控制得比较好 [11] [12];2) 血糖高属于机体对炎症应激反应的结果,即人体遭受应激时(如创伤、感染或炎症等),内生性的激素会进行调控以应付突发状况,相关机制与下视丘–脑下腺–肾上腺轴的回馈机制及细胞因子有关 [13],血糖高可能提示疾病程度更严重 [14];3) 新冠病毒攻击宿主的胰岛β细胞,使得机体对血糖的调控能力降低 [15]。具体原因还需要进一步研究。
5. 结论
综上所述,新型冠状病毒肺炎重型和危重型患者转入重症监护室24小时内的空腹血糖偏高是病毒转阴时间长的危险因素,临床救治该类患者时应该给予关注。空腹血糖对患者病毒转阴时间的预测具有一定的参考价值。
基金项目
1) 2020年成都市科学技术局新冠肺炎防控科技项目基金(2020-YF05-00191-SN)。
2) 四川省科学技术厅2020年第一批应对新型冠状病毒科技攻关应急项目基金(2020YFS0005)。
文章引用
冉启惠,陈 红,张 玲,钟雨岑. 新型冠状病毒肺炎重型和危重型患者病毒转阴时间的影响因素分析
Analysis of Factors Influencing Viral Shedding Time in Severe and Critical COVID-19 Patients[J]. 临床医学进展, 2020, 10(08): 1717-1724. https://doi.org/10.12677/ACM.2020.108258
参考文献
- 1. 秦红亚, 刘瑞娟, 苗健龙, 等. 2019新型冠状病毒肺炎研究进展[J]. 临床肺科杂志, 2020, 25(3): 440-444.
- 2. Wang, D., Hu, B., Hu, C., et al. (2020) Clinical Characteristics of 138 Hospitalized Patients with 2019 Novel Coronavirus-Infected Pneumonia in Wuhan, China. JAMA, 323, 1061-1069. https://doi.org/10.1001/jama.2020.1585
- 3. World Health Organization. Coronavirus Disease 2019 (COVID-19) Situation Report 69. https://www.who.int/docs/default-source/coronaviruse/situation-reports/20200329-sitrep-69-covid-19.pdf?sfvrsn=8d6620fa_2
- 4. Huang, C., Wang, Y., Li, X., Ren, L., Zhao, J., Hu, Y., et al. (2020) Clinical Features of Patients Infected with 2019 Novel Coronavirus in Wuhan, China. The Lancet, 395, 497-506. https://doi.org/10.1016/S0140-6736(20)30183-5
- 5. Zhou, F., Yu, T., Du, R., Fan, G., Liu, Y., Liu, Z., et al. (2020) Clinical Course and Risk Factors for Mortality of Adult Inpatients with COVID-19 in Wuhan, China: A Retrospective Study. The Lancet, 395, 1054-1062.
- 6. 国家卫生健康委员会. 新型冠状病毒肺炎诊疗方案(试行第七版) [EB/OL]. http://www.nhc.gov.cn/yzygj/s7653p/202003/46c9294a7dfe 4cef80dc7f5912eb1989/files/ce3e6945832a438eaae415350a8ce964.pdf, 2020-03-04/2020-03-30.
- 7. 国家卫生健康委员会. 新型冠状病毒肺炎诊疗方案(试行第五版) [EB/OL]. http://www.nhc.gov.cn/yzygj/s7653p/202002/d4b895337e194 45f8d728fcaf1e3e13a/files/ab6bec7f93e64e7f998d802991203 cd6.pdf, 2020-02-08/2020-03-30.
- 8. 房晓伟, 梅清, 杨田军, 等. 2019新型冠状病毒感染的肺炎79例临床特征及治疗分析[J]. 中国药理学通报, 2020, 36(4): 1-7.
- 9. 曹勇, 郭威, 陈广, 等. 13例中老年重症新型冠状病毒肺炎患者临床资料分析[J]. 华中科技大学学报(医学版), 2020, 42(2): 1-5.
- 10. 陈莉, 冯世艳, 王福祥, 等. 新型冠状病毒肺炎危重症患者的临床诊治(附12例报告) [J]. 中国临床医学, 2020, 27(1): 1-4.
- 11. 成平, 刘兴高, 谢家宁. 糖化血红蛋白和血糖水平检测对精神病患者并发糖尿病的诊断价值[J]. 检验医学与临床, 2020, 17(1): 51-53.
- 12. 中华医学会糖尿病学分会. 中国2型糖尿病防治指南(2017年版) [J]. 中华糖尿病杂志, 2018, 10(1): 4-67.
- 13. 谢蕙蕙. ICU急危重症患者高血糖状态的影响因素研究[J]. 中外医学研究, 2020, 18(2): 138-140.
- 14. Colombo, R., Corona, A., Praga, F., et al. (2012) A Reorientation Strategy for Reducing Delirium in the Critically Ill. Results of an Interventional Study. Minerva Anestesiologica, 78, 1026-1033.
- 15. 柯飒, 邓媛媛, 章鑫煦, 向娟. 慢性乙型肝炎患者糖代谢异常的研究进展[J]. 中国感染控制杂志 2019, 18(7): 696-700.
