Journal of Comparative Chemistry
Vol.
02
No.
04
(
2018
), Article ID:
27371
,
19
pages
10.12677/CC.2018.24017
Progress in Hypoglycemic and Lipid-Lowering Drugs
Bo Li1,2, Wenxiang Hu1,2,3*
1School of Chemistry and Environmental Engineering, Wuhan Institute of Technology, Wuhan Hubei
2Jingdong Xianghu Microwave Chemistry Union Laboratory, Beijing Excalibur Space Military Academy of Medical Sciences, Beijing
3Space Systems Division, Strategic Support Troops, Chinese People’s Liberation Army, Beijing
Email: *huwx66@163.com
Received: Oct. 7th, 2018; accepted: Oct. 24th, 2018; published: Oct. 31st, 2018

ABSTRACT
Diabetes and hyperlipidemia are important diseases that threaten human health. The research on related drugs and their targets has been paid close attention. This article mainly describes the targets of 9 hypoglycemic drugs and the targets of 9 lipid-lowering drugs, as well as a brief introduction of some drugs related to the targets.
Keywords:Hypoglycemic Drugs, Lipid-Lowering Drugs, Target, Pharmacological Activity
降糖降脂药物研究进展
李博1,2,胡文祥1,2,3*
1武汉工程大学化学与环境工程学院,湖北 武汉
2北京神剑天军医学科学院京东祥鹄微波化学联合实验室,北京
3中国人民解放军战略支援部队航天系统部,北京
Email: *huwx66@163.com
收稿日期:2018年10月7日;录用日期:2018年10月24日;发布日期:2018年10月31日
摘 要
糖尿病和高脂血症是威胁人类健康的重要病患,其相关药物及其作用靶点研究一直受到人们的关注。本文主要叙述了9个降糖药物的作用靶点及9个降脂药物的作用靶点,以及简要介绍了部分作用靶点的相关药物。
关键词 :降糖药物,降脂药物,作用靶点,药理作用

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
糖尿病(diabetes mellitus, DM)是一种严重威胁人类健康的慢性代谢疾病,主要特征是血糖高于正常范围,通常是由于胰岛素分泌不足或胰岛素难以发挥正常作用所导致的。糖尿病主要分为I型和II型两种:I型糖尿病,属于先天发病型,是胰岛素依赖型糖尿病(Insulin-dependent diabetes mellitus, IDDM);II型糖尿病为成年发病型,是非胰岛素依赖型糖尿病(Non-insulin dependent diabetes mellitus, NIDDM)。其中II型患者占糖尿病病例的90%以上。患病时间较长、病情较重的糖尿病患者通常有冠心病、脑血管疾病、肾病、下肢坏死等并发症,是一种复杂的多发病。
目前全世界约6%的人口受糖尿病的困扰。2013年我国成人糖尿病患病率达11.6%,且以每年75万新增患者的速度增加 [1]。DM目前虽然还不能根治,但良好的血糖控制可以减少糖尿病患者慢性并发症的发生 [2]。
全球每年约有1200万人死于心血管病和脑中风,高脂血症引起的动脉粥样硬化是造成冠心病、高血压和脑血管疾病的主要原因。高脂血症主要是指血清总胆固醇(TC)或甘油三酯(TG)水平过高和(或)血清高密度脂蛋白-胆固醇(HDI-C)水平过低。
随着人类社会的发展和生活水平的提高,糖尿病和高脂血症患者越来越多,已经逐步发展成为一个严重的社会问题,引起了各国政府的高度重视。治疗糖尿病和高脂血症的高效低毒的药物研究发展显得越来越迫切。
2. 降糖药物的研究进展
迄今为止,治疗2型糖尿病药物的种类很多,既有传统的磺脲类、双胍类、格列奈类、噻唑烷二酮类、α-葡萄糖苷酶抑制剂,也有很多新型作用机理的药物。此外,还有一些中成药如黄连素等在糖尿病治疗中也发挥着越来越重要的作用 [3] - [10]。
2.1. 葡萄糖激酶激动剂
葡萄糖激酶(Glucokinase, GK)是一种己糖激酶,有465个氨基酸,分子量51,919,等电点4.85,存在于成熟肝细胞和胰岛β细胞中。葡萄糖激酶作为胰岛β细胞的葡萄糖传感器,在肝细胞葡萄糖利用的调节中起着重要作用 [11]。葡萄糖激酶促进肝糖原合成,刺激胰岛素分泌及催化葡萄糖转变为6-磷酸葡萄糖,均是葡萄糖代谢中极为关键的过程。因此,葡萄糖激酶活性异常在糖代谢紊乱的发生发展中起着重要的作用 [12]。GK作为葡萄糖感受器,参与糖代谢的各条途径,在脑组织(主要是下丘脑部)和小肠内分泌细胞也有少量表达 [13]。目前,有多个葡萄糖激酶激动剂已进入I期临床或临床前的研究阶段(见表1) [14]。
Table 1. Glucokinase stimulators in R&D
表1. 研发中的葡萄糖激酶激动剂
此外,新型葡萄糖激酶激动剂还包括:C5-烷基-2-甲基脲取代的吡啶类、乙酰基苯甲酰胺衍生物等 [15] [16]。
2.2. 胰高血糖素抑制剂
近年来,胰高血糖素对2型糖尿病发病的重要影响引起医学研究者的广泛关注。糖尿病是由于胰岛β细胞分泌胰岛素减少和α细胞分泌胰高血糖素过多共同导致,2型糖尿病患者胰高血糖素高于健康人群。大量临床试验证实:无论是口服降糖药物还是胰岛素均可使2型糖尿病患者胰高血糖素水平下降,提示胰高血糖素与2型糖尿病的发生、发展密切相关 [17]。基于胰高血糖素的糖尿病治疗药物中,胰高血糖素主要作用于肝脏,启动糖原分解和糖异生,导致内源性葡萄糖生产迅速增加。内源性胰高血糖素能快速升高血糖,作为严重低血糖的急救药物应用于临床;胰高血糖素受体抑制剂的研发起源于糖尿病患者胰高血糖素的过度分泌,抑制胰高血糖素的作用能降低患者血糖 [18] [19]。目前,胰高血糖素受体抑制剂的部分研发药物见表2 [14]。
Table 2. Glucagon receptor antagonists in R&D
表2. 研发中的胰高血糖素受体抑制剂
此外,呋喃-2-碳酰肼、基于吲唑/吲哚的和基于螺环咪唑酮的一系列胰高血糖素受体抑制剂等也有所发现 [20] [21] [22]。
2.3. G蛋白偶联受体119激动剂
G蛋白偶联受体119是治疗2型糖尿病的新靶点,它主要在胰腺、肝脏和胃肠道中表达。GPR119激动剂使细胞内环磷酸腺苷(cAMP)水平上升,导致胰岛素分泌增加,胰高血糖素样肽-1 (GLP-1)和抑胃肽(GIP)的释放增加 [23] [24] [25]。GIP可以刺激胰岛素释放,抑制胰高血糖素的分泌。正常情况下体内活性GLP-1会被二肽基肽酶(DPP-4)迅速降解,而DPP-4抑制剂可以抑制体内GLP-1降解。
GLP-1与胰岛β细胞上GLP-1受体结合可以促进胰岛素分泌,抑制胰岛α细胞分泌胰高血糖素,从而降低血糖。并可刺激胰岛β细胞的增殖和分化,抑制胰岛β细胞凋亡 [26]。目前GPR119激动剂的部分研发药物见表3 [14]。
Table 3. GPR119 agonists in R&D
表3. 研发中的GPR119激动剂
此外,5-氟-4,6-二烷氧基嘧啶、吡唑并[3,4-d]嘧啶衍生物、噻吩并嘧啶衍生物、5-(2-((1-(苯基磺酰基)-1,2,3,4-四氢喹啉-7-基)氧基)吡啶-4-基)-1,2,4-恶二唑、新型N-(3-(1,3-二氧代-2,3-二氢-1H-吡咯并[3,4-c]吡啶-4-基氧基)苯基)苯磺酰胺GPR119激动剂等也有所发现 [27] [28] [29] [30] [31]。
2.4. 腺苷酸活化蛋白激酶激动剂
腺苷酸活化蛋白激酶(Adenosine 5'-monophosphate (AMP)-activated protein kinase, AMPK)是一类重要的蛋白激酶,广泛存在于真核细胞中,对机体能量代谢平衡起调节作用,被称为“细胞能量调节器”。近年研究发现,AMPK的激活可使机体分解代谢增强,合成代谢减弱,减少脂质沉积,促进脂肪酸氧化和线粒体生物合成,增强胰岛素敏感性,而抑制下丘脑AMPK活性,则机体食物或能量摄入减少。AMPK信号通路可能是代谢性疾病防治的新靶点 [32] [33] [34]。胰岛素抵抗IR(IR是指肝脏、肌肉和脂肪等组织对胰岛素生物效应的反应性下降,以葡萄糖和脂肪酸代谢异常为特征)是2型糖尿病及其它代谢性疾病如肥胖、高血压、冠心病和卒中等发病的共同病理基础。腺苷酸活化蛋白激酶(AMPK)在葡萄糖、脂肪酸代谢方面起到了关键作用,并对食物摄取和体重具有调节作用。因此,AMPK与IR密切相关 [35]。目前AMPK激动剂的部分研发药物见表4 [14]。
Table 4. AMPK stimulators in R&D
表4. 研发中的AMPK激动剂
2.5. 蛋白酪氨酸磷酸酶-1B抑制剂
研究证实,蛋白酪氨酸磷酸酶-1B(protein tyrosine phosphatase 1B, PTP-1B)主要通过以下几方面参与2型糖尿病的发病:1) 蛋白酪氨酸磷酸酶-1B(PTP-1B)是胰岛素信号转导的主要负调控因子,对2型糖尿病的发生、发展有重要作用。PTP-1B通过使胰岛素受体及其底物酪氨酸去磷酸化而阻断胰岛素的信号转导。2型糖尿病患者和动物模型PTP-1B的表达水平和活性均明显提高,引起胰岛素抵抗,而PTP-1B基因被敲除的小鼠胰岛素敏感性却升高。2) 参与对胰岛β细胞数量的调节。3) 与瘦素抵抗及脂代谢异常关系密切,由此引发并加重2型糖尿病。因此,深入研究PTP-1B及其有效的抑制剂对于2型糖尿病的治疗具有良好的发展前景 [36] [37] [38]。目前PTP-1B抑制剂的部分研发药物见表5 [14]。
Table 5. PTP-1B inhibitors in R&D
表5. 研发中PTP-1B抑制剂
此外,蛋白酪氨酸磷酸酶1B抑制剂还包括:2,4-二羟基卤代烷衍生物和2-取代的乙烯磺酸酯衍生物等 [39] [40]。
2.6. 11β-羟类固醇脱氢酶1抑制剂
糖皮质激素(glucocorticoid, GC)是胰岛素的拮抗激素之一,在糖、蛋白质、脂肪、水盐代谢及应激反应中发挥重要作用。过量GC可诱导机体产生胰岛素抵抗而致糖、脂代谢紊乱,促进T2DM的发生和发展。而11β-羟基类固醇脱氢酶1 (11β-hydroxy steroid dehydrogenase type 1, 11β-HSD1)是GC的代谢酶,将组织中无活性的GC转化为有活性的GC,扩大局部激素生物效应。11β-HSD1抑制剂能减少GC的生成及活化,从而提高脂肪组织、骨骼肌和肝脏内胰岛素的敏感性。所以,11β-HSD1已成为研发治疗2型DM药物的靶点 [41] [42]。目前11β-HSD1抑制剂的部分研发药物见表6 [14]。
Table 6. 11β-HSD1 inhibitors in R&D
表6. 研发中的11β-HSD1抑制剂
2.7. 糖原合成酶激酶3β抑制剂
糖原合成酶激酶3β(GSK3β)是一种丝氨酸/苏氨酸蛋白激酶。抑制GSK3β可以在提高胰岛素敏感性和促进胰岛β细胞增殖这两个方面产生潜在的抗糖尿病效果。如果在细胞中过度表达GSK3β会引起胰岛素信号传导受阻,导致胰岛素抵抗的发生。因此,开发抑制剂作用于GSK3β有利于增强细胞中胰岛素信号的传递,增加胰岛素敏感性并促进糖原的生物合成 [43]。
2.8. 过氧化物酶体增殖激活受体(PPARγ)激动剂
过氧化物酶体增殖激活受体(peroxisome proliferator-activated receptor, PPAR),PPAR存在3种亚型,即PPARα,PPARδ和PPARγ,PPARγ参与调节脂质的合成、碳水化合物的代谢、脂肪细胞的分化及胰岛素抵抗等多种生理和病理过程,是胰岛素的增敏剂—噻唑烷二酮类药物(troglitazone, TZDs)作用的受体 [44] [45]。
2.9. 二肽基肽酶4(DPP-4)抑制剂
二肽基肽酶4(Dipeptidyl peptidase IV, DPP-4)是一种细胞表面的丝氨酸蛋白酶。DPP-4在肠道中表达最高,在肝脏、胰腺、胎盘、胸腺也有表达。肠促胰岛素(incretin)是一类在肠道生成的具有促胰岛素分泌作用的多肽激素,在人体内主要包括胰高血糖素样肽-1(glucagon-like peptide-1, GLP-1)和葡萄糖依赖性促胰岛素分泌多肽(glucose-dependent insulinotropic polypeptide, GIP)。DPP-4可以灭活多种生物活性肽,包括胰高血糖素样肽-1(GLP-1)和葡萄糖依赖性促胰岛素分泌多肽(GIP)。
其中,GLP-1的作用特点包括:① 在餐后生成,以葡萄糖依赖的方式促进胰岛β细胞分泌胰岛素从而降低血糖,不易诱发低血糖;② 抑制胰岛α细胞分泌胰高血糖素;③ 延迟胃排空从而有利于餐后血糖的控制;④ 降低食欲,减少食物的摄入;⑤ 抑制肠道分泌脂蛋白并可能降低作为心血管疾病危险因子的餐后高血脂,从而具有心脏保护作用;⑥ 在体外可调节胰岛β细胞再生、增殖和存活。DPP-4抑制剂(图1)可以使DPP-4失活,从而不分解GLP-1,通过提高GLP-1的水平,发挥控制血糖的作用,是目前治疗糖尿病的主攻方向之一。

Figure 1. Mechanism of action of DPP-4 inhibitor
图1. DPP-4抑制剂作用机理
世界范围内已上市多种DPP-4抑制剂:西格列汀(sitagliptin)、维格列汀(vildagliptin)、沙格列汀(saxagliptin)、阿格列汀(alogliptin)、利格列汀(linagliptin)、吉格列汀(gemigliptin)和替格列汀(teneligliptin)等。
3. 降脂药物的研究进展
血脂异常是动脉粥样硬化、冠心病等心血管疾病的重要危险因素,调脂药物治疗的主要目标是降低血浆低密度脂蛋白,升高高密度脂蛋白。胆固醇转运蛋白(NPC1L1),胆固醇酰基转移酶(ACAT),微粒体三酰甘油转运蛋白(MTP),单酰基甘油酰基转移酶(MAGT),二酰基甘油酰基转移酶(DAGT),过氧化物酶体增生激活型受体(PPAR),法尼醇x受体(FxR),前蛋白转化酶枯草溶菌素9(PCSK9)等是参与血脂代谢的重要蛋白,也是调脂药物作用相关的靶点,在调脂药物的开发和临床用药选择上具有重要参考价值 [46] [47]。近年来,中药在调节血脂血压方面也发挥了重要作用 [48] [49] [50]。
3.1. 胆固醇转运蛋白
胆固醇转运蛋白(NPC1L1)是近年来人们研究高脂血症的重点内容,该蛋白已被证实在胆固醇的肠道吸收和胆汁分泌中发挥了关键作用。NPC1L1调节体内胆固醇的生物合成,是维持生物体胆固醇动态平衡的重要因素,同时也是新型降脂药物依泽替米贝的作用靶点。依泽替米贝通过与NPC1L1结合,抑制NPC1L1的转运功能而降低血脂 [51]。
3.2. 羟甲基戊二酰辅酶A还原酶
羟甲基戊二酰辅A(3-hydroxy-3-methylglutary coenzyme A, HMG-CoA)还原酶抑制剂,是一类有希望的血脂调节药物。HMG-CoA还原酶催化HMG-CoA生成二羟甲基戊酸(MVA),是合成胆固醇的关键一步,所以HMG-CoA还原酶是催化胆固醇合成的限速酶。由于其作用机制新颖,疗效显著,毒副作用小,耐受性好,被认为是防治心血管病的一个突破性进展。目前在美、日、中等国临床广泛应用的就有洛伐汀(Lovastatin)、辛伐他汀(Simvastatin)、普伐他汀(Pravastatin)、氟伐他汀(fluvastatin)、阿伐他汀(atovastatin)、西立伐他汀(cerivastatin)、匹伐他汀(pitavastatin)、瑞舒伐他汀(rosuvastatin)等药物 [52]。
3.3. 胆汁酸受体(FXR)
法尼酯衍生物X受体(FXR)是一种胆汁酸受体,在肝和肠中高表达并且在胆汁酸代谢和胆固醇代谢中发挥重要作用。鹅去氧胆酸和其它胆汁酸是FXR天然配体。FXR在调节肝脏甘油三酯水平方面也很重要,有望成为降低胆固醇,治疗某些心血管病及肝脏疾病的治疗靶点 [53] [54] [55]。FXR部分激动剂有咖啡豆(Cafestol) [56] 、鹅去氧胆酸(Chenodeoxycholic acid)、胆甾酸(Obeticholic acid)、非那明(Fexaramine)。FXR激动剂可作为非酒精性脂肪肝病的治疗药物 [57]。
3.4. 脂肪酸合成酶
脂肪酸合成酶(fatty acid synthase, FAS)是催化脂肪酸合成的并起重要作用的限速酶,肥胖就是由于它过度的表达,导致了生物体内脂肪的沉积。然而当脂肪酸合成酶的活力较低时,脂肪酸不能及时的催化生产,而是在逐渐在细胞内堆积,通过对下丘脑进行作用,从而来控制食物的摄入量。可见要达到降低食欲的目的,可以通过抑制FAS的活性来减少脂肪的合成,人体脂肪组织脂肪酸合成酶基因的表达与肥胖和2型糖尿病有关。哺乳动物FAS是一种很有前途的药物靶标:它可以通过抑制与FAS功能相关的化合物来使动物减轻体重,具有研究多种疾病的潜在价值 [58] [59] [60]。
FAS抑制剂的研究,对于抑制内源性脂肪酸的生物合成从而有效控制肥胖和癌症的发生、发展有着重要的意义,已发现FAS小分子抑制剂浅蓝菌素、C75能导致多种癌细胞的凋亡,但由于低效、毒性高、性能不稳定等因素限制了其临床应用,因此开发高效、低毒、性能稳定的FAS抑制剂成为当前该领域研究的热点,为肥胖和癌症提供新的有效治疗方法 [61]。
3.5. 前蛋白转化酶枯草溶菌酶
前蛋白转化酶枯草溶菌酶PCSK9 (proprotein convertase subtilisin/kexin type9)通过与LDLR(肝细胞表面低密度脂蛋白受体)结合,降解LDLR,从而升高血液中LDL-C水平,阻断PCSK9与LDLR的结合,已经成为血脂异常一个新的治疗靶点。研究发现,PCSK9过多表达可引起广泛动脉粥样硬化,而PCSK9缺乏则可降低心血管疾病风险,因此认为PCSK9参与了动脉粥样硬化的过程。因此,抑制PCSK9浓度水平,成为降低动脉粥样硬化性心血管疾病的一个新靶点 [62] [63] [64]。
2007年,第一个PCSK9抑制剂诞生,后续出现不同途径的PCSK9抑制剂,主要包括:1) 抑制PCSK9的合成:反义寡核苷酸(antisense oligonucleotides, ASOs)、小分子干扰RNA (small interfering RNA, siRNA);2) 抑制PCSK9与LDL-R结合:单克隆抗体、小分子多肽。目前已进入临床研究阶段的PCSK9抑制剂见表7 [65]。
Table 7. PCSK9 inhibitors in R&D
表7. 研发阶段的PCSK9抑制剂
3.6. 角鲨烯合成酶
角鲨烯合成酶(squalene synthetase, SQS)是体内胆固醇合成、代谢途径中的一种重要酶,它能催化两分子法呢基二磷酸(FPP)经还原性二聚作用,产生中间体前角鲨烯二磷酸,在NADPH(还原型辅酶Ⅱ或还原型烟酰胺腺嘌呤二核苷酸磷酸)的还原作用下,前角鲨烯二磷酸生成角鲨烯,后者再经进一步合成生成胆固醇。抑制的SQS活性,就能减少角鲨烯的生成量,从而降低胆固醇的水平。SQS抑制剂不仅能降低血浆胆固醇水平,还可以降低血浆甘油三酯水平。所以,SQS抑制剂的研究也已成为降血脂药物研发的一个重要方向 [66]。
角鲨烯合成酶抑制剂分为Zaragozic Acid类、Viridiofungin类、Schizostatin、Bisabosqual类、CJ-15,183及相关化合物等(见图2) [66]。
 Zaragozic acid A
Zaragozic acid A
 Zaragozic acid B
Zaragozic acid B
 Zaragozic acid C
Zaragozic acid C
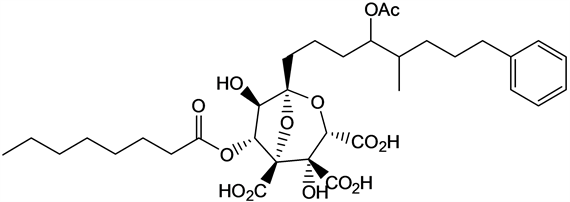 Zaragozic acid D
Zaragozic acid D
 Zaragozic acid F (Zaragozic Acid类化合物的典型结构)
Zaragozic acid F (Zaragozic Acid类化合物的典型结构)

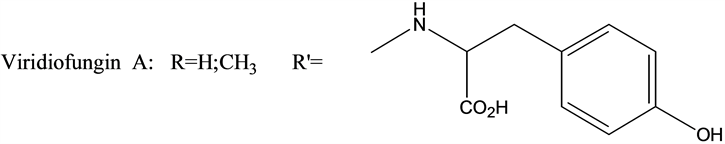

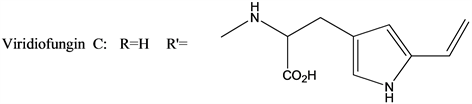 (Viridiofungin类化合物的典型结构)
(Viridiofungin类化合物的典型结构)
 (schizostatin的化学结构)
(schizostatin的化学结构)

 (Bisabosquals的结构)
(Bisabosquals的结构)
 (CJ-15,183、CJ-13,981及CJ-13,982的结构)
(CJ-15,183、CJ-13,981及CJ-13,982的结构)
Figure 2. Molecular structure of several classes of squalene synthetase inhibitors
图2. 几类角鲨烯合成酶抑制剂的分子结构
3.7. 过氧化物酶体增殖激活受体α
过氧化物酶体增殖激活受体PPAR (Peroxisome proliferators-actived receptor)受体主要有三个亚型,即α、β、δ。这三种亚型有不同的生物学作用。PPARα被激活后能降低血浆中低密度脂蛋白和甘油三酯水平,升高高密度脂蛋白水平;还能调节炎症反应,改善胰岛素的耐受性。PPARα激动剂的分类和PPARα激动剂的分子结构式,见表8、图3 [67]。
Table 8. PPARα Agonist classification
表8. PPARα激动剂分类
 天然植物中提取的PPARα激动剂
天然植物中提取的PPARα激动剂
 苯基并杂环类PPARα激动剂
苯基并杂环类PPARα激动剂
 酰脲类PPARα激动剂
酰脲类PPARα激动剂
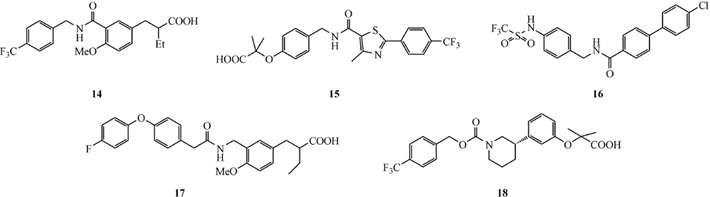 酰胺类PPARα激动剂
酰胺类PPARα激动剂
 苯基噁唑(噻唑)类PPARα激动剂
苯基噁唑(噻唑)类PPARα激动剂
 其他类PPARα激动剂
其他类PPARα激动剂
Figure 3. Molecular structure of PPARα agonist
图3. PPARα激动剂的分子结构
3.8. 过氧化物酶体增殖激活受体γ
过氧化物酶体增殖激活受体γ(PPARγ),目前,已知PPARγ在脂肪细胞生成、糖脂代谢以及炎症等多种生物学过程中发挥关键作用。PPARγ的激动剂可以改善机体的胰岛素抵抗,降低血糖水平,减少炎症的发生,因而被广泛应用于糖尿病、高血脂、动脉硬化、肥胖、癌症和氧化应激等疾病的临床治疗中。鉴于PPARγ在脂肪生成、肥胖症及其相关疾病中的重要作用,PPARγ基因一直是脂肪生物学和医学研究的热点 [68] [69]。
PPARα/γ双重激动剂可以改善胰岛素抵抗、调节体内糖代谢、脂代谢、调控脂肪细胞的分化,有望成为治疗2型糖尿病的新型药物。研究资料表明,副作用小且药效良好的PPARα/γ双重激动剂有:TZD18、Netoglitazone (MCC-555, RWJ-241947)、Naveglitazar (LY519818)、Chiglitazar (CS038) [70]。
3.9. 肝X受体
哺乳动物体内存在两种LXR(Liver X Receptor)亚型:LXRα和LXRβ,二者在DNA结合区和配体结合区约有80%的氨基酸同源。LXR是肝脏中丰富表达的一种核受体。天然LXR甾体类激动剂化合物1、化合物2,由于它们不会引起甘油三酯升高等相应副作用,因而有望成为预防和治疗动脉粥样硬化的潜在候选药物。合成型LXR激动剂化合物3、化合物4对LXRβ的选择性和亲和力较好。因为同时激活LXRα和LXRβ亚型容易形成脂肪肝,LXRβ选择性激动剂可避免此风险。因此,化合物3、化合物4是治疗动脉粥样硬化的潜在候选药物。此外,胆汁酸类胆固醇化合物5也是强效的LXR激动剂 [71]。LXR的主要作用机制是调节胆固醇的逆向转运及其排泄。而在胆固醇吸收、合成方面作用较弱或作用极微。LXR通过调节胆固醇外流、胆汁酸转化、脂肪酸合成及几种脂质转运蛋白从而维持脂质的动态平衡。LXR除调节脂质代谢外,还有调节糖的代谢、抗炎、抗免疫等方面的作用 [72] [73]。

1 2

3 4

5
4. 小结与展望
本文叙述了9个降糖药物的作用靶点及9个降脂药物的作用靶点及相关典型药物。在今后的科研中可在目前已发现的并具有良好的降糖、降脂作用的药物的基础上,依据药物设计原理改造并修饰已有的药物或依据受体的天然配体设计新药。运用分子对接及分子动力学模拟等方法,继续探究药物与靶向受体的结合效果,为药物的深入研发奠定理论基础。
文章引用
李 博,胡文祥. 降糖降脂药物研究进展
Progress in Hypoglycemic and Lipid-Lowering Drugs[J]. 比较化学, 2018, 02(04): 142-160. https://doi.org/10.12677/CC.2018.24017
参考文献
- 1. 朱芳莹, 董正伟, 朱文渊, 柳志强. 糖尿病治疗药物及其合成进展[J]. 发酵科技通讯, 2016, 45(3): 175-181.
- 2. 晏黎, 田静. 降糖药物的研究进展[J]. 中国医药导报, 2008, 5(2): 22-23.
- 3. 胡文祥, 等. 一种降糖及降脂药物组合物及其制备方法[P]. 中国发明专利, ZL200710179390.3.
- 4. 韩谢, 邵开元, 胡文祥. 小檗碱结构修饰的研究进展[J]. 武汉工程大学学报, 2018, 40(1): 1-7.
- 5. 韩谢, 邵开元, 胡文祥. 微波辐射合成9-氧-2-溴乙基小檗碱工艺研究[J]. 微波化学, 2017, 1(1): 8-14.
- 6. Xie, H., Shao, K.Y. and Hu, W.X. (2018) Synthesis of 9-Substituted Berberine Derivatives with Microwave Irradiation. Chemical Research in Chinese Universities, 1, 1-7.
- 7. Hamid, A., Yusoff, M.M., Liu, M., et al. (2015) α-Glucosidase and α-Amylase Inhibitory Constituents of Tinospora crispa: Isolation and Chemical Profile Confirmation by Ultra-High Performance Liquid Chromatography-Quadrupole Time-of- Flight/Mass Spectrometry. Journal of Functional Foods, 16, 74-80. https://doi.org/10.1016/j.jff.2015.04.011
- 8. Zhang, J., Tang, H., Deng, R., et al. (2015) Berberine Suppresses Adipocyte Differentiation via Decreasing CREB Transcriptional Activity. Plos One, 10, e0125667. https://doi.org/10.1371/journal.pone.0125667
- 9. Choi, Y.J., Lee, K.Y., Jung, S.H., et al. (2017) Activation of AMPK by Berberine Induces Hepatic Lipid Accumulation by Upregulation of Fatty Acid Translocase CD36 in Mice. Toxicology & Applied Pharmacology, 316, 74-82. https://doi.org/10.1016/j.taap.2016.12.019
- 10. Sun, Y., Xia, M., Yan, H., et al. (2018) Berberine Attenuates He-patic Steatosis and Enhances Energy Expenditure in Mice by Inducing Autophagy and Fibroblast Growth Factor 21. British Journal of Pharmacology, 175, 374-387. https://doi.org/10.1111/bph.14079
- 11. Kietzmann, T. and Ganjam, G.K. (2005) Glucokinase: Old Enzyme, New Target. Expert Opinion on Therapeutic Patents, 6, 705-713. https://doi.org/10.1517/13543776.15.6.705
- 12. 郑宏庭, 邓华聪. 葡萄糖激酶与糖尿病的研究进展[J]. 中国临床康复, 2004, 8(27): 5960-5961.
- 13. 黄卉, 申竹芳. 以葡萄糖激酶为靶点的抗糖尿病新药研究[J]. 中国药理学通报, 2006, 22(9): 1025-1029.
- 14. 刘永贵, 解学星, 吴疆, 沈雪砚, 陈常青. 治疗2型糖尿病的新靶点药物研究进展[J]. 现代药物与临床, 2015, 30(2): 222-227.
- 15. Du, X.H.H., Xiong, R.J., Dransfield, Y., Park, P., Kohn, J., Pattaropong, T.J., Lai, V., Fu, S.J., Jiao, Z., Chow, X.Y., Jin, D., Davda, L., Veniant, J., Anderson, M.M., Baer, D.A., Bencsik, B.R., Boyd, J.R., Chicarelli, S.A., Mohr, M.J., Wang, P.J., Condroski, B., De Wolf, K.R., Conn, W.E., Yang, M.T.T., Aicher, J., Medina, T.D., Coward, J.C., Houze, P. and Jonathan, B. (2014) C5-Alkyl-2-Methylurea-Substituted Pyridines as a New Class of Glucokinase Activators. ACS Medicinal Chemistry Letters, 12, 1284-1289. https://doi.org/10.1021/ml500341w
- 16. Lee, P.K., Hyun, B.M., Han, K.H., Lee, T., Choi, D.H. and Ho, H. (2015) Design and Synthesis of Acetylenyl Benzamide Derivatives as Novel Glucokinase Activators for the Treatment of T2DM. ACS Medicinal Chemistry Letters, 3, 296-301. https://doi.org/10.1021/ml5004712
- 17. 孟梅. 胰高血糖素与2型糖尿病[J]. 国际病理科学与临床杂志, 2013, 33(2): 160-164.
- 18. 李柯, 吴霞, 邵加庆. 基于胰高血糖素的糖尿病治疗药物研究进展[J]. 国际内分泌代谢杂志, 2018, 38(1): 15-18.
- 19. Young, A. (2005) Inhibition of Glucagon Secretion. Advances in Pharmacology, 52, 151-171. https://doi.org/10.1016/S1054-3589(05)52008-8
- 20. Lin, S., et al. (2015) A Novel Series of Inda-zole-/Indole-Based Glucagon Receptor Antagonists. Bioorganic and Medicinal Chemistry Letters, 19, 4143-4147. https://doi.org/10.1016/j.bmcl.2015.08.015
- 21. Hasegawa, F., et al. (2014) Discovery of Fu-ran-2-Carbohydrazides as Orally Active Glucagon Receptor Antagonists. Bioorganic and Medicinal Chemistry Letters, 17, 4266-4270. https://doi.org/10.1016/j.bmcl.2014.07.025
- 22. De Mong, D., Dai, X., Hwa, J., Miller, M., Lin, S.-I., Kang, L., Stamford, A., Greenlee, W., Yu, W., Wong, M., Lavey, B., Kozlowski, J., Zhou, G., Yang, D.-Y., Patel, B., Soriano, A., Zhai, Y., Sondey, C., Zhang, H., Lachowicz, J., Grotz, D., Cox, K., Morrison, R., Andreani, T. and Cao, Y. (2014) The Discovery of N-((2H-Tetrazol-5-yl)methyl)-4-((R)- 1-((5r,8R)-8-(tert-butyl)-3-(3,5-dichlorophenyl)-2-oxo-1,4-diazaspiro[4.5]dec-3-en-1-yl)-4,4-dimethylpentyl)benzamide (SCH 900822): A Potent and Selective Glucagon Receptor Antagonist. Journal of Medicinal Chemistry, 6, 2601-2610. https://doi.org/10.1021/jm401858f
- 23. 刘浩淼, 胡晓雯, 周金培, 张惠斌. G蛋白偶联受体119激动剂及其构效关系的研究进展[J]. 中国药科大学学报, 2013, 44(1): 11-19.
- 24. Ohishi, T. and Yoshida, S. (2012) The Thera-peutic Potential of GPR119 Agonists for Type 2 Diabetes. Expert Opinion on Investigational Drugs, 3, 321-328. https://doi.org/10.1517/13543784.2012.657797
- 25. Shigeru, Y. (2011) GPR119 Agonist for the Treatment of Type 2 Diabetes. 第一届内分泌与代谢大会论文集, 169.
- 26. 姜思屹, 于萍, 李强. G蛋白偶联受体119激动剂在2型糖尿病治疗中的应用[J]. 中国医药, 2015, 10(10): 1566-1568.
- 27. Gillespie, P., Goodnow Jr., R.A., Saha, G., Bose, G., Moulik, K., Zwingelstein, C., Myers, M., Conde-Knape, K., Pietranico-Cole, et al. (2014) Discovery of py-razolo[3,4-d]pyrimidine Derivatives as GPR119 Agonists. Bioorganic and Medicinal Chemistry Letters, 3, 949-953. https://doi.org/10.1016/j.bmcl.2013.12.063
- 28. Jeon, M.-K., Lee, K.M., Kim, I.H., Jang, Y.K., Kang, S.K., Lee, J.M., Jung, K.-Y., Kumar, J.A., Rhee, S.D., Jung, W.H., Song, J.S., Bae, M.A., Kim, K.R. and Ahn, J.H. (2014) Syn-thesis and Biological Evaluation of Thienopyrimidine Derivatives as GPR119 Agonists. Bioorganic and Medicinal Chemistry Letters, 17, 4281-4285. https://doi.org/10.1016/j.bmcl.2014.07.020
- 29. Wang, Y., Yu, M., Zhu, J., Zhang, J., Kayser, F., Medina, J.C., Siegler, K., Conn, M., Shan, B., Grillo, M.P., Liu, J. and Coward, P. (2014) Discovery and Optimization of 5-(2-((1-(phenylsulfonyl)-1,2,3,4-tetrahydroquinolin-7-yl)oxy)pyridine 4-yl)-1,2,4-oxadiazoles as Novel GPR119 Ago-nists. Bioorganic and Medicinal Chemistry Letters, 4, 1133-1137. https://doi.org/10.1016/j.bmcl.2013.12.127
- 30. Yu, M., Zhang, J., Wang, Y., Zhu, J., Kayser, F., Medina, J.C., Siegler, K., Conn, M., Shan, B., Grillo, M.P., Coward, P. and Liu, J. (2014) Discovery and Optimization of N-(3-(1,3-dioxo-2,3-dihydro-1H-pyrrolo[3,4-c] pyridin-4-yloxy) phenyl) Benzenesulfonamides as Novel GPR119 Agonists. Bioorganic and Medicinal Chemistry Letters, 1, 156-160. https://doi.org/10.1016/j.bmcl.2013.11.053
- 31. Buzard, D.J., Kim, S.H., Lehmann, J., Han, S., Calderon, I., Wong, A., Kawasaki, A., Narayanan, S., Bhat, R., Gharbaoui, T., Lopez, L., Yue, D., Whelan, K., Al-Shamma, H., Unett, D.J., Shu, H.H., Tung, S.F., Chang, S., Chuang, C.F., Morgan, M., Sadeque, A., Chu, Z.L., Leonard, J.N. and Jones, R.M. (2014) Discovery and Optimization of 5-fluoro- 4,6-dialkoxypyrimidine GPR119 Agonists. Bioorganic and Medicinal Chemistry Letters, 17, 4332-4335. https://doi.org/10.1016/j.bmcl.2014.06.071
- 32. 俞牧雨, 殷峻. 腺苷酸活化蛋白激酶调节糖脂代谢的研究进展[J]. 山东医药, 2017, 57(1): 109-111.
- 33. Zhang, B.B., Zhou, G. and Li, C. (2009) AMPK: An Emerging Drug Target for Diabetes and the Metabolic Syndrome. Cell Metabolism, 9, 407-416. https://doi.org/10.1016/j.cmet.2009.03.012
- 34. Hardie, D.G. (2008) AMPK: A Key Regulator of Energy Balance in the Single Cell and the Whole Organism. International Journal of Obesity, 32, S7-S12. https://doi.org/10.1038/ijo.2008.116
- 35. 胡淑国. 腺苷酸活化蛋白激酶与胰岛素抵抗[J]. 国际内科学杂志, 2009, 36(3): 137-140.
- 36. 王淼, 邹大进. 蛋白酪氨酸磷酸酶-1B与2型糖尿病[J]. 国际内分泌代谢杂志, 2006, 26(6): 388-390.
- 37. 丁玉静, 刘德敏. 蛋白酪氨酸磷酸酶-1B及其抑制剂与2型糖尿病[J]. 国际内分泌代谢杂志, 2006, 26(s): 6-8.
- 38. Yip, S.-C., Saha, S. and Chernoff, J. (2010) PTP1B: A Double Agent in Metabolism and Onco-genesis. Trends in Biochemical Sciences, 35, 442-449. https://doi.org/10.1016/j.tibs.2010.03.004
- 39. Xie, C., Sun, Y., Pan, C.Y., Tang, L.M. and Guan, L.P. (2014) 2,4-Dihydroxy-chalcone Derivatives as Novel Potent Cell Division Cycle 25B Phosphatase Inhibitors and Protein Tyrosine Phosphatase 1B Inhibitors. Die Pharmazie, 4, 257-262.
- 40. Liu, J., Deng, X., Jin, Y., Xu, B., Liu, W., et al. (2015) Design, Synthesis, and Biological Evaluation of 2-Substituted Ethenesulfonic Acid Ester Derivatives as Selective PTP1B Inhibitors. Die Pharmazie, 7, 446-451.
- 41. 张晶晶, 蔡金艳, 郭姣. 11β-羟基类固醇脱氢酶1在2型糖尿病中的研究进展[J]. 食品与药品, 2017, 19(2): 142-146.
- 42. Webster, S.P. and Pallin, T.D. (2007) 11β-Hydroxysteroid Dehydrogenase Type 1 Inhibitors as Thera-peutic Agents. Expert Opinion on Therapeutic Patents, 12, 1407-1422. https://doi.org/10.1517/13543776.17.12.1407
- 43. 王薪宁, 徐斌, 周金培, 张惠斌. 基于新靶点的抗糖尿病药物研究进展[J]. 中国医科大学学报, 2015, 46(2): 141-152.
- 44. 张莉静, 卢曦. 基于PPAR抗糖尿病药物的研究进展[J]. 国外医学药学分册, 2004, 31(5): 287-291.
- 45. Lu, J.X., Lei, L., Huan, Y., Li, Y.Q., Zhang, L.J., Shen, Z.F., Hu, W.X. and Feng, Z.Q. (2014) Design, Synthesis, and Activity Evaluatian of GK/PPARγ Dual-Daret-Directed Ligands as Hypoglycemic Agents. ChemMedChem, 9, 922-927. https://doi.org/10.1002/cmdc.201400009
- 46. 王海勇. 降血脂药物的研究进展[J]. 国外医学药学分册, 2004, 31(3): 160-166.
- 47. 李慧, 景贤, 邓晓兰, 欧阳冬生. 调脂药物的作用靶点[J]. 中南大学学报(医学版), 2013, 38(1): 101-108.
- 48. He, K., Kou, S., Zou, Z., et al. (2016) Hypolipidemic Effects of Alkaloids from Rhizoma Coptidis in Diet-Induced Hyperlipidemic Hamsters. Planta Medica, 82, 690-697. https://doi.org/10.1055/s-0035-1568261
- 49. Thomson, D.M. and Winder, W.W. (2009) AMP-Activated Protein Kinase Control of Fat Metabolism in Skeletal Muscle. Acta Physiologica, 196, 147-154. https://doi.org/10.1111/j.1748-1716.2009.01973.x
- 50. Wang, C., Huang, Z., Wang, L., et al. (2014) Application of Berberine Derivative in Preparation of Drug for Treating Atherosclerosis. CN 103804374 A.
- 51. 张艳平, 许崇利, 刘霞, 高飞, 武蓉, 欧阳红生, 逄大新, 许崇波. 胆固醇转运蛋白NPC1L1的研究进展[J]. 中国动物检疫, 2012, 29(6): 76-79.
- 52. 何菊英, 唐敏, 藏雷. 羟甲基戊二酰辅酶A还原酶抑制剂抗高脂血症的研究进展[J]. 中国临床康复, 2003, 7(30): 4130-4131.
- 53. 李烁, 张志文, 管又飞. 胆汁酸受体FXR的研究进展[J]. 生理科学进展, 2003, 34(4): 314-318.
- 54. Forman, B.M., Goode, E., Chen, J., Oro, A.E., Bradley, D.J., Perlmann, T., Noonan, D.J., Burka, L.T., McMorris, T., Lamph, W.W., Evans, R.M. and Weinberger, C. (1995) Identification of a Nuclear Receptor That Is Activated by Farnesol Metabolites. Cell, 81, 687-693. https://doi.org/10.1016/0092-8674(95)90530-8
- 55. Jiao, Y., Lu, Y. and Li, X.Y. (2015) Farnesoid X Receptor: A Master Regulator of Hepatic Triglyceride and Glucose Homeostasis. Acta Pharmacologica Sinica, 36, 44-50. https://doi.org/10.1038/aps.2014.116
- 56. Ricketts, M.L., Boekschoten, M.V., Kreeft, A.J., Hooiveld, G.J., Moen, C.J., Müller, M., Frants, R.R., Kasanmoentalib, S., Post, S.M., Princen, H.M., Porter, J.G., Katan, M.B., Hofker, M.H. and Moore, D.D. (2007) The Cholesterol-Raising Factor from Coffee Beans, Cafestol, as an Agonist Ligand for the Farnesoid and Pregnane X Receptors. Molecular Endocrinology, 21, 1603-1616. https://doi.org/10.1210/me.2007-0133
- 57. Carr, R.M. and Reid, A.E. (2015) FXR Agonists as Therapeutic Agents for Non-Alcoholic Fatty Liver Disease. Current Atherosclerosis Reports, 3, 14. https://doi.org/10.1007/s11883-015-0500-2
- 58. 张芮, 陈斯钰. 脂肪酸合成酶(FAS)的研究综述[J]. 农村经济与科技, 2018, 29(13): 103-105.
- 59. Liang, Y., Ma, X.F., Hao, J., Hou, Y.F. and Tian, W.X. (2007) Natural Inhibitors of Fatty Acid Synthase from Fruits. Proceeding of the International Enzyme Engineering Conference, 87.
- 60. Tian, W., Ma, X., Zhang, S., Sun, Y. and Li, B. (2011) Fatty Acid Synthase Inhibitors from Plants and Their Potential Application in the Prevention of Metabolic Syndrome. Clinical Oncology and Cancer Research, 1, 1-9.
- 61. 敏霞, 巫冠中. 脂肪酸合成酶与疾病[J]. 亚太传统医药, 2012, 8(9): 210-212.
- 62. 王世鹏. 前蛋白转化酶枯草溶菌素9与心血管疾病关系研究进展[J]. 心血管病学进展, 2016, 37(6): 685-688.
- 63. Gouni-Berthold, I. and Berthold Heiner, K. (2014) PCSK9 Antibodies for the Treatment of Hypercholesterolemia. Nutrients, 12, 5517-5533.
- 64. Verbeek, R.S., Hovingh, R.M. and Kees, G. (2015) PCSK9 Inhibitors: Novel Therapeutic Agents for the Treatment of Hypercholesterolemia. European Journal of Pharmacology, No. A, 38-47.
- 65. 曾雨薇. 前蛋白转化酶枯草溶菌素9抑制剂的研究进展[J]. 心血管病学进展, 2015, 36(3): 341-345.
- 66. 顾觉奋, 牛佳. 角鲨烯合成酶抑制剂降血脂作用及机制的研究进展[J]. 药学进展, 2007, 31(1): 15-20.
- 67. 胡越, 许军, 刘燕华, 王增涛, 黄黎敏, 方加龙, 王晨. PPARα激动剂降血脂作用的研究进展[J]. 中国药科大学学报, 2016, 47(1): 118-124.
- 68. 崔婷婷, 邢天宇, 褚衍凯, 李辉, 王宁. PPARγ在脂肪生成中的遗传和表观遗传调控[J]. 遗传, 2017, 39(11): 1066-1077.
- 69. Peymani, M., Ghaedi, K., Irani, S. and Nasr-Esfahani, M.H. (2016) Peroxisome Proliferator-Activated Receptor γ Activity Is Required for Appropriate Cardiomyocyte Differentiation. Cell Journal (Yakhteh), 18, 221-228.
- 70. 荆丹清, 尹士男, 母义明. PPARα/γ双重激动剂研究进展[J]. 中国药物应用与监测, 2007(4): 46-49.
- 71. 梁瑜, 郭长彬, 张冲, 侯振更. 肝脏X受体激动剂研究进展[J]. 药学学报, 2012, 47(4): 427-433.
- 72. 顾文娟, 李江. 肝脏X受体研究在心血管疾病中的应用展望[J]. 医学与哲学(临床决策论坛版), 2010, 31(1): 52-54.
- 73. 刘接卿. 三种中药的化学成分及其活性研究[J]. 博士学位论文, 北京: 首都师范大学, 2009.
