Hans Journal of Nanotechnology
Vol.
12
No.
04
(
2022
), Article ID:
57453
,
12
pages
10.12677/NAT.2022.124026
电化学方法制备H2O2催化剂研究进展
韩涛1,胡俊华1,郭子琪2,孙君沣2,姚奕江2,叶浩楠3,王晓霞1*
1华东理工大学机械与动力工程学院,上海
2华东理工大学材料科学与工程学院,上海
3华东理工大学化工学院,上海
收稿日期:2022年8月23日;录用日期:2022年10月22日;发布日期:2022年11月2日

摘要
通过氧的电化学反应制备H2O2,是一种绿色环保、易于实现的新能源利用途径,近年来受到了广泛的关注,有望成为目前工业蒽醌法的替代工艺。有效实现这一工艺的根本条件是使用低成本、高效的电催化剂,这也是决定H2O2生产效率的关键因素。本文综述了近几年通过2电子氧化还原路径直接制备H2O2所取得的进展,着重介绍了催化剂结构、组成与催化活性之间的依赖关系以及相关催化机制,最后,对2电子氧还原催化剂的发展给出了展望。
关键词
过氧化氢,2电子氧还原反应,催化剂,电化学

Recent Advances in Catalysts for Electrochemical Methods of H2O2 Production
Tao Han1, Junhua Hu1, Ziqi Guo2, Junfeng Sun2, Yijiang Yao2, Haonan Ye3, Xiaoxia Wang1*
1School of Mechanical and Power Engineering, East China University of Science and Technology, Shanghai
2School of Materials Science and Engineering, East China University of Science and Technology, Shanghai
3School of Chemical Engineering, East China University of Science and Technology, Shanghai
Received: Aug. 23rd, 2022; accepted: Oct. 22nd, 2022; published: Nov. 2nd, 2022

ABSTRACT
Direct electrochemical production of hydrogen peroxide (H2O2) through two-electron oxygen electrochemistry is an effective way to utilization of green energy, which has attracted widespread attention in recent years and has emerged as the most promising method to replace the traditional anthraquinone process. The practical application of these processes depends greatly on the low-cost and highly effective catalysts, which are also the determining factor for the H2O2 production efficiency. Herein, we review the advances in electrochemical H2O2 production through a two-electron Oxygen Reduction Reaction (ORR). We focus on the relationship between the unique structure-, component-, and composition-dependent electrochemical performance, as well as the related catalytic mechanisms. Finally, the perspective on the development of the catalysts for two-electron ORR is provided.
Keywords:Hydrogen Peroxide (H2O2), Two-Electron Oxygen Reduction Reaction, Catalysts, Electrochemistry

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 概述
过氧化氢是一种重要的化学物质,被列为世界上100种最重要的化学品之一,在工业、医药和环境保护等领域有着广泛的应用 [1]。它的氧化能力强于氯、二氧化氯和高锰酸钾,在环境中自然分解成水和氧气,不产生有害化学残留物,因此,比其它氧化剂更安全、绿色环保。截至2020年,我国过氧化氢的产能为1460万吨/年,预测2025年中国过氧化氢需求量将达2379万吨,其重要性不言而喻 [2]。
目前,H2O2的主要生产途径是通过烷基蒽醌在有机溶剂中与H2发生氢化反应后,再与空气或氧气进行逆流氧化来间接制造,即蒽醌法 [3]。蒽醌法是生产H2O2最广泛的工艺,尽管该工艺适合大规模生产,但是它并不“绿色”,需要进行杂质分离和浓缩,这是一个高能耗的过程。此外,H2O2的不稳定性也对运输造成了一定安全隐患,使运输、存储成本增高。另一种途径是由氢气和氧气通过催化工艺直接合成,该途径可连续分散生产H2O2。但是,H2O2的选择性和产率通常很低,并且H2和O2的混合易爆特性所涉及的安全问题进一步阻碍它的实际应用 [4] [5]。基于上述缺点,人们越来越关注开发直接、高效和经济的H2O2生产方法。
电化学方法制备过氧化氢具有操作简单、绿色环保、可分散式制取的特点,吸引了广泛的关注。更重要的是,电化学产生双氧水的装置可以与可再生能源系统,如风能、太阳能联动使用,由可再生能源提供电能实现氧的电化学过程,产生双氧水,这一系统特别适用于风能、太阳能富集的偏远地区,从而解决过氧化氢存储、运输问题。尽管电化学方法具有许多优点,但电化学反应动力学非常复杂,通常水氧化或氧还原都具有较高的过电位,这严重限制了H2O2电合成的能量效率。因此,寻找具有高反应活性和高选择性的电产H2O2催化剂具有十分重要的意义。
本文综述了电化学生产H2O2的研究进展,主要侧重于电化学2电子氧还原方法制备H2O2过程中涉及到的电催化材料,总结了电催化剂的结构、组成等对催化性能的影响。
2. 电化学氧还原制备H2O2催化剂
电化学氧还原是一个多电子反应过程,氧气可以通过4电子路径被还原生成水,或通过2电子路径生成双氧水。同时,生成的双氧水可以继续获得2个电子被还原成水,或者失去2个电子被氧化成氧气。由于氧还原过程涉及复杂的多电子转移,使催化剂的选用变得十分重要,是电化学制备过氧化氢的关键材料之一。早期对于2电子氧还原催化制备过氧化氢的研究主要集中在碱性条件,但是碱性条件下的双氧水不稳定、易分解、应用领域较少。由于酸性/中性条件下过氧化氢具有更高的稳定性和更广泛的应用范围,近几年,对于酸性条件及中性条件下电化学制备过氧化氢的研究更广泛地开展起来。到目前为止,已有不同种类的2电子氧还原催化剂被研究、报道,主要包括贵金属及其合金催化剂、碳基催化剂和过渡金属化合物催化剂。
2.1. 贵金属催化剂
在各类催化材料中,贵金属(铂、金、钯、铱、钌等)一直表现着最优的催化活性。Marković等人在Au (111)和Au (110)面首次观察到2电子氧还原过程,各种Au纳米结构随后被广泛研究 [6] [7]。已有报道指出含有25个原子的金团簇在碱性条件下电化学制备双氧水的选择性可达90%,这来源于氧分子与金团簇之间有效的电子转移 [8]。由于金基催化剂的催化活性和选择性很大程度上与晶面取向及其表面能相关,因而通过调节Au纳米颗粒的结构,Amal等人构造出含有高指数晶面的Au-Ni和Au-Ni-Pt核壳结构纳米棒,对于电化学制备H2O2具有很高的选择性和活性。在过电位为150 mV的条件下,Au-Ni-Pt核壳结构纳米棒的选择性和活性分别达到95%和1.01 mA/cm2 [9]。最近,Xia和Shao课题组报道了一种具有核壳结构的Pd@AuxPd1−x纳米立方体电催化剂,研究表明,壳的厚度和元素组成对催化剂选择性有很大影响。如图1所示,通过调控{100}晶面和表面Au/Pd的比例,当壳结构组成为Au0.95Pd0.05时,其最高H2O2选择性可达93%~100% (电位区间0.4~0.7 V) [10]。
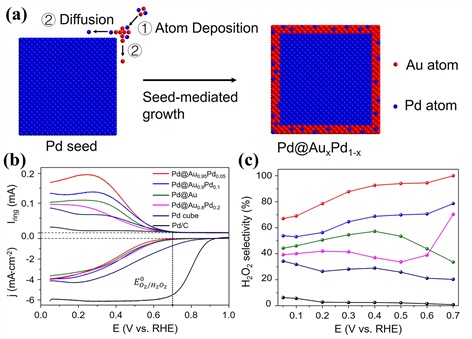
Figure 1. (a) Preparative schematic illustration of Pd@AuxPd1−x nanocubes; (b) Polarization curves and (c) H2O2 selectivity of Pd@Au0.95Pd0.05 nanocubes [10]
图1. (a) 制备Pd@AuxPd1−x纳米立方体催化剂的示意图;(b) Pd@Au0.95Pd0.05的极化曲线及(c) 对应的H2O2选择性 [10]
与金相比,贵金属铂和钯具有更强的氧气吸附性能,常被用作4电子氧还原的催化材料,因而铂和钯通常要与对氧气有弱吸附性能的材料形成合金使用,以提高其作为2电子氧还原催化剂的选择性。对于Au-Pd合金催化剂的研究表明,合金中Au与Pd的含量对生成H2O2的选择性有很大影响。通过密度泛函理论计算(DFT)及实验结果推断,催化剂颗粒表面被金原子包围的钯原子在很大程度上阻碍了O-O键的断裂,因而表现出更高的H2O2选择性 [11] [12]。
对于2电子氧还原,其反应过程涉及到一种中间产物即为*OOH,理想的催化剂应对O2分子有较强的吸附能力,同时,对于*OOH易于脱附。理论计算与实验结果都表明,当铂纳米颗粒与Hg形成合金后,其选择性和活性均有提高,在0.2~0.4 V范围内,生产H2O2的效率可达96%,电流密度可达3 mA/cm2,基本上达到2电子氧还原的极限电流密度。而且,该催化剂在反应条件下表现出了很好的稳定性,在氧气饱和的HClO4溶液中循环8000次后,没有发生催化活性的下降 [13]。基于与Hg合金化后铂催化剂性能的提高,Stephens等人系统地研究了Hg修饰的不同贵金属对H2O2生产的性能影响。结果表明,Pd-Hg催化活性最高,在0.35~0.55 V的电位区间,其H2O2选择性达到95%。在50 mV的过电位条件下,Pd-Hg/C的质量活性是Pt-Hg/C的5倍,同时,该催化剂经过8000次循环后仍保持很好的活性 [14]。
单原子催化剂,即具有催化活性的金属以原子状态分散,最近在催化领域引起了广泛的关注。由于其单原子的分散状态,可以使催化剂原子利用率达到最大,同时,提高了其质量比活性。Von Weber等人研究了沉积在氧化铱上Ptn纳米团簇的ORR性能,发现H2O2选择性随着团簇尺寸的增加而减小,当Pt原子数为1时选择性最大 [15]。据此,Lee等人制备了负载在TiN上的铂单原子催化剂(Pt/TiN),载体上的N空位在很大程度上起到了稳定铂原子的作用。当铂的质量百分含量为0.35 wt%时,表现出最高的H2O2选择性 [16]。他们又将单原子铂负载在TiC载体上(Pt/TiC),表现出比Pt/TiN更高的选择性、活性和稳定性 [17]。
碳材料也可以作为单原子铂催化剂的载体,但由于碳载体与金属原子之间的相互作用较弱,需要对其进行表面修饰。最近,Choi等人研究发现大量硫掺杂的ZIF衍生碳可以有效地稳定原子分散的铂,使其载量达到5 wt%。这种铂单原子负载在含硫碳基体上的催化剂(Pt/HSC)具有较高的H2O2选择性,避免H2O2的进一步分解或还原,其选择性可达96%。Joo等人采用SiO2保护层包覆在碳载贵金属前驱体外面,在热活化制备单原子催化剂的过程中,SiO2层在单原子催化剂制备过程中起到了稳定铂单原子的作用,有利于形成高含量的单原子贵金属催化剂 [18]。Li等人还报道了负载于中空CuSx载体上的单原子铂催化剂,其铂的百分含量达到24.8 at%,这一催化剂在酸性条件下,0.05~0.7 V的电位区间中,2电子ORR的选择性达到92%~96% [19]。
大量研究已经阐明了*OOH中间体与催化剂表面的结合以及O-O键的保留对2电子反应路径具有重要作用。理想情况下,催化剂表面应对O2分子具有强烈吸附性,以诱导*OOH的形成,同时,表现出对*OOH的弱吸附,以便于其从催化剂表面脱附生成H2O2。*OOH中间体在催化剂表面停留时间过长会导致*OOH解离(O-O键断裂),从而形成*O和*OH中间产物并最终还原为H2O。氧分子在贵金属催化剂表面的吸附方式主要有两种,为“单址”吸附和“双址”吸附,单址吸附即只有一个氧原子与铂表面接触,这种方式有助于*OOH中间体从催化剂表面脱附,从而提高H2O2的生成率;而双址吸附时两个氧原子都被吸附在催化剂表面,中间体不容易脱附,从而O-O键更易断裂生成水。对贵金属的掺杂合金、表面包覆等都是为了创造更多的单址吸附位点,进而提高H2O2的选择性。
2.2. 碳基材料
2.2.1. 多孔碳材料
由于贵金属材料的稀缺性,因而价格高昂,使电化学制备H2O2成本增加,并不适用于大规模生产。而碳材料具有导电性好、比表面积高、结构容易调控等诸多优点,近年来被广泛用作新能源材料,其作为电化学催化剂也表现出一定的优势。研究表明,碳材料的表面缺陷和孔隙率(孔径和孔密度)在很大程度上影响质量传输,同时,为H2O2的产生提供额外的活性位点 [20]。
碳基材料的孔结构对于2电子ORR催化剂活性和选择性的影响也被广泛地研究。与微孔结构相比,介孔结构提供了更高的电化学活性、选择性和稳定性。通过协同光谱表征和密度泛函理论计算,sp2型缺陷,特别是具有非六边形环的双空位缺陷,被确定为双电子途径的活性位点 [21]。这一概念被广泛应用到实际的H2O2生产 [22] [23],具有周期性六边形阵列结构的石墨有序介孔碳(GOMC)催化剂表现出比基底平面碳纳米管(CNT)高约28倍的质量比活性,H2O2选择性超过90%。借助Tafel曲线和电化学阻抗谱分析,发现通过边缘富集和氧化设计可以提高异质电子转移速度,较快的异质外层电子转移能力(O2活化)是决定H2O2生成速度的重要步骤。
近年来,金属有机骨架(MOFs)结构,一种由金属离子和有机配体组成的晶体配位化合物,作为新型功能化碳材料的优良前驱体受到了广泛的关注 [24]。金属有机骨架具有结构多样、易于功能化、高比表面积和良好的可设计性等优点。使用各种类型的MOFs作为前驱体,可以调控产物的多孔结构和成分,使其呈现出一种多层次的孔结构,具有丰富的微孔、中孔和大孔。这种结构使所得催化剂具有更多的催化活性位点并暴露在电解液中,同时,丰富的三维孔道结构使反应物扩散路径变短,有利于传质过程。Liu等人提出了用MOF材料作为前驱体制备分级多孔炭(HPC)作为电化学生产H2O2的催化剂 [25],如图2所示。实验结果表明,水热处理24 h,并且在H2气氛下1000℃热处理的HPC-24,在pH值为1~4条件下,选择性可达95%;在中性条件下,选择性大于80%。HPC电合成H2O2的优异性能是由于其sp3-C含量高、缺陷多、比表面积大、传质快。

Figure 2. (a) Preparative schematic illustration of HPC; (b) Morphology and (c) H2O2 selectivity of HPC-H24 heat-treated at 1000℃ in H2 atmosphere [25]
图2. (a) 制备HPC的示意图;(b) 在H2气氛下1000℃热处理的HPC-H24的形貌及(c) H2O2选择性 [25]
多孔碳材料的结构特点使其具有很多缺陷结构,已有研究表明缺陷结构可以调控碳材料的电子结构,从而提高其氧还原活性。基于对氧还原中间产物OH*和OOH*的吸附能的理论计算,碳材料中不同的缺陷结构与吸附能之间呈现“火山型”线性关系,当催化剂表面对氧分子吸附能低时,有利于2电子过程,但此时具有较大的过电位。对于碳材料的缺陷结构,大部分表现出较弱的氧吸附性能,基于理论计算结果,介孔和微孔碳中的sp2杂化碳综合表现出很好的H2O2选择性和活性。
2.2.2. 多孔碳材料
在碳表面进行含氧官能团功能化也可以提高H2O2生产的性能,通过氧功能化可以改善O2在水溶液中的缓慢传质,从而增强催化剂表面的亲水性,为H2O2生产的电催化剂设计提供了一种有前途的策略 [26]。最近,Cui等人报道了通过表面氧化处理碳纳米管来提高其催化生产H2O2的性能。如图3所示,与未氧化的碳纳米管(CNT)相比,氧化碳纳米管(O-CNTs)在碱性和中性介质中的过电位显著降低,选择性提高到约90% [27]。各种表征结果表明,C=O和C-O官能团的存在对提高H2O2生成性能起着关键作用,H2O2生成的活性和选择性与氧含量呈正相关,进一步说明了氧官能团的重要性。此外,通过DFT计算,发现基面和边缘上的醚位(-COC)以及羧基位(-COOM)对H2O2生产表现出高活性。
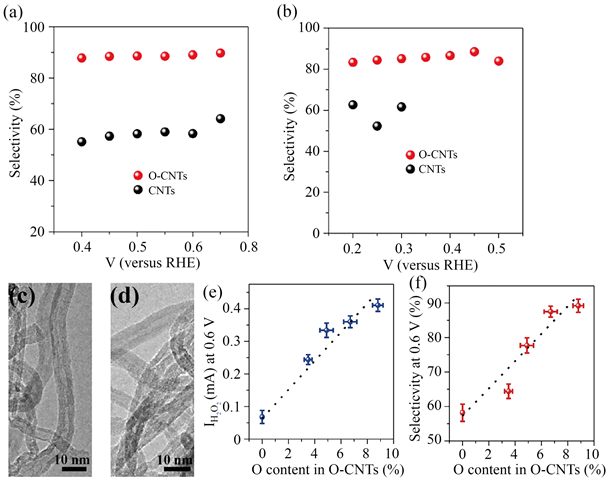
Figure 3. (a), (b) Transmission electron microscopy images of CNTs before (a) and after oxidation (b); (c), (d) Plots of H2O2 current (c) and selectivity (d) at 0.6 V as a function of oxygen content for O-CNTs with various oxidation times; (e), (f) Calculated selectivity of CNTs and O-CNTs at various potentials at 0.1 M KOH (e) and 0.1 M PBS (f) [27]
图3. (a),(b) CNTs氧化前(a)后(b)的透射电子显微镜图;(c),(d) 0.6 V下的H2O2电流(c)和选择性(d)随不同氧化时间的O-CNTs的氧含量变化的曲线图;(e),(f) CNTs和O-CNTs在0.1 M KOH (e)和0.1 M PBS (f)中的不同电压下的选择性 [27]
与此类似,Xia等人通过硝酸氧化的方法制备了一种用于双电子氧还原的功能化炭黑,得到表面氧含量分别为7.33%、10.19%和11.62%的氧化炭黑 [28]。其中,CB-10 (氧含量为10%) H2O2选择性最大,约为98%,起始电位为0.438 V,提供0.1 mA∙cm−2 H2O2生成电流。在中性和碱性溶液中,催化剂具有宽的电位窗口以提供高的H2O2选择性(>90%)。上述研究表明,表面氧基官能化对于提升2电子生成H2O2的选择性和催化活性是一种简单有效的方法。
氧化石墨烯基材料在基面和平面边缘都含有不同的氧官能团,有望在制备H2O2方面表现出良好的性能 [29]。最近,McCloskey展示了一种高效的轻度还原石墨烯电催化剂(F-mrGO),在600℃下,石墨烯氧化物经过轻度的退火还原,在碱性介质中,其选择性可达100%,在0.45 V下稳定性可超过15 h,表现出了优异的电催化生产H2O2的性能 [30]。对于不同含氧官能团功能化的碳材料,理论计算结果表明,-OH官能团对于氧还原反应的促进作用并不大,而不同位置的C-O-C结构对于2电子ORR选择性均有很大的提高。同时,处于椅型边缘的羧基官能团(-COOM),在2电子氧还原过程中的过电位仅0.06 V,具有很好的H2O2选择性。
2.2.3. 多孔碳材料
在碳基体中掺杂异质原子不但会产生缺陷,而且会引起周围碳原子电子结构的变化,从而引入更多的活性中心,显著提高生成H2O2的活性和选择性,已成为电催化领域的研究热点 [31]。Sun等人研究了氮掺杂介孔碳材料中氮的相对表面含量对H2O2选择性的影响,结果表明H2O2选择性随氮含量的变化遵循火山趋势 [32],如图4所示。通过原位XPS观察了氮掺杂物质在ORR过程中的不同作用,其中,吡啶-N在酸性介质中有助于催化2电子ORR过程,而石墨-N在中性和碱性条件下是2电子ORR过程的活性位点。基于掺杂碳材料结构表征结果,介孔掺氮碳材料中氮含量的增加、氮结合碳的自由基性质以及吡咯氮的位点是进行2电子氧还原的有利因素。
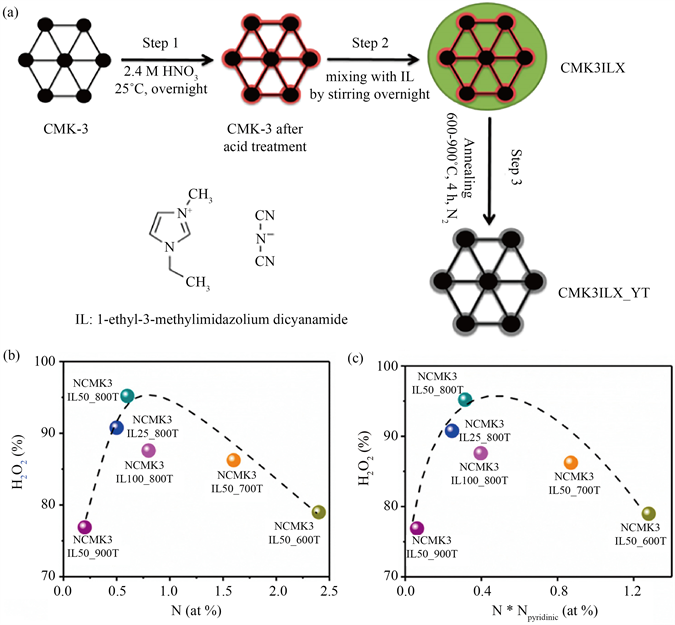
Figure 4. (a) Preparative schematic illustration of nitrogen-doped mesoporous carbon catalysts; (b), (c) Relationship between the H2O2 selectivity at 0.1 V and (b) total amount of doped nitrogen (N), (c) amount of pyridinic nitrogen (N*Npyridinic) of different catalysts [32]
图4. (a) 制备氮掺杂介孔碳催化剂的示意图;(b),(c) 不同催化剂在0.1 V下的H2O2选择性与掺杂氮的总量(b)和吡啶氮的量(c)之间的关系 [32]
Liu等人制备了一种新型的氮掺杂石墨烯和碳纳米管复合材料(N-G@CNT),首先,通过水热法将碳纳米管桥接到石墨烯片上,再将氮原子掺杂到石墨烯和碳纳米管中,石墨烯片之间碳纳米管的存在可以增加基底间距以及电化学活性表面积,此外,它可以弥合缺陷,并以这种方式促进电子转移 [33]。在制备的催化剂中,吡啶氮和吡咯氮的比例很大,并且N-G@CNT对于生产H2O2的ORR活性显著提高,表现在更大的电流密度和更正的起始电位。N掺杂碳的H2O2选择性主要来源于N原子的掺入引起碳骨架的电子结构变化,具有较高电负性的氮原子能够激活π电子并引起电荷重分布,从而改变碳材料对*OOH中间体的吸附性能,因此,有利于H2O2的生成。氮原子周围的碳原子具有更高的正电荷密度,这种行为可以改变O2在催化剂上的吸附模式,从而保留O-O键,提高H2O2的选择性。
同样的,电负性最高的氟也可以调节碳的电子结构,在掺杂到碳材料中时产生催化活性中心。Zhao等人报道了基于铝基MOF材料衍生的氟掺杂分层多孔碳(FPC)电催化生产H2O2的研究。电化学测试和DFT计算表明,将氟原子结合到碳框架中可以促进O2的吸附和活性中间体*OOH的脱附,从而显著提高生成H2O2的活性和选择性 [34]。
过渡金属原子配位掺杂的碳纳米结构同样是一种有效的H2O2电催化剂 [35] [36]。这类过渡金属配合物材料,如钴基卟啉以及酞菁等,它们具有独特的几何构型,由配位原子(氮、碳等)包围活性过渡金属原子,形成过渡金属–氮–碳(M-N-C)结构。基于DFT计算,Sun等人发现在Co-卟啉和Co-酞菁表面,O2可以完全还原为H2O2,而不会进一步分解 [37]。Yamanaka等人同样发现,通过使用Co-卟啉衍生物作为阴极电催化剂,在室温下以42%的电流效率可以获得13.5 wt%的H2O2溶液 [38]。这些结果充分说明,M-N-C结构可有效地抑制O-O键的解离,并且反应中间体*OOH在这些催化剂表面的结合既不太强也不太弱,证明这种催化材料对H2O2的生成十分有利,从而实现2电子生产H2O2的高选择性。
过渡金属配合物中含有的M-N结构引起了学者们的关注,他们设计制备了含有单原子金属–氮–碳的催化剂,并对过渡金属-氮结构所连接的原子进行微观调控,系统的对比了不同过渡金属情况下,作为2电子氧还原催化剂的选择性和活性 [39] [40]。实验结果表明,Co-N-C结构具有较高的H2O2选择性,而Fe、Mn、Ni、Cu掺杂的碳材料虽然也表现出一定的H2O2选择性,但其活性较低。Li等人提出了一种协同策略来制备具有高ORR反应性和高H2O2选择性的电催化剂 [41]。他们基于钴配位卟啉,合成了一种Co-Nx-C结构和氧官能团共修饰的碳基电催化剂(Co-POC-O)。进一步的机理研究表明,Co-Nx-C原子中心是氧还原的活性中心,氧官能团促进了两电子路径的选择性。所以Co-Nx-C位点和氧官能团分别有助于H2O2电生成的反应性和选择性。在最新的研究中,Jiang等人指出Fe-C-O是一种高效的H2O2催化剂在碱性和中性条件下,H2O2选择性均超过95%。为了更好地研究结构-活性关系,通过协同实验方法和DFT计算,Fe-C-O被确定为2电子ORR的活性中心,这与众所周知的Fe-N-C的4电子ORR途径形成鲜明对比 [42]。这些工作不仅为设计性能优异的H2O2电合成催化剂提供了一种新的策略,而且为电化学绿色、可持续地合成H2O2提供了多活性中心,合理组合的原则。
2.3. 过渡金属/碳复合材料
过渡金属基材料,主要包括碳负载过渡金属和金属化合物纳米颗粒,在2电子反应途径中表现出良好的催化活性和生产H2O2的高选择性。Shen等人报道了在碱性条件下使用氮掺杂碳负载镍催化剂直接连续电合成过氧化氢 [43]。作者以不同比例的咪唑基沸石骨架-8 (ZIF-8)和 为前驱体,在流动氩气条件下,900℃一步热解合成了一系列Ni-N-C催化剂。在0.40~0.77 V电压范围内,Ni/C-4对H2O2的选择性均大于95%,对应的电子转移数n小于2.1。通过设计理论模型和DFT计算,阐明了镍纳米粒子在H2O2电合成中的作用:Ni团簇增强了Ni-N-C与含氧物质(O*和OH*)之间的相互作用,因此,Ni纳米团簇阻碍了H2O2进一步还原,从而提高了2电子还原为H2O2的选择性。在空气饱和的0.1 M KOH中,过渡金属基Ni-N-C电催化剂在稳定的过氧化氢生产速率下,法拉第效率始终超过95%,它的可持续、高效、安全的生产工艺是迈向双氧水连续生产的重要一步。
最近,对于金属氧化物催化剂的研究也开展起来。Zhang等人报道了一种负载在多孔碳纳米片上的非晶NiOx结构,如图5所示,其对2电子氧还原的起始电位为0.76 V,H2O2的选择性达到91% [44]。NiOx无定型的结构使Ni-OH键具有合适的结合能,对其高选择性有很大作用。理论计算结果表明,*OOH中间体更倾向于端点吸附在NiOx-C上,从而促进了2电子ORR过程。Sun及其同事发现,当Fe3O4纳米颗粒被支撑在石墨烯或Printex 6L碳上时,Fe3O4/石墨烯和Fe3O4/Printex 6L碳复合材料可以在碱性条件下有效地生成H2O2,并且选择性高达60% [45],这些复合材料性能的提高可归因于Fe3O4和碳载体之间的协同效应。另外,过渡金属硒化物因具有可调控的晶体结构、元素分布和电子结构,近年来在电化学能量转换过程中表现出一定的催化性能。Jiang等最近合成了一系列纳米尺寸的Cu, Ni, Co硒化物,对其结构研究发现硒化物表面金属原子被硒原子包围,去除了纯金属表面能够吸附氧的空位点,因而硒合金表面对于氧的吸附非常弱,这在一定程度上提高了H2O2的选择性 [46]。通过精确调控Cu-Se的组成使化合物电子结构发生改变,更有助于O2向H2O2的转化,其中,立方状的纳米Cu7.2Se4在较高的电位范围内表现出90%的H2O2选择性。
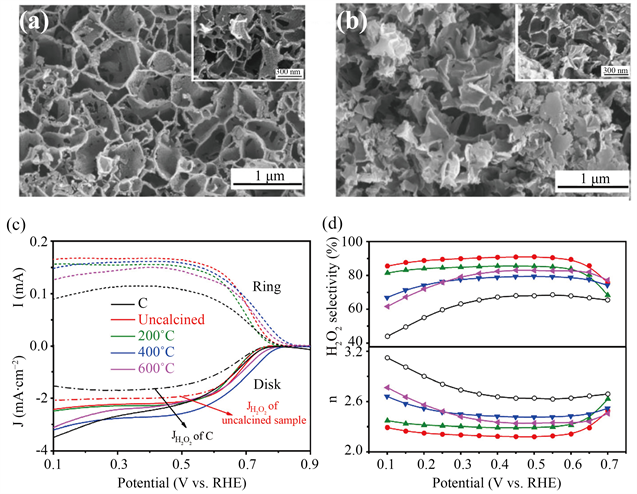
Figure 5. (a) SEM images of pristine carbon nanosheets pyrolyzed at 800˚C; (b) SEM images of NiOx-C; (c), (d) Polarization curves of C and NiOx-C calcined at different temperatures (c) and H2O2 selectivity and electron transfer number (d) [44]
图5. (a) 在800℃下热解的原始碳纳米片的扫描电子显微镜图像;(b) NiOx-C的扫描电子显微镜图像;(c) (d) 不同温度焙烧的C和NiOx-C的的极化曲线(c)及对应的H2O2选择性和电子转移数(d) [44]
3. 结论与展望
与目前工业蒽醌法相比,氧的2电子还原反应为H2O2的绿色制备提供了有效的备选技术,非常适用于偏远地区低浓度双氧水的生产。虽然在过去几十年中,对于氧还原反应的研究取得了很大的进展,但对于2电子ORR反应的催化剂,仍然存在一些亟待解决的问题,进一步提高催化剂的选择性、活性和寿命,是实现分散式电产双氧水实际应用的关键所在。对于不同种类的催化剂,他们面临的挑战可以总结为以下几个方面。
1) 贵金属仍被认为是2电子氧还原最有效的催化剂,但其稀缺性使价格昂贵,不适合大规模应用。因此,开发低成本、高效稳定的非贵金属催化剂以实现量产需求。
2) 尽管大量的研究表明碳基催化剂可以应用于电化学生产H2O2,但是对于其结构组成与催化活性之间的关系仍需进一步深入探讨。特别是针对于单原子催化剂,其催化活性中心结构组成、催化机制尚不明确,2电子氧还原活性位点仍存在争议。
3) 对于过渡金属化合物催化剂的研发,精确调控其元素组成、微观结构是进一步提高催化活性和选择性的重要途径。
基金项目
上海市自然科学基金探索类(19ZR1472600),华东理工大学大学生创新创业训练计划(X202110251215)。
文章引用
韩 涛,胡俊华,郭子琪,孙君沣,姚奕江,叶浩楠,王晓霞. 电化学方法制备H2O2催化剂研究进展
Recent Advances in Catalysts for Electrochemical Methods of H2O2 Production[J]. 纳米技术, 2022, 12(04): 258-269. https://doi.org/10.12677/NAT.2022.124026
参考文献
- 1. Myers, R.L. (2007) The 100 Most Important Chemical Compounds, a Reference Guide. Greenwood Publishing Group, Westport.
- 2. 潘智勇, 邢定峰. 过氧化氢市场现状和技术发展趋势[J]. 现代化工, 2021, 41(4): 11-16.
- 3. 胡长诚. 国内外蒽醌法制过氧化氢工艺技术研发新进展[J]. 化学推进剂与高分子材料, 2017, 15(2): 1-13+47.
- 4. Edwards, J.K., Freakley, S.J., Carley, A.F., Kiely, C.J. and Hutchings, G.J. (2014) Strategies for De-signing Supported Gold-Palladium Bimetallic Catalysts for the Direct Synthesis of Hydrogen Peroxide. Accounts of Chemical Research, 43, 845-854. https://doi.org/10.1021/ar400177c
- 5. Yi, Y., Wang, L., Li, G. and Guo, H. (2016) A Review on Research Progress in the Direct Synthesis of Hydrogen Peroxide from Hydrogen and Oxygen: No-ble-Metal Catalytic Method, Fuel-Cell Method and Plasma Method. Catalysis Science & Technology, 6, 1593-1610. https://doi.org/10.1039/C5CY01567G
- 6. Adžić, R.R., Tripković, A.V. and Marković, N.M. (1983) Structural Effects in Electrocatalysis: Oxidation of Formic Acid and Oxygen Reduction on Single-Crystal Electrodes and the Effects of Foreign Metal Adatoms. Journal of Electroanalytical Chemistry and Interfacial Electrochemistry, 150, 79-88. https://doi.org/10.1016/S0022-0728(83)80192-2
- 7. Jirkovský, J.S., Halasa, M. and Schiffrin, D.J. (2010) Kinet-ics of Electrocatalytic Reduction of Oxygen and Hydrogen Peroxide on Dispersed Gold Nanoparticles. Physical Chemis-try Chemical Physics, 12, 8042-8053. https://doi.org/10.1039/c002416c
- 8. Lu, Y., Jiang, Y., Gao, X. and Chen, W. (2014) Charge State-Dependent Catalytic Activity of [Au25(Sc12h25)18] Nanoclusters for the Two-Electron Reduction of Dioxygen to Hydrogen Per-oxide. Chemical Communications, 50, 8464-8467. https://doi.org/10.1039/C4CC01841A
- 9. Zheng, Z., Ng, Y.H., Wang, D.-W. and Amal, R. (2016) Epitaxial Growth of Au-Pt-Ni Nanorods for Direct High Selectivity H2O2 Production. Advanced Materials, 28, 9949-9955. https://doi.org/10.1002/adma.201603662
- 10. Xia, Y., Zhang, Y., Lyu, Z., Zitao, C., Zhu, S., Shi, Y., Chen, R., Xie, M., Yao, Y., Chi, M. and Shao, M. (2021) Maximizing the Catalytic Performance of Pd@Auxpd1−x Nanocubes in H2O2 Production by Reducing Shell Thickness to Increase Compositional Stability. Angewandte Chemie, 133, 19795-19799. https://doi.org/10.1002/ange.202105137
- 11. Pizzutilo, E., Kasian, O., Choi, C.H., Cherevko, S., Hutchings, G.J., Mayrhofer, K.J.J. and Freakley, S.J. (2017) Electrocatalytic Synthesis of Hydrogen Peroxide on Au-Pd Nanoparticles: From Fundamentals to Continuous Production. Chemical Physics Letters, 683, 436-442. https://doi.org/10.1016/j.cplett.2017.01.071
- 12. Jirkovský, J.S., Panas, I., Ahlberg, E., Halasa, M., Romani, S. and Schiffrin, D.J. (2011) Single Atom Hot-Spots at Au-Pd Nanoalloys for Electrocatalytic H2O2 Production. Journal of the American Chemical Society, 133, 19432-19441. https://doi.org/10.1021/ja206477z
- 13. Siahrostami, S., Verdaguer-Casadevall, A., Karamad, M., Deiana, D., Malacrida, P., Wickman, B., Escudero-Escribano, M., Paoli, E.A., Frydendal, R., Hansen, T.W., Chorkendorff, I., Ste-phens, I.E.L. and Rossmeisl, J. (2013) Enabling Direct H2O2 Production through Rational Electrocatalyst Design. Nature Materials, 12, 1137-1143. https://doi.org/10.1038/nmat3795
- 14. Deiana, D., Verdaguer-Casadevall, A., Malacrida, P., Stephens, I.E.L., Chorkendorff, I., Wagner, J.B. and Hansen, T.W. (2015) Determination of Core-Shell Structures in Pd-Hg Nanoparticles by STEM-EDX. ChemCatChem, 7, 3748-3752. https://doi.org/10.1002/cctc.201500791
- 15. Von Weber, A. and Anderson, S.L. (2016) Electrocatalysis by Mass-Selected Ptn Clusters. Accounts of Chemical Research, 49, 2632-2639. https://doi.org/10.1021/acs.accounts.6b00387
- 16. Yang, S., Kim, J., Tak, Y.J., Soon, A. and Lee, H. (2016) Sin-gle-Atom Catalyst of Platinum Supported on Titanium Nitride for Selective Electrochemical Reactions. Angewandte Chemie International Edition, 55, 2058-2062. https://doi.org/10.1002/anie.201509241
- 17. Yang, S., Tak, Y.J., Kim, J., Soon, A. and Lee, H. (2017) Support Effects in Single-Atom Platinum Catalysts for Electrochemical Oxygen Reduction. ACS Catalysis, 7, 1301-1307. https://doi.org/10.1021/acscatal.6b02899
- 18. Kim, J.H., Shin, D., Lee, J., Baek, D.S., Shin, T.J., Kim, Y.-T., Jeong, H.Y., Kwak, J.H., Kim, H. and Joo, S.H. (2020) A General Strategy to Atomically Dispersed Precious Metal Catalysts for Unravelling Their Catalytic Trends for Oxygen Reduction Reaction. ACS Nano, 14, 1990-2001. https://doi.org/10.1021/acsnano.9b08494
- 19. Shen, R., Chen, W., Peng, Q., Lu, S., Zheng, L., Cao, X., Wang, Y., Zhu, W., Zhang, J., Zhuang, Z., Chen, C., Wang, D. and Li, Y. (2019) High-Concentration Single Atomic Pt Sites on Hollow CuSx for Selective O2 Reduction to H2O2 in Acid Solution. Chem, 5, 2099-2110. https://doi.org/10.1016/j.chempr.2019.04.024
- 20. Ichiro, Y., Takeshi, O., Sakae, T. and Kiyoshi, O. (2003) Direct and Continuous Production of Hydrogen Peroxide with 93% Selectivity Using a Fuel-Cell System. Angewandte Chemie International Edition, 42, 3653-3655. https://doi.org/10.1002/anie.200351343
- 21. Chen, S., Chen, Z., Siahrostami, S., Kim, T.R. and Bao, Z. (2017) Defective Carbon-Based Materials for the Electrochemical Synthesis of Hydrogen Peroxide. ACS Sustainable Chemistry & Engineering, 6, 311-317. https://doi.org/10.1021/acssuschemeng.7b02517
- 22. Sa, Y.J., Kim, J.H. and Joo, S.H. (2019) Active Edge-Site-Rich Carbon Nanocatalysts with Enhanced Electron Transfer for Efficient Electrochemical Hydrogen Peroxide Production. Angewandte Chemie International Edition, 131, 1112-1117. https://doi.org/10.1002/ange.201812435
- 23. Chen, Z., Chen, S., Siahrostami, S., Chakthranont, P., Hahn, C., Nordlund, D., Dimosthenis, S., Nørskov, J. K., Bao, Z. and Jaramillo, T.F. (2017) Development of a Reactor with Car-bon Catalysts for Modular-Scale, Low-Cost Electrochemical Generation of H2O2. Reaction Chemistry & Engineering, 2, 239-245. https://doi.org/10.1039/C6RE00195E
- 24. Wang, C., Kim, J., Tang, J., Kim, M., Lim, H., Malgras, V., You, J., Xu, Q., Li, J. and Yamauchi, Y. (2020) New Strategies for Novel MOF-Derived Carbon Materials Based on Nanoarchitectures. Chem, 6, 19-40. https://doi.org/10.1016/j.chempr.2019.09.005
- 25. Liu, Y., Quan, X., Fan, X., Wang, H. and Chen, S. (2015) High-Yield Electrosynthesis of Hydrogen Peroxide from Oxygen Reduction by Hierarchically Porous Carbon. An-gewandte Chemie International Edition, 54, 6837-6841. https://doi.org/10.1002/anie.201502396
- 26. Zhang, J., Xu, Z., Mai, W., Min, C., Zhou, B., Shan, M., Li, Y., Yang, C., Wang, Z. and Qian, X. (2013) Improved Hydrophilicity, Permeability, Antifouling and Mechanical Performance of PVDF Composite Ultrafiltration Membranes Tailored by Oxidized Low-Dimensional Carbon Nanomaterials. Journal of Materials Chemistry A, 1, 3101-3111. https://doi.org/10.1039/c2ta01415g
- 27. Lu, Z., Chen, G., Siahrostami, S., Chen, Z. and Cui, Y. (2018) High-Efficiency Oxygen Reduction to Hydrogen Peroxide Catalysed by Oxidized Carbon Materials. Nature Catalysis, 1, 156-162. https://doi.org/10.1038/s41929-017-0017-x
- 28. Xia, C., Xia, Y., Zhu, P., Fan, L. and Wang, H. (2019) Direct Electrosynthesis of Pure Aqueous H2O2 Solutions up to 20% by Weight Using a Solid Electrolyte. Science, 366, 226-231. https://doi.org/10.1126/science.aay1844
- 29. Xiao, X., Wang, T., Bai, J., Li, F., Ma, T. and Chen, Y. (2018) En-hancing the Selectivity of H2O2 Electrogeneration by Steric Hindrance Effect. ACS Applied Materials & Interfaces, 10, 42534-42541. https://doi.org/10.1021/acsami.8b17283
- 30. Kim, H.W., Ross, M.B., Kornienko, N., Zhang, L., Guo, J., Yang, P. and Mccloskey, B.D. (2018) Efficient Hydrogen Peroxide Generation Using Reduced Graphene Oxide-Based Oxygen Reduction Electrocatalysts. Nature Catalysis, 1, 282-290. https://doi.org/10.1038/s41929-018-0044-2
- 31. Fellinger, T.-P., Hasché, F., Strasser, P. and Antonietti, M. (2012) Mesoporous Nitrogen-Doped Carbon for the Electrocatalytic Synthesis of Hydrogen Peroxide. Journal of the American Chemical Society, 134, 4072-4075. https://doi.org/10.1021/ja300038p
- 32. Sun, Y., Sinev, I., Ju, W., Bergmann, A., Dresp, S.R., KüHl, S., SpöRi, C., Schmies, H., Wang, H. and Bernsmeier, D. (2018) Efficient Electrochemical Hydrogen Peroxide Production from Mo-lecular Oxygen on Nitrogen-Doped Mesoporous Carbon Catalysts. ACS Catalysis, 8, 2844-2856. https://doi.org/10.1021/acscatal.7b03464
- 33. Liu, T., Wang, K., Song, S., Brouzgou, A., Tsiakaras, P. and Wang, Y. (2016) New Electro-Fenton Gas Diffusion Cathode Based on Nitrogen-Doped Graphene@Carbon Nanotube Compo-site Materials. Electrochimica Acta, 194, 228-238. https://doi.org/10.1016/j.electacta.2015.12.185
- 34. Zhao, K., Su, Y., Quan, X., Liu, Y., Chen, S. and Yu, H. (2018) Enhanced H2O2 Production by Selective Electrochemical Reduction of O2 on Fluorine-Doped Hierarchically Porous Carbon. Journal of Catalysis, 357, 118-126. https://doi.org/10.1016/j.jcat.2017.11.008
- 35. Monte-PéRez, I.S., Kundu, S., Chandra, A., Craigo, K.E., Chernev, P., Kuhlmann, U., Dau, H., Hildebrandt, P., Greco, C. and Van Stappen, C. (2017) Temperature Dependence of the Cat-alytic Two- versus Four-Electron Reduction of Dioxygen by a Hexanuclear Cobalt Complex. Journal of the American Chemical Society, 139, 15033-15042. https://doi.org/10.1021/jacs.7b07127
- 36. Siahrostami, S., Björketun, M.E., Strasser, P., Greeley, J. and Rossmeisl, J. (2013) Tandem Cathode for Proton Exchange Membrane Fuel Cells. Physical Chemistry Chemical Physics, 15, 9326-9334. https://doi.org/10.1039/c3cp51479j
- 37. Sun, S., Jiang, N. and Xia, D. (2011) Density Functional Theory Study of the Oxygen Reduction Reaction on Metalloporphyrins and Metallophthalocyanines. The Journal of Physical Chemistry C, 115, 9511-9517. https://doi.org/10.1021/jp101036j
- 38. Murayama, T., Tazawa, S., Takenaka, S. and Yamanaka, I. (2011) Catalytic Neutral Hydrogen Peroxide Synthesis from O2 and H2 by PEMFC Fuel. Catalysis Today, 164, 163-168. https://doi.org/10.1016/j.cattod.2010.10.102
- 39. Gao, J., Yang, H.B., Huang, X., Hung, S.-F., Cai, W., Jia, C., Miao, S., Chen, H.M., Yang, X., Huang, Y., Zhang, T. and Liu, B. (2020) Enabling Direct H2O2 Production in Acidic Media through Rational Design of Transition Metal Single Atom Catalyst. Chem, 6, 658-674. https://doi.org/10.1016/j.chempr.2019.12.008
- 40. Sun, Y., Silvioli, L., Sahraie, N. R., Ju, W., Li, J., Zitolo, A., Li, S., Bagger, A., Arnarson, L., Wang, X., Moeller, T., Bernsmeier, D., Rossmeisl, J., Jaouen, F. and Strasser, P. (2019) Activity-Selectivity Trends in the Electrochemical Production of Hydrogen Peroxide over Single-Site Met-al-Nitrogen-Carbon Catalysts. Journal of the American Chemical Society, 141, 12372-12381. https://doi.org/10.1021/jacs.9b05576
- 41. Li, B.Q., Zhao, C.X., Liu, J.N. and Zhang, Q. (2019) Electrosynthesis of Hydrogen Peroxide Synergistically Catalyzed by Atomic Co-Nx-C Sites and Oxygen Functional Groups in No-ble-Metal-Free Electrocatalysts. Advanced Materials, 31, Article ID: 1808173. https://doi.org/10.1002/adma.201808173
- 42. Jiang, K., Back, S., Akey, A.J., Xia, C., Hu, Y., Liang, W., Schaak, D., Stavitski, E., Nørskov, J.K., Siahrostami, S. and Wang, H. (2019) Highly Selective Oxygen Reduction to Hydrogen Peroxide on Transition Metal Single Atom Coordination. Nature Communications, 10, Article No. 3997. https://doi.org/10.1038/s41467-019-11992-2
- 43. Shen, H., Pan, L., Thomas, T., Wang, J., Guo, X., Zhu, Y., Luo, K., Du, S., Guo, H., Hutchings, G.J., Attfield, J.P. and Yang, M. (2020) Selective and Continuous Electrosynthesis of Hydrogen Peroxide on Nitrogen-Doped Carbon Supported Nickel. Cell Reports Physical Science, 1, Article ID: 100255. https://doi.org/10.1016/j.xcrp.2020.100255
- 44. Wu, Z., Wang, T., Zou, J.-J., Li, Y. and Zhang, C. (2022) Amor-phous Nickel Oxides Supported on Carbon Nanosheets as High-Performance Catalysts for Electrochemical Synthesis of Hydrogen Peroxide. ACS Catalysis, 12, 5911-5920. https://doi.org/10.1021/acscatal.2c01829
- 45. Barros, W.R., Wei, Q., Zhang, G., Sun, S., Lanza, M.R. and Tavares, A.C. (2015) Oxygen Reduction to Hydrogen Peroxide on Fe3O4 Nanoparticles Supported on Printex Carbon and Gra-phene. Electrochimica Acta, 162, 263-270. https://doi.org/10.1016/j.electacta.2015.02.175
- 46. Yuan, Q., Zhao, J., Mok, D.H., Zheng, Z., Ye, Y., Liang, C., Zhou, L., Back, S. and Jiang, K. (2022) Electrochemical Hydrogen Peroxide Synthesis from Selective Oxygen Reduction over Metal Selenide Catalysts. Nano Letters, 22, 1257-1264. https://doi.org/10.1021/acs.nanolett.1c04420
NOTES
*通讯作者。