Advances in Analytical Chemistry
Vol.
12
No.
03
(
2022
), Article ID:
54313
,
7
pages
10.12677/AAC.2022.123023
基于表面等离子共振技术分析蛋白之间结合 活性的方法开发策略
陈莹莹
中国药科大学药学院,江苏 南京
收稿日期:2022年7月11日;录用日期:2022年7月22日;发布日期:2022年8月3日

摘要
表面等离子共振(SPR)技术是一种新型光学分析技术,可以实时、无标记检测分子间相互作用。该技术不仅可以直接反映分子结合的动态过程,还能够得到具体的速率常数及解离常数,被广泛用于分析蛋白之间结合活性。如何高效地完成基于表面等离子共振技术的方法开发及数据分析是研究人员面临的重要问题,本文围绕缓冲液的筛选、固定配体策略的选择、分析物条件的优化、再生条件的筛选等方面,综述了基于SPR技术分析蛋白之间结合活性的方法开发策略。
关键词
表面等离子共振,结合活性,方法开发

Method Development Strategies for Analysis of Binding Activity between Proteins Based on Surface Plasmon Resonance Technology
Yingying Chen
School of Pharmacy, China Pharmaceutical University, Nanjing Jiangsu
Received: Jul. 11th, 2022; accepted: Jul. 22nd, 2022; published: Aug. 3rd, 2022

ABSTRACT
Surface plasmon resonance (SPR) technology is a novel optical analysis technique that enables real-time, label-free detection of intermolecular interactions. This technique can not only directly reflect the dynamic process of molecular binding, but also obtain specific rate constants and dissociation constants, and is widely used to analyze the binding activity between proteins. How to efficiently complete the method development and data analysis based on surface plasmon resonance technology is an important problem faced by researchers. In this paper, the method development strategies for analyzing the binding activity between proteins based on SPR technology were reviewed in terms of buffer screening, selection of immobilized ligand strategies, optimization of analyte conditions, and screening of regeneration conditions.
Keywords:Surface Plasmon Resonance, Binding Activity, Method Development

Copyright © 2022 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
表面等离子共振(Surface Plasmon Resonance, SPR)技术是一种光学检测技术,具有无标记、实时分析、高灵敏度、操作简单便捷等优点,目前已被中国药典(2020版)、美国药典(2016版)和日本药典(2016版)收录 [1]。SPR技术在药物研究领域应用广泛,包括结合活性分析、小分子互作分析、浓度分析、非标曲法浓度分析、热力学分析、指纹图谱对比、免疫原性分析等。其中,SPR技术在分析蛋白之间结合活性方面应用最为广泛,特别是在单克隆抗体研发领域 [2] [3]。与传统的蛋白结合活性检测技术相比,SPR技术具有操作简单、耗时短、灵敏度高等优点,已开始逐步取代传统检测技术酶联免疫吸附检测法 [4] [5] [6]。因此,基于SPR技术分析蛋白之间结合活性的方法开发策略对生物药物开发及质量控制具有重要意义,如何高效地完成基于表面等离子共振技术的方法开发及数据分析是研究人员面临的重要问题,本文对基于SPR技术的方法开发中缓冲液的筛选、固定配体策略的选择、分析物条件的优化、再生条件的筛选等方面进行了综述,期望对基于SPR技术的方法开发提供一些参考。
2. 表面等离子共振技术
表面等离子共振是一种物理光学现象,当光由光密介质射入光疏介质中时,一旦入射角超过临界角,会发生全反射,此时,沿着两种介质的临界面会产生光波,这种光波被称为消逝波 [2]。如图1所示,当光疏介质为介电常数为复数的金属时,消逝波可以激发金属表面的自由电子集体振荡,产生表面等离子体波(Surface Plasmon Wave, SPW) [7]。此时,光波部分能量转移至表面等离子波的能量并消散在金属薄膜中,因此检测到的反射光强度减弱。在一定的条件下,消逝波与表面等离子波产生共振,此时,光波大部分能量转化为表面等离子共振波的能量,检测到的反射光强度大幅减弱,这种现象被称为表面等离子共振,此时的入射角被称为SPR角,入射波长被称为共振波长 [7]。由于共振发生在金属表面,当其他条件确定时,SPR角或共振波长对金属表面介电常数非常敏感,因此,可以通过检测SPR角或共振波长来分析金属表面分子相互作用。
目前,最常用的SPR商业化仪器为Cytiva公司的Biacore系列产品,因此本文以此系列仪器为例介绍方法开发策略。Biacore系列产品的激发结构为Kretscmann、Raether构建的棱镜耦合式,检测方法为角度调制法,采用单色光入射,固定入射光波长,改变入射光角度,检测反射光强度的变化,其结构如图2所示 [8]。入射光通过两极真空管激发,最终信号由电荷耦合元件(Charge Coupled Device, CCD)检测,经由软件程序分析记录响应值变化。
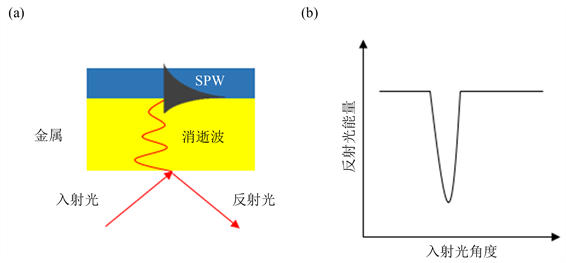
Figure 1. Principle of surface plasmon resonance. (a) Surface plasmon resonance model [7]; (b) Relationship curve of incident light angle and reflected light energy
图1. 表面等离子共振原理图。(a) 表面等离子共振模型 [7];(b) 入射光角度与反射光能量的关系曲线

Figure 2. Structure of angle modulated Kretscmann type SPR sensor
图2. 角度调制型Kretscmann式SPR传感器结构示意图
3. 方法开发策略
根据完整的蛋白之间结合活性实验传感曲线,可将实验步骤分为5个阶段:1) 固定配体(Ligand);2) 分析物(Analyte)与配体结合;3) 分析物与配体解离;4) 芯片再生;5) 数据分析。本文将对各个步骤的方法开发策略进行综述。
3.1. 缓冲液的筛选
通常情况下,蛋白之间结合活性分析实验的缓冲液选择含吐温20的磷酸盐缓冲液或者HBS-EP (配方为0.01 M HEPES,0.15 M NaCl,3 mM EDTA,,0.005% P20)。当实验中非特异性结合值较高时,可通过调整缓冲液pH、盐浓度和表面活性剂的比例有效降低实验中的非特异性结合。因此在方法开发前,需要对缓冲液进行筛选。非特异性结合指分析物与芯片表面的结合,可能由于分析物与芯片表面存在静电作用或者疏水作用 [9]。
静电作用由分析物与芯片表面带相反电荷引起。当分析物的等电点高于缓冲液pH,带正电,而芯片表面带负电,因此相互吸引。通常通过调节缓冲液pH值和盐离子浓度可减少因静电作用引起的非特异性结合,但需要注意pH值和盐浓度可能影响蛋白之间的结合活性。另外,在缓冲液中添加牛血清白蛋白(Bovine Serum Albumin, BSA),既可以减少由静电作用引起的非特异性结合也可以减少由疏水作用引起的非特异性结合。BSA是一种同时具有亲水基团和亲脂基团的球蛋白,等电点约为4.7,小于SPR实验缓冲液pH,带负电,而一般分析物等电点大于缓冲液pH,带正电,因此BSA分子可以聚集在分析物周围,从而保护分析物,减少其与芯片表面的结合。另外,由于BSA存在疏水基团,可以封闭通道表面,减少分析物与通道表面的结合,避免低浓度下分析物的损失,稳定分析物的浓度 [10]。而提高表面活性剂如聚山梨酯20浓度可减少因疏水作用引起的非特异性结合,同样,其可以避免分析物吸附在通道表面,减少分析物的损失,提高分析物的稳定性。
3.2. 固定配体策略的选择
固定配体可通过直接偶联或者间接捕获两种方法实现,其流程如图3所示。在检测结合活性实验中,固定配体策略的选择尤为重要。直接偶联可直接将配体共价偶联于芯片表面,此时在芯片再生时,配体不会从芯片表面解离,常用的直接偶联法为氨基偶联法。在氨基偶联时应注意选择的醋酸钠试剂的pH值应大于3.5且低于待偶联蛋白的等电点,此时芯片表面的羧甲基葡聚糖带负电荷,待偶联蛋白带正电荷,两者之间存在静电作用,可以提高芯片表面的蛋白浓度从而减少配体消耗并提高偶联效率。直接偶联的芯片可以重复使用,但不同配体和偶联条件会导致芯片保存时间和重复实验次数不同。直接将待分析的蛋白偶联至芯片是最简单便捷的方法,也可以节省蛋白用量。但此方法存在比较明显的缺陷,即无法确定偶联的位点和蛋白在芯片上的方向。同时在氨基偶联时一些较为敏感的蛋白活性可能会受到影响 [11]。因此对于受位阻影响较大的蛋白相互作用以及较为敏感的蛋白分子不建议选择直接偶联法 [12]。
间接偶联指先将捕获分子共价偶联于芯片表面,之后通过捕获分子与配体之间的亲和作用捕获配体,此时芯片再生时,配体会与捕获分子解离,下次循环开始时,需要重新进样配体。间接捕获可以确定配体在芯片上的方向,并且对蛋白活性影响较小 [13]。根据实验需求的不同可选择不同的捕获分子,如Protein A、protein A/G、Protein G、Protein L、抗组氨酸抗体、抗小鼠IgG抗体、人Fab结合因子等,固定捕获分子一般采用氨基偶联方法 [9] [14] [15] [16]。在选择不同的捕获分子时需考虑捕获分子与配体的结合位点是否与分析物结合位点重合或是否会引起配体以特殊的方向存在,从而引起位阻效应 [17]。有研究表明,单克隆抗体与FcγRs结合活性的结果会受到不同捕获分子的影响 [18] [19]。

Figure 3. Procedure for direct immobilization and indirect capture [20]. (a) Procedure for direct coupling; (b) Procedure for indirect capture
图3. 直接偶联法和间接捕获法的流程 [20]。(a) 直接偶联法流程图;(b) 间接捕获法流程图
不论应用直接捕获还是间接捕获策略都需要注意传感芯片的选择,常见的芯片种类及特点如表1所示,通常情况下,CM 5芯片可满足大部分实验需求。但如果需要降低非特异性结合值,可以尝试CM 4芯片和C 1芯片 [21]。另外,还需要注意配体的固定量,固定量过高可能引起物质迁移限制。物质迁移指分子从溶液迁移至芯片表面的过程,当分析物在芯片表面的结合速度高于从溶液扩散至表面的速度时会产生物质迁移限制,此时测得的响应值与进样的浓度间的关系存在偏差,物质迁移限制在传感曲线中表现为浓度和响应值呈线性变化。降低配体固定量或者提高分析物进样流速可减少物质迁移限制的影响。而过低的配体固定量会导致分析物结合后的响应值过低,此时实验误差较大,因此需要通过实验筛选合适的配体固定量 [22]。
Table 1. Common chip types and characteristics [20]
表1. 常见的芯片种类及特点 [20]
3.3. 分析物条件的优化
固定配体后,分析物以恒定流速通过芯片表面,此时,分析物与配体结合。引起芯片表面折射率变化,通过对SPR角的分析测得折射率的变化,以共振单位(Response Unit, RU)表示,1 RU对应芯片表面1 pg/mm2蛋白质量的变化,对应10−6折射率的变化,以时间对RU连续作图,得到传感曲线。
分析物的浓度范围会影响结果的真实性、稳定性和重复性。在具有明显动力学曲线的结合活性实验中,浓度范围必须包含平衡常数Kd值,至少设置5个浓度梯度,并且最高浓度点需达到平衡,低浓度梯度的传感曲线应无重合 [23]。在快结合快解离的结合活性实验中,浓度范围的响应值至少包含20%至80%的Rmax值,至少设置5个浓度梯度,每个浓度的传感曲线应当达到稳态平衡。另外,为获得更优的结果,结合活性实验都需要设置参比通道、设置零浓度样品和设置至少一个浓度的样品重复并与同一浓度样品间隔完成检测。设置参比通道和零浓度样品是为了在最终分析数据时进行扣减,扣减非特异性结合以及缓冲液带来的数据误差,得到更精确的结果。设置一个浓度样品的重复可以分析不同循环样品的检测之间是否存在差异,避免实验误差。
3.4. 再生条件的筛选
再生试剂可通过改变芯片表面的pH和离子强度破坏蛋白之间的相互结合,通常选择不同pH值的甘氨酸盐酸缓冲液再生芯片。不同的再生条件可能会影响实验的重复性、准确度以及芯片的使用寿命。良好的再生条件应当达到以下几点要求:去除所有结合的配体和分析物;能够保持芯片表面捕获分子的活性;尽可能减少对芯片使用寿命的影响 [24]。方法开发时,可通过比较再生前后基线水平的变化以及同一条件实验结果之间的差异评估再生条件 [25]。在相同的再生效果下应选择较为温和的再生条件来保护芯片延长芯片使用寿命。
3.5. 数据分析模型的选择
实验结束后可通过Biacore仪器自带分析软件进行数据分析。一般情况下,为获得真实的传感曲线,避免样品溶液与缓冲液的差异引起的误差,在实验中通常会设置参比通道和零浓度实验,在数据处理时,首先进行参比通道和零浓度的扣减,即“双扣减”。之后根据传感曲线选择合适的数据分析模型。蛋白之间结合活性分析可通过两种分析模型进行拟合。即“Kinetic”和“Steady State”。“Kinetic”对应存在明显动力学曲线的实验结果。“Steady State”对应快结合快解离的实验结果。同时,软件会给出chi2以及非特异性结合值用于判断结果的可靠性,通常情况下要求chi2小于等于Rmax值的十分之一,非特异性结合值小于等于Rmax值的百分之十五 [10]。数据分析软件不仅提供了1:1结合模型,也可以分析1:2或2:1结合的蛋白相互作用。但需要注意除了分子相互作用会影响传感曲线,分析物和配体的纯度、浓度等多种因素都会影响传感曲线,因此需要谨慎地选择非1:1结合的复杂模型来分析数据 [26]。
4. 总结
基于SPR技术分析蛋白之间结合活性的方法开发过程中涉及参数较多,其中固定配体策略对结果影响较大,在开发方法时应重点关注固定配体策略,并在此基础上通过实验对其他条件进行逐个摸索与分析,可减少非特异性结合值和物质迁移效应,提高方法开发的效率以及方法的稳定性。
文章引用
陈莹莹. 基于表面等离子共振技术分析蛋白之间结合活性的方法开发策略
Method Development Strategies for Analysis of Binding Activity between Proteins Based on Surface Plasmon Resonance Technology[J]. 分析化学进展, 2022, 12(03): 178-184. https://doi.org/10.12677/AAC.2022.123023
参考文献
- 1. 王静, 王倩, 宋书香. 表面等离子共振技术在药物研发领域的应用进展[J]. 中国药学(英文版), 2020, 29(7): 504-513.
- 2. 王鸣人, 段徐华, 邵泓, 陈钢. 表面等离子共振(SPR)技术在生物药物质量控制中的应用前景[J]. 中国药师, 2020, 23(11): 2257-2260.
- 3. O’connell, N. (2021) Protein Ligand Interactions Using Surface Plasmon Resonance. In: Cacace, A.M., Hickey, C.M. and Békés, M., Eds., Targeted Protein Degradation, Vol. 2365, Humana, New York, 3-20.
https://doi.org/10.1007/978-1-0716-1665-9_1 - 4. Láng, J.A., Balogh, Z.C., Nyitrai, M.F., Juhász, C., Gilicze, A.K.B., Iliás, A., et al. (2020) In Vitro Functional Characterization of Biosimilar Therapeutic Antibodies. Drug Discovery Today: Technologies, 37, 41-50.
https://doi.org/10.1016/j.ddtec.2020.11.010 - 5. Jason-Moller, L., Murphy, M. and Bruno, J. (2006) Overview of Biacore Systems and Their Applications. Current Protocols in Protein Science, 45, 19.13.1-19.13.14.
https://doi.org/10.1002/0471140864.ps1913s45 - 6. Olaru, A., Bala, C., Jaffrezic-Renault, N. and Aboul-Enein, H.Y. (2015) Surface Plasmon Resonance (SPR) Biosensors in Pharmaceutical Analysis. Critical Reviews in Analytical Chemistry, 45, 97-105.
https://doi.org/10.1080/10408347.2014.881250 - 7. 刘芳芳. SPR传感检测细胞表面分子相互作用的方法研究[D]: [博士学位论文]. 北京: 清华大学, 2010.
- 8. 江丽. 增强的新型表面等离子体共振传感器及其应用[D]: [博士学位论文]. 杭州: 浙江大学, 2018.
- 9. Forest-Nault, C., Gaudreault, J., Henry, O., Durocher, Y. and De Crescenzo, G. (2021) On the Use of Surface Plasmon Resonance Biosensing to Understand IgG-FcγR Interactions. International Journal of Molecular Sciences, 22, Article No. 6616.
https://doi.org/10.3390/ijms22126616 - 10. Rich, R.L. and Myszka, D.G. (2008) Survey of the Year 2007 Commercial Optical Biosensor Literature. Journal of Molecular Recognition, 21, 355-400.
https://doi.org/10.1002/jmr.928 - 11. Jovic, M. and Cymer, F. (2019) Qualification of a Surface Plasmon Resonance Assay to Determine Binding of IgG- Type Antibodies to Complement Component C1q. Biologicals, 61, 76-79.
https://doi.org/10.1016/j.biologicals.2019.08.004 - 12. De Weers, M., Tai, Y.T., Van Der Veer, M.S., Bakker, J.M., Vink, T., Jacobs, D.C.H., et al. (2011) Daratumumab, a Novel Therapeutic Human CD38 Monoclonal Antibody, Induces Killing of Multiple Myeloma and Other Hematological Tumors. The Journal of Immunology, 186, 1840-1848.
https://doi.org/10.4049/jimmunol.1003032 - 13. Patel, R., Neill, A., Liu, H. and Andrien, B. (2015) IgG Subclass Specificity to C1q Determined by Surface Plasmon Resonance Using Protein L Capture Technique. Analytical Biochemistry, 479, 15-17.
https://doi.org/10.1016/j.ab.2015.03.012 - 14. Dekkers, G., Treffers, L., Plomp, R., Bentlage, A.E.H., de Boer, M. and Koeleman, C.A.M. (2017) Decoding the Human Immunoglobulin G-Glycan Repertoire Reveals a Spectrum of Fc-Receptor- and Complement-Mediated-Effector Activities. Frontiers in Immunology, 8, Article No. 877.
https://doi.org/10.3389/fimmu.2017.00877 - 15. Li, T., Dilillo, D.J., Bournazos, S., Giddens, J.P., Ravetch, J.V. and Wang, L.X. (2017) Modulating IgG Effector Function by Fc Glycan Engineering. Proceedings of the National Academy of Sciences of the United States of America, 114, 3485-3490.
https://doi.org/10.1073/pnas.1702173114 - 16. Hayes, J.M., Frostell, A., Cosgrave, E.F., Struwe, W.B., Potter, O., Davey, G.P., et al. (2014) Fc Gamma Receptor Glycosylation Modulates the Binding of IgG Glycoforms: A Requirement for Stable Antibody Interactions. Journal of Proteome Research, 13, 5471-5485.
https://doi.org/10.1021/pr500414q - 17. Abdiche, Y.N., Yeung, Y.A., Chaparro-Riggers, J., Barman, I., Strop, P., Chin, S.M., et al. (2015) The Neonatal Fc Receptor (FcRn) Binds Independently to Both Sites of the IgG Homodimer with Identical Affinity. mAbs, 7, 331-343.
https://doi.org/10.1080/19420862.2015.1008353 - 18. Dorion-Thibaudeau, J., Raymond, C., Lattová, E., Perreault, H., Durocher, Y. and De Crescenzo, G. (2014) Towards the Development of a Surface Plasmon Resonance Assay to Evaluate the Glycosylation Pattern of Monoclonal Antibodies Using the Extracellular Domains of CD16a and CD64. Journal of Immunological Methods, 408, 24-34.
https://doi.org/10.1016/j.jim.2014.04.010 - 19. Cambay, F., Henry, O., Durocher, Y. and De Crescenzo, G. (2019) Impact of N-Glycosylation on Fcγ Receptor/IgG Interactions: Unravelling Differences with an Enhanced Surface Plasmon Resonance Biosensor Assay Based on Coiled- Coil Interactions. mAbs, 11, 435-452.
https://doi.org/10.1080/19420862.2019.1581017 - 20. Biacore (2016) Biacore Sensor Surface Handbook. 1st Edition, Biacore, Uppsala, 13-16.
- 21. Drake, A.W., Tang, M.L., Papalia, G.A., Landes, G., Haak-Frendscho, M. and Klakamp, S.L. (2012) Biacore Surface Matrix Effects on the Binding Kinetics and Affinity of an Antigen/Antibody Complex. Analytical Biochemistry, 429, 58-69.
https://doi.org/10.1016/j.ab.2012.06.024 - 22. Douzi, B. (2017) Protein-Protein Interactions: Surface Plasmon Resonance. In: Journet, L. and Cascales, E., Eds., Bacterial Protein Secretion Systems, Humana Press, New York, 257-275.
https://doi.org/10.1007/978-1-4939-7033-9_21 - 23. Knowling, S., Clark, J., Sjuts, H. and Abdiche, Y.N. (2020) Direct Comparison of Label-Free Biosensor Binding Kinetics Obtained on the Biacore 8K and the Carterra LSA. SLAS Discovery, 25, 977-984.
https://doi.org/10.1177/2472555220934814 - 24. Schasfoort, R.B. (2017) Handbook of Surface Plasmon Resonance. Royal Society of Chemistry, London.
- 25. 王晓骏. 磺胺类药物表面等离子共振免疫传感检测研究[D]: [硕士学位论文]. 天津: 天津科技大学, 2015.
- 26. Abdiche, Y.N., Malashock, D.S. and Pons, J. (2008) Probing the Binding Mechanism and Affinity of Tanezumab, a Recombinant Humanized Anti-NGF Monoclonal Antibody, Using a Repertoire of Biosensors. Protein Science, 17, 1326-1335.
https://doi.org/10.1110/ps.035402.108
