Medical Diagnosis
Vol.
11
No.
01
(
2021
), Article ID:
40851
,
11
pages
10.12677/MD.2021.111003
基于网络药理学方法预测扶正抑瘤方 作用于PD-1和CTLA-4免疫检查点 潜在信号转导途径
蒋畅1,韩静1,胡娟2,陈立武2*
1福建省中医药科学院,福建 福州
2福建中医药大学附属第二人民医院,福建 福州

收稿日期:2021年2月9日;录用日期:2021年3月1日;发布日期:2021年3月10日

摘要
目的:运用网络药理学方法预测扶正抑瘤方作用于PD-1和CTLA-4免疫检查点潜在信号转导途径。方法:ETCM、TCMSP数据库筛选扶正抑瘤方中各味药物活性成分,利用STITCH、Swiss Target Prediction等数据库对各活性成分进行作用靶点预测,构建成分–靶点集,与MalaCards、DisGeNET等数据库中PD-1和CTLA-4免疫检查点相关核心靶点取交集。利用STRING数据库进行蛋白互作网络构建,DAVID数据库进行富集分析,利用Cytoscape构建“药物–成分–靶点–通路”网络图,对数据进行可视化。结果:从扶正抑瘤方种筛选得到195个活性化合物,涉及相关作用靶标676个;筛选核心靶标44个,映射交集16个。蛋白互作网络筛选得到5个关键靶标HIF1A、STAT1、STAT3、CD80、CD86,主要通过PD-L1表达于PD-1检查点通路及CTLA4介导的T细胞受体信号转导。结论:扶正抑瘤方可通过多成分多靶点发挥肿瘤免疫杀伤作用,与T细胞受体信号通路CTLA-4和PD-1检查点通路等高度相关。
关键词
扶正抑瘤方,网络药理学,免疫检查点,信号转导途径

Research on Potential Signal Transduction Pathways of Fuzheng Yiliu Prescription on PD-1 and CTLA-4 Immune Checkpoints Based on Network Pharmacology
Chang Jiang1, Jing Han1, Juan Hu2, Liwu Chen2*
1Fujian Academy of Chinese Medicine Sciences, Fuzhou Fujian
2The Second People’s Hospital Affiliated to Fujian University of Traditional Chinese Medicine, Fuzhou Fujian
Received: Feb. 9th, 2021; accepted: Mar. 1st, 2021; published: Mar. 10th, 2021

ABSTRACT
Objective: Using network pharmacology methods to predict the potential signal transduction pathways of Fuzheng Yiliu Prescription on PD-1 and CTLA-4 immune checkpoints. Methods: ETCM, TCMSP databases screened the active ingredients of various medicines in Fuzheng Yiliu Prescription, and used STITCH, Swiss Target Prediction and other databases to predict the action target of each active ingredient, and constructed the ingredient-target set, which was combined with MalaCards, DisGeNET and other databases Intersection of relevant targets for PD-1 and CTLA-4 immune checkpoints. Use STRING database for protein-protein interaction network construction, DAVID database for enrichment analysis, use Cytoscape to construct a “drug-com- ponent-target-pathway” network diagram to visualize the data. Result: 195 active compounds were screened from Fuzheng Yiliu Prescription, involving 676 related targets; 44 liver cancer-related key targets were screened, and 16 were mapped. The protein interaction network screened 5 key targets HIF1A, STAT1, STAT3, CD80, and CD86, mainly through PD-L1 expression PD-1 checkpoint pathway and CTLA4 mediated T cell receptor signal transduction. Conclusion: Fuzheng Yiliu Prescription can play a role in tumor immune killing through multiple components and multiple targets, which is highly related to T cell receptor signaling pathway CTLA-4 and PD-1 checkpoint pathway.
Keywords:Fuzheng Yiliu Prescription, Network Pharmacology, Immune Checkpoints, Signal Transduction Pathway

Copyright © 2021 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
扶正抑瘤方是“全国名中医”杜建教授依据扶正培本法则拟定而来的经验方 [1],由黄芪、女贞子、灵芝、山药组成,具有健脾益气,滋补肝肾、养心安神、扶正固本之功效。在长期的临床实践中已证实其具有降低术后癌症复发、延长患者生存时间的作用 [2] [3]。目前,对于扶正抑瘤方抗癌的完整药效机制尚未完全阐明。
网络药理学由生物信息学、系统生物学等学科整合而成,其分析方式注重系统性、整体性,可较好的阐明多成分,多靶点之间的协同作用 [4],与中医药整体观念相符。本研究通过运用网络药理学,构建“药物–成份–靶标–通路”作用网络,探讨扶正抑瘤方作用于PD-1和CTLA-4免疫检查点潜在信号转导途径,为中医药抗癌后续研究提供方向和思路。
2. 方法
2.1. 扶正抑瘤方活性化合物与靶标获取
分别以“Astragali Radix”、“Ganoderma”、“Dioscoreae Rhizoma”、“Ligustri Lucidi Fructus”为关键词在中药系统药理学分析平台(TCMSP, https://tcmspw.com/tcmsp.php)与中医药百科全书(ETCM, http://www.tcmip.cn/ETCM/index.php/Home/Index/)中进行搜索,汇总得扶正抑瘤方所含活性化学成分。
通过PubChem (https://pubchem.ncbi.nlm.nih.gov)查找并获取上述活性化学成分的SMILE结构式,运用STITCH (http://stitch.embl.de/)、Swiss Target Prediction (http://swisstargetprediction.ch)进行对应的生物作用靶点预测。利用UniProt (https://www.uniprot.org)将各靶点信息归一化为Gene Symbol。
2.2. 免疫检查点核心靶点的收集
以“PD-1”、“CTLA-4”、“immune checkpoint”等为关键词,在MalaCards (https://www.malacards.org)、DisGeNET (https://www.disgenet.org)等数据库中进行搜索,汇总取交集后得到免疫检查点相关核心靶点。
2.3. 基因映射与网络构建
将筛选所得的扶正抑瘤方活性成分对应靶点与免疫检查点相关核心靶点进行映射,得到交集基因并利用Venny (https://bioinfogp.cnb.csic.es/tools/venny)绘制花瓣图。将上述所得映射基因通过STRING (https://string-db.org)建立蛋白质–蛋白质相互作用(PPI)网络。最后,将扶正抑瘤方筛选所得活性成分、成分作用靶点、免疫检查点相关核心靶点通路等节点信息与映射关系导入Cytoscape软件进行可视化分析并对各项属性进行调整,构建“药物–成分–靶点–通路”网络图。
2.4. GO富集分析与KEGG通路富集分析
于Rstudio软件中加载clusterProfiler扩展包,对PPI网络中的核心靶点进行Kyoto Encyclopedia of Genes and Genomes (KEGG)通路富集和Gene Ontology (GO)功能富集分析,进一步利用ggplot2扩展包绘图使结果可视化。
3. 结果
3.1. 扶正抑瘤方活性化合物与靶标
经TCMSP及ETCM数据库筛选汇总得到扶正抑瘤方中各味药物活性成分195个(见表1),通过SwissTargetPrediction数据库及STITCH数据库预测,去重后得到对应靶点676个。
3.2. 靶点映射与网络构建
将筛选得到的扶正抑瘤方中所含化合物作用靶点经过Uniprot数据库归一转换为Gene Symbol格式后,与MalaCards、DisGeNET等数据库搜集得到的免疫检查点相关靶标进行对应映射,绘制花瓣图(见图1),得免疫检查点相关核心靶标44个,其中16个靶点与扶正抑瘤方作用靶点重合。
通过STRING数据库对上步所得的免疫检查点相关核心靶标–扶正抑瘤方作用靶点交集基因进行分析。选择分析模式为Multiple Proteins,设定物种类别为Homo Sapiens,互作分数阈值设为高度置信(0.700),得到16个节点,边数58条,平均节点度值7.25,平均局部聚类系数0.752的PPI网络图(见图2)。
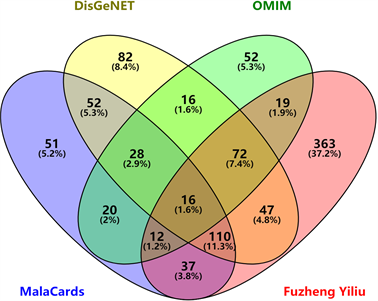
Figure 1. The petals diagram of drug targets associated with immune checkpoint
图1. 药物靶点与免疫检查点相关靶点花瓣图
Table 1. Active compounds contained in Fuzheng Yiliu decoction
表1. 扶正抑瘤方所含活性化合物
将扶正抑瘤方中各味中药、对应活性成分、作用基因靶点等各个节点及映射关系导入Cytoscape软件,进行可视化分析并对其各项属性进行设置,得到如图3所示“药物–成分–靶点–通路”网络图,图中左侧绿色菱形代表扶正抑瘤方中各味中药,外圈黄色椭圆表示各有效成分,内圈三角形代表相对应的基因靶点,右侧蓝色方形表示关联性较高的通路。

Figure 2. Protein-protein interaction network diagram
图2. 蛋白–蛋白互作网络图
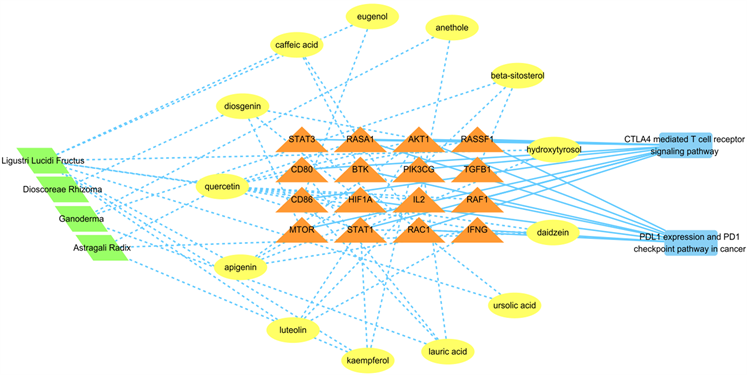
Figure 3. Drug-component-target-pathway network (Green: single Chinese medicine, yellow: Chinese medicine chemical composition, orange: protein target, blue: acting pathway)
图3. 药物–成分–靶点–通路网络图(绿色:单味中药,黄色:中药化学成分,橙色:蛋白靶标,兰色:作用途径)
3.3. 靶点生物学功能分析
于Rstudio软件中加载clusterProfiler扩展包,对PPI网络中筛选出的核心靶点进行KEGG通路富集和Gene Ontology (GO)功能富集分析,pvalueCutoff与qvalueCutoff值均设定为0.05,得到扶正抑瘤方抗肝癌过程中的生物过程(Biological Process, BP)、细胞组分(Cellular Component, CC)、分子功能(Molecular Function, MF)与KEGG通路富集情况,进一步利用ggplot2扩展包绘图使结果可视化,绘制条形图及气泡图。

Figure 4. The GO enrichment analysis chart
图4. GO富集分析图
由图4可知,靶点参与免疫系统过程的正向调节、细胞分化的正调控、细胞内信号转导的调节、免疫系统过程的调节、细胞内信号转导等生物过程,主要分布在质膜有界细胞投影及肥大细胞颗粒,涉及磷酸转移酶活性、信号受体结合、细胞因子受体结合、酶结合等分子功能。
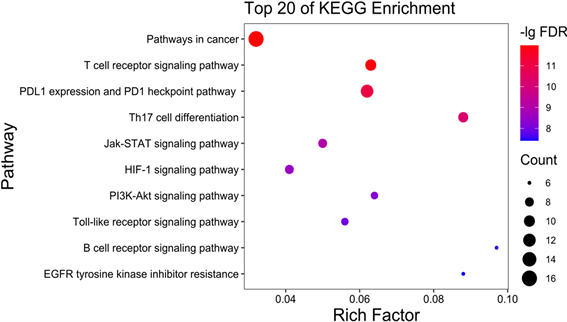
Figure 5. The KEGG enrichment analysis chart
图5. KEGG富集分析图
由图5结果可以推断,扶正抑瘤方抗肿瘤作用机制可能和PD-L1表达与PD-1检查点通路(PDL1 expression and PD1 checkpoint pathway in cancer)及T细胞受体信号通路(T cell receptor signaling pathway)高度相关。
PD-1及其配体PD-L1是关键的调节性生理免疫检查点,其可调节T细胞和B细胞在其他免疫细胞类型中的活化程度,维持生物体的自我耐受 [5]。在实体瘤中,肿瘤细胞通过增加细胞表面PD-L1的表达以沉默免疫系统。PD-L1的调控受HIF-1,STAT1,STAT3影响 [6],阻断PD-1/PD-L1途径的治疗性抗体纳武利尤单抗(Opdivo)在肿瘤的临床治疗上已被广泛使用,具有较好的疗效 [7]。
受CTLA4介导的T细胞受体以及共刺激分子(例如CD28)通过与CD28反受体B7-1/B7-2分别相关的外源抗原(CD80, CD86)的相互作用导致一系列信号级联反应 [8],包括蛋白质–酪氨酸激酶,磷酸酶,GTP结合蛋白和衔接子蛋白等 [9],从而对T细胞增殖,细胞因子产生和分化成效应细胞产生影响。
4. 讨论
本研究通过ETCM、TCMSP数据库筛选扶正抑瘤方中各味药物活性成分195个,共涉及相关作用靶标676个。从MalaCards、DisGeNET等数据库中筛选得到免疫检查点相关核心靶标44个,其中16个靶点与扶正抑瘤方作用靶点重合。通过构建“药物–成分–靶点–通路”网络图,体现中医药治疗疾病中多成分多靶点联合调控的作用特点。
研究提示,扶正抑瘤方主要通过PD-L1表达于PD-1检查点通路及CTLA4介导的T细胞受体信号通路发挥抗肿瘤作用,涉及HIF1A、STAT1、STAT3、CD80、CD86等关键靶标。在临床上,PD1抑制剂纳武利尤单抗(Opdivo)与CTLA4抑制剂伊匹木单抗(Yervoy)联用是美国FDA批准的首个也是唯一一个双重免疫疗法,“OY组合”已获FDA批准运用于涵盖肝细胞癌,结直肠癌,肾细胞癌、黑色素瘤、非小细胞肺癌在内的五种类型癌症 [10]。二者同属免疫检查点抑制剂,分别作用于抗肿瘤免疫的不同阶段。CTLA4抑制剂主要作用于T细胞发育早期,PD1抑制剂则主要在T细胞的效应阶段起作用。二者联用具有协同增效作用,III期临床试验证明,与传统化疗相比,双重免疫疗法显著改善了患者总生存期(OS),(p < 0.05)及总体缓解率(ORR),(p < 0.05) [11]。
5. 结论
本研究通过网络药理学分析构建了扶正抑瘤方“药物–成分–靶点–通路”复杂网络图,探讨扶正抑瘤方抗肿瘤的可能作用机制。结果表明扶正抑瘤方可通过多成分、多靶点、多通路发挥抗肿瘤作用,主要涉及PD-L1表达与PD-1检查点通路及CTLA4介导的T细胞受体信号通路,为后续深入研究扶正抑瘤方治疗癌症的作用机制奠定基础。
基金项目
福建省自然科学基金(2020J01249),中央引导地方科技发展专项(2020L3012),白求恩·医学科学研究基金(B19003CS)。
文章引用
蒋 畅,韩 静,胡 娟,陈立武. 基于网络药理学方法预测扶正抑瘤方作用于PD-1和CTLA-4免疫检查点潜在信号转导途径
Research on Potential Signal Transduction Pathways of Fuzheng Yiliu Prescription on PD-1 and CTLA-4 Immune Checkpoints Based on Network Pharmacology[J]. 医学诊断, 2021, 11(01): 13-23. https://doi.org/10.12677/MD.2021.111003
参考文献
- 1. 陈旭征, 曹治云, 廖联明, 刘志臻, 杜建. Application of Serum Pharmacology in Evaluating the Antitumor Effect of Fuzheng Yiliu Decoction (扶正抑瘤方) from Chinese Medicine [J]. 中国结合医学杂志: 英文版, 2014(6): 450-455.
- 2. 兰岚, 曹治云, 杜建. 扶正抑瘤方加味配合化疗治疗消化道肿瘤[J]. 福建中医药大学学报, 2014(2): 43-45.
- 3. 赵红佳, 杜建, 陈曦, 陈立武, 陈美华, 王秀丽, 黄飞翔. 扶正抑瘤方协同微波消融治疗肝癌的临床研究[J]. 中国中西医结合杂志, 2012, 32(1): 32-34.
- 4. 韩露, 程肖蕊, 伯晓晨, 曹亮, 陈纯, 陈洛南, 陈禹保, 段大跃, 方坚松, 高丽, 高莉, 高耀, 李美娜, 李学军, 刘艾林, 刘骏, 秦雪梅, Bauer Rudolf, 宋文婷, Alastair Stew-art, 孙蓉, 孙妩弋, 田俊生, 王永华, 王忠, 魏伟, 肖伟, 徐峰, 徐筱杰, 张文娟, 张媛媛, 赵静, 周文霞, 张永祥. 新形势•新策略——网络药理学与中药新药研发[J]. 中国药理学与毒理学杂志, 2018, 32(11): 827-828.
- 5. Zhou, T.C., Sankin, A.I., Porcelli, S.A., Perlin, D.S., Schoenberg, M.P. and Zang, X. (2017) A Review of the PD-1/PD-L1 Checkpoint in Bladder Cancer: From Mediator of Immune Escape to Target for Treatment. Urologic Oncology: Seminars and Original Investigations, 35, 14-20. https://doi.org/10.1016/j.urolonc.2016.10.004
- 6. Wang, Y., Wang, H., Yao, H., Li, C., Fang, J.Y. and Xu, J. (2018) Regulation of PD-L1: Emerging Routes for Targeting Tumor Immune Evasion. Frontiers in Pharmacology, 9, 536. https://doi.org/10.3389/fphar.2018.00536
- 7. Finkelmeier, F., Waidmann, O. and Trojan, J. (2018) Nivolumab for the Treatment of Hepatocellular Carcinoma. Expert Review of An-ticancer Therapy, 18, 1169-1175. https://doi.org/10.1080/14737140.2018.1535315
- 8. Pai, C.S., Simons, D.M., Lu, X., Evans, M., Wei, J., Wang, Y.H., Chen, M., Huang, J., Park, C., Chang, A., Wang, J., Westmoreland, S., Beam, C., Banach, D., Bowley, D., Dong, F., Seagal, J., Ritacco, W., Richardson, P.L., Mitra, S., Lynch, G., Bousquet, P., Mankovich, J., Kingsbury, G. and Fong, L. (2019) Tumor-Conditional Anti-CTLA4 Uncouples Antitumor Efficacy from Immunotherapy-Related Toxicity. The Journal of Clinical Investigation, 129, 349-363. https://doi.org/10.1172/JCI123391
- 9. Chen, L. (2004) Co-Inhibitory Molecules of the B7-CD28 Family in the Control of T-Cell Immunity. Nature Reviews Immunology, 4, 336-347. https://doi.org/10.1038/nri1349
- 10. Tian, Y., Abu-Sbeih, H. and Wang, Y. (2018) Immune Checkpoint Inhibitors-Induced Hepatitis. Advances in Experimental Medicine and Biology, 995,159-164. https://doi.org/10.1007/978-3-030-02505-2_8
- 11. Larkin, J., Chiarion-Sileni, V., Gonzalez, R., Grob, J.J., Rutkowski, P., Lao, C.D., Cowey, C.L., Schadendorf, D., Wagstaff, J., Dummer, R., Ferrucci, P.F., Smylie, M., Hogg, D., Hill, A., Márquez-Rodas, I., Haanen, J., Guidoboni, M., Maio, M., Schöffski, P., Carlino, M.S., Lebbé, C., McArthur, G., Ascierto, P.A., Daniels, G.A., Long, G.V., Bastholt, L., Rizzo, J.I,, Balogh, A., Moshyk, A., Hodi, F.S. and Wolchok, J.D. (2019) Five-Year Survival with Combined Nivolumab and Ipilimumab in Advanced Melanoma. The New England Journal of Medicine, 381, 1535-1546. https://doi.org/10.1056/NEJMoa1910836
