Traditional Chinese Medicine
Vol.
08
No.
05
(
2019
), Article ID:
32056
,
11
pages
10.12677/TCM.2019.85052
Study on the Intervention of Ardisia japonica and Lespedeza cuneata on Airway DCN Smad7 of COPD Rats
Minghui Liu1, Xun Zhou1*, Mei Wang2, Gaigai Li1
1The Second Affiliated Hospital of Guizhou University of Traditional Chinese Medicine, Guiyang Guizhou
2People’s Hospital of Udang District, Guiyang, Guiyang Guizhou

Received: Aug. 12th, 2019; accepted: Aug. 27th, 2019; published: Sep. 5th, 2019

ABSTRACT
Objective: To discuss the mechanism of action of miao medicine (Ardisia japonica, Lespedeza cuneata) on inhibiting COPD rats' airway obstruction, through DCN, Smad7 and TGF-β1 intervention. To observe the treatment, different doses of miao medicine were used to treat the COPD rats, to find the best relationship of dose effect. Methods: The 60 healthy male SD rats were divided into normal group (12 rats) and COPD models group (48 rats) randomly. The COPD rat model was made by using the method of smoking cigarette and injecting LPS into the trachea. Later, the 48 rats of modeling were divided into 4 groups: blank group, high-miao medicine group, middle-miao medicine group and low-miao medicine group, 12 rats in each group. 8 rats belonging to COPD model (each group of two) and 2 healthy rats were randomly chosen for chip check to verify the models. Rats of miao medicine groups were treated with miao medicine of different doses; rats of normal group and blank group were treated with normal saline for four weeks, respectively. Using hematoxylin-eosin staining (HE staining) to observe rats’ lungs pathological manifestations, western blot was used to detect the expression quantity of TGF-β1, Smad7 and DCN in rats’ lungs, and Pearson correlation coefficient was used to analyze the relationship among proteins of TGF-β1, Smad7 and DCN. Results: Groups of HE staining results: in the lungs of COPD models group, rats had the same pathologic changes with COPD. The lungs of each miao medicine group rates had improved more than the blank group, especially the high-miao medicine group. Comparison among groups symptoms: the symptoms of each miao medicine group improved, especially the high-miao medicine group changed most. After miao medicine treatment, all miao medicine groups’ protein expression of Smad7, TGF-β1 had obvious difference with the blank group (P < 0.05); middle-miao and high-miao medicine groups' protein expression of DCN had obvious difference with the blank group (P < 0.05). Low-miao medicine group had no obvious difference with the blank group (P > 0.05). High-miao and middle-miao medicine groups' protein expression of Smad7, DCN, TGF-β1 had no obvious difference (P > 0.05), but the average number of high-miao medicine groups’ protein expression of Smad7, DCN was higher than the middle-miao medicine group; TGF-β1 was lower than the middle-miao medicine group. Smad7 and DCN of COPD rats models’ lungs had positive correlation (P < 0.01); their TGF-β1 had negative correlation (P < 0.01). In the lungs of COPD rats models, content of TGF-β1 increased obviously; DCN and Smad7 decreased obviously. After treated by miao medicine, the treatment groups’ TGF-β1 content decreased obviously, DCN and Smad7 content increased obviously, and the high-miao medicine group developed especially obvious. Smad7 and DCN in COPD rats models lungs had positive correlation, but they had a negative correlation with TGF-β1.
Keywords:Ardisia japonica, Lespedeza cuneata, DCN, Smad7, TGF-β1, COPD
紫金牛、铁扫帚对COPD大鼠气道DCN、 Smad7的干预研究
刘明慧1,周洵1*,王美2,李改改1
1贵州中医药大学第二附属医院,贵州 贵阳
2贵阳市乌当区人民医院,贵州 贵阳

收稿日期:2019年8月12日;录用日期:2019年8月27日;发布日期:2019年9月5日

摘 要
目的:探讨苗药紫金牛、铁扫帚通过对COPD大鼠模型DCN、Smad7、TGF-β1的干预抑制气道重塑的可能作用机制,并观察不同剂量苗药对COPD大鼠的疗效差异,以寻求最佳的量效关系。方法:将60只健康雄性SD大鼠随机分为健康对照组12只,COPD模型组48只,模型组利用熏香烟加气管内注入脂多糖的方法制作COPD大鼠模型,将模型组大鼠随机分为4组:COPD空白组、苗药高剂量组、苗药中剂量组和苗药低剂量组,每组各12只,造模结束后每组随机选取2只大鼠,同时选2只健康大鼠,行病理切片检查(苏木精–伊红染色,HE染色)做模型鉴定。对各苗药组分别对应给予高、中、低剂量苗药紫金牛、铁扫帚灌胃干预治疗4周,健康对照组及COPD空白组分别予灭菌生理盐水灌胃干预治疗4周。运用HE染色观察治疗后各组大鼠肺组织病理改变;用蛋白质印迹法(Western Blot)检测治疗后各组大鼠肺组织中DCN、Smad7、TGF-β1的表达;通过Pearson相关系数分析DCN、Smad7、TGF-β1蛋白之间的相关性。结果:烟熏加气管内注射脂多糖造模法使得实验大鼠出现与COPD相应的病理改变。各苗药组肺组织形态较COPD空白组有所改善,尤以苗药高剂量组最为明显。经苗药治疗后,COPD大鼠模型症状均有所缓解,尤以苗药高剂量组缓解最为明显。经苗药紫金牛、铁扫帚干预治疗后,Smad7、TGF-β1蛋白表达苗药各组与COPD空白组之间均有明显差异(P < 0.05);DCN蛋白表达苗药高、中剂量组与COPD空白组均有明显差异(P < 0.05),苗药低剂量组与COPD空白组之间无明显差异(P > 0.05);苗药高、中剂量组之间Smad7、DCN、TGF-β1蛋白表达均无明显差异(P > 0.05),但苗药高剂量组Smad7、DCN蛋白表达均数高于苗药中剂量组、TGF-β1蛋白表达均数低于苗药中剂量组。COPD大鼠模型肺组织中Smad7与DCN呈正性相关(P < 0.01),二者与TGF-β1均呈负性相关(P < 0.01)。结论:在COPD大鼠模型组肺组织中,TGF-β1含量显著升高,DCN、Smad7显著降低;经苗药紫金牛、铁扫帚干预治疗后,苗药治疗组TGF-β1明显降低,DCN、Smad7明显升高,综合比较后发现尤以苗药高剂量组变化最为明显,说明苗药高剂量组疗效最佳。TGF-β1与Smad7、DCN均呈负性相关,Smad7与DCN呈正性相关。
关键词 :紫金牛,铁扫帚,DCN,Smad7,TGF-β1,COPD

Copyright © 2019 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
作为一种破坏性的肺部疾病——慢性阻塞性肺疾病(chronic obstructive pulmonary disease, COPD)以不完全可逆的持续进行性发展的气流受限为其主要特征,多与肺部接触烟雾等有害颗粒或有害气体所引起的异常慢性炎症反应有关。目前COPD虽然可以进行预防与治疗,但仍具有发病率高、致残率高、致死率高等特点。众多研究发现,气道重塑对COPD气流受限产生了重要影响。气道重塑亦称气道重构,是指由于气道壁反复受到慢性炎症刺激损伤且修复不完全导致的气道壁结构功能改变、胶原含量增加以及瘢痕组织形成 [1]。气道壁及肺实质的慢性炎症、结构破坏是其病理基础,其特征性病理变化是气道壁变形增厚,尤以平滑肌细胞增厚最明显,还发生了细胞外基质(extracellular matrix, ECM)重塑,从而导致气流阻力增加和气道管腔狭窄 [2] [3]。还有研究 [4] 表明,COPD的气道重塑与成纤维细胞增生、黏液腺肥大增生、胶原沉积、杯状细胞增生、氨基聚糖沉积等的参与有关。由于COPD患者气道重塑的不完全可逆性导致患者呼吸困难、喘息等症状呈进行性加重,故很多学者将研究重心转向如何抑制COPD气道重塑,若能逆转或部分逆转其气道重塑,将为治疗疾病带来关键性的突破。
转化生长因子-β1 (transforming growth factor-β1, TGF-β1)是一种广泛存在的多功能细胞因子,哺乳动物体内几乎所有细胞都能分泌TGF-β [5] ,它具有多种生物活性。在呼吸系统疾病中,ECM、炎症介质、成纤维细胞、平滑肌细胞等因子在TGF-β1的调控下可发生多种与气道重塑病理改变有关的反应 [6]。TGF-β1是迄今为止最强的细胞外基质沉积促进剂 [5]。当COPD患者气道受炎症刺激时,气道平滑肌会分泌大量的TGF-β1,TGF-β1反作用于气道,使平滑肌增生、杯状细胞肥大,加速细胞外基质沉积,影响胶原及纤维连接蛋白的合成增多等,最终导致气道管腔狭窄阻塞,直至发生不完全可逆的功能改变。TGF-β1的这一系列作用需要在信号转导因子Smads蛋白的介导下才能顺利完成,活化的TGF-β1能够诱导R-Smads蛋白(受体特异性Smads,主要是Smad2、3参与)磷酸化,磷酸化后的Smads蛋白与Co-Smads (公用Smads,Smad4是哺乳动物体内唯一的Co-Smads)结合形成复合物,形成复合物后对TGF-β1的信号进行直接转导,经过转导后的TGF-β1进入细胞核直接发挥其生物作用。组织学分析显示,Smad7的表达水平在肺部最高,它属于抑制性Smads (I-Smads),与TGF-β的I型受体结合后能够阻止R-Smads蛋白与I型受体结合,进而阻止R-Smads的磷酸化激活,从而抑制TGF-β的转录应答,TGF-β1本身也能诱导I-Smad进行基因转录过程,因此二者之间的关系属于TGF-β信号自身的负反馈调节 [7]。在正常机体中,随着TGF-β1的升高,Smad7蛋白反而降低发挥其抑制作用,在COPD肺组织中,是否因为TGF-β1过表达抑制了Smad7蛋白的正常表达,从而限制其对TGF-β1的负向调节作用尚待研究。
核心蛋白聚糖(decorin, DCN)主要存在于结缔组织中,与胶原纤维合成有关,是TGF-β的天然拮抗剂,能够通过核心蛋白与TGF-β1特异性结合使TGF-β的生物活性被中和灭活,具有负反馈调节TGF-β1的作用 [8]。对于气道重塑来说,TGF-β1占有至关重要的促进作用 [5] ,若能证实抑制性Smads蛋白Smad7和DCN呈正性相关,在对TGF-β1的抑制过程中起相互协同、促进作用,是否能为改善COPD的气道重塑提供新思路呢?
对于COPD稳定期的治疗目标是减轻当前症状、减少急性加重次数、提高生活质量、改善活动能力等,做到早治早防,降低其致死、致残率。2013版诊治指南 [9] 提出,对COPD稳定期的患者实行教育和管理,包括戒烟、缩唇锻炼、远离吸入性粉尘烟雾等,提高患者对自身疾病的认识及对疾病的处理能力,配合管理、加强预防,维持疾病的稳定;药物治疗主要有支气管舒张剂、β2-受体激动剂、抗胆碱药、茶碱类药、激素、磷酸二酯酶4抑制剂等,以上药物虽然能改善患者症状、体征,但也能引起一系列不同程度的不良反应,根据2011版中医诊疗指南 [10] ,对于稳定期的治疗,中医药或中西医结合治疗在症状改善、生活质量和运动能力的提高及急性加重的减少方面疗效较单纯西医药治疗好。目前对COPD的治疗均不能从根本上解决问题,很大程度上取决于其未明的发病机制,研究COPD的发病机制,探索新的治疗方法成为亟待解决的医学问题。紫金牛、铁扫帚是贵州民族医药的重要组成部分,是贵州苗族止咳化痰平喘民间验方中的主要药物。目前对于苗药干预COPD气道重塑的研究甚少,本课题分使用不同剂量苗药紫金牛、铁扫帚煎剂对COPD大鼠模型进行灌胃治疗,观察各组大鼠的症状改善情况、肺组织的形态学改变及肺组织中TGF-β1、DCN、Smad7的蛋白表达差异,研究DCN、Smad7对TGF-Smads信号传导通路可能产生的影响及苗药紫金牛、铁扫帚干预治疗COPD大鼠模型气道重塑的可能作用机制,探讨DCN、TGF-Smads信号通路在COPD气道重塑中所扮演的角色,旨在为苗药的推广及临床应用奠定一定的理论基础。
2. 材料与方法
2.1. 实验动物
选用清洁级(二级)雄性健康Sprague-Dauley (SD)大鼠,4周鼠龄,体重100 ± 20 g,产自重庆滕鑫生物技术有限公司,合格证号SCXK(渝)2014-0004。所有大鼠均饲养于贵阳中医学院实验动物所,饲养环境清洁、干燥,温度20℃ ± 5℃,湿度40%~60%,每天定时清扫动物实验室,定时更换饲料和水,隔天清洗鼠笼并更换垫料。
2.2. 主要仪器设备
石蜡包埋机、倒置显微镜、酶标仪(日本OLYMPUS公司);Leica RM2235切片机(德国徕卡公司);TKD-TK摊片烤片机(孝感泰康达医疗设备有限公司);水浴锅(55~60度)、恒温摇床(上海一恒科学仪器有限公司);Centrifuger 5418高速离心机(德国Eppendorf公司);水浴恒温振荡器(大龙兴创实验仪器(北京)有限公司);组织超声破碎仪(美国SONICS公司);电泳仪(164-5050)、转移槽、凝胶成像仪(美国BIO-RAD公司)。
2.3. 主要试剂
紫金牛、铁扫帚(贵阳太升中药批发市场);脂多糖、SDS(Segma公司);电泳液、RIPA裂解液(强) (Beyotime公司);考马斯亮蓝蛋白胶快速染色液(北京索莱宝科技有限公司);Anti-Smad7 (美国R&D System公司);Anti-TGF-β1 (英国Abcam公司);Anti-Decorin (美国Santa cruz公司);Anti-Actin、蛋白酶抑制剂、PVDF膜(size: 0.45 um) (美国Millipore公司);Mouse anti-β-actin (英国Abcam公司);Anti-Mouse IgG、Anti-Goat IgG (美国Sigma公司);5 × 蛋白上样缓冲液、10% SDS、1M Tris-HCl (PH8.8)、1M Tris-HCl (PH6.8)、过硫酸铵、TEMED (Beyotime公司);Marker (美国Thermo公司);30% Acrylamide/Bis solution (29:1) (美国BIO-RAD公司);Tris (Solarbio(Cat#T8060));BCA蛋白浓度测定试剂盒(beyotime公司)。
2.4. 造模与分组
将60只大鼠随机分为健康对照组12只;COPD模型组48只(8只做模型鉴定,将造模成功的40只大鼠随机分为4组:COPD空白组、苗药高剂量组、苗药中剂量组和苗药低剂量组,每组各10只)。参照宋一平等 [11] 利用熏香烟加气管内注入脂多糖(lipopolysaccharide, LPS)的方法制备COPD大鼠模型。将COPD模型组大鼠放入几乎密闭的干燥、洁净烟熏箱(80*40*50 cm)内加以烟熏,每箱10只大鼠,每次10支香烟,一天2次,一次30分钟,两次间隔时间为6~8小时,共饲养30天,第1天和第14天不给予烟熏,从气管内注入LPS (10 mg LPS加入10 ml蒸馏水,配制成1 mg/ml的溶液) 0.2 ml/只,健康对照组除第1天和第14天以同样方法从气管内注入0.2 ml生理盐水/只外,其余时候均正常饲养。期间仔细观察记录模型组大鼠每天的体貌特征变化。第31天随机选取8只COPD模型大鼠及2只健康大鼠麻醉处死,取肺组织,肉眼观察肺组织,使用苏木精-伊红染色法(hematoxylin-eosin staining,HE染色)对肺组织石蜡切片进行检查,判定造模是否成功。
2.5. 分组治疗
COPD空白组:给予灭菌生理盐水1 ml/次灌胃,早晚各一次,连续灌胃一个月。苗药高剂量组:用高剂量苗药紫金牛、铁扫帚煎剂灌胃,1 ml/次,早晚各一次,连续灌胃治疗一个月。苗药中、低剂量组:用中、低剂量苗药按高剂量组方法进行灌胃。治疗期间密切观察记录各组大鼠的症状变化。
注:按大鼠与人的由标准体重求非标准体重的剂量公式 [12] :大鼠用药剂量Db’(mg/kg) = 成人常用剂量Da (mg/kg) × 换算系数Rab × Sb (Sb = 1/B1/3,B = 体重W/W标,大鼠标准体重为0.15 kg)。从标准体重动物的由动物a到动物b的mg/kg剂量折算表查出成人a到大鼠b换算系数Rab = 6.17,成人紫金牛、铁扫帚常用剂量分别为15~60 g/人/日 [13] 和15~30 g/人/日 [14] ,本实验中COPD模型大鼠体重约0.2 kg,故分别计算出大鼠紫金牛的剂量为1.401~5.606 g/kg/日、铁扫帚的剂量为1.401~2.803 g/kg/日。苗药紫金牛低、中、高剂量组分别为1.401 g/kg、2.803 g/kg、5.606 g/kg,铁扫帚低、中、高剂量组分别为1.401 g/kg、2.102 g/kg、2.803 g/kg。
2.6. 观察指标
2.6.1. 各苗药治疗组肺组织病理切片检查(HE染色)
于灌胃治疗结束后取各苗药治疗组做病理切片后行HE染色,观察治疗后各组大鼠肺组织病理变化。HE染色方法:将固定好的肺组织进行脱水、透明、浸蜡、包埋,切片(4 μm),脱蜡、脱水、透明,中性树脂进行封片。光镜下观察各组织病理学改变。
2.6.2. 蛋白质印迹法(Western Blot)检测蛋白
运用Western Blot检测治疗后各组大鼠肺组织中TGF-β1、Smad7、DCN的表达差异。用Pearson相关系数分析各组大鼠TGF-β1、Smad7、DCN三者之间蛋白表达的相关性。Western Blot检测方法:提取总蛋白,配制浓度为25 mg/ml蛋白标准液,稀释成0.5 mg/ml最终浓度,使每孔上样量为20 ul。用酶标仪测定590 nm的吸光度。根据样品吸光值和标准曲线计算出样品的蛋白浓度(单位:μg/μl)。蛋白变性后进行电泳,选择100V电压,跑2~2.5 h。300 MA恒流电转1~1.5 h进行转模。用TBS缓冲液将膜浸湿,然后移到5%脱脂奶粉溶液中进行封闭(室温摇床1 h)。分别进行一抗孵育(TGF-β1 1:1000、Smad7 1:1000、DCN 1:500、内参 1:5000)置于4℃冰箱孵育过夜。TBST洗膜后室温下孵育二抗(TGF-β1 (兔抗) 1:5000、Smad7 (鼠抗) 1:5000、DCN (羊抗) 1:5000、内参(鼠抗) 1:5000) 1~2 h。待二抗孵育结束后,用TBST溶液洗3次,每次洗5分钟,洗完后开始显影。将A、B两种发光液按1:1比例稀释混合,将膜蛋白面与其充分接触后使用BIO-RAD凝胶成像仪进行成像分析。
2.7. 统计数据分析
运用SPSS16.0统计软件对以上Western Blot数据资料进行统计分析,描述数据用 表示,多组之间及多重比较选择单因素方差分析(One-Way ANOVA),两组之间组间比较根据正态与否分别选用成组t检验和Wilcoxon秩和检验,用Pearson相关系数描述两个变量之间的相关性。P < 0.05为差异有统计学意义。
3. 结果
3.1. COPD大鼠模型鉴定结果
3.1.1. COPD模型大鼠症状改变及肺组织形态改变
1) 症状:造模前:毛发整齐,色泽光亮,体型圆润,精神饱满,活蹦乱跳,饮食正常;造模前期(1~10天):毛发整齐,毛色变灰,体型圆润,烦躁好动,饮食基本正常;造模中期(11~20天):毛发部分脱落,色泽变暗,身形渐瘦,精神逐渐萎靡,活动能力下降,部分呼吸急促,稍有喘息,听见些许喉间痰鸣音,饮食较对照组减少,体重增长缓慢;造模后期(20天以后):毛发脱落,色泽晦暗无光,形体消瘦,精神萎靡,懒动,呼吸急促,喘息明显,喉间闻及明显痰鸣音,饮食减少,体重较健康对照组明显减轻。
2) 肺组织形态改变:健康对照组大鼠肺组织未见膨大,色泽粉红,表面光滑有弹性;COPD模型组两肺组织均可见到体积明显膨大,色泽灰白,弹性较差容易破损,表明凹凸不平,肺切面可以见到多个肺泡融合过后形成的大的肺泡空腔,部分可见散在的囊泡突起。
3.1.2. 病理切片(HE染色)结果分析
健康对照组:大鼠肺组织肺泡、支气管上皮、支气管管腔结构完整,纤毛排列整齐,支气管管壁未见增厚,无炎性细胞浸润(见图1)。
COPD模型组:大鼠肺泡细胞融合扩大,支气管管壁破坏、管腔显著增厚、管壁周围及肺泡腔内有大量炎性物质浸润,上皮细胞脱落,纤毛粘连、倒伏甚至脱落(见图2和图3)。
3.2. 灌胃治疗过程中各组大鼠症状改变
3.2.1. 健康对照组
毛发整齐,色泽光亮,体型圆润,精神饱满,活蹦乱跳,饮食正常,体重日渐增加,无呼吸急促、喘息等。
3.2.2. COPD空白组
毛发脱落严重,色泽晦暗无光,形体明显消瘦,精神萎靡,懒动,呼吸急促,喘息明显,喉间闻及明显痰鸣音,饮食明显减少,体重逐渐减轻。
3.2.3. 苗药组
苗药各组大鼠毛发脱落逐渐减轻,色泽发黄,形体消瘦逐渐改善,神情倦怠,活动能力增强,呼吸急促、喘息症状较空白组明显减轻,喉间痰鸣音逐渐减少,饮食改善,体重逐渐增加,尤以高剂量组症状改善最为明显。
3.3. 各苗药治疗组肺组织病理切片检查(HE染色)结果
各苗药治疗组肺泡细胞融合扩大现象均较空白组减轻,支气管管壁破坏、管腔增厚均较空白组有所改善,管壁周围及肺泡腔内炎性物质浸润亦较空白组减少,尤以苗药高剂量组改善最为明显(见图4、图5、图6)。
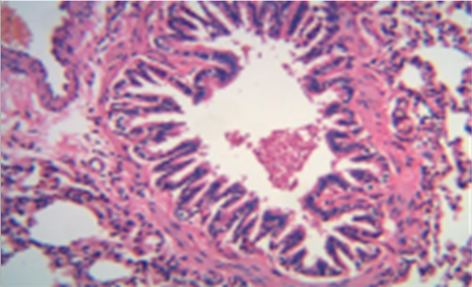 注:以上图片为大鼠肺组织HE染色光镜下×200显微照片。
注:以上图片为大鼠肺组织HE染色光镜下×200显微照片。
Figure 1. Normal control group (HE dyeing pictures)
图1. 正常对照组(HE染色图片)
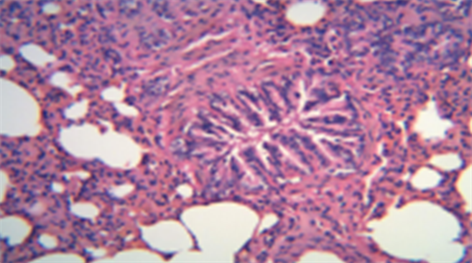 注:以上图片为大鼠肺组织HE染色光镜下×200显微照片。
注:以上图片为大鼠肺组织HE染色光镜下×200显微照片。
Figure 2. COPD Model group (HE dyeing pictures)
图2. COPD模型组(HE染色图片)
 注:以上图片为大鼠肺组织HE染色光镜下×200显微照片。
注:以上图片为大鼠肺组织HE染色光镜下×200显微照片。
Figure 3. COPD Model group (HE dyeing pictures)
图3. COPD模型组(HE染色图片)
 注:以上图片为大鼠肺组织HE染色光镜下×200显微照片。
注:以上图片为大鼠肺组织HE染色光镜下×200显微照片。
Figure 4. High-miao medicine group (HE dyeing pictures)
图4. 苗药高剂量组(HE染色图片)
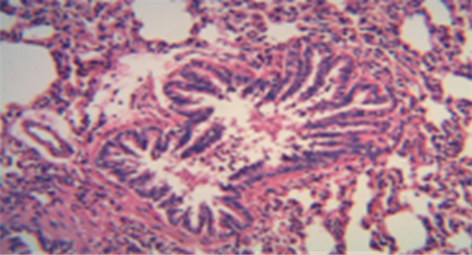 注:以上图片为大鼠肺组织HE染色光镜下×200显微照片。
注:以上图片为大鼠肺组织HE染色光镜下×200显微照片。
Figure 5. Middle-miao medicine group (HE dyeing pictures)
图5. 苗药中剂量组(HE染色图片)
 注:以上图片为大鼠肺组织HE染色光镜下×200显微照片。
注:以上图片为大鼠肺组织HE染色光镜下×200显微照片。
Figure 6. Low-miao medicine group (HE dyeing pictures)
图6. 苗药低剂量组(HE染色图片)
3.4. Western Blot结果分析
3.4.1. 各组间Smad7、DCN、TGF-β1灰度值比较
首先,对健康对照组和COPD空白组进行成组t检验,Smad7、DCN、TGF-β1灰度值均满足正态分布,方差不齐,故读取方差不齐的校正t检验结果:三者P值分别为0.000、0.037、0.000,均<0.05,故以α = 0.05为水准,认为两组Smad7、DCN、TGF-β1表达均有明显差异,且从表1可以看出COPD空白组Smad7、DCN表达较健康对照组低,TGF-β1表达较健康对照组高,说明COPD大鼠模型Smad7、DCN、TGF-β1蛋白表达较健康对照组有改变。
Table 1. Gray values of Smad7, DCN and TGF-beta 1 in lung tissues of rats in each group ( x ¯ ± s )
表1. 各组大鼠肺组织Smad7、DCN、TGF-β1灰度值( )
其次,对COPD空白组和苗药高、中、低剂量组大鼠肺组织Smad7、DCN、TGF-β1灰度值进行比较分析,并两两进行组间多重比较。
Smad7:服从正态分布,方差齐性,故用One-Way-ANOVA检验,P = 0.000 < 0.01,说明四组之间Smad7表达不全相等。经过LSD法进行组间多重比较得知:COPD空白组和苗药高、中、低剂量组比较P值均为0.000 < 0.01,均有显著性差异;苗药高剂量组与苗药中剂量组比较P值为0.067 > 0.05,无明显差异,与苗药低剂量组比较P值为0.000 < 0.01,有显著差异;苗药中剂量组和苗药低剂量组比较P = 0.000 < 0.01,有显著性差异。四组均数从高到低排列:苗药高剂量组1.191 > 苗药中剂量组1.116 > 苗药低剂量组0.950 > COPD空白组0.734,故可以认为在各COPD模型组大鼠肺组织中Smad7的表达苗药高剂量组最高,COPD空白组最低。
DCN:服从正态分布,满足方差齐性,进行One-Way-ANOVA检验,P = 0.000 < 0.01,说明四组之间DCN表达不全相等。经LSD法进行组间多重比较得知:COPD空白组和苗药高、中剂量组比较P值均为0.000 < 0.01,有显著性差异,和苗药低剂量组比较P = 0.098 > 0.05,无差异;苗药高剂量组和苗药中剂量组比较P值为0.282 > 0.05,无明显差异,与苗药低剂量组比较P = 0.001 < 0.01,有显著性差异;苗药中剂量组和苗药低剂量组比较P值为0.014 < 0.05,有明显差异。四组均数从高到低排列分别为:苗药高剂量组1.252 > 苗药中剂量组1.176 > 苗药低剂量组0.997 > COPD空白组0.879,故可以认为在各组大鼠肺组织中DCN的表达苗药高剂量组最高,COPD空白组最低。
TGF-β1:满足正态分布和方差齐性,进行One-Way-ANOVA检验,P = 0.000 < 0.01,说明四组之间TGF-β1表达不全相等。经LSD法进行组间多重比较得知:COPD空白组和苗药高、中、低剂量组比较,P值分别为0.000、0.000、0.004 < 0.01,均有显著性差异;苗药高剂量组和苗药中剂量组比较P = 0.134 > 0.05,无差异,和苗药低剂量组比较P = 0.001 < 0.05,有显著性差异;苗药中剂量组和苗药低剂量组比较P = 0.028 < 0.05,有明显差异。四组均数从低到高排列为:苗药高剂量组1.022 < 苗药中剂量组1.231 < 苗药低剂量组1.543 < COPD空白组1.962,故可以认为在各组大鼠肺组织中TGF-β1的表达苗药高剂量组最低,COPD空白组最高(Western blot部分结果见图7)。

Figure 7. Partly as a result
图7. Western blot部分结果
3.5. Smad7、DCN、TGF-β1相关性分析
COPD模型组:COPD空白组、苗药高、中、低剂量组大鼠Smad7、DCN、TGF-β1蛋白含量均服从正态分布,对其两两进行总体相关性分析,用Pearson相关系数描述,结果如下:
1) Smad7与DCN之间的相关性:r = 0.621,P = 0.000 < 0.01,可以认为COPD大鼠模型肺组织中Smad7和DCN呈正性相关。
2) Smad7与TGF-β1之间的相关性:r = −0.650,P = 0.000 < 0.01,可以认为COPD大鼠模型肺组织中Smad7和TGF-β1呈负性相关。
3) DCN与TGF-β1之间的相关性:r = −0.542,P = 0.000 < 0.01,可以认为COPD大鼠模型肺组织中DCN和TGF-β1呈负性相关。
4. 结论
烟熏加气管内注射脂多糖导致实验大鼠出现COPD病理性改变。各苗药组肺组织形态较COPD空白组有所改善,尤以苗药高剂量组最为明显。经苗药治疗后,COPD大鼠模型症状均有所缓解,尤以苗药高剂量组缓解最为明显。在COPD大鼠模型组肺组织中,TGF-β1含量显著升高,DCN、Smad7显著降低;经苗药紫金牛、铁扫帚干预治疗后,苗药治疗组TGF-β1明显降低,DCN、Smad7明显升高,综合比较后发现尤以苗药高剂量组变化最为明显,说明苗药高剂量组疗效最佳。TGF-β1与Smad7、DCN均呈负性相关,Smad7与DCN呈正性相关,紫金牛、铁扫帚治疗COPD大鼠模型可能与以下机制有关:1) 通过上调Smad7在COPD大鼠模型体内的表达,保证TGF-Smads信号传导通路的正常作用,抑制TGF-β1对气道重塑的促进作用。2) 上调COPD大鼠模型体内TGF-β拮抗剂DCN的表达,使TGF-β1失活,并解除了其过度表达对Smad7的抑制作用,DCN与Smad7相互协同、相互促进,并促进TGF-Smad7信号传导通路的恢复,二者起到共同抑制TGF-β1过表达的作用,对COPD大鼠模型的气道重塑起到改善作用。
基金项目
DCN对COPD大鼠气道重塑信号传导通路的干预及苗药对其影响。项目编号:贵州省科技厅立项资助(黔科合SY字[2013] 3071号);补肾苗药双肾草通过HPA轴调控COPD大鼠气道炎症的机制研究。项目编号:贵州省卫生厅立项资助(黔省专合字[2012] 189号);苗药紫冬煎对COPD大鼠DCN、TGF-Smads信号通路的干预及对不同时期COPD患者临床疗效的观察。项目编号:贵州省中医药管理局中医药、民族医药科学技术研究专项课题(QZYY-2015-017);苗药验方久喘煎对COPD缓解期的临床疗效研究。项目编号:贵州省科技合作计划项目(黔科合LH字[2015] 7258号);苗医药基本理论的深化、拓展及应用研究。项目编号:贵州省科技合作计划项目(黔科合J重大字[2015] 2002)。
文章引用
刘明慧,周 洵,王 美,李改改. 紫金牛、铁扫帚对COPD大鼠气道DCN、Smad7的干预研究
Study on the Intervention of Ardisia japonica and Lespedeza cuneata on Airway DCN Smad7 of COPD Rats[J]. 中医学, 2019, 08(05): 314-324. https://doi.org/10.12677/TCM.2019.85052
参考文献
- 1. 钟南山, 刘又宁. 呼吸病学[M]. 第二版. 北京: 人民卫生出版社, 2015: 546.
- 2. Jeffery, P.K. (2001) Remonde-ling in Asthma and Chronic Obstructive Lung Disease. American Journal of Respiratory and Critical Care Medicine, 164, S28-S38. https://doi.org/10.1164/ajrccm.164.supplement_2.2106061
- 3. Sin, D.D. and Man, S.F. (2003) Why Are Patients with Chronic Obstructive Pulmonary Disease at Increased Risk of Cardiovascular Diseases? The Potential Role of Systemic Inflammation in Chronic Obstructive Pulmonary Disease. Circulation, 107, 1514-1519. https://doi.org/10.1161/01.CIR.0000056767.69054.B3
- 4. Chapman, H.A. (2004) Disorders of Lung Matrix Remodeling. The Journal of Clinical Investigation, 113, 148-157. https://doi.org/10.1172/JCI20729
- 5. 邓虎, 王晓旭, 毛相裕, 等. TGF-β1/Smad信号转导通路在慢性阻塞性肺疾病中的研究进展[J]. 世界中西医结合杂志, 2014, 9(12): 1350-1354.
- 6. 郭永红, 罗金燕. TGF-β超家族与Smad信号转导通路研究进展[J]. 医学综述, 2005, 11(8): 685-688.
- 7. 张素平. Smad7通过干扰Smad-DNA复合物的形成抑制TGF-β信号[D]: [博士学位论文]. 北京: 清华大学, 2006.
- 8. 戎彪学. Decorin mRNA、p57KIP2 mRNA与TGF-β1在肺癌中的表达及临床意义[D]: [硕士学位论文]. 兰州: 兰州大学, 2006.
- 9. 中华医学会呼吸病学分会慢性阻塞性肺疾病学组. 慢性阻塞性肺疾病诊治指南(2013年修订版) (一) [J]. 全科医学临床与教育, 2013, 11(5): 484-491.
- 10. 中华中医药学会内科分会肺系病专业委员会. 慢性阻塞性肺疾病中医诊疗指南(2011版) [J]. 中医杂志, 2012, 53(1): 80-84.
- 11. 宋一平, 崔德建, 茅培英, 等. 慢性阻塞性肺疾病大鼠模型气道重塑及生长因子的研究[J]. 中华结核和呼吸杂志, 2001, 24(5): 283-287.
- 12. 魏伟, 吴希美, 李元建. 药理实验方法学[M]. 第4版. 北京: 人民卫生出版社, 2010: 71.
- 13. 《全国中草药汇编》编写组. 全国中草药汇编上册[M]. 第2版. 北京: 人民卫生出版社, 1996: 864-865.
- 14. 《全国中草药汇编》编写组. 全国中草药汇编上册[M]. 第2版. 北京: 人民卫生出版社, 1996: 723-724.
