Open Journal of Nature Science
Vol.04 No.04(2016), Article ID:18854,7
pages
10.12677/OJNS.2016.44045
The Impact of GSK-3β on the Replication of Influenza Virus in A549 Cells
Xinxian Dai1*, Lishu Zhang2, Hongya Han2
1National Vaccine & Serum Institute, Beijing
2School of Science, Beijing Jiaotong University, Beijing

Received: Oct. 12th, 2016; accepted: Oct. 29th, 2016; published: Nov. 1st, 2016
Copyright © 2016 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Objective: In order to clarify the role of glycogen synthase kinase-3β (GSK-3β) in the process of influenza virus infection. Methods: We preformed the RNAi to knock down the GSK-3β gene expression, then we determined the virus titers in the A549 cell supernatants by performing TCID 50 assay, and examined the influence of GSK-3β to cell viabilities of the infected cells as well as the influenza virus-induced A549 cell apoptosis using CCK-8 Kit and Caspase-Glo 3/7 Kit. Results: The results demonstrated that down-regulation of GSK3 expression decreased the viral titers in the A549 cells supernatants. Down-regulation of GSK-3β expression decreased the A549 cell viability, at the same time, increased the influenza virus induced cell apoptosis. Conclusion: Hence, GSK-3β negatively regulated the influenza virus-induced host cell apoptosis, and it was essential for the efficient replication of influenza virus.
Keywords:Virology, Influenza Virus, Cell Apoptosis, Glycogen Synthase Kinase-3β, Viral-Host Interaction

GSK-3β对流感病毒在A549细胞中复制的影响
戴新宪1*,张丽姝2,韩鸿雅2
1北京生物制品研究所有限责任公司,北京
2北京交通大学理学院,北京

收稿日期:2016年10月12日;录用日期:2016年10月29日;发布日期:2016年11月1日

摘 要
目的:明确GSK-3β在流感病毒感染过程中所发挥的作用。方法:我们应用RNA干扰技术下调GSK-3β的表达水平后,用TCID50法测定A549细胞上清中的流感病毒滴度,并使用CCK-8细胞活力检测试剂盒和Caspase-Glo凋亡检测试剂盒检测了GSK-3β对流感病毒感染A549细胞活力及流感病毒诱导的A549细胞凋亡的影响。结果:下调GSK-3β的表达降低了流感病毒感染A549细胞上清中的病毒滴度,并且GSK-3β的表达下调还降低了流感病毒感染A549细胞的细胞活力同时增强了流感病毒诱导的细胞凋亡。结论:GSK-3β对流感病毒诱导的宿主细胞凋亡具有负调节作用并且是病毒在细胞中高效复制所必需的。
关键词 :病毒学,流感病毒,细胞凋亡,糖原合成激酶-3β,病毒与宿主相互作用

1. 引言
糖原合成激酶-3(GSK-3)是在哺乳动物细胞中普遍表达的丝氨酸/苏氨酸激酶 [1] [2] 。虽然GSK-3是因为可以磷酸化糖原合成酶而阻止糖原合成而被发现,但是很快发现它可以磷酸化多达50种底物,这些众多的底物使得GSK-3参与了很多的细胞过程 [3] 。对于细胞凋亡的影响,GSK-3表现出两面性,GSK-3可以促进由线粒体途径介导的内源性细胞死亡信号传导,而对于死亡受体介导的外源性凋亡信号传导产生抑制 [4] 。本文研究了GSK-3β对甲型流感病毒在A549细胞中复制的影响以及它在流感病毒感染诱导的宿主细胞凋亡中的作用。
2. 材料与方法
2.1. 材料
2.1.1. 细胞株和病毒株
A549 (人肺腺癌上皮细胞)为本室保存;MDCK (狗肾细胞)为中国医学科学院病原所王健伟研究员惠赠;毒株为Influenza A virus A/Puerto Rico/8/34 (H1N1)。
2.1.2. 主要试剂和仪器
细胞培养基DMEM,胎牛血清和真核转染试剂Lipofectamine 2000购自Invitrogen公司;CCK-8细胞增殖检测试剂盒购自同仁化学;Caspase-Glo 3/7细胞凋亡检测试剂盒购自Promega公司;细胞总蛋白提取试剂盒购自碧云天生物技术研究所;NC膜购自Millipore公司;GSK-3β单克隆抗体购自Cell Signaling Technology公司;流感病毒NP单克隆抗体购自Millipore公司;二抗购自北京中杉金桥生物技术有限公司;ECL超敏发光底物为Thermo公司产品;显影胶片为Kodak公司产品;细胞核染料DAPI购自Sigma公司;倒置荧光显微镜TE2000-S为Nikon公司产品;酶标仪;siRNA由上海吉玛制药技术有限公司合成,序列如下:阴性对照,UUCUCCGAACGUGUCACGUTT;GSK-3β,GUAAUCCACCUCUGGCUACTT。
2.2. 方法
2.2.1. 病毒感染
A549细胞使用DMEM培养基37℃培养,细胞长满后按1:3传代,待细胞汇合度至70%~80%时,PBS洗涤细胞3次,换含有病毒原液的病毒吸附液,接毒剂量为m.o.i = 5.37℃于二氧化碳孵箱中吸附1小时,弃吸附液,PBS洗涤3次,换病毒维持液后置于二氧化碳培养箱37℃继续培养。
2.2.2. GSK-3β基因沉默
将A549细胞按照5000个每孔的密度铺96孔板,37℃过夜培养,按照每孔5pmol siRNA和0.25 ul脂质体的条件进行转染,设置对照组和实验组各3个平行孔,操作按照Lipofectamine 2000说明书,在转染后48小时进行接毒等实验。
2.2.3. 细胞间接免疫荧光
接毒后不同时间的A549经PBS洗涤后用4%多聚甲醛室温固定15分钟,0.1% Triton X-100透膜20分钟,PBS洗涤3次,1%BSA室温封闭1小时,加入按1:500稀释于PBS中的流感病毒NP蛋白单克隆抗体,4℃于湿盒中孵育过夜。PBS洗涤3次,加入按1:100稀释的罗丹明标记的羊抗小鼠IgG抗体,室温孵育2小时,PBS洗涤3次,DAPI染色后置于倒置荧光显微镜下观察。
2.2.4. 细胞活力的测定
将A549细胞铺96孔板,24小时后转染阴性对照siRNA,GSK-3β siRNA,48小时后以m.o.i = 5感染流感病毒。感染24小时后,每孔加入10μl CCK-8试剂,放入二氧化碳培养箱37℃继续放置2小时。取出96孔板,使用酶标仪测定450 nm处吸收值。
2.2.5. 细胞凋亡的检测
将A549细胞铺96孔板,24小时后转染阴性对照siRNA,GSK-3β siRNA,48小时后以m.o.i = 5感染流感病毒。感染24小时后取出,待温度降至室温后每孔加入100 μl Caspase-Glo 3/7试剂,使用荧光读板机测定562 nm处吸收值。
2.2.6. SDS-PAGE与蛋白免疫印迹
病毒感染后一定时间收集的A549细胞用试剂盒提取总蛋白,操作按说明书,调整蛋白浓度后,加5×上样缓冲液并煮样变性,每孔上等量蛋白样品。进行SDS聚丙烯酰胺电泳,12%分离胶和5%积层胶,80V电泳120分钟后将蛋白转移至NC膜,室温封闭2小时,分别加入一抗,稀释度如下:GSK-3β (1:1000)、GAPDH (1:10,000),4℃缓缓摇动过夜孵育。辣根过氧化酶标记二抗稀释度为1:5000,室温孵育2小时后加入ECL底物于暗室中压片、洗片。
2.2.7. 病毒滴度测定
感染流感病毒24小时的A549细胞上清液,取100 μl使用铺于96孔板的MDCK细胞测定组织半数感染量(TCID 50),然后计算病毒滴度。
3. 结果
3.1. 流感病毒在A549细胞中的复制
流感病毒可以在人肺腺癌上皮细胞中高效的复制,我们用甲型流感病毒PR8株以m.o.i = 5感染A549细胞,在感染后不同时间点进行间接免疫荧光来检测流感病毒的核蛋白来反映流感病毒在A549细胞内的复制情况。如图1所示,相对于未感染对照组,感染流感病毒3小时后,细胞内即出现明显的NP蛋白表达,NP蛋白的表达量随感染时间逐渐上升,并且由细胞核逐渐输出至细胞浆,感染24小时后,几乎所有细胞均被感染。我们在8小时,12小时和24小时检测A549细胞悬液中的病毒滴度,如图2所示,病毒滴度随时间上升。
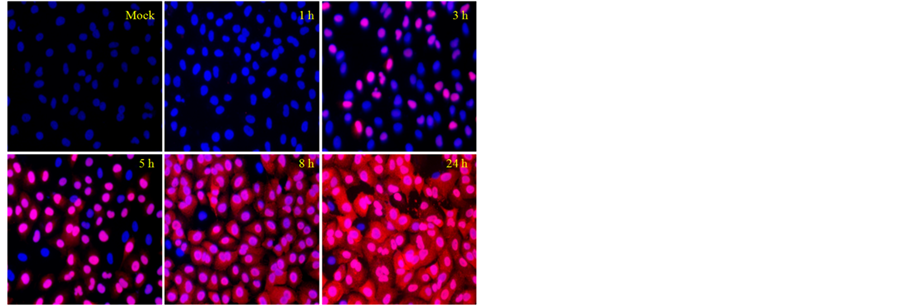
Figure 1. Indirect immunofluorescent of influenza virus NP protein (20 × 10)
图1. 流感病毒NP蛋白间接免疫荧光(20 × 10)
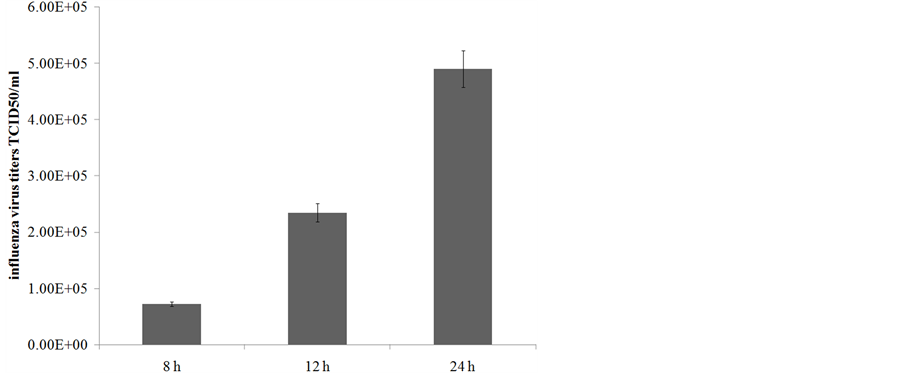
Figure 2. Viral titers at various time points after infection
图2. 感染流感病毒后不同时间的病毒滴度
3.2. GSK-3β基因沉默效果
为了验证基因沉默效果我们用GSK-3β的抗体检测了蛋白表达水平,如图3所示,转染了GSK-3β siRNA的细胞相对于转染了阴性对照siRNA的A549细胞,GSK-3β的表达水平明显下调。Bandscan 5.0灰度扫描结果显示,转染了GSK-3β siRNA后,GSK-3β的表达量下降为对照的60%左右(图3)。
3.3. GSK-3β对流感病毒滴度的影响
为了研究GSK-3β对于流感病毒复制的影响,我们测定了转染阴性对照siRNA组和转染GSK-3βsiRNA组A549细胞感染流感病毒后24小时的细胞上清中的病毒滴度,如图4所示,阴性对照组的24小时细胞上清中的病毒滴度明显高于GSK-3β转染组。
3.4. GSK-3β对流感病毒感染的A549细胞活力的影响
转染阴性对照siRNA和GSK-3β siRNA 48小时后的A549细胞以m.o.i = 5感染流感病毒,24小时后测定A549细胞的细胞活力。在感染流感病毒24小时后,GSK-3β表达下调的A549细胞活力明显低于转染阴性对照siRNA的A549细胞(图5)。
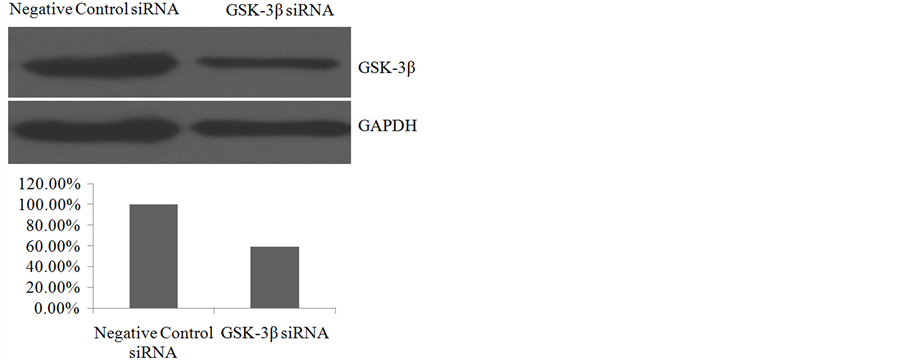
Figure 3. The expression levels of GSK-3β, GAPDH as a loading control
图3. GSK-3β的表达水平,GAPDH作为上样内参
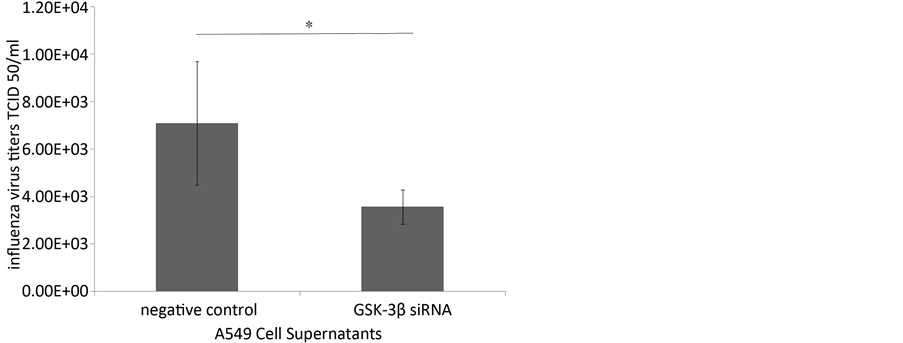
Figure 4. The influenza virus titers of A549 cell supernatants at 24 hours (*P < 0.05)
图4. 24小时细胞A549细胞上清中的流感病毒滴度(*P < 0.05)

Figure 5. The influence of GSK-3β on cell viability (*P < 0.05)
图5. GSK-3β对细胞活力的影响(*P < 0.05)
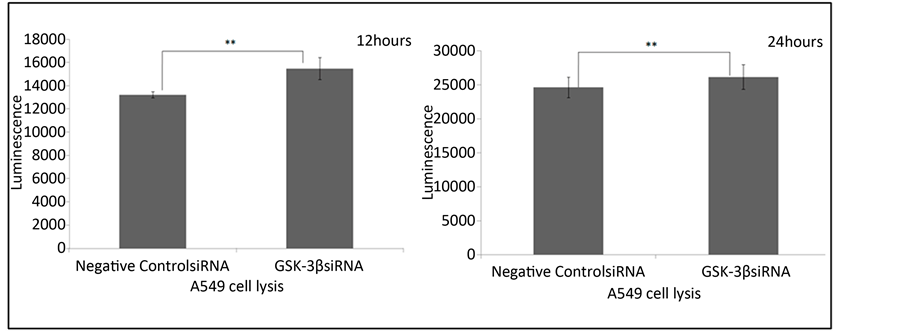
Figure 6. The regulation of influenza virus induced apoptosis by GSK-3β (**P < 0.01)
图6. GSK-3β对流感病毒诱导的细胞凋亡的调节(**P < 0.01)
3.5. GSK-3β对流感病毒诱导的宿主细胞凋亡的影响
在感染的后期,流感病毒可以使宿主细胞发生明显的凋亡。我们使用Caspase-Glo 3/7凋亡检测试剂盒流感病毒感染过程中A549细胞凋亡的情况。如图6所示,在流感病毒感染12小时和24小时的A549细胞中,GSK-3β siRNA转染组与阴性对照siRNA转染组相比,A549细胞凋亡水平升高。
4. 讨论
细胞凋亡也称为细胞程序性死亡(Programmed Cell Death),是细胞应对细胞损伤或病毒感染等外界压力而产生的应答反应。在流感病毒感染细胞时,细胞发生快速凋亡可以缩短流感病毒的复制过程以达到抵抗病毒复制的目的。GSK-3β对于细胞凋亡的调控比较复杂,对于由DNA损伤、内质网压力、氧化应激和生长因子缺失照成的细胞凋亡有促进作用 [5] [6] [7] [8] [9] ,而对于由肿瘤坏死因子和死亡受体引起的凋亡则起到抑制作用 [10] 。GSK-3β还可以调节一些参与凋亡控制的转录因子和翻译因子的表达水平并以此参与细胞凋亡的调控 [8] [9] [11] [12] [13] 。
此前有研究报道GSK-3β在流感病毒感染过程中磷酸化水平增加 [14] 。为了明确GSK-3β在流感病毒感染过程中所起的作用,我们应用RNA干扰技术对细胞内GSK-3β的表达进行阻断,蛋白免疫印迹检测GSK-3β的表达下降为对照组的60%左右。我们发现GSK-3β基因表达下调降低了流感病毒感染的A549细胞上清中的病毒滴度,提示GSK-3β在流感病毒在A549细胞中高效复制过程中起到了重要作用。同时我们发现GSK-3β的表达下调降低了宿主细胞活力;GSK-3β表达下调组的Caspase 3/7活性增强即宿主细胞凋亡水平提高。综合分析,上述研究结果提示GSK-3β参与了流感病毒感染诱导的宿主细胞凋亡的调控,很可能该分子通过抑制流感病毒感染细胞的凋亡而为流感病毒在细胞内的复制和增殖提供条件。流感病毒是通过哪些信号通路促发了GSK-3β的抗凋亡效应以及这一效应具体是经由哪些分子或过程来实现的,尚有待进一步研究。揭示流感病毒感染过程中的复杂的病毒-宿主相互作用将为流感病毒的防治提供新的线索。
5. 结论
1) 使用Caspase-Glo 3/7凋亡检测试剂盒,我们发现GSK-3β表达下调可以增强流感病毒造成的宿主细胞凋亡。
2) GSK-3β的表达下调造成了流感病毒滴度的下降,说明GSK-3β在流感病毒的复制中发挥重要作用。
基金项目
国家自然科学基金资助项目(30700696)。
文章引用
戴新宪,张丽姝,韩鸿雅. GSK-3β对流感病毒在A549细胞中复制的影响
The Impact of GSK-3β on the Replication of Influenza Virus in A549 Cells[J]. 自然科学, 2016, 04(04): 371-377. http://dx.doi.org/10.12677/OJNS.2016.44045
参考文献 (References)
- 1. Embi, N., Rylatt, D.B. and Cohen, P. (1980) Glycogen Synthase Kinase-3 from Rabbit Skeletal Muscle. Separation from Cyclic-AMP-Dependent Protein Kinase and Phosphorylase Kinase. European Journal of Biochemistry, 107, 519- 527. http://dx.doi.org/10.1111/j.1432-1033.1980.tb06059.x
- 2. Rylatt, D.B., Aitken, A., Bilham, T., Condon, G.D., Embi, N. and Cohen, P. (1980) Glycogen Synthase from Rabbit Skeletal Muscle. Amino Acid Sequence at the Sites Phosphorylated by Glycogen Synthase Kinase-3, and Extension of the N-Terminal Sequence Containing the Site Phosphorylated by Phosphorylase Kinase. European Journal of Biochemistry, 107, 529-537. http://dx.doi.org/10.1111/j.1432-1033.1980.tb06060.x
- 3. Jope, R.S. and Johnson, G.V. (2004) The Glamour and Gloom of Glycogen Synthase Kinase-3. Trends in Biochemical Sciences, 29, 95-102. http://dx.doi.org/10.1016/j.tibs.2003.12.004
- 4. Beurel, E. and Jope, R.S. (2006) The Paradoxical Pro- and An-ti-Apoptotic Actions of GSK3 in the Intrinsic and Extrinsic Apoptosis Signaling Pathways. Progress in Neurobiology, 79, 173-189. http://dx.doi.org/10.1016/j.pneurobio.2006.07.006
- 5. Chin, P.C., Majdzadeh, N. and D’Mello, S.R. (2005) Inhibition of GSK3β Is a Common Event in Neuroprotection by Different Survival Factors. Molecular Brain Research, 137, 193-201. http://dx.doi.org/10.1016/j.molbrainres.2005.03.004
- 6. Shin, S.Y., Kim, C.G., Jho, E.-H., Rho, M.-S., Kim, Y.S., Kim, Y.-H. and Lee, Y.H. (2004) Hydrogen Peroxide Negatively Modulates Wnt Signaling through Downregulation of β-Catenin. Cancer Letters, 212, 225-231. http://dx.doi.org/10.1016/j.canlet.2004.03.003
- 7. Srinivasan, S., Ohsugi, M., Liu, Z., Fatrai, S., Bernal-Mizrachi, E. and Permutt, M.A. (2005) Endoplasmic Reticulum Stress-Induced Apoptosis Is Partly Mediated by Reduced Insulin Signaling through Phosphatidylinositol 3-Kinase/Akt and Increased Glycogen Synthase Kinase-3β in Mouse Insulinoma Cells. Diabetes, 54, 968-975. http://dx.doi.org/10.2337/diabetes.54.4.968
- 8. Watcharasit, P., Bijur, G.N., Song, L., Zhu, J., Chen, X. and Jope, R.S. (2003) Glycogen Synthase Kinase-3β (GSK3β) Binds to and Promotes the Actions of p53. The Journal of Biological Chemistry, 278, 48872-48879. http://dx.doi.org/10.1074/jbc.M305870200
- 9. Watcharasit, P., Bijur, G.N., Zmijewski, J.W., Song, L., Zmijewska, A., Chen, X., Johnson, G.V.W. and Jope, R.S. (2002) Direct, Activating Interaction between Glycogen Synthase Kinase-3β and p53 after DNA Damage. Proceedings of the National Academy of Sciences of the United States of America, 99, 7951-7955. http://dx.doi.org/10.1073/pnas.122062299
- 10. Song, L., Zhou, T. and Jope, R.S. (2004) Lithium Facilitates Apoptotic Signaling Induced by Activation of the Fas Death Domain-Containing Receptor. BMC Neuroscience, 5, 1-7. http://dx.doi.org/10.1186/1471-2202-5-20
- 11. Bournat, J.C., Brown, A.M.C. and Soler, A.P. (2000) Wnt-1 Dependent Activation of the Survival Factor NF-κB in PC12 Cells. Journal of Neuroscience Research, 61, 21-32. http://dx.doi.org/10.1002/1097-4547(20000701)61:1<21::AID-JNR3>3.0.CO;2-7
- 12. Ciani, L. and Salinas, P.C. (2005) WNTs in the Vertebrate Nervous System: From Patterning to Neuronal Connectivity. Nature Reviews. Neuroscience, 6, 351-362. http://dx.doi.org/10.1038/nrn1665
- 13. Zmijewski, J.W. and Jope, R.S. (2004) Nuclear Accumulation of Glycogen Synthase Kinase-3 during Replicative Senescence of Human Fibroblasts. Aging Cell, 3, 309-317. http://dx.doi.org/10.1111/j.1474-9728.2004.00117.x
- 14. Ehrhardt, C., Wolff, T., Pleschka, S., Planz, O., Beermann, W., Bode, J.G., Schmolke, M. and Ludwig, S. (2007) Influenza A Virus NS1 Protein Activates the PI3K/Akt Pathway to Mediate Antiapoptotic Signaling Responses. Journal of Virology, 81, 3058-3067. http://dx.doi.org/10.1128/JVI.02082-06