Journal of Organic Chemistry Research
Vol.03 No.01(2015), Article ID:14817,9
pages
10.12677/JOCR.2015.31003
The Study of Antioxidation and Reducing Ability of Polysaccharides from Pogonatherum crinitum
Fenling Li, Hanquan Cai, Lisheng Chen
Hanshan Normal University, Chaozhou Guandong
Email: lfl8832@126.com
Received: Jan. 23rd, 2015; accepted: Feb. 3rd, 2015; published: Feb. 10th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
The ultrasonic extraction method was used to extract the polysaccharide from Pogonatherum crinitum. The clearing hydroxyl radical ( ) and the superoxide anion (
) and the superoxide anion ( ) activity of purified polysaccharide were operated to evaluate polysaccharide in vitro antioxidant activity; hydroxyl radical (
) activity of purified polysaccharide were operated to evaluate polysaccharide in vitro antioxidant activity; hydroxyl radical ( ) was produced by Fenton reaction, and superoxide anion (
) was produced by Fenton reaction, and superoxide anion (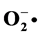 ) was produced by pyrogallol autoxidation. The spectrophotometric method was used to determine the sodium nitrite removal ability of the extracted polysaccharide solution of different concentrations. The results showed that the Pogonatherum crinitum polysaccharide has good scavenging ability not only on superoxide anion and hydroxyl radical, but also on sodium nitrite.
) was produced by pyrogallol autoxidation. The spectrophotometric method was used to determine the sodium nitrite removal ability of the extracted polysaccharide solution of different concentrations. The results showed that the Pogonatherum crinitum polysaccharide has good scavenging ability not only on superoxide anion and hydroxyl radical, but also on sodium nitrite.
Keywords:Pogonatherum crinitum, Polysaccharide, Ultrasonic, Hydroxyl Radical ( ), Superoxide Anion (
), Superoxide Anion (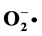 )
)

金丝草多糖的抗氧化性及还原能力的研究
李粉玲,蔡汉权,陈利生
广东韩山师范学院,广东 潮州
Email: lfl8832@126.com
收稿日期:2015年1月23日;录用日期:2015年2月3日;发布日期:2015年2月10日

摘 要
采用超声波浸取法从金丝草中提取多糖,纯化后的多糖通过清除Fenton反应产生的羟自由基(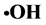 )、邻苯三酚自氧化体系产生的超氧阴离子(
)、邻苯三酚自氧化体系产生的超氧阴离子( )的能力评价金丝草多糖体外抗氧化活性;以及采用分光光度法测定了不同浓度的多糖溶液提取液对亚硝酸钠的清除能力。研究结果表明金丝草多糖对超氧阴离子和羟基自由基具有良好的清除能力,同时对亚硝酸钠也有一定的清除能力。
)的能力评价金丝草多糖体外抗氧化活性;以及采用分光光度法测定了不同浓度的多糖溶液提取液对亚硝酸钠的清除能力。研究结果表明金丝草多糖对超氧阴离子和羟基自由基具有良好的清除能力,同时对亚硝酸钠也有一定的清除能力。
关键词 :金丝草,多糖,超声波,羟自由基( ),超氧阴离子(
),超氧阴离子( ),抗氧化性
),抗氧化性

1. 引言
金丝草,别名黄毛草、猫毛草、落苏、毛毛草、笔仔草、伯公须、猫仔草、猪毛草、马尾丝、狐狸尾、后坎草、笔须草、墙头竹[1] ;为禾本科,单子叶植物纲,被子植物门;其拉丁文名Pogonatherum crinitum (Thunb) Kunth,全草入药[2] 。据《中华本草》记载,金丝草性凉味甘,淡,无毒,清热,解暑,利尿,用于感冒高热,中暑,尿路感染,肾炎水肿,黄疸型肝炎,糖尿病等[3] 。金丝草主要含黄酮甙,酚类,氨基酸,有机酸和糖类[4] ,主要分布在亚热带温带,广东、福建、浙江、江西、台湾、湖南、广西、四川、云南等地,资源十分丰富。
多糖(polysaccharide)是一类天然大分子化合物,是由10个以上的单糖基通过糖苷糖键连接而成,其性质大大不同单糖,是除核酸和蛋白质以外的另一个重要生命物质,具有调节细胞生长与衰老等多种复杂的功能。近年来随着研究的深入与提法方法纯度及得率的提高,多糖作为抗氧化药物被得到了广泛的应用[5] 。
自由基,主要包括超氧阴离子自由基( ),羟自由基(
),羟自由基(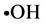 )、氮氧自由基等,可与生物体内的许多物质如脂肪酸,蛋白质等作用,夺取它们的氢原子,造成相关细胞的结构与功能的破坏,更重要的是其氧化产物和中间产物会伤害生物膜、酶、蛋白质及活细胞功能。因此,对自由基和亚硝基清除能力的研究与相关疾病的防治有着重要的意义。
)、氮氧自由基等,可与生物体内的许多物质如脂肪酸,蛋白质等作用,夺取它们的氢原子,造成相关细胞的结构与功能的破坏,更重要的是其氧化产物和中间产物会伤害生物膜、酶、蛋白质及活细胞功能。因此,对自由基和亚硝基清除能力的研究与相关疾病的防治有着重要的意义。
本实验通过邻苯三酚自氧化法、水杨酸法比色法分别测定金丝草多糖清除超氧阴离子自由基( )以及羟基自由基(
)以及羟基自由基(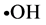 )的效果、还原能力的测定以及在模拟人体胃液条件下,采用分光光度法测定了同一体积不同浓度的多糖溶液提取液对亚硝酸钠的清除能力。
)的效果、还原能力的测定以及在模拟人体胃液条件下,采用分光光度法测定了同一体积不同浓度的多糖溶液提取液对亚硝酸钠的清除能力。
2. 材料和方法
2.1. 材料
金丝草:购于市场。将金丝草洗净、晾干,在干燥箱中60℃下干燥,然后将其研磨成粉,过100目筛,装入磨口瓶备用。
2.2. 实验仪器
JFSD-100II高效粉碎机(上海嘉定粮油仪器有限公司);
FA2004N电子分析天平(上海精密科学仪器有限公司);
Spectrumlab 752S紫外分光光度计(上海棱光技术有限公司);
KQ-500DB型数控超声波清洗器(昆山市超声仪器有限公司);
800型离心机(上海手术器械厂);
KDM型调温电热套(山东省鄄城永兴仪器厂);
SHZ-D(III)循环水式真空泵(巩义市英峪予华仪器厂);
101-1A型数显电热鼓风干燥箱(上海协达计控设备公司通州医科仪器厂);
予华牌KQ-B型玻璃仪器气流烘干器(河南省巩义市英峪予华仪器有限责任公司);
ET-Q型气浴恒温振荡器(常州荣冠实验分析仪器厂);
烧杯、量筒、试管、移液管、离心管、容量瓶、分液漏斗、圆底烧瓶、碘量瓶若干。
2.3. 实验试剂
以下试剂均为市售国产分析纯。
2.4. 金丝草多糖的提取 [6] - [9]
2.4.1. 超声辅助提取 [6] [7]
超声辅助提取工艺条件为金丝草粉碎后过100目,原料称取1.00 g以水为提取剂,提取温度55℃、提取时间20 min、超声波功率50 W、料液比1:20 (g/ml)在此条件下多糖得率为草多糖得率为20.75%。
2.4.2. 金丝草多糖的预处理
称取适量的金丝草样品,于圆底烧瓶中经石油醚(60℃~90℃)和95%乙醇(1:1)混合液回流脱脂2次,1 h/次,除去单糖和低聚糖。将脱脂后样品放入烘箱烘干至恒重,保存于磨口瓶,用于下面多糖的提取。
2.4.3. 金丝草多糖的提取工艺
准确称取脱脂后金丝草样品于碘量瓶中,加入一定比例蒸馏水(料液比),在某一温度(浸提温度),某一功率(超声波功率)下超声波浸提一段时间,趁热减压抽滤,收集滤液。相同条件下,滤渣进行二次浸提。合并滤液并浓缩至2~3 ml,滤液加入4倍95%乙醇醇析,冷藏静置过夜。离心收集沉淀,用95%乙醇洗涤至洗涤液无色,干燥,得深褐色粗多糖。
粗多糖用一定比例的蒸馏水溶解于碘量瓶中,用Sevage法除蛋白。多糖溶液:氯仿:正丁醇 = 5:1:0.2。置于振荡器中充分振荡,取出后倒入分液漏斗,静置两小时。随后分液脱去蛋白,取其上层溶液即为金丝草多糖提取液。
将剩余金丝草多糖提取液浓缩至2~3 ml,加入4倍95%乙醇醇析,冷藏静置过夜。离心收集沉淀,用95%乙醇洗涤至洗涤液无色,干燥,得精制多糖。
3. 抗氧化性的研究
3.1. 清除(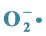 )自由基活性 [10] - [12]
)自由基活性 [10] - [12]
3.1.1. 实验原理
邻苯三酚自氧化过程为链式反应,可产生( )其自身氧化产物的含量可用分光光度仪检测。在pH 值<9.0时,邻苯三酚自氧化速率与(
)其自身氧化产物的含量可用分光光度仪检测。在pH 值<9.0时,邻苯三酚自氧化速率与( )生成的浓度呈正相关,故可通过紫外可见光分光光度仪来定量测定抗氧化剂在此体系中对(
)生成的浓度呈正相关,故可通过紫外可见光分光光度仪来定量测定抗氧化剂在此体系中对(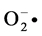 )的清除作用,间接评价抗氧化剂的抗氧化能力[12] 。
)的清除作用,间接评价抗氧化剂的抗氧化能力[12] 。
3.1.2. 实验步骤
准确地将金丝草多糖配成1.4 mg/ml,用蒸馏水将该溶液稀释成种浓度:0.2 mg/ml、0.4 mg/ml 、0.6 mg/ml、0.8 mg/ml、1.0 mg/ml、1.2 mg/ml、1.4 mg/ml。将于试管中加1.0 ml蒸馏水,pH 7.8的Tris-HCl缓冲液(含2 mmol EDTA二钠)和80 mmol/L邻苯三酚(10 mmol/L HCl作溶剂配制,4℃保存备用)在(25 ± 0.5)℃的恒温水浴锅中保温20 min后,取2.8 ml pH 7.8 Tris-HCl缓冲液,加0.1 ml 10 mM盐酸和0.1 ml 80 mmol/L邻苯三酚,混合均匀,加完马上计时,在25℃水浴中准确反应4 minz,马上加入8 mol/L盐酸3滴终止反应,在320 nm吸光度(以pH 7.8 Tris-HCl缓冲液为空白),计算出邻苯三酚的自氧化吸光度A0。样品测定:不同浓度的多糖溶液1.0 ml,重复以上实验步骤,在320 nm测吸光度A1。样品本底测定:不同浓度的多糖溶液1.0 ml,以0.1 ml 10 mM盐酸代替80 mmol/L邻苯三酚,重复以上实验步骤,在320 nm测吸光度A2,平行测定三次(见表1)。
3.1.3. 计算方法
按下式计算抑制率:
抑制率(%) = ((A0 − (A1 − A2))/A0) × 100%
式中:A0为邻苯三酚自氧化吸光度;A1为加入样品后邻苯三酚自氧化吸光度;A2为样品本底吸光度。
由图1可以看出,金丝草多糖对在受试浓度范围内表现出量效关系,自由基清除率随着多糖浓度的增长而逐渐增长。各取不同浓度梯度多糖溶液各2.0 ml的前提下,多糖浓度为0.2 mg/ml到0.4 mg/ml时清除自由基速率较快;在0.4 mg/ml到1.0 mg/ml时清除速率变得缓慢;当浓度在1.0 mg/ml到1.4 mg/ml时,清除速率加快且有继续上升的趋势,是一种较好的天然抗氧化剂。
3.2. 羟自由基( )清除能力的测定 [13] - [16]
)清除能力的测定 [13] - [16]
3.2.1. 实验原理
利用H2O2和Fe2+混合发生Fenton反应,生成具有很高反应活性的(c),在体系内加入水杨酸捕捉(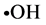 )并产生有色物质,该物质在510 nm下有最大吸收。但若加入具有清除作用的物质,便会与水杨酸竞争,从而使有色产物生成量减少。本实验在Smironff等[13] 报道的方法的基础上进行了改进,在试管中依次加入9 mmol/L FeSO4溶液1.0 ml,不同浓度金丝草多糖溶液1.5 ml,9 mmol/L水杨酸–乙醇溶液1.0 ml,摇匀,再加入8.8 mmol/L H2O2溶液1.0 ml启动反应,摇匀,水浴37℃水浴中保温60 min。于510 nm处测得不同多糖浓度下的吸光度A0;用水代替8.8 mmol/L H2O2溶液时测得某浓度多糖的本底吸光度A1;用水代替抗氧化剂时测得空白对照吸光度A2。平均实验三次。
)并产生有色物质,该物质在510 nm下有最大吸收。但若加入具有清除作用的物质,便会与水杨酸竞争,从而使有色产物生成量减少。本实验在Smironff等[13] 报道的方法的基础上进行了改进,在试管中依次加入9 mmol/L FeSO4溶液1.0 ml,不同浓度金丝草多糖溶液1.5 ml,9 mmol/L水杨酸–乙醇溶液1.0 ml,摇匀,再加入8.8 mmol/L H2O2溶液1.0 ml启动反应,摇匀,水浴37℃水浴中保温60 min。于510 nm处测得不同多糖浓度下的吸光度A0;用水代替8.8 mmol/L H2O2溶液时测得某浓度多糖的本底吸光度A1;用水代替抗氧化剂时测得空白对照吸光度A2。平均实验三次。
Table 1. Pyrogallol autoxidation determination method and reagent volume
表1. 邻苯三酚自氧化测定方法和试剂量

Figure 1. Different polysaccharide concentration on superoxide anion radical scavenging effects
图1. 不同多糖浓度对超氧阴离子自由基清除率的影响
3.2.2. 实验步骤
准确地将多糖配成1.4 mg/ml,用蒸馏水将该溶液稀释成7种浓度:0.2 mg/ml、0.4 mg/ml、0.6 mg/ml、0.8 mg/ml、1.0 mg/ml、1.2 mg/ml、1.4 mg/ml。
反应体系如表2。
空白实验:于试管中依次加入1.5 ml蒸馏水,1.0 ml 9 mmol/L FeSO4,1.0 ml 8.8 mmol/L H2O2,1.0 ml 9 mmol/L水杨酸–乙醇,摇匀,于37℃水浴中保温60 min取出,以蒸馏水为参比,510 nm下测其吸光度(A0)。
样品测定:以1.5 ml不同浓度被测定样品代替1.5 ml蒸馏水,重复空白实验步骤,以蒸馏水水为参比,510 nm下测其吸光度(A1)。考虑到色素本身的吸收光值,做对照实验:另取2试管中依次加入9 mmol/L FeSO4 1.0 ml,蒸馏水1.0 ml,9 mmol/L水杨酸–乙醇1.0 ml,然后加入1 ml被测定样品,摇匀,37℃水浴保温60 min后取出,以超纯水为参比,510 nm下测其吸光度(A2),实验平均三次(如表2所示)。
3.2.3. 计算方法
清除率计算公式为:
(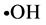 )清除率(%) = [A2 − (A0 − A1)]/A2 × 100%
)清除率(%) = [A2 − (A0 − A1)]/A2 × 100%
式中:A0为金丝草多糖的吸光度值;A1为金丝草多糖溶液本底吸光度值;A2为空白对照液吸光度值。
由图2可知,该多糖对羟基自由基有良好的清除能力,多糖浓度为0.2 mg/ml到0.4 mg/ml时清除羟自由基速率较快,浓度大于0.4 mg/ml时增长趋于缓慢,当浓度大于1.4 mg/ml时清除率已经接近稳定,总体上来讲金丝草多糖溶液对于清除羟自由基具有良好的效果。
3.3. 还原能力测定 [17] [18]
参考OYAIZU [18] 的方法加以改进,取不同浓度的多糖样品溶液1 ml,加入pH 6.6的磷酸缓冲溶液2.5 ml和1% K3Fe (CN)6溶液5.0 ml并混合均匀,混合液在50℃下保温20 min,之后加入2.5 ml 10%的三氯乙酸溶液终止反应。在3000 r/min离心机离心,吸取其上清液2.5 ml,加入2.5 ml蒸馏水和0.5 ml 0.1% FeCl3溶液,混合均匀,30 min后于700 nm波长处测定吸光度(见表3)。
从图3可以看出,该多糖还原能力随着浓度的增加而增大,其效果与多糖添加量呈正相关性,呈现出良好的量效关系。
3.4. 对亚硝酸钠清除率的测定 [19] - [24]
3.4.1. 实验原理
亚硝酸盐在弱酸性的条件下,与对氨基苯磺酸重氮化后,再与N-1-萘基乙二胺盐酸盐偶合生成红色络合物,用紫外分光光度计测出该络合物的吸光值,就可知道反应液中亚硝酸盐含量多少。研究其清除
Table 2. The specific pipetting of Fenton reaction system
表2. Fenton反应体系的具体加样
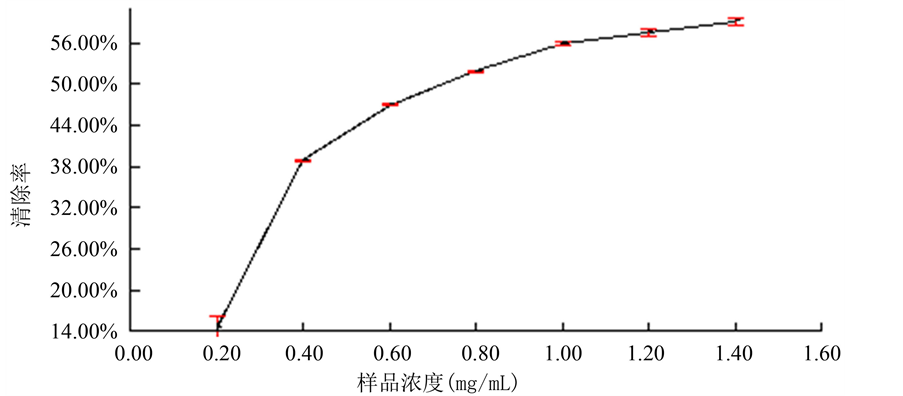
Figure 2. The impact of different polysaccharide concentration on hydroxyl radical ( ) clearance rate
) clearance rate
图2. 不同多糖浓度对羟自由基( )清除率的影响
)清除率的影响
Table 3. The specific pipetting of reducing capacity determination
表3. 测定还原能力的具体加样
Figure 3. Different polysaccharide concentration on the impact of reducing capacity
图3. 不同多糖浓度对还原能力的影响
亚硝酸盐的剂量效应关系和速度关系,来反映多糖清除亚硝酸盐能力的大小。
3.4.2. 实验步骤
分别精确吸取50.0 mg/L的NaNO2标准液2.0 ml于7支25 ml比色管中,分别加入不同浓度的金丝草多糖溶液2.0 ml和5.0 ml PH = 3.0柠檬–磷酸缓冲溶液,37℃恒温反应60 min。各吸取1.0 ml于10 ml比色管中,加入质量分数0.4%的对氨基苯磺酸2.0 ml,摇匀,静置5 min。后加入质量分数0.2%盐酸萘乙二胺1.0 ml,定容至刻度,摇匀,静置15 min。在确定的最大吸收波长λmax = 538 nm处测定吸光值A0;设置空白实验,以蒸馏水代替多糖溶液重复以上实验步骤,测定吸光值A1;在考虑到色素本身的吸收光值,做对照实验,重复以上实验步骤,以同体积蒸馏水代替0.4%的对氨基苯磺酸和0.2%盐酸萘乙二胺,测定吸光值A2;实验平均三次(如表4所示)。
3.4.3. 计算方法
SR = (A1 – (A0 − A2))/A1 × 100%
式中:SR为清除率;A0为加入试样后NaNO2溶液的吸光值;A1为未加试样时NaNO2溶液的吸光值;A2为样品本底吸光值。
从图4可以看出,该多糖对亚硝酸钠有良好的清除能力,其效果与多糖添加量呈正相关性,亚硝酸钠的清除率随多糖添加量的增加而不断增大,呈现出良好的量效关系。当浓度大于1.4 mg/ml时,清除率趋于稳定。
Table 4. The specific pipetting of experimental nitrite
表4. 亚硝酸实验具体加样表

Figure 4. Different polysaccharide concentration on the impact of sodium nitrite
图4. 不同多糖浓度对清除亚硝酸钠的影响
4. 结论
本实验对金丝草多糖抗氧化性功效进行测定,有实验数据可以知道金丝草多糖对超氧自由基和羟基自由基都具有良好的清除能力,且随着多糖浓度的增大清除能力增强,两者之间存在着量效关系,对超氧自由基的清除率最大可达51.7%。多糖作为外源性抗氧化剂,在生物体内直接参与猝灭自由基,能增强机体防御毒性自由基损伤的能力,因而具有抗衰老作用,从而避免或减轻自由基对机体的损伤,因而具有抗衰老作用。所以金丝草多糖具有抗氧化、抗衰老作用的保健食品开发应用价值。
亚硝酸盐与仲胺在人体和动物体内均能合成亚硝胺,尤其在人和动物的胃中更适于合成亚硝胺[25] 。因此,阻断亚硝胺合成或消除亚硝胺的前体是防治癌病因产生的有效途径之一。在模拟人体胃液条件下,用超声辅助提取的金丝草多糖提取液,进行对清除亚硝酸钠的实验,在一定的多糖浓度范围内,清除率随多糖量的增加而增加,清除率最大可达56.4%,当提取液浓度大于1.4 mg/ml,清除率变化不大,趋于稳定。因此,金丝草保健品有助于清除体内亚硝酸盐,对防治癌症病因具有更重要的开发价值。
文章引用
李粉玲,蔡汉权,陈利生. 金丝草多糖的抗氧化性及还原能力的研究
The Study of Antioxidation and Reducing Ability of Polysaccharides from Pogonatherum crinitum[J]. 有机化学研究, 2015, 03(01): 16-24. http://dx.doi.org/10.12677/JOCR.2015.31003
参考文献 (References)
- 1. 潘鸿江 (2007) 南方青草药彩色全书. 汕头大学出版社, 汕头, 349.
- 2. 谭树辉, 黄海波 (2004) 中草药野外识别手册(3). 广东科技出版社, 广州, 302.
- 3. 潘鸿江 (2002) 潮汕青草药彩色全书. 汕头大学出版社, 汕头, 84-85.
- 4. 王秀芳 (2007) 复方金丝草对大鼠慢性肾衰治疗作用的研究. 硕士论文, 福建农林大学, 福州, 21.
- 5. 丁保金, 金丽琴, 吕建新 (2004) 多糖生物活性研究进展. 中国药学杂志, 8, 561-564.
- 6. 张锦雀, 黄丽英, 苏聪枚 (2008) 中草药多糖提取分离纯化研究进展. 中藥材, 31, 1760-1764.
- 7. 许丽丽, 庄晓文 (2012) 超声波辅助提取松针多糖的工艺研究. 现代食品科技, 10, 1376-1379.
- 8. 吕明生, 王淑军, 房耀维, 等 (2011) 超声波提取雪莲薯多糖工艺优化及其对羟自由基的清除. 食品科学, 2, 24- 27.
- 9. 李宏睿, 姚树林, 陈云超, 邹立强 (2011) 山药多糖提取工艺的优化及抗氧化活性的测定. 安徽农业科学, 6, 3322-3324.
- 10. 王炳娟 (2007) 氧自由基的分析研究进展. 北京教育学院学报: 自然科学版, 1, 3-71.
- 11. 许申鸿, 杭瑚, 李运平 (2001) 超氧化物歧化酶邻苯三酚测活法的研究及改进. 化学通报, 8, 516-519.
- 12. 袁倬斌, 高若梅 (1997) 邻苯三酚自氧化反应的动力学研究. 高等学校化学学报, 9, 1438-1441.
- 13. Smironff, N. and Cumbes, Q.J. (1989) Hyroxyl radical scavenging activity of compatible solutes. Phytochemistry, 28, 1057-1060.
- 14. 翟继英 (2005) 光度法测定羟自由基及蔬菜抗氧化性. 卫生职业教育, 7, 107-108.
- 15. 谭萍, 方玉梅, 王毅红, 张春生 (2011) 苦荞麦多糖的抗氧化作用. 食品研究与开发, 4, 5-8.
- 16. 姚以才, 李超, 耿中华 (2011) 芦根多糖的抗氧化活性研究. 食品工程, 9, 129-132.
- 17. 吕喜茹, 郭亮, 常明昌, 李振, 王国晋, 冯翠萍 (2010) 姬松茸粗多糖抗氧化作用. 食用菌学报, 1, 69-71.
- 18. Oyaizu, M. (1986) Studies on products of browning reaction: Antioxidative activities of products browning reaction prepared from glucosamine. Japanese Journal of Nutrition, 44, 307.
- 19. 宁正祥, 张永华, 等 (1992) 一些果蔬对活性自由基和亚硝酸盐的清除作用. 食品与发酵工业, 2, 31-35.
- 20. 梁英岳, 傅亮, 孙颖莺, 陈勇 (2010) 模拟胃液条件下红豆多肽清除亚硝酸盐及阻断亚硝胺合成的研究. 食品与发酵工业, 4, 40-44.
- 21. 张虹, 许钢, 袁建耀 (2000) 刘寄奴提取液对亚硝化反应的抑制作用. 郑州粮食学院学报, 1, 50-53.
- 22. 赵二劳, 王晓妮, 张海容, 李满秀 (2006) 山楂清除亚硝酸盐及阻断亚硝胺合成的研究. 食品与发酵工业, 10, 29-31.
- 23. 刘爱文, 陈忻, 郑健英 (2003) 荔枝核提取液对亚硝胺的抑制作用. 食品工业科技, 12, 27-29.
- 24. 黄俊生 (2012) 南姜表皮花青清除亚硝酸盐及阻断亚硝胺合成的研究. 中国中药杂志, 2, 243-246.
- 25. 许钢, 张虹, 庞洁 (2000) 竹叶提取物对亚硝化反应的抑制. 无锡轻工大学学报, 6, 583-586.
