Advances in Psychology
Vol.
10
No.
11
(
2020
), Article ID:
38946
,
21
pages
10.12677/AP.2020.1011213
亚临床抑郁和临床抑郁症患者认知改变相关的大尺度功能脑网络的变化
裘吉成1,吴国伟2,刘永1,袁宏1
1西南大学心理学部,重庆
2江苏师范大学语言科学与艺术学院,江苏 徐州

收稿日期:2020年10月21日;录用日期:2020年11月20日;发布日期:2020年11月30日

摘要
目的:基于静息态功能磁共振的网络内和网络间的功能连接方法探索亚抑郁与临床抑郁患者脑功能的变化,为进一步探索亚临床抑郁和抑郁症患者认知改变的神经基础提供更多的科学证据。方法:采用独立成分分析方法对抑郁组(26名)、亚临床抑郁组(25名)和健康对照组(25名)进行脑网络成分划分,划分为6个子成分网络,然后使用网络内和网络间的分析方法进行进一步分析,并与抑郁量表评分结合进行探索性的相关分析。结果:楔前叶脑区与多个功能网络的网络内连接存在组间差异,是临床抑郁症和亚临床抑郁相对于健康人脑网络连接变化的重要节点。亚临床抑郁组的腹侧默认网络与右侧执行控制网络的网络间连接相对于对照组显著增强,且与亚临床抑郁组被试的抑郁症状显著负相关,而临床抑郁症组无显著变化。结论:亚临床抑郁和临床抑郁症患者认知状态相关的功能网络变化发生在网络内、网络间静态连接的多个方面,并且与抑郁症状的变化存在显著相关。
关键词
抑郁症,亚临床抑郁,独立成分分析,功能网络连接
Changes in Large-Scale Functional Brain Networks Associated with Cognitive Change in Patients with Subclinical Depression and Clinical Depression
Jicheng Qiu1, Guowei Wu2, Yong Liu1, Hong Yuan1
1Department of Psychology, Southwest University, Chongqing
2College of Language Science and Art, Jiangsu Normal University, Xuzhou Jiangsu

Received: Oct. 21st, 2020; accepted: Nov. 20th, 2020; published: Nov. 30th, 2020

ABSTRACT
Purpose: The purpose of this study was to explore the changes of brain function in patients with sub depression and clinical depression through in-network and inter-network functional connectivity methods based on resting-state FMRI. Then, it will provide a solid scientific basis for further exploring the neural basis of cognitive changes in patients with subclinical depression and depression. Method: Brain network components were divided into 26 patients with depression, 25 patients with subclinical depression and 25 healthy controls by dependent component analysis. First, it was divided into six sub-component networks. Then, the data were further analyzed by using in-network and inter-network analysis methods. At the same time, it was combined with depression scale score to explore the correlation analysis. Result: The results showed that there were intergroup differences in intra-network connections between precuneus and multiple functional networks. These are important nodes in the connection between clinical depression and subclinical depression compared to healthy brain networks. In addition, the connections between the ventral default network and the right executive control network were much closer in the subclinical depression group than in the control group which was significantly negative related to depression symptoms in the subclinical depression group. However, there was no significant change in the clinical depression group. Conclusion: In conclusion, functional networks associated with subclinical depression and the cognitive status of patients with clinical depression changed in multiple aspects of static connections within and between networks, which was significantly related to changes in depressive symptoms.
Keywords:Depression, Subclinical Depression, Dependent Component Analysis, Functional Network Connection

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 研究背景
随着社会生活节奏的加快和生活形式的快速变化,精神类疾病已经成为了严重困扰当代人类的重要问题。其中,抑郁症是最普遍的精神疾病之一。根据世界卫生组织的调查(2016年),全球估计有3.2亿人正在经历或经历过抑郁症。在美国有近20%,在总量上可能超过3000万的成年人正在经历着抑郁症的折磨(Friedrich, 2017; Gotlib & Joormann, 2010)。有研究表明,我国居民当前的抑郁症终身患病率约为百分之六点八,并且随着我国许多地区已经或者正在经历的快速的城市化进程,很多地区的抑郁症患病风险正在不断增加。因此,理解抑郁症形成的生理机制、形成稳定和有效的抑郁症诊断方法和寻找治疗抑郁症的有效方案成为了目前解决抑郁症带来的巨大的社会经济负担和人类健康问题的重要研究命题。
尽管我们对抑郁症的研究已经超过七十年,但到目前为止,还没有形成一个有效的能够系统解释抑郁症形成原因的病理学模型,而对抑郁症的临床诊断也主要依靠其临床表现,例如《美国精神障碍诊断和统计手册——第四版,DSM-IV》(Segal, 2010)和由世界卫生组织发布的《国际疾病和相关健康问题统计分类——第十版》(WHO ICD-10, 2016)。
从DSM-IV的诊断定义可以看到抑郁症的症状中有许多是健康人群在遭遇情绪突变或者心理障碍时同样容易诱发的问题,而两周周期的时间定义则是从疾病人群的患病经验总结出的一个平均周期。因此,在面对内部异质性大,个体变异性强的抑郁症时,准确和有效的诊断往往依赖精神科医生的职业技能和业务熟练能力,这不仅带来了高昂的经济负担,也降低了识别抑郁症病人和有此类症状表现的非临床抑郁症病人的准确性。尤其是对那些被称为亚临床抑郁症的人群而言,这类问题显得更为突出。
目前,亚临床抑郁症已经非常普遍,该风险的增加与生活质量水平下降、卫生服务使用增加、经济成本的提升和更高的死亡率有关,是抑郁症状影响人类健康的重要问题。一般认为,当个体表现出临床相关的抑郁症状,但不符合抑郁障碍的标准诊断标准时,就被认为是亚临床抑郁症。它可以根据DSM定义(至少存在一个常发的抑郁症的核心症状以及偶发的另一个症状,但总共不超过四个症状),或者使用自我评定抑郁量表时得分高于截止水平但不满足临床抑郁症诊断标准(Rucci et al., 2003)。从临床角度出发,对亚临床抑郁症群体的鉴别是有显著意义的,这不仅因为它是一种需要及时治疗的可能导致生理残疾的疾病,还因为它有发展成为重度抑郁症的相关风险,而许多研究表明,重度抑郁症可以通过早期治疗加以避免(Cuijpers et al., 2014)。但在目前的临床诊断框架下,有效识别亚临床抑郁症面临许多困难,其中一个重要的困难就是缺乏客观的生物标记。
随着神经影像学技术的发展,通过影像学方法寻找精神类疾病患者和健康人群之间有效的生物标记已经成为了本世纪最重要的方法之一。在这些方法中,由于静息态功能磁共振图像在临床采集上的便利性、采集方法的标准化和数据分析方法的鲁棒性等方面在近年来取得了极大进步,因此受到了研究者们的青睐并被广泛使用。如大量研究使用静息态功能磁共振方法发现临床抑郁症病人与健康对照组相比,在大脑的广泛区域出现了功能障碍,并且这些脑区处于多个不同的参与认知控制的功能网络中,这些脑区包括内侧前额叶皮层、纹状体、海马旁回、丘脑、扣带回和基底节前部等区域,它们属于情感处理、情绪调节和认知控制等多个不同的功能网络(Diener et al., 2012; Price & Drevets, 2012)。
Yan et al. (2019)使用多中心的fMRI数据进一步确定了以往研究中发现的结果,即临床抑郁症病人的默认网络存在大范围的功能连接的异常下降,并且进一步解释了抗抑郁症药物在临床抑郁症病人中的作用机制,提示了认知控制网络在抑郁症患者脑功能异常中的重要性。这些研究都表明静息态功能磁共振方法是有效地识别抑郁症病人的神经标记的重要方法。并且,不仅仅是科研人员在推动将神经标记作为疾病特征识别和诊断的重要依据,在用于临床诊断的DSM-V (2013年)中就已经尝试将生物学标记作为精神疾病的临床诊断依据,虽然从实践上看临床医生仍倾向于使用临床行为来作为诊断标准,但是这种尝试已经说明了临床诊断对可靠的疾病神经标记是有明显需求的(Koshiyama et al., 2020)。
相比于临床抑郁症神经标记的丰富研究,对亚临床抑郁症的神经标记的研究仍旧有限。但这些研究仍旧表明了一些亚临床抑郁症人群和健康对照组之间脑功能的差异(Hwang et al., 2015, 2016; Yokoyama et al., 2018)。例如一项使用静息态功能磁共振方法的研究发现亚临床抑郁症人群在脑功能方面与健康对照组存在明显差异,该研究基于体素的全脑功能网络方法发现,与对照组相比,亚临床抑郁患者在右侧海马旁回(PHG)、左侧海马旁回/杏仁核、左侧尾状核(caudate)的节点度值显著降低,在右侧顶后小叶(PPL)、左侧额下回(IFG)和左侧额中回(MFG)的节点度值则显著升高。此外,通过机器学习方法发现出现节点度变化的区域可以有效地将两组被试分类为亚临床抑郁受试者与健康对照受试者(平均正确率超过70%)。这说明,静息态功能磁共振方法可以作为识别亚临床抑郁症人群的神经标记的有效方法。并且这些发现与临床抑郁症相关研究中发现的抑郁症患者在认知控制网络的主要脑区出现功能异常的结果相似,提示亚临床抑郁症人群可能存在认知功能网络的异常。
综合以上分析可以看出,临床抑郁症患者和亚临床抑郁症人群和健康对照组存在脑功能上的差异,并且静息态功能磁共振方法作为有效且稳定的测量不同群体脑功能差异的方法,已经取得了许多成果。但是,目前大量的研究主要针对临床抑郁症患者,仅有较少的研究比较了亚临床抑郁症患者和健康人群之间的脑功能差异,且这些结果无法从不同的认知控制网络来反映亚临床抑郁症的疾病特征,而当前许多研究都表明大尺度的网络研究方法和动态网络相比图论等方法更能识别精神类疾病的神经标记(Rashid et al., 2016, 2019)。
通常有两种方法计算脑区间的功能连接(functional connectivity, FC):基于感兴趣区域(region of interest, ROI)的分析和独立成分分析(independent component analysis, ICA)。基于ROI的分析方法需要基于先验假设选定ROI,但其有效性受到ROI的形状、大小和位置差异以及不同图谱间差异的影响较大。而ICA是一种数据驱动的方法,它可以识别出空间上最大程度独立的成分,并求得每个成分对应的时间序列。ICA不需要基于特定的模型假设,是分析静息态fMRI的理想工具。同时,在ICA基础上进行各成分之间相互关系的手段被定义为功能网络连接(functional network connectivity, FNC) (He et al., 2016)。目前ICA和FNC的研究方法主要集中于抑郁症患者与正常人之间的差异,对于亚临床抑郁者研究较少(Salman et al., 2019; Zhi et al., 2018)。
除此以外,仅仅比较亚临床抑郁症和健康人群之间的脑功能差异从临床实践上来讲是远远不够的。在临床实践中,往往面临着区分有部分抑郁症状的健康人群、亚临床抑郁症和临床抑郁症病人的复杂问题。因此有必要对健康对照组、亚临床抑郁症人群和临床抑郁症患者的脑功能进行严格设计下的系统比较,但目前仍旧缺乏这样的研究。因此,本文的主要研究目的如下:
1) 使用静息态功能磁共振方法测量健康人群、亚临床抑郁症人群和临床抑郁症患者大脑的主要认知控制网络(包括额顶执行控制网络、默认网络和突显网络),并探索三组人在这些功能脑网络的网络内连接是否存在差异。
2) 使用静态的网络间构建方法,探索三组被试在不同网络的静态连接中是否存在显著的连接差异。
3) 确定这些在不同认知控制网络内部和网络间连接上的差异是否和抑郁表现相关。
2. 研究方法
2.1. 被试
本研究共招募被试76名,其中健康对照25名(女性6名,年龄19.2 + 0.97)、亚临床抑郁者25名(女性10名,年龄19.7 + 1.8)和临床抑郁症患者26名(女性9名,年龄20.3 + 4.6)。三组被试在年龄(皮尔逊卡方值(2) = 0.21,p = 0.9)和性别(F(2,74) = 0.93, p = 0.399)。根据被试的自我报告,都是右利手。三组被试均是由广东省人民医院精神科医生于2018年6月至2019年5月收集,对亚临床抑郁症患者和健康被试的临床诊断依靠贝克抑郁量表(the Beck Depression Inventory,BDI第二版)和专业医师的诊断经验,对临床抑郁症患者的临床诊断则依据14项汉密尔顿焦虑量表(Hamilton anxiety scale, HAMA)和24项汉密尔顿抑郁量表(The Hamilton rating scale for depression, HAMD)。BDI常用于对抑郁症的早期诊断,以往研究表明该量表对于抑郁症与非抑郁症患者的诊断敏感性和特异性都更好(Richter et al., 1998; Szymkowicz et al., 2019),本文使用的BDI第二版是在DSM-IV的基础上改变而来,在以往研究中被广泛使用。本研究中的健康对照和亚临床患者都在医院对抑郁症患者的筛查中选出,其中自评低于4分其经医生结构性问诊无任何临床症状的为健康者,评分在14分以上,但是经医生临床诊断,其抑郁症状达不到DSM-IV中要求的四个症状的阈值的患者,被诊断为亚临床抑郁症患者。本研究中健康对照被试的平均BDI分数为1 (1~3之间),亚临床抑郁症患者的平均BDI分数为22.84 (14~41之间且抑郁症临床症状少于四项,介于0~3之间)。
使用HAMA、HAMD和PANSS对临床抑郁症患者的临床表现进一步评估,其中HAMA和HAMD量表都是临床上常见的抑郁症评定量表,结合HAMA和HAMD两个量表的评分以及临床医生的临床诊断确定临床抑郁症患者,得分均超过8分且在临床上认定有超过四个抑郁症临床症状的被诊断为临床抑郁症。本研究中的临床抑郁症患者包含了轻度到重度患者,HAMA平均得分为19 (12~35分之间),HAMD平均得分为21 (9~29之间)。PANSS全称为阳性与阴性症状量表(Positive And Negative Syndrome Scale),其中的一般精神病理学症状分量表共16个项目,在衡量抑郁症患者的认知受损状况和焦虑症状方面具有良好的稳定性(Brdar, 2014),每个项目从1~7分,总共112分,本研究中的抑郁症患者组的平均评分为55分(36~92之间)。本研究获得了广东省人民医院伦理委员会的批准。所有被试在加入研究前都接受了了完整的书面和口头解释,并签署了一份书面知情同意书。两位经验丰富的临床精神病医生参与了所有被试的诊断。
2.2. 图像采集和预处理
本研究所有的核磁共振数据采集于广东省人民医院,使用美国西门子医疗设备公司的MagnetomVerio 3.0T的磁共振仪器里记录被试静息态的fMRI数据和T1加权的结构数据。使用一副和MRI兼容的耳机用来减少核磁扫描的噪音和呈现听觉刺激。为防止头动,用泡沫垫固定被试头部,要求被试尽量不动。具体扫描参数如下:
功能扫描:
使用一个单次激发的梯度加权的EPI序列采集,TR = 2500 ms;TE = 30 ms;翻转角90度;矩阵 = 64 × 64;层厚3.5 mm;FOV = 224 mm2平面分辨率3.125 mm × 3.125 mm;隔行扫描,层数为42,被试闭眼采集8分钟20秒,每个被试共采集200张图像。
结构扫描:
结构成像通过一个高分辨率的T1加权序列:TR = 2.53 ms;TE = 2.34 ms;反转角为12˚,层厚1 mm,体素1.0 × 1.0 × 1.0 mm3;像素矩阵为256 × 240;隔行扫描,层数为192。
使用spm12 (https://www.fil.ion.ucl.ac.uk/spm/software/spm12/)对静息态数据进行预处理。对于每个被试,首先对同一TR内各片之间的采集时间延迟进行校正,然后对头动进行校正,校正是依据每个被试的第一张采集图像的位置来计算的,本研究的所有被试均满足我们的头动排除标准,即在任何平面上的位移和旋转均在2以内(2 mm或者2度)。其后,将头动校正后的数据在空间上归一化到蒙特利尔神经学研究所(MNI)空间,本文使用了基于DARTEL的两部配准法,该方法相比于其他配准方法有更好的鲁棒性,能够获得更好的配准效果(Tahmasebi et al., 2009)。将图像重新采样到3 mm * 3 mm * 3 mm的体素大小。最后使用6毫米全宽半最大值的各向同性高斯核函数对归一化图像进行空间平滑。
2.3. 基于组水平的独立成分分析
使用GIFT工具(3.0a版,http://icatb.sourceforge.net.)中的基于组水平的空间独立分量分析方法(ICA)将预处理后的fMRI数据分解为不同的功能网络(Calhoun et al., 2001)。首先,使用两阶段主成分分析进行数据降维以降低计算复杂度。其次,ICA使用Infomax算法将分组数据分解为30个独立成分(ICs) (Beckmann & Smith, 2004)。考虑到不同组别的被试在全脑功能连接状态可能本就存在组别异质性的问题,因此我们对三组被试分别执行了这一步骤,也就是每一组被试都进行了单独的组水平的ICA分析,每组获得30个成分。
为了评估ICA过程的稳定性和重复性,对每一组的ICA分析都使用了ICASSO算法重复100次。最后,将组水平ICA映射至每个被试预处理后的静息态功能数据,获得每个被试的ICs,并将其转换为z分数。通过计算获得成分的空间图像与以往研究中分割出的经典的脑网络成分图像的空间相似度以及人工视觉检查(Liu et al., 2017),我们最终获取了每组被试6个成分,其中默认网络有三个成分:前部默认网络(aDMN)、背侧默认网络(dDMN)和腹侧默认网络(vDMN);额顶控制网络有两个成分:左侧额顶控制网络(LECN)和右侧额顶控制网络(RECN);以及一个突显网络(SN)。最后对三组被试的所有6个成分取对应的并集,最后形成对三个组的共同的6个网络成分。整个处理流程如图1所示。

Figure 1. Independent component analysis process based on group level
图1. 基于组水平的独立成分分析流程
2.4. 静态网络间连接构建
静态网络间连接使用GIFT工具提供的计算工具对三组被试的aDMN、dDMN、vDMN、LECN、RECN和SN成分所对应的时间序列计算了互相之间的皮尔逊积差相关,以评估不同网络之间的功能连接。对获取的相关矩阵应用Fisher’z变换,以确保数据的正态性(Wang et al., 2015) (见图2)。
2.5. 统计分析
首先使用spm工具中的统计工具对三组被试额顶控制网络、突显网络和默认网络的6个成分的网络内功能连接强度进行了比较。使用单因素方差分析比较了临床抑郁组、亚抑郁临床抑郁组和健康对照组在每个子网络上的功能连接差异,在每次比较中都将年龄和性别作为不感兴趣的协变量,对多次比较使用严格的体素水平的FWE (family wise error control)矫正方法以控制假阳性(p < 0.05)。
其次,使用MANCOVA方法计算三组被试在不同网络间的静态功能连接差异,同样将年龄和性别作为不感兴趣的协变量,使用FDR (false discover rates error control)方法进行多重比较校正(p < 0.05)。
最后,对网络内连接分析和网络间的静态连接分析中发现组间差异的功能连接指标进行进一步量表相关的探索分析,以发现在脑功能层面发现的差异与疾病所表现出来的临床症状之间的关系。相关分析都使用皮尔逊相关方法,对同一假设下涉及的多次比较使用Bonerroni方法进行矫正。
3. 研究结果
3.1. 基于组水平的独立成分分析
对三组被试分别进行独立成分分析,并在30个成分中挑选出属于三网络(即默认模式网络、执行控制网络和凸显网络)的共计6个子成分,分别为aDMN、dDMN、vDMN、LECN、RECN和SN。图3为每组各成分在组水平的平均空间分布图,红色部分为标准化后空间分布值Z > 1的脑区。

Figure 2. Functional network connection analysis process
图2. 功能网络连接分析流程

Figure 3. The spatial distribution of aDMN, dDMN, vDMN, LECN, RECN and SN in the control group, the subclinical depression group and the depression group
图3. 对照组、亚临床抑郁组和抑郁组被试aDMN、dDMN、vDMN、LECN、RECN和SN的空间分布
3.2. aDMN网络内连接在三组间的差异
使用spm工具包对三组被试的dDMN的网络内连接进行单因素方差分析发现差异显著的脑区主要集中在内侧和旁扣带脑回、距状裂周围皮层和背外侧额上(图4,表1)。提取该三者脑区进行事后检验发现:亚临床抑郁组和抑郁组在内侧和旁扣带脑回以及背外侧额上回与aDMN的网络内功能连接相较于对照组均显著降低,且抑郁组显著低于亚临床抑郁组;抑郁组在背外侧额上回与aDMN的网络内功能连接相较于对照组显著降低;而亚临床抑郁组在背外侧额上回与aDMN的网络内功能连接相较于对照组显著增强(图5)。

Figure 4. Difference among three group of within-network connectivity in aDMN
图4. aDMN的网络内功能连接的三组差异
Table 1. Difference among three group of within-network connectivity in aDMN (FWE P < 0.05)
表1. aDMN的网络内功能连接的三组差异(FWE P < 0.05)
3.3. vDMN网络内连接在三组间的差异
使用spm工具包对三组被试的vDMN的网络内连接进行单因素方差分析发现差异显著的脑区主要集中在楔前叶(图6,表2)。提取该脑区连接值进行事后检验发现:亚临床抑郁组在楔前叶与vDMN的网络内功能连接相较于对照组均显著降低(图7)。
3.4. LECN网络内连接在三组间的差异
使用spm工具包对三组被试的LECN的网络内连接进行单因素方差分析发现差异显著的脑区主要集中在楔前叶、额叶和颞叶的大部分区域(图8,表3)。有趣的是,只有在楔前叶与LECN的网络内功能连接呈现出对照组到亚临床抑郁组到抑郁组的显著性递减;而在其他脑区与LECN的网络内功能连接上,相对于对照组,亚临床抑郁组和抑郁组表现出相反的趋势(图9)。
 *: P < 0.05; **: P < 0.01; ***: P < 0.001.
*: P < 0.05; **: P < 0.01; ***: P < 0.001.
Figure 5. Different brain region among three group of within-network connectivity in aDMN
图5. aDMN网络内功能连接的差异脑区

Figure 6. Difference among three group of within-network connectivity in vDMN
图6. vDMN的网络内功能连接的三组差异
Table 2. Difference among three group of within-network connectivity in vDMN (FWE P < 0.05)
表2. vDMN的网络内功能连接的三组差异(FWE P < 0.05)
 *: P < 0.05; **: P < 0.01; ***: P < 0.001.
*: P < 0.05; **: P < 0.01; ***: P < 0.001.
Figure 7. Different brain region among three group of within-network connectivity in vDMN
图7. vDMN网络内功能连接的差异脑区

Figure 8. Difference among three group of within-network connectivity in LECN
图8. LECN的网络内功能连接的三组差异
Table 3. Difference among three group of within-network connectivity in LECN (FWE P < 0.05)
表3. LECN的网络内功能连接的三组差异(FWE P < 0.05)
 *: P < 0.05; **: P < 0.01; ***: P < 0.001.
*: P < 0.05; **: P < 0.01; ***: P < 0.001.
Figure 9. Different brain region among three group of within-network connectivity in LECN
图9. LECN网络内功能连接的差异脑区
3.5. RECN网络内连接在三组间的差异
使用spm工具包对三组被试的RECN的网络内连接进行单因素方差分析发现差异显著的脑区主要集中在顶叶、额叶和颞叶的大部分区域(图10,表4)。事后检验发现,与LECN不同的是,亚临床抑郁组在大部分脑区与RECN的功能连接出现相较于另两组显著的升高或者降低,而抑郁组与健康对照组差异不显著(图11)。
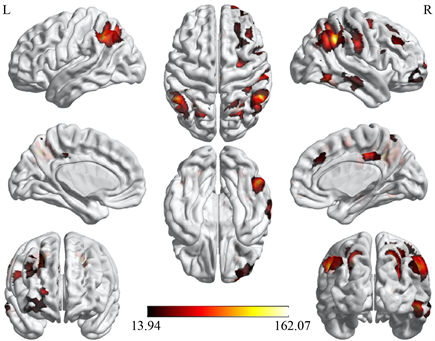
Figure 10. Difference among three group of within-network connectivity in RECN
图10. RECN的网络内功能连接的三组差异
3.6. SN网络内连接在三组间的差异
使用spm工具包对三组被试的SN的网络内连接进行单因素方差分析发现差异显著的脑区主要集中在眶部额中回、楔前叶和补充运动区(图12,表5)。事后检验发现,相对于对照组和亚临床抑郁组,抑郁组眶部额中回与SN的功能连接显著降低;而亚临床抑郁组在楔前叶和补充运动区与SN的功能连接相对于对照组和抑郁组显著增强;抑郁组在补充运动区与SN的功能连接相对于对照组显著增强(图13)。
Table 4. Difference among three group of within-network connectivity in RECN (FWE P < 0.05)
表4. RECN的网络内功能连接的三组差异(FWE P < 0.05)
 *: P < 0.05; **: P < 0.01; ***: P < 0.001.
*: P < 0.05; **: P < 0.01; ***: P < 0.001.
Figure 11. Different brain region among three group of within-network connectivity in RECN
图11. RECN网络内功能连接的差异脑区
Table 5. Difference among three group of within-network connectivity in SN (FWE P < 0.05)
表5. SN的网络内功能连接的三组差异(FWE P < 0.05)
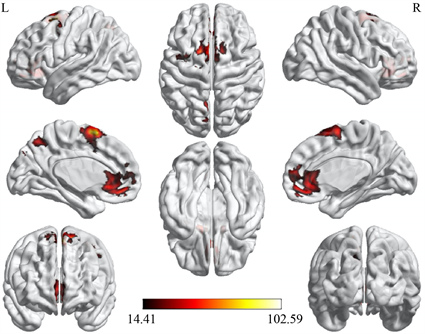
Figure 12. Difference among three group of within-network connectivity in SN
图12. SN的网络内功能连接的三组差异
 *: P < 0.05; **: P < 0.01; ***: P < 0.001.
*: P < 0.05; **: P < 0.01; ***: P < 0.001.
Figure 13. Different brain region among three group of within-network connectivity in SN
图13. SN网络内功能连接的差异脑区
3.7. 额顶控制网络、突显网络和默认网络的网络间功能连接
使用gift工具包对经过ICA分解求得的每个被试的六个网络成分对应的时间序列进行两两间的皮尔逊积差相关,得到每个被试的FNC连接矩阵(图14、图15)。在组水平上对三组被试进行单因素方差分析,发现显著性差异主要出现在aDMN与vDMN、aDMN与SN、aDMN与SN、vDMN与RECN、LECN与SN以及LECN与SN的功能网络连接上(图16),事后检验发现在这些网络连边中,相对于对照组,亚临床抑郁组和抑郁组表现出不同的网络间的连接变化趋势(图17)。
3.8. 基于ICA的网络内和网络间功能连接与临床指标的相关性
在抑郁组患者中,aDMN和左侧背外侧额上回的功能连接与PANNS量表(r = −0.47, p < 0.05)、LECN和左侧颞下回的功能连接与PANNS量表(r = −0.45, p < 0.05)、LECN和右侧颞中回的功能连接与PANNS量表(r = −0.67, p < 0.001)、LECN和左侧岛盖部额下回的功能连接与HAMA量表(r = −0.42, p < 0.05)以及RECN和右侧额中回的功能连接与PANNS量表(r = −0.46, p < 0.05)均出现显著负相关(图18)。而在亚临床抑郁组被试中,LECN和左侧枕中回的功能连接与BDI-II量表出现显著负相关(图19,r = −0.47,p < 0.05)。在亚临床抑郁组被试中,vDMN和RECN的功能连接与BDI-II量表呈现显著负相关(r = −0.54,p < 0.01,图20)。

Figure 14. Group-level mean FNC connection matrix (from left to right, the control group, the subclinical depression group and the depression group)
图14. 组平均FNC连接矩阵图(从左到右依次为对照组、亚临床抑郁组和抑郁组)

Figure 15. Group mean FNC connection ring map (left to right: control group, subclinical depression group, and depression group)
图15. 组平均FNC连接环形图(从左到右依次为对照组、亚临床抑郁组和抑郁组)

Figure 16. The significant different edges of one-way ANOVA of FNC among three groups (color bar is shown as F value)
图16. 三组间FNC单因素方差分析的显著性差异连边(颜色条显示为F值)

Figure 17. The post-hoc test of one-way ANOVA of FNC among three groups for significant edge
图17. 三组间FNC单因素方差分析显著连边的两两比较
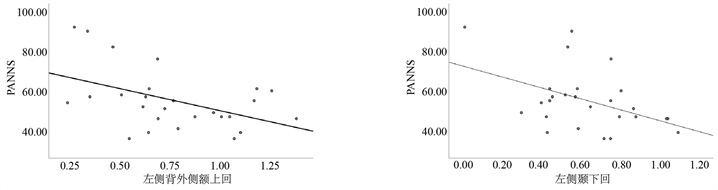


Figure 18. The within-network functional connections of subjects in the depression group were significantly correlated with PANNS and HAMA scale

图18. 抑郁组被试网络内功能连接与PANNS以及HAMA量表的显著相关性

Figure 19. The within-network functional connections of subjects in the subclinical depression group were significantly correlated with BDI-II scale
图19. 亚临床抑郁组被试网络内功能连接与BDI-II量表的显著相关性

Figure 20. The between-network functional connections of subjects in the depression group were significantly correlated with BDI-II scale
图20. 亚临床抑郁组被试网络间功能连接与BDI-II量表的显著相关性
4. 讨论
4.1. 亚临床与临床抑郁症的静态功能连接异常存在相似性
在本研究中我们发现,在默认网络的子成分即前部默认网络和后部默认网络中,除了左侧距状裂周围皮质脑区以外,在其他存在显著组间的脑区包括左侧内侧和旁扣带回、左侧背外侧额上回和左侧楔前叶都表现为亚临床抑郁症和临床抑郁症组相对于健康对照组的网络内功能连接的异常下降。在左侧执行控制网络的楔前叶也同样表现出了两组被试相对与健康对照组的网络内功能连接的异常下降。
默认网络是当前抑郁症研究主要关注的负责高级认知功能的网络,已经和人类休息期间的大脑认知过程(如自我信息参照、思考他人行为以及优化注意网络等)高度联系起来,并且在大量的研究中被与抑郁症的不同临床症状联系起来(Kaiser et al., 2016; Mulders et al., 2015; Yan et al., 2019)一项针对32项研究的体素水平的元分析显示,重度抑郁症患者眶部额中回的默认网络内部功能连接增加,而背侧前额叶皮层以及后侧默认网络区域的功能连接出现下降(Kaiser et al., 2015)。这与本研究中发现的结果是相似的,本研究中发现临床抑郁症患者在默认网络的前部网络的脑区包括左侧背外侧额上回和左侧内侧和旁侧扣带回脑区以及左侧距状裂周围皮层都表现为功能连接下降的异常模式。并且,在探索性分析中发现,临床抑郁症患者左侧背外侧额上回的功能连接的下降与其PANNS得分的升高呈现负相关关系,该区域的功能连接越弱,PANNS得分越高。这进一步说明,临床抑郁症患者在前部默认网络尤其是左侧背外侧额上回的功能连接的异常下降可能影响了其认知表现和焦虑症状。与临床抑郁症缓则在默认网络前部功能连接的异常下降一致的是,与对照组相比,亚临床抑郁症在左侧内侧和旁扣带回以及左侧背外侧额上回和腹侧的左侧楔前叶同样也出现显著了功能连接的下降,这可能反应出亚临床抑郁症患者在出现早期抑郁症症状的期间就出现了与临床抑郁症相似的功能连接异常。但相比于在临床抑郁症患者中对默认网络内部功能连接差异的广泛研究,对亚临床抑郁症患者的默认网络功能连接差异的研究仍处于探索阶段。
除了发现亚临床抑郁症被试和临床抑郁症被试在默认网络前部都出现功能连接下降以外,在左侧额顶控制网络内的左侧楔前页也发现了相同的结果。左侧楔前页是位于楔叶的前部,是扣带沟的边缘分支。它涉及情景记忆,视觉空间处理,自我反思,以及意识的各个方面。在左侧额顶控制网络中,楔前页是重要的网络节点,以往研究发现临床抑郁症患者在这一区域存在功能连接的下降,并且与认知受损有关(Mulders et al., 2015)。并且在Hwang et al. (2015)中对亚临床抑郁者认知控制网络的研究中也发现了相似的结论。这些与本研究中一致的发现可能提示左侧楔前页是在亚临床抑郁症和临床抑郁症脑功能网络异常的重要共变节点。
在不同网络的网络间连接上,相比健康对照,两组被试都变现出前部默认网络和右侧额顶控制网络的更弱连接、腹侧默认网络和右侧执行控制网络的更强连接、左侧执行控制网络和突显网络的更强连接以及前部默认网络和突显网络的更强连接。以往已有对首发未服药的重度抑郁症患者的研究发现重度抑郁症患者在默认网络内前侧和后侧默认网络子成分的功能连接显著强于健康对照组(Guo et al., 2014),本研究中的腹侧默认网络与该研究中的后侧默认网络相似。虽然还未发现对亚临床抑郁症患者默认网络的不同子成分之间的功能连接异常进行探索的研究,但本研究中发现在腹侧默认网络和右侧执行控制网络中更强的功能连接和亚临床抑郁症被试的BDI-II分数存在显著的负相关关系,这说明本研究中的发现是有着重要的临床意义的,该脑区功能连接的异常增加有可能直接影响了亚临床抑郁症被试的抑郁症症状的严重程度。
4.2. 亚临床与临床抑郁症的静态功能连接异常存在特异性
在发现亚临床与临床抑郁症在静态功能连接异常模式存在许多相似性结果的同时,本研究在对亚临床抑郁被试、临床抑郁症被试和健康对照被试的6个子网络功能连接差异的比较中,出现了两组被试差异模式不同且部分差异在方向性上明显相反的结果。主要出现于左侧和右侧的额顶控制网络和突显网络的内部功能连接。具体来说,在左侧额顶控制网络内的左侧颞下回、左侧岛盖部额下回、右侧颞中回、左侧枕中回和右侧角回都表现出临床抑郁症患者相对健康被试的功能连接增强,但亚临床抑郁症患者与健康对照无显著差异;而在右侧执行控制网络中的右侧颞中回、右侧背外侧额上回、右侧内侧和旁侧扣带回、右侧顶上回和右侧额中回以及突显网络中的左侧楔前页和左侧辅助运动区,亚临床抑郁症被试都表现出相比健康对照被试更强的功能连接,但临床抑郁症被试则与健康对照组无显著的功能连接差异。在对6个子成分的网络间连接分析中发现亚临床抑郁症被试在左侧执行控制网络和右侧执行控制网络的网络间功能连接显著弱于对照组,但临床抑郁症被试则与健康对照组相当。这些发现可能表明,额顶执行控制网络对于临床抑郁症与亚临床抑郁症是具有一定特异性的。
在以往对重度抑郁症的研究使用ICA方法对额顶控制网络的功能连接探究的研究较少,一些仅有的研究基本发现重度抑郁症在额顶控制网络的网络内连接相比健康对照组有显著的上升,主要出现在前额区域以及颞顶区域(Manoliu et al., 2014; Sexton et al., 2012)。这与本研究中发现的临床抑郁症患者在左侧额顶控制网络中出现的功能连接增强的区域是相似的。在另一项研究中也发现,在一个参与情绪处理的突显网络中,重度抑郁症患者的脑岛和杏仁核与网络内其他脑区的连接出现了显著的下降,该结果与以往发现的重度抑郁症患者的突显网络内部的连接性下降一致(Veer et al., 2010)。本研究在突显网络的网络内连接的比较中,仅发现亚临床抑郁症被试在突显网络中的左侧楔前页和左侧辅助运动区出现了更强的连接。这可能是由于本研究中的临床抑郁症患者严重度与以往研究差异较大,因此没有重复以往研究的结果。而在对亚临床抑郁症群体的相关研究中,还未出现使用ICA方法讨论突显网络和额顶控制网络功能连接差异的文献,仅有一篇使用基于种子点方法的研究发现,亚临床抑郁症被试在右侧顶上回后部、左侧额下回和左侧额中回表现出比健康对照组更高的节点强度(Gao et al., 2016),节点强度是该节点功能连接边数的求和,节点强度越高反应出该节点的功能连接越强。因此,该研究的结果与本研究的发现是相似的,但是考虑到该研究使用的是基于全脑体素的功能连接计算的节点强度,其反应的是该区域与全脑范围的功能连接的强弱,而不是额顶控制网络内部的功能连接强度,因此,无法与本研究结果进行直接有效的比较。
虽然以往研究能够为本研究发现的结果提供的可比较性证据较少,但是,在探索性分析中,我们发现临床抑郁症被试在左侧颞下回、左侧岛盖部额下回和右侧颞中回更强的网络内功能连接分别与更低的PANNS得分、HAMA得分以及PANNS得分显著相关。这说明,本研究发现的临床抑郁症被试在左侧额顶控制网络内多个区域的更强连接可能是这些被试的相关抑郁症状和认知受损的神经基础。遗憾的是,没有发现亚临床抑郁症被试在右侧额顶控制网络内功能连接与BDI-II评分之间的显著相关性,这可能受限于我们获取的有限的临床量表得分,从而限制了我们探索更多丰富以及细节的临床症状和亚临床抑郁症被试在右侧额顶控制网络以及突显网络内的异常的强连接之间的关系的能力。但是,我们的研究结果发现,在亚临床抑郁组被试中,vDMN和RECN的功能连接与BDI-II量表呈现显著负相关。vDMN处于默认网络的腹侧和后部,在以往研究中被认为和支持情感处理、管理与自我参照相关的心理活动以及回忆生活中的经历过程有关(Raichle, 2015),而RECN在以往研究中发现对于抑制功能具有重要的调控作用,尤其是在与情绪相关的抑制控制过程中扮演了重要的角色,相关研究发现RECN网络的功能连接的异常增高和有情绪障碍的重度抑郁症患者对悲观情绪的抑制控制失效有显著关联(Malhi et al., 2019)。在本研究中发现,亚临床抑郁症患者的vDMN和RECN网络的网络间功能连接的异常升高和他们的BDI-II量表呈现显著的负相关关系说明,在抑郁情绪出现的早期,在亚临床抑郁症患者的脑功能连接上就已经出现了变化,这两个网络间功能连接的异常升高可能导致了亚临床抑郁症者在面对悲观情绪时难以有效的进行抑制控制,而对悲观情绪的失调可能进一步加重了亚临床抑郁症者的抑郁表现,从而在BDI-II量表上表现出更高的评分。
因此,从本文的研究结果出发,可以看出左右侧额顶控制网络很可能在亚临床抑郁症和临床抑郁症的神经基础差异上扮演了重要的角色,而vDMN和RECN的网络间功能连接的异常升高可能是亚临床抑郁症病人与情绪失调症状相关的重要的神经基础。
5. 结论
本研究基于独立成分分析的方法,从两个不同的方向讨论了亚临床抑郁被试和抑郁症患者相对于正常人脑功能网络的变化,包括静态网络内功能连接和静态网络间功能连接。总体来说,本研究主要包括两个层面上的结果:
1) 从网络内连接的重要节点脑区这一层面看,在临床抑郁症和亚临床抑郁症群体与健康对照组进行比较时,都发现了楔前叶脑区在LECN网络和vDMN网络内的功能连接下降,该脑区作为与自我认知和自尊程度相关的脑区,它与认知控制主要网络的网络内节点的功能连接的异常增高可能与抑郁时增加的内部反刍想法有关。该脑区在临床抑郁症和亚临床抑郁相对于正常人脑网络连接的异常变化,可能是与自我反刍相关的抑郁症状在脑功能持续性变化上所体现出的重要神经标志;
2) 在脑网络层面上,LECN是揭示临床抑郁症和亚临床抑郁相对于正常人脑网络连接变化的重要脑网络。该网络的网络内连接的变化与抑郁症状存在显著的相关关系,揭示了临床抑郁症和亚临床抑郁执行控制能力下降可能与LECN网络中左侧颞下回、右侧颞中回和左侧岛盖部额下回等脑区的网络内连接的异常有关;
3) 在网络间连接层面上,vDMN与RECN的连接相对于正常人的显著增强可能是亚临床抑郁的特异性改变。这两个网络的网络间功能连接在亚临床抑郁组的异常增强可能调节了他们对悲观情绪的抑制控制能力,相关分析进一步显示,vDMN和RECN的连接越强,抑郁症状越明显,抑制悲观情绪的控制能力越弱。
总而言之,本研究发现了一些基于脑功能连接的亚临床抑郁被试和抑郁症患者在认知神经机制上的一致性和特异性,对此方面的后续研究发现具有一定的提示作用。
文章引用
裘吉成,吴国伟,刘 永,袁 宏. 亚临床抑郁和临床抑郁症患者认知改变相关的大尺度功能脑网络的变化
Changes in Large-Scale Functional Brain Networks Associated with Cognitive Change in Patients with Subclinical Depression and Clinical Depression[J]. 心理学进展, 2020, 10(11): 1821-1841. https://doi.org/10.12677/AP.2020.1011213
参考文献
- 1. Beckmann, C. F., & Smith, S. M. (2004). Probabilistic Independent Component Analysis for Functional Magnetic Resonance Imaging. IEEE Transactions on Medical Imaging, 23, 137-152. https://doi.org/10.1109/TMI.2003.822821
- 2. Brdar, I. (2014). Positive and Negative Affect Schedule (PANAS). In Encyclopedia of Quality of Life and Well-Being Research. Berlin: Springer. https://doi.org/10.1007/978-94-007-0753-5_2212
- 3. Calhoun, V. D., Adali, T., Pearlson, G. D., & Pekar, J. J. (2001). A Method for Making Group Inferences from Functional MRI Data Using Independent Component Analysis. Human Brain Mapping, 14, No. 3. https://doi.org/10.1002/hbm.1048
- 4. Cuijpers, P., Koole, S. L., Van Dijke, A., Roca, M., Li, J., & Reynolds, C. F. (2014). Psychotherapy for Subclinical Depression: Meta-Analysis. British Journal of Psychiatry, 205, 268-274. https://doi.org/10.1192/bjp.bp.113.138784
- 5. Diener, C., Kuehner, C., Brusniak, W., Ubl, B., Wessa, M., & Flor, H. (2012). A Meta-Analysis of Neurofunctional Imaging Studies of Emotion and Cognition in Major Depression. NeuroImage, 61, 677-685. https://doi.org/10.1016/j.neuroimage.2012.04.005
- 6. Friedrich, M. J. (2017). Depression Is the Leading Cause of Disability Around the World. JAMA, 317, 1517. https://doi.org/10.1001/jama.2017.3826
- 7. Gao, C., Wenhua, L., Liu, Y., Ruan, X., Chen, X., Liu, L., & Jiang, X. (2016). Decreased Subcortical and Increased Cortical Degree Centrality in a Nonclinical College Student Sample with subclinical Depressive Symptoms: A Resting-State fMRI Study. Frontiers in Human Neuroscience, 10, 617. https://doi.org/10.3389/fnhum.2016.00617
- 8. Gotlib, I. H., & Joormann, J. (2010). Cognition and Depression: Current Status and Future Directions. In Annual Review of Clinical Psychology, 6, 285-312. https://doi.org/10.1146/annurev.clinpsy.121208.131305
- 9. Guo, W., Liu, F., Zhang, J., Zhang, Z., Yu, L., Liu, J., Chen, H., & Xiao, C. (2014). Abnormal Default-Mode Network Homogeneity in First-Episode, Drug-Naive Major De-pressive Disorder. PLoS ONE, 9, e91102. https://doi.org/10.1371/journal.pone.0091102
- 10. He, H., Yu, Q., Du, Y., Vergara, V., Victor, T. A., Drevets, W. C., Savitz, J. B., Jiang, T., Sui, J., & Calhoun, V. D. (2016). Resting-State Functional Network Connectivity in Prefrontal Regions Differs between Unmedicated Patients with Bipolar and Major Depressive Disorders. Journal of Affective Dis-orders, 190, 483-493. https://doi.org/10.1016/j.jad.2015.10.042
- 11. Hwang, J. W., Egorova, N., Yang, X. Q., Zhang, W. Y., Chen, J., Yang, X. Y., Hu, L. J., Sun, S., Tu, Y., & Kong, J. (2015). Subthreshold Depression Is Associated with Impaired Restingstate Functional Connectivity of the Cognitive Control Network. Translational Psychiatry, 5, e683. https://doi.org/10.1038/tp.2015.174
- 12. Hwang, J. W., Xin, S. C., Ou, Y. M., Zhang, W. Y., Liang, Y. L., Chen, J., Yang, X. Q., Chen, X. Y., Guo, T. W., Yang, X. J., Ma, W. H., Li, J., Zhao, B. C., Tu, Y., & Kong, J. (2016). Enhanced Default Mode Network Connectivity with Ventral Striatum in Subthreshold Depression Individuals. Journal of Psychiatric Research, 76, 111-120. https://doi.org/10.1016/j.jpsychires.2016.02.005
- 13. Kaiser, R. H., Andrews-Hanna, J. R., Wager, T. D., & Pizzagalli, D. A. (2015). Large-Scale Network Dysfunction in Major Depressive Disorder: A Meta-Analysis of Resting-State Functional Connectivity. JAMA Psychiatry, 72, 603-611. https://doi.org/10.1001/jamapsychiatry.2015.0071
- 14. Kaiser, R. H., Whitfield-Gabrieli, S., Dillon, D. G., Goer, F., Beltzer, M., Minkel, J., Smoski, M., Dichter, G., & Pizzagalli, D. A. (2016). Dynamic Resting-State Functional Connectivity in Major Depression. Neuropsychopharmacology, 41, 1822-1830. https://doi.org/10.1038/npp.2015.352
- 15. Koshiyama, D., Fukunaga, M., Okada, N., Morita, K., Nemoto, K., Usui, K., Yamamori, H., Yasuda, Y., Fujimoto, M., Kudo, N., Azechi, H., Watanabe, Y., Hashimoto, N., Narita, H., Kusumi, I., Ohi, K., Shimada, T., Kataoka, Y., Yamamoto, M. et al. (2020). White Matter Microstructural Alterations across Four Major Psychiatric Disorders: Mega-Analysis Study in 2937 Individuals. Molecular Psychiatry, 25, 883-895. https://doi.org/10.1038/s41380-019-0553-7
- 16. Liu, F., Wang, Y., Li, M., Wang, W., Li, R., Zhang, Z., Lu, G., & Chen, H. (2017). Dynamic Functional Network Connectivity in Idiopathic Generalized Epilepsy with Generalized Ton-ic-Clonic Seizure. Human Brain Mapping, 38, No. 2. https://doi.org/10.1002/hbm.23430
- 17. Malhi, G. S., Das, P., Outhred, T., Gessler, D., John Mann, J., & Bryant, R. (2019). Cognitive and Emotional Impairments Underpinning Suicidal Activity in Patients with Mood Disorders: An fMRI Study. Acta Psychiatrica Scandinavica, 139, No. 5. https://doi.org/10.1111/acps.13022
- 18. Manoliu, A., Meng, C., Brandl, F., Doll, A., Tahmasian, M., Scherr, M., Schwerthöffer, D., Zimmer, C., Förstl, H., Bäuml, J., Riedl, V., Wohlschläger, A. M., & Sorg, C. (2014). Insular Dysfunction within the Salience Network Is Associated with Severity of Symptoms and Aberrant Inter-Network Connectivity in Major Depressive Disorder. Frontiers in Human Neuroscience, 7, 930. https://doi.org/10.3389/fnhum.2013.00930
- 19. Mulders, P. C., van Eijndhoven, P. F., Schene, A. H., Beckmann, C. F., & Tendolkar, I. (2015). Resting-State Functional Connectivity in Major Depressive Disorder: A Review. Neuroscience and Biobehavioral Reviews, 56, 330-344. https://doi.org/10.1016/j.neubiorev.2015.07.014
- 20. Price, J. L., & Drevets, W. C. (2012). Neural Circuits Underlying the Pathophysiology of Mood Disorders. Trends in Cognitive Sciences, 16, 61-71. https://doi.org/10.1016/j.tics.2011.12.011
- 21. Raichle, M. E. (2015). The Brain’s Default Mode Network. Annual Review of Neuroscience, 15, 433-447. https://doi.org/10.1146/annurev-neuro-071013-014030
- 22. Rashid, B., Arbabshirani, M. R., Damaraju, E., Cetin, M. S., Miller, R., Pearlson, G. D., & Calhoun, V. D. (2016). Classification of Schizophrenia and Bipolar Patients Using Static and Dynamic Resting-State fMRI Brain Connectivity. NeuroImage, 134, 645-657. https://doi.org/10.1016/j.neuroimage.2016.04.051
- 23. Rashid, B., Chen, J., Rashid, I., Damaraju, E., Liu, J., Miller, R., Agcaoglu, O., van Erp, T. G. M., Lim, K. O., Turner, J. A., Mathalon, D. H., Ford, J. M., Voyvodic, J., Mueller, B. A., Belger, A., McEwen, S., Potkin, S. G., Preda, A., Bustillo, J. R., et al. (2019). A Framework for Linking Resting-State Chronnectome/Genome Features in Schizophrenia: A Pilot Study. NeuroImage, 184, 843-854. https://doi.org/10.1016/j.neuroimage.2018.10.004
- 24. Richter, P., Werner, J., Heerlein, A., Kraus, A., & Sauer, H. (1998). On the Validity of the Beck Depression Inventory. A Review. Psychopathology, 31, 160-168. https://doi.org/10.1159/000066239
- 25. Rucci, P., Gherardi, S., Tansella, M., Piccinelli, M., Berardi, D., Bisoffi, G., Corsino, M. A., & Pini, S. (2003). Subthreshold Psychiatric Disorders in Primary Care: Prevalence and Associated Cha-racteristics. Journal of Affective Disorders, 76, 171-181. https://doi.org/10.1016/S0165-0327(02)00087-3
- 26. Salman, M. S., Du, Y., Lin, D., Fu, Z., Fedorov, A., Damaraju, E., Sui, J., Chen, J., Mayer, A. R., Posse, S., Mathalon, D. H., Ford, J. M., Van Erp, T., & Calhoun, V. D. (2019). Group ICA for Identifying Biomarkers in Schizophrenia: “Adaptive” Networks via Spatially Constrained ICA Show More Sensitivity to Group Differences than Spatio-Temporal Regression. NeuroImage: Clinical, 22, 101747. https://doi.org/10.1016/j.nicl.2019.101747
- 27. Segal, D. L. (2010). Diagnostic and Statistical Manual of Mental Disorders (DSM-IV-TR). In: The Corsini Encyclopedia of Psychology. https://doi.org/10.1002/9780470479216.corpsy0271
- 28. Sexton, C. E., Allan, C. L., Le Masurier, M., McDermott, L. M., Kalu, U. G., Herrmann, L. L., Mäurer, M., Bradley, K. M., Mackay, C. E., & Ebmeier, K. P. (2012). Magnetic reson-ance imaging in late-life depression: Multimodal examination of network disruption. Archives of General Psychiatry, 69, 680-689. https://doi.org/10.1001/archgenpsychiatry.2011.1862
- 29. Szymkowicz, S. M., Woods, A. J., Dotson, V. M., Porges, E. C., Nissim, N. R., O’Shea, A., Cohen, R. A., & Ebner, N. C. (2019). Associations between Subclinical De-pressive Symptoms and Reduced Brain Volume in Middle-Aged to Older Adults. Aging and Mental Health, 23, 819-830. https://doi.org/10.1080/13607863.2018.1432030
- 30. Tahmasebi, A. M., Abolmaesumi, P., Zheng, Z. Z., Munhall, K. G., & Johnsrude, I. S. (2009). Reducing Inter-Subject Anatomical Variation: Effect of Normalization Method on Sensitivity of Functional Magnetic Resonance Imaging Data Analysis in Auditory Cortex and the Superior Temporal Region. NeuroImage, 47, 1522-1531. https://doi.org/10.1016/j.neuroimage.2009.05.047
- 31. Veer, I. M., Beckmann, C. F., van Tol, M. J., Ferrarini, L., Milles, J., Veltman, D. J., Aleman, A., van Buchem, M. A., van der Wee, N. J., & Rombouts, S. A. R. B. (2010). Whole Brain Resting-State Analysis Reveals Decreased Functional Connectivity in Major Depression. Frontiers in Systems Neu-roscience, 4, 41. https://doi.org/10.3389/fnsys.2010.00041
- 32. Wang, L., Liu, Q., Shen, H., Li, H., & Hu, D. (2015). Large-Scale Functional Brain Network Changes in Taxi Drivers: Evidence from Resting-State fMRI. Human Brain Mapping, 36, No. 3. https://doi.org/10.1002/hbm.22670
- 33. WHO ICD-10. (2016). International Statistical Classification of Diseases and Related Health Problems, 10th Revision (ICD-10). World Health Organization.
- 34. Yan, C. G., Chen, X., Li, L., Castellanos, F. X., Bai, T. J., Bo, Q. J., Cao, J., Chen, G. M., Chen, N. X., Chen, W., Cheng, C., Cheng, Y. Q., Cui, X. L., Duan, J., Fang, Y. R., Gong, Q. Y., Guo, W. Bin, Hou, Z. H., Hu, L. et al. (2019). Reduced Default Mode Network Functional Connectivity in Patients with Recurrent Major Depressive Disorder. Proceedings of the National Academy of Sciences of the United States of America, 116, 9078-9083. https://doi.org/10.1073/pnas.1900390116
- 35. Yokoyama, S., Okamoto, Y., Takagaki, K., Okada, G., Takamura, M., Mori, A., Shiota, S., Ichikawa, N., Jinnin, R., & Yamawaki, S. (2018). Effects of Behavioral Activation on Default Mode Network Connectivity in Subthreshold Depression: A Preliminary Resting-State fMRI Study. Journal of Affective Disorders, 227, 156-163. https://doi.org/10.1016/j.jad.2017.10.021
- 36. Zhi, D., Calhoun, V. D., Lv, L., Ma, X., Ke, Q., Fu, Z., Du, Y., Yang, Y., Yang, X., Pan, M., Qi, S., Jiang, R., Yu, Q., & Sui, J. (2018). Aberrant Dynamic Functional Network Connectivity and Graph Properties in Major Depressive Disorder. Frontiers in Psychiatry, 9, 1-11. https://doi.org/10.3389/fpsyt.2018.00339
