Advances in Clinical Medicine
Vol.
13
No.
05
(
2023
), Article ID:
65107
,
13
pages
10.12677/ACM.2023.1351019
基于网络药理学探讨三生饮治疗缺血性脑卒中的作用机制
朱泓宇1,刘学全1,陈积2,冯伟1*
1青岛大学附属医院麻醉科,山东 青岛
2青岛大学药学院药物化学系,山东 青岛
收稿日期:2023年4月9日;录用日期:2023年5月3日;发布日期:2023年5月10日

摘要
目的:利用网络药理学探究三生饮治疗缺血性脑卒中的潜在作用机制。方法:通过TCMSP数据库检索和ADME筛选三生饮中各中药的活性成分,并收集其相应靶标,与PharmMapper数据库预测的活性成分潜在作用靶标相结合,构建中药–有效成分–靶点作用网络。通过DisGeNET、GeneCards、OMIM、TTD、DrugBank数据库获取缺血性脑卒中疾病靶标后,绘制有效成分作用靶标与疾病靶标的映射关系。采用STRING平台构建三生饮治疗缺血性脑卒中潜在作用靶点间蛋白相互作用网络图、利用Cytoscape3.8.2进行可视化分析并筛选核心靶标;运用R软件3.6.3进行基因本体(GO)功能及京都基因与基因组百科全书(KEGG)通路富集分析。结果:筛选出了三生饮19个有效成分(β-谷甾醇、谷甾醇、二氢辣椒素、丁子香萜、石防风素等),48种有效成分与疾病的交集靶点,PPI中5个核心靶标(ALB, JUN, PTGS2, MAPK1, ANXA5)。GO功能注释得到生物学过程条目997条(如血清素受体信号通路、细胞的激素代谢、细胞对类固醇激素和金属离子的反应等),细胞组成条目67条(如细胞膜区、膜微结构域、膜筏、细胞窖等),分子功能条目107条(如核受体活性、神经递质型G蛋白偶联受体活性、类固醇激素受体活性等);KEGG通路富集分析确定了118条三生饮治疗缺血性脑卒中的通路(如cAMP信号通路、IL-17信号通路、TNF信号通路等、神经营养因子相关信号通路等)。结论:本研究从多靶标、多通路阐释了三生饮可能通过抗氧化应激、抗炎、抗凋亡、促进细胞存活等生物学过程,发挥抗缺血性脑损伤作用,为后续对本方的深入研究提供了理论依据。
关键词
网络药理学,缺血性脑卒中,三生饮,作用机制

Exploring the Mechanism of Action of Sangshengyin in the Treatment of Ischemic Stroke Based on Network Pharmacology
Hongyu Zhu1, Xuequan Liu1, Ji Chen2, Wei Feng1*
1Department of Anesthesiology, The Affiliated Hospital of Qingdao University, Qingdao Shandong
2Department of Medicinal Chemistry, School of Pharmacy, Qingdao University, Qingdao Shandong
Received: Apr. 9th, 2023; accepted: May 3rd, 2023; published: May 10th, 2023

ABSTRACT
Objective: To investigate the potential mechanism of action of Sangshengyin in the treatment of ischemic stroke based on network pharmacology. Methods: The active ingredients of each herbal medicine in Sangshengyin were searched by TCMSP database and screened by ADME, and their corresponding targets were collected and combined with the potential targets of active ingredients predicted by PharmMapper database to construct a herbal medicine-active ingredient-target action network. After obtaining the ischemic stroke disease targets through DisGeNET, GeneCards, OMIM, TTD and DrugBank databases, the mapping relationships between the active ingredient targets and disease targets were drawn. The STRING platform was used to construct a protein interaction network between the potential targets of Sanshengyin for ischemic stroke, and Cytoscape3.8.2 was used to visualize and screen the core targets; R software 3.6.3 was used to enrich the gene ontology (GO) function and Kyoto Encyclopedia of Genomes (KEGG) pathway. Results: Nineteen active ingredients (β-sitosterol, Stigmasterol, Dihydrocapsaicin, Mairin, Deltoin, etc.), 48 active ingredient-disease intersection targets, and 5 core targets in PPI (ALB, JUN, PTGS2, MAPK1, ANXA5) were screened. 997 entries of biological processes were obtained from GO functional annotation (e.g. serotonin receptor signaling pathway, cellular hormone metabolism, cellular response to steroid hormones and metal ions, etc.), 67 entries for cellular composition (e.g. cellular membrane regions, membrane microdomains, membrane rafts, caveola, etc.) and 107 entries for molecular functions (e.g. nuclear receptor activity, neurotransmitter-type G protein-coupled receptor activity, steroid hormone receptor activity, etc.); the KEGG pathway enrichment analysis identified 118 pathways (e.g. cAMP signaling pathway, IL-17 signaling pathway, TNF signaling pathway, neurotrophic factor-related signaling pathway, etc.) for the treatment of ischemic stroke. Conclusion This study illustrates that Sanshengyin may exert anti-ischemic brain injury effects through antioxidant stress, anti-inflammatory, anti-apoptotic and cell survival biological processes, and provides a theoretical basis for further research on this formula.
Keywords:Network Pharmacology, Ischemic Stroke, Sangshengyin, Mechanism of Action

Copyright © 2023 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY 4.0).
http://creativecommons.org/licenses/by/4.0/


1. 引言
脑卒中俗称“中风”,是全球第二大死因和第三大残疾原因。2010年,约10%的死亡和4%的DALYs (伤残调整寿命年)损失由中风引起 [1] 。它每年消耗近4%的医疗保健总成本,并给医疗保健系统带来巨大的负担 [2] 。随着全球人口老龄化,中风造成的死亡率和负担将继续增加。据估计,到2030年,中风将导致1200万人死亡,全球死亡DALYs将超过2亿。大约87%的中风病例是缺血性中风 [3] 。脑缺血引起的神经元死亡决定了中风的死亡率和致残率 [4] 。
tPA (组织型纤溶酶原激活剂)是目前美国食品药品监督管理局批准的唯一治疗缺血性中风的药物 [5] 。然而,由于4.5小时的狭窄治疗时间窗和出血转化的潜在风险,只有不到10%的中风患者接受到tPA治疗 [6] 。缺血性脑卒中诱导神经损伤的细胞和分子机制包括酸中毒、兴奋性毒性、氧化应激、能量衰竭和炎症,最终导致细胞坏死或凋亡 [7] 。鉴于其机制的复杂性,迄今为止,所有临床前有效的神经保护药物都在临床试验中失败了 [8] 。最近,由于缺乏有效的中风治疗策略,人们对天然药物越来越感兴趣。与西方医学不同,中医药采用多途径、多靶点和整体概念治疗疾病,在治疗复杂疾病方面具有独特的优势 [9] 。推进中医药现代化,需要厘清中医药成分的物质基础,探索中医药活性成分的作用机制 [10] 。
三生饮由生南星、生川乌、生附子、木香、生姜等组成,具有祛风化痰、温阳散寒的作用,为治疗风痰壅盛、卒中外风的代表方。网络药理学基于“多靶点、多药物、多途径”的新概念,整合中药、蛋白质和基因等多个数据库进行分析,并利用生物信息学方法构建药物靶点疾病网络,预测药物作用机制 [11] 。因此,本研究通过网络药理学,探讨三生饮治疗缺血性脑卒中的有效成分和作用机制,为该方剂的进一步开发和临床应用提供理论依据。
2. 方法
2.1. 三生饮有效成分及靶点的筛选
利用TCMSP数据库(https://tcmspw.com/tcmsp.php)收集三生饮中各味中药的有效化学成分及作用靶点,按照TCMSP数据库中的吸收、分布、代谢和排泄(ADME)相关指标对活性成分进行筛选。筛选标准为:口服生物利用度(OB) ≥ 30%和药物相似性(DL) ≥ 0.18,血脑屏障通透性(BBB) ≥ −0.3。
2.2. 有效成分作用靶点的预测
通过PubChem数据库搜索上述有效成分的2D化学结构,并使用ChemBioDraw14.0软件绘制,保存为MOL2文件,并将其导入使用PharmMapper数据库(http://www.lilab-ecust.cn/pharmmapper/)对其作用靶点进行预测。设定物种(Human Protein Targets Only),每个基因保留前100位结果,获得的靶基因根据Fit 值排序。
2.3. “中药–有效成分–靶点”网络的构建
将筛选得到的有效成分及其相关作用靶点导入CytoScape软件(Version 3.8.2),构建“中药–有效成分-靶点”网络,根据靶标degree值大小定义颜色深浅并进行直观分析。
2.4. 缺血性脑卒中相关靶点的获取
以“Ischemic stroke”为检索词,在DisGeNET、GeneCards、OMIM、TTD、DrugBank数据库检索并获取缺血性脑卒中的基因靶点,去重后对其名称标准化。将疾病靶标与三生饮中有效成分预测的靶标取交集,并绘制韦恩图(https://bioinfogp.cnb.csic.es/tools/venny/),作为三生饮治疗缺血性脑卒中的潜在作用靶点。
2.5. 靶点蛋白质–蛋白质相互作用(PPI)网络的构建与分析
通过String数据库(https://String-db.org/)构建三生饮有效成分治疗缺血性脑卒中潜在靶标间的相互作用网络,设置物种为Homo sapiens,confidence score ≥ 0.9。利用CytoScape (Version 3.8.2)中的插件CytoNCA分析网络中各个节点的拓扑参数(BC、CC、DC等),以大于中位值为条件筛选2次后,得到网络核心基因。
2.6. 靶点基因功能注释和富集分析
将潜在的作用靶标导入Rx64软件(3.6.3版本),使用clusterProfiler包(3.14.3版本)用于富集分析,org.Hs.eg.db包(3.10.0版本)用于ID转换,ggplot2包(3.3.3版本)用于结果可视化,设定物种为Homo sapiens,阈值P < 0.05。基因本体(Gene Ontology, GO)注释分析结果包括分子功能(Molecular function, MF)、生物过程(Biological process, BP)和细胞组分(Cellular component, CC) 3部分,通过P值评估蛋白注释功能的显著性。Kyoto encyclopedia of genes and genomes (KEGG)信号通路富集分析取排名前20位的通路进行分析和可视化,利用KEGG数据库(https://www.kegg.jp/)检索通路图并着色。
3. 结果
3.1. 三生饮中的主要化学成分
三生饮由生南星,生川乌,生附子,木香及生姜四味中药组成。结合以下特点进行筛选:1) 中药经口服后吸收;2) 成分结构性质上应具备良好的类药性;3) 药物治疗脑卒中需穿透血脑屏障在脑内发挥作用,获得三生饮的有效成分,其中附子7种、天南星6种、木香4种、生姜5种、川乌两种。去重后共19种小分子成分,如β-谷甾醇(Beta-sitosterol)、谷甾醇(Sitosterol)、植物甾醇(Stigmasterol)、水黄皮素(Karanjin)、二氢辣椒素(Dihydrocapsaicin)、丁子香萜(Mairin)、石防风素(Deltoin)、11,14-二十碳二烯酸甲酯(11,14-eicosadienoic acid)、多根乌头碱(karakoline)等,各味中药对应成分示例见图1。

Figure 1. Pictures of Chinese herbal compound and examples of potential active ingredients
图1. 复方中的中药及潜在的有效成分示例
3.2. 三生饮中有效成分的相关作用靶点
收集上述化合物在TCMSP数据库中的对应靶点,去重后通过UniProt数据库将靶点标准化处理(转换为gene symbols),总共得到59个相关靶点。从PharmMapper服务器预测的结果,每个化合物选择具有最高Fit分数的前10个靶点基因作为其潜在靶点,去重后共获得51个潜在靶标,“中药–有效成分–靶点”具体网络关系的直观展示见图2。
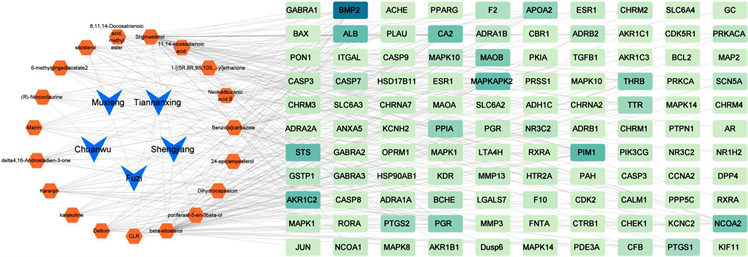
Figure 2. “Chinese medicine-active ingredient-target” network relationship diagram
图2. “中药–有效成分–靶点”网络关系图
3.3. 缺血性脑卒中疾病靶点汇总
从GeneCards、DisGenet、DrugBank、TTD和OMIM共5个数据库中,获取缺血性脑卒中疾病相关靶点分别为2912、126、78、10、7个,将数值取并集共得到2961个相关靶基因,见图3。

Figure 3. Venn plot of ischemic stroke targets
图3. 缺血性脑卒中疾病靶点的韦恩图
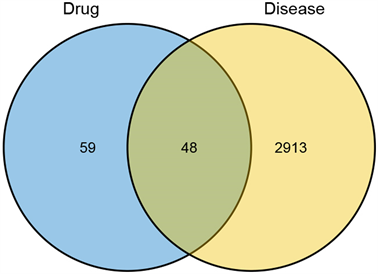
Figure 4. Venn diagram of drug targets and disease targets
图4. 药物靶点与疾病靶点的韦恩图
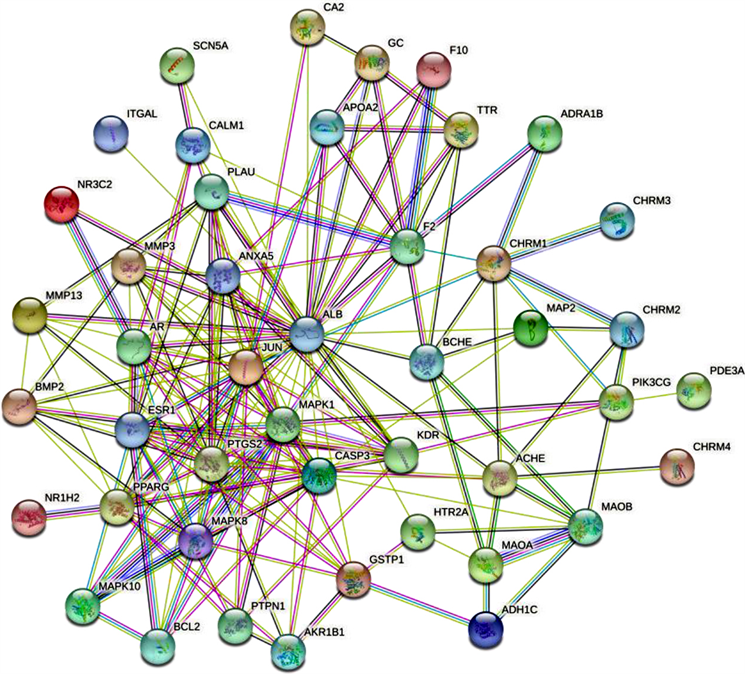
Figure 5. Protein-protein interaction (PPI) network of Sanshengyin Prescription in treatment of ischemic stroke
图5. 三生饮治疗缺血性脑卒中的PPI网络
3.4. 三生饮治疗缺血性脑卒中潜在靶点的PPI网络构建
结合文献研究和预测结果,最终选取三生饮有效成分作用靶标107个,同缺血性脑卒中2961个靶标取交集,获得药物治疗疾病过程中发挥作用的潜在靶标48个,如图4所示。将上述靶点导入STRING数据库,得到蛋白质相互作用网络图,去除游离节点后,共得到45个节点和358条边,见图5。
3.5. 核心靶点的筛选
将STRING数据库中得到的PPI网络文件导入Cytoscape软件,利用CytoNCA计算节点的Betweenness、Closeness、Degree、Eigenvector、LAC以及Network值,以大于中位值为筛选条件,进行两轮筛选最终得到5个节点,10条边的核心网络图。核心节点为,白蛋白(ALB)、JUN蛋白(JUN)、人前列腺素G/H合酶2 (PTGS2)、丝裂原活化蛋白激酶1 (MAPK1)、膜联蛋白A5 (ANXA5),见图6。

Figure 6. Core targets of Sanshengyin Prescription in treatment of ischemic stroke
图6. 三生饮治疗缺血性脑卒中关键靶点筛选图
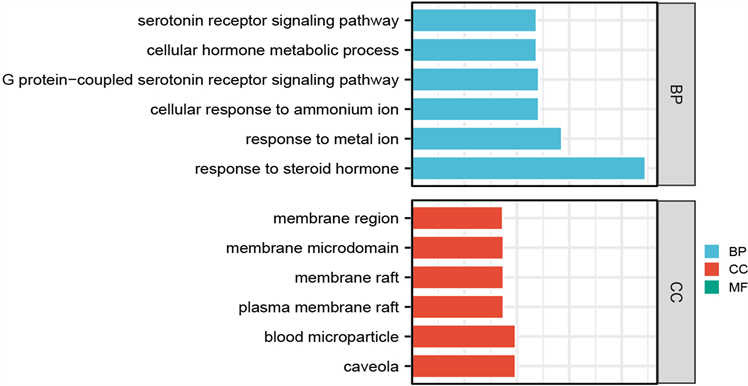
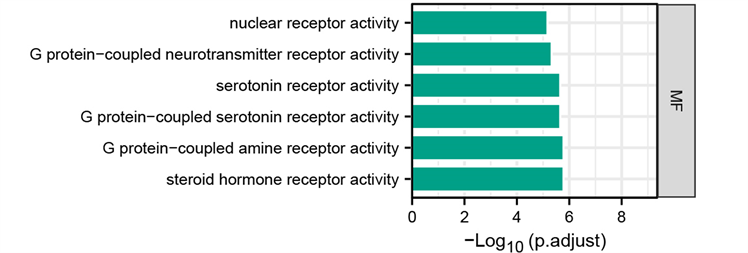
Figure 7. GO functional enrichment analysis
图7. GO功能富集分析

Figure 8. KEGG pathway enrichment analysis
图8. KEGG通路富集分析
3.6. GO功能富集分析和 KEGG通路富集分析
GO富集分析结果如图7所示,三生饮治疗缺血性脑卒中涉及的生物过程条目997条,主要有G蛋白偶联型和配体门控离子通道型5-羟色胺(血清素)受体信号通路、细胞的激素代谢、细胞对铵根离子及金属离子的反应、细胞对类固醇激素的反应;作用的细胞组分67个,主要在细胞膜区、膜微结构域、膜筏、血液微粒、胞膜窖;参与的分子功能107种,主要调节核受体活性、5-羟色胺(血清素)受体的活性、胺类或其他神经递质结合的G蛋白偶联受体活性、类固醇激素受体活性。
KEGG富集分析得到相关通路118条,结果表明,中药里的活性成分主要通过作用于环磷酸腺苷(cAMP)信号通路、胆碱能突触相关细胞通路、白介素17 (IL-17)和肿瘤坏死因子(TNF)信号通路、神经营养因子(Neurotrophin)相关信号通路、凋亡通路、C型凝集素受体等信号通路来治疗缺血性脑卒中,见图8。
3.7. 核心信号通路中的靶基因分布
在信号通路富集分析结果中,根据靶基因命中数(Counts)和校正后的P值(p.adjust)综合分析,治疗作用显示出与cAMP信号通路(hsa04024)和IL-17信号通路(hsa04657)的显著功能关联。靶点基因相关蛋白包括激素与神经递质调控的G蛋白偶联受体(GPCR)、磷酸二酯酶(PDE)、钙调蛋白(CaM)、细胞外调节蛋白激酶(ERK1/2)、c-Jun氨基末端激酶(JNK)、Jun家族蛋白(JUN等)、环氧合酶2 (COX-2)、基质金属蛋白酶家族蛋白(MMP)、半胱氨酸–天冬氨酸蛋白酶家族(CASP)等,在通路中由粉红色标出,详见图9。

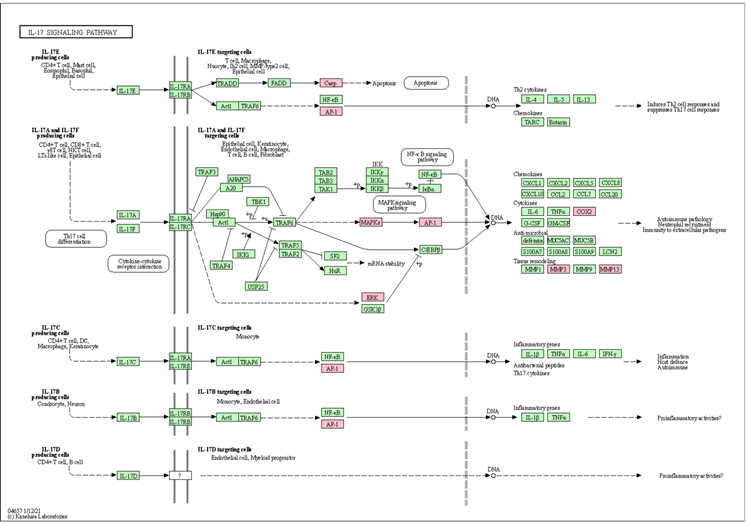
Figure 9. Enrichment of targets in cAMP signal pathway and IL-17 signal pathway
图9. 靶点在cAMP和IL-17信号通路的分布情况
4. 讨论
三生饮最早见于宋·王硕的《易简方》,后为《太平惠民和剂局方》所载。方由生南星、生川乌、生附子、木香、生姜组成,具有祛风化痰,散寒温阳之功效。缺血性中风的损伤机制包括细胞凋亡、坏死、炎症、免疫调节和氧化应激等关键病理过程 [12] 。相关动物实验证明,复方三生饮(生南星、生乌头、生附子,木香及生姜),发挥自由基清除剂及Ca2+拮抗剂类作用,可增加脑血流量,降低动静脉氧分压差,来防止脑缺血性损伤 [13] [14] [15] 。同时,本方可以在局灶性脑缺血再灌注损伤大鼠模型中,可上调缺血侧的脑皮质和海马Bcl-2的表达,下调Caspase-3蛋白表达,减少脑缺血后的细胞凋亡,缩小脑梗死体积 [16] [17] 。
本研究通过网络药理学分析,筛选出三生饮中有效活性成分19个,作用于缺血性脑卒中的治疗靶点45个,其中β-谷甾醇、谷甾醇、植物甾醇、水黄皮素、石防风素、二氢辣椒素等活性成分发挥重要作用,这与中药复方多成分、多靶点干预的特点相吻合。有研究发现,复方中生姜可以显著减少caspase-3表达,升高Bcl-2/Bax比值,抑制MCAO大鼠皮层神经元凋亡 [18] 。对生姜挥发油的药理学研究表明,生姜中有效成分可以降低大鼠脑组织细胞凋亡,减少皮层和海马神经元中细胞色素C、组织蛋白酶B、组织蛋白酶D表达,对溶酶体–线粒体凋亡途径产生抑制效应,保护脑缺血再灌注损伤 [19] 。活性成分二氢辣椒素可以降低神经细胞中MDA水平,改善CAT和SOD活性,降低Bax和caspase-3的比值,增加Bcl-XL与β-肌动蛋白表达比值,通过抗氧化和抗凋亡途径减轻缺血性脑损伤 [20] 。二氢辣椒素还能激活Nrf2,增强SOD和GPx活性,并下调ROS、NADPH氧化酶(NOX2, NOX4)、NF-ĸB和NO水平,降低基质金属蛋白酶-9 (MMP-9)表达从而减轻脑组织氧化应激和炎症相关损伤 [21] 。天南星、木香和生姜中共有的有效成分为豆甾醇,可以降低缺血再灌注损伤小鼠脑组织NO和MDA水平,减少COX-2和NF-ĸB的表达。同时,豆甾醇还通过上调Nrf2和HO-1表达,增强SOD、GSH和GSH-Px活性,减轻氧化应激和炎症反应来保护大脑免受脑缺血再灌注损伤 [22] 。
在构建的PPI网络中,ALB、JUN、PTGS2、MAPK1、ANXA5被确定为药物发挥神经保护作用的核心靶点。研究表明,较高的血清白蛋白(ALB)水平能够降低缺血性脑卒中的死亡风险 [23] 。白蛋白的催化作用影响内源性和外源性化合物的代谢,包括蛋白质、脂质、胆固醇、活性氧(ROS)和药物 [24] 。氧化应激被认为是脑缺血后脑损伤的主要因素,体内过多的ROS产生会导致中风后的氧化应激诱导细胞死亡 [25] 。白蛋白催化功能的增强,可加快ROS的清除以达到降低氧化应激损伤的功效。最近研究表明,COX-2/PGE2通路可抑制脑缺血再灌注损伤中诱导的铁死亡 [26] ,铁死亡是缺血性中风后神经元死亡的方式之一 [27] ,作用于PTGS2的成分可能作用于该通路发挥脑保护作用。转录因子AP-1家族蛋白涉及多种细胞过程的调控,包括增殖和存活、生长、分化、凋亡、细胞迁移,Jun蛋白是其中一员 [28] 。脑缺血再灌注过程中,神经细胞中c-Jun表达增加,并与Bcl-2/Bax同步变化 [29] 。丝裂原活化蛋白激酶(MAPK)家族的磷酸化在神经细胞的生长和稳态中发挥重要作用 [30] ,病理情况下与促炎因子的调节以及血脑屏障的损伤密切相关 [31] 。膜联蛋白(Annexin)家族成员参与抗凝血、抗炎、细胞增殖、分化和凋亡等生物过程,Annexin A5是其中分布最多最广泛的成员,主要起抗凝血的功能 [32] 。随着研究的深入,发现Annexin A5还参与炎症反应和凋亡等过程。总之,药物作用于核心靶点是通过抗氧化应激、抗凋亡、抗血栓、抗炎等方面发挥积极治疗作用。
GO功能富集分析结果显示,三生饮抗脑缺血性损伤的活性成分主要作用在中枢神经系统中的膜受体上(特异性神经递质受体及G蛋白偶联受体),调节受体功能及其下游信号通路靶点的活性发挥作用,还参与细胞对神经类固醇和离子变化的反应,调节神经传递,改变神经元的兴奋性 [33] 。KEGG通路富集分析结果表明,治疗作用与多条信号通路有关,主要调控PKA系统(cAMP信号通路)和IL-17、TNF等炎症信号通路。缺血性脑卒中时,细胞外Ca2+的大量内流,启动胞内多种激酶途径,包括cAMP依赖性蛋白激酶(PKA)和CaM依赖性激酶(CaMK),它们促进CREB蛋白磷酸化和基因表达 [34] [35] 。活化的CREB上调BDNF活性,并促进其与高亲和力受体TrkB-FL的结合 [36] ,触发MAPK/ERK [37] 、PI3K/Akt的激活调控神经元存活相关蛋白活性 [38] ,抑制促凋亡蛋白BAD,发挥强大的神经保护作用。TNF是一种参与全身炎症急性期的典型细胞因子,与脑缺血的严重程度密切相关 [39] ,对再灌注损伤引起的炎症反应具有一定的调节作用 [40] 。白介素-17 (IL-17)是体内重要的促炎细胞因子,参与先天和适应性免疫应答,与多种疾病相关。IL-17A是IL-17家族中研究最广泛的成员之一,可通过多种不同信号途径加重神经元损伤,使神经功能恶化。然而,在恢复期由反应性星形胶质细胞分泌的IL-17A则发挥促进神经元再生、突触形成的作用,从而改善神经功能 [41] 。
5. 总结
综上所述,本研究基于网络药理学分析出了三生饮治疗缺血性脑卒中的潜在生物学机制。复合靶点基因网络可以揭示多组分和多靶点之间的密切相互作用,增强对组方三生饮中各味中药在缺血性中风中潜在作用的理解,同时也为探索更多具有脑保护作用的天然成分提供了理论依据。
文章引用
朱泓宇,刘学全,陈 积,冯 伟. 基于网络药理学探讨三生饮治疗缺血性脑卒中的作用机制
Exploring the Mechanism of Action of Sangshengyin in the Treatment of Ischemic Stroke Based on Network Pharmacology[J]. 临床医学进展, 2023, 13(05): 7280-7292. https://doi.org/10.12677/ACM.2023.1351019
参考文献
- 1. Feigin, V.L., Forouzanfar, M.H., Krishnamurthi, R., Mensah, G.A., Connor, M., Bennett, D.A., et al. (2014) Global and Regional Burden of Stroke during 1990-2010: Findings from the Global Burden of Disease Study 2010. The Lancet, 383, 245-254. https://doi.org/10.1016/S0140-6736(13)61953-4
- 2. Donnan, G.A., Fisher, M., Macleod, M. and Davis, S.M. (2008) Stroke. The Lancet, 371, 1612-1623. https://doi.org/10.1016/S0140-6736(08)60694-7
- 3. Minnerup, J., Sutherland, B.A., Buchan, A.M. and Klein-schnitz, C. (2012) Neuroprotection for Stroke: Current Status and Future Perspectives. International Journal of Molecu-lar Sciences, 13, 11753-11772. https://doi.org/10.3390/ijms130911753
- 4. Campbell, B.C.V., De Silva, D.A., Macleod, M.R., Coutts, S.B., Schwamm, L.H., Davis, S.M. and Donnan, G.A. (2019) Ischaemic Stroke. Nature Reviews Disease Primers, 5, 70. https://doi.org/10.1038/s41572-019-0118-8
- 5. Bansal, S., Sangha, K.S. and Khatri, P. (2013) Drug Treatment of Acute Ischemic Stroke. American Journal of Cardiovascular Drugs, 13, 57-69. https://doi.org/10.1007/s40256-013-0007-6
- 6. Bhaskar, S., Stanwell, P., Cordato, D., Attia, J. and Levi, C. (2018) Reperfusion Therapy in Acute Ischemic Stroke: Dawn of a New Era? BMC Neurology, 18, Article No. 8. https://doi.org/10.1186/s12883-017-1007-y
- 7. Tuo, Q.Z., Zhang, S.T. and Lei, P. (2022) Mechanisms of Neu-ronal Cell Death in Ischemic Stroke and Their Therapeutic Implications. Medicinal Research Reviews, 42, 259-305. https://doi.org/10.1002/med.21817
- 8. Zhu, T., Wang, L., Wang, L.P. and Wan, Q. (2022) Therapeutic Targets of Neuroprotection and Neurorestoration in Ischemic Stroke: Applications for Natural Compounds from Medicinal Herbs. Biomedicine & Pharmacotherapy, 148, Article ID: 112719. https://doi.org/10.1016/j.biopha.2022.112719
- 9. Tao, T., Liu, M., Chen, M., Luo, Y., Wang, C., Xu, T., Jiang, Y., Guo, Y. and Zhang, J.H. (2020) Natural Medicine in Neu-roprotection for Ischemic Stroke: Challenges and Prospective. Pharmacology & Therapeutics, 216, Article ID: 107695. https://doi.org/10.1016/j.pharmthera.2020.107695
- 10. Hu, Y.Z. and Wang, J. (2019) Interactions between Clopidogrel and Traditional Chinese Medicine. Journal of Thrombosis and Thrombolysis, 48, 491-499. https://doi.org/10.1007/s11239-019-01945-3
- 11. Niu, B.X., Zhang, H., Li, C.Y., Yan, F., Song, Y., Hai, G.F., Jiao, Y.J. and Feng, Y.S. (2019) Network Pharmacology Study on the Active Components of Pterocypsela elata and the Mechanism of Their Effect against Cerebral Ischemia. Drug Design, Development and Therapy, 13, 3009-3019. https://doi.org/10.2147/DDDT.S207955
- 12. Pandya, R.S., Mao, L., Zhou, H., Zhou, S., Zeng, J., Popp, A.J. and Wang, X. (2011) Central Nervous System Agents for Ischemic Stroke: Neuroprotection Mechanisms. Central Nervous System Agents in Medicinal Chemistry, 11, 81‑97. https://doi.org/10.2174/187152411796011321
- 13. 杨万章, 万中民. 逐瘀化痰汤、三生饮、抵当汤对实验大鼠脑出血后EEG变化的研究[J]. 北京中医药大学学报, 1996(3): 64-66+73-74.
- 14. 杨万章, 万中民, 李明富, 张发荣. 逐瘀化痰汤等三方对大鼠脑出血脑组织MDA、Ca2+、Fe2+影响的实验研究[J]. 北京中医药大学学报, 1997(6): 35-37+69.
- 15. 孙爱续, 王秀荣, 高晓山. 三生饮对小鼠缺氧及兔血流动力学、血气、pH值的影响[J]. 中国实验方剂学杂志, 1996(4): 18-21.
- 16. 王媛媛, 王长松, 胡曼菁, 晋光荣. 三生饮对大鼠局灶性脑缺血Bcl-2 Bax蛋白表达的影响[J]. 辽宁中医杂志, 2005(5): 492-494.
- 17. 胡申, 王长松, 晋光荣. 三生饮对脑缺血大鼠大脑皮质区caspase-3表达的影响[J]. 现代中医药, 2006(2): 40-42.
- 18. 王军, 于震, 张红霞, 贾士奇, 黄霞. 生姜对局灶性脑缺血再灌注大鼠皮层神经细胞凋亡及Bcl-2, Baxc, aspase-3表达的影响[J]. 中国中药杂志, 2011, 36(19): 2734-2736.
- 19. 王晓丽, 张薇, 张雪侠, 田萍, 王军. 生姜挥发油对脑缺血再灌注大鼠溶酶体-线粒体途径凋亡的影响[J]. 中药新药与临床药理, 2020, 31(10): 1153-1157.
- 20. Jittiwat, J., Suksamrarn, A., Tocharus, C. and To-charus, J. (2021) Dihydrocapsaicin Effectively Mitigates Cerebral Ischemia-Induced Pathological Changes in Vivo, Partly via Antioxidant and Anti-Apoptotic Pathways. Life Sciences, 283, Article ID: 119842. https://doi.org/10.1016/j.lfs.2021.119842
- 21. Janyou, A., Wicha, P., Jittiwat, J., Suksamrarn, A., Tocharus, C. and Tocharus, J. (2017) Dihydrocapsaicin Attenuates Blood Brain Barrier and Cerebral Damage in Focal Cerebral Ische-mia/Reperfusion via Oxidative Stress and Inflammatory. Scientific Reports, 7, Article No. 10556. https://doi.org/10.1038/s41598-017-11181-5
- 22. Liang, Q., Yang, J., He, J., Chen, X., Zhang, H., Jia, M., Liu, K., Jia, C., Pan, Y. and Wei, J. (2020) Stigmasterol Alleviates Cerebral Ischemia/Reperfusion Injury by Attenuating Inflam-mation and Improving Antioxidant Defenses in Rats. BioScientific Reports, 40, BSR20192133. https://doi.org/10.1042/BSR20192133
- 23. 吴恺迪, 尹霄, 任占云, 赵彦平, 董佳怡, 沈冲, 马铁梁, 陈如华. 血清清蛋白水平与缺血性脑卒中患者出院后死亡风险的相关性[J]. 临床检验杂志, 2021, 39(7): 500-503.
- 24. De Simone, G., di Masi, A. and Ascenzi, P. (2021) Serum Albumin: A Multifaced Enzyme. Internation-al Journal of Molecular Sciences, 22, 10086. https://doi.org/10.3390/ijms221810086
- 25. Chen, H., He, Y., Chen, S., Qi, S. and Shen, J. (2020). Therapeutic Targets of Oxidative/Nitrosative Stress and Neuroinflammation in Ischemic Stroke: Applications for Natural Product Efficacy with Omics and Systemic Biology. Pharmacological Research, 158, Article ID: 104877. https://doi.org/10.1016/j.phrs.2020.104877
- 26. Xu, Y., Liu, Y., Li, K., Yuan, D., Yang, S., Zhou, L., Zhao, Y., Miao, S., Lv, C. and Zhao, J. (2022) COX-2/PGE2 Pathway Inhibits the Ferroptosis Induced by Cerebral Ischemia Reperfusion. Molecular Neurobiology, 59, 1619-1631. https://doi.org/10.1007/s12035-021-02706-1
- 27. Mao, R., Zong, N., Hu, Y., Chen, Y. and Xu, Y. (2022) Neu-ronal Death Mechanisms and Therapeutic Strategy in Ischemic Stroke. Neuroscience Bulletin, 38, 1229-1247. https://doi.org/10.1007/s12264-022-00859-0
- 28. Vesely, P.W., Staber, P.B., Hoefler, G., et al. (2009) Transla-tional Regulation Mechanisms of AP-1 Proteins. Mutation Research, 682, 7-12. https://doi.org/10.1016/j.mrrev.2009.01.001
- 29. Xiao, X., Liu, X.W., Zhao, N.N., et al. (2018) Correlations of Neuronal Apoptosis with Expressions of c-Fos and c-Jun in Rats with Post-Ischemic Recording Damage. European Re-view for Medical and Pharmacological Sciences, 22, 2832-2838.
- 30. Veeranna, Amin, N.D., Ahn, N.G., Jaffe, H., et al. (1998) Mitogen-Activated Protein Kinases (Erk1,2) Phosphorylate Lys-Ser-Pro (KSP) Repeats in Neurofilament Pro-teins NF-H and NF-M. The Journal of Neuroscience: The Official Journal of the Society for Neuroscience, 18, 4008-4021. https://doi.org/10.1523/JNEUROSCI.18-11-04008.1998
- 31. Vikman, P., Ansar, S., Henriksson, M., et al. (2007) Cerebral Ischemia Induces Transcription of Inflammatory and Extracellular-Matrix-Related Genes in Rat Cerebral Arteries. Experimental Brain Research, 183, 499-510. https://doi.org/10.1007/s00221-007-1062-5
- 32. Yeh, Y.H., Chang, S.H., Chen, S.Y., Wen, C.J., Wei, F.C., Tang, R., Achilefu, S., Wun, T.C. and Chen, W.J. (2017) Bolus Injections of Novel Thrombogenic Site-Targeted Fusion Pro-teins Comprising Annexin-V and Kunitz Protease Inhibitors Attenuate Intimal Hyperplasia after Balloon Angioplasty. International Journal of Cardiology, 240, 339-346. https://doi.org/10.1016/j.ijcard.2017.03.150
- 33. Rupprecht, R. (1997) The Neuropsychopharmacological Potential of Neuroactive Steroids. Journal of Psychiatric Research, 31, 297-314. https://doi.org/10.1016/S0022-3956(96)00060-X
- 34. Mabuchi, T., Kitagawa, K., Kuwabara, K., Takasawa, K., Ohtsuki, T., Xia, Z., Storm, D., Yanagihara, T., Hori, M. and Matsumoto, M. (2001) Phosphorylation of cAMP Re-sponse Element-Binding Protein in Hippocampal Neurons as a Protective Response after Exposure to Glutamate in Vitro and Ischemia in Vivo. Journal of Neuroscience, 21, 9204-9213. https://doi.org/10.1523/JNEUROSCI.21-23-09204.2001
- 35. Ling, Y.Z., Zhang, X.W., Wang, X., Du, Y. and Yu, L. (2021) Changes of CaM-CaMK-CREB Signaling Pathway and Related Neuron Factors in Hippocampus of Rats after Sevoflurane and Propofol Administration. European Review for Medical and Pharmacological Sciences, 25, 957-967.
- 36. Tejeda, G.S., Esteban-Ortega, G.M., San Antonio, E., Vidaurre, O.G. and Diaz-Guerra, M. (2019) Pre-vention of Excitotoxicity-Induced Processing of BDNF Receptor TrkB-FL Leads to Stroke Neuroprotection. EMBO Mo-lecular Medicine, 11, e9950. https://doi.org/10.15252/emmm.201809950
- 37. Wang, Y., Han, J., Zhu, J., Zhang, M., Ju, M., Du, Y. and Tian, Z. (2021) GluN2A/ERK/CREB Signaling Pathway Involved in Electroacupuncture Regu-lating Hypothalamic-Pituitary-Adrenal Axis Hyperactivity. Frontiers in Neuroscience, 15, Article ID: 703044. https://doi.org/10.3389/fnins.2021.703044
- 38. Gaidin, S.G., Turovskaya, M.V., Gavrish, M.S., Babaev, A.A., Mal’tseva, V.N., Blinova, E.V. and Turovsky, E.A. (2020) The Selective BDNF Overexpression in Neurons Protects Neuroglial Networks against OGD and Glutamate-Induced Excitotoxicity. International Journal of Neuroscience, 130, 363-383. https://doi.org/10.1080/00207454.2019.1691205
- 39. Oliveira, D.M.G., Aguiar, L.T., de Oliveira Limones, M.V., Gomes, A.G., da Silva, L.C., de Morais Faria, C.D.C. and Scalzo, P.L. (2019) Aerobic Training Efficacy in Inflammation, Neurotrophins, and Function in Chronic Stroke Persons: A Randomized Controlled Trial Protocol. Journal of Stroke and Cerebrovascular Diseases, 28, 418‑424. https://doi.org/10.1016/j.jstrokecerebrovasdis.2018.10.016
- 40. Lambertsen, K.L., Biber, K. and Finsen, B. (2012) Inflammatory Cytokines in Experimental and Human Stroke. Journal of Cerebral Blood Flow & Metabolism, 32, 1677-1698. https://doi.org/10.1038/jcbfm.2012.88
- 41. Lin, Y., Zhang, J.C., Yao, C.Y., et al. (2016) Critical Role of Astrocytic Interleukin-17 A in Post-Stroke Survival and Neuronal Differentiation of Neural Precursor Cells in Adult Mice. Cell Death & Disease, 7, e2273. https://doi.org/10.1038/cddis.2015.284