Advances in Analytical Chemistry
Vol.08 No.03(2018), Article ID:26237,12
pages
10.12677/AAC.2018.83014
Study on the Polymorph and Properties of Pyrimethamine
Jing Lan, Xiaozhen Feng*, Guocheng Han
School of Life and Environmental Sciences, Guilin University of Electronic Technology, Guilin Guangxi
Received: Jul. 7th, 2018; accepted: Jul. 26th, 2018; published: Aug. 2nd, 2018

ABSTRACT
In this paper, polymorph of pyrimethamine was studied by using the sublimation and recrystallization of the drug to prepare form A, B and C three types of crystal, which were characterized by SEM, XRD and IR spectra. At the same time, the tablets of three crystals were prepared according to “Chinese Pharmacopoeia” 2015 version for testing, and focused on whether the tablets of the dissolution profile similarity. Form A converted to Form B after sublimation at 280˚C, Form B recrystallized in ethanol to give crystal Form C. The solubility results show that A crystalline has slightly hygroscopic; B polymorph has hygroscopic. The prepared tablets of Form A and Form B pyrimethamine about content, content uniformity, dissolution test results are in line with the scope of the 2015 edition of Chinese Pharmacopoeia standards. The dissolution curves of Form A and Form B pyrimethamine are similar to each other.
Keywords:Pyrimethamine, Drug Polycrystalline, Quality, Dissolution
乙胺嘧啶药物的多晶型及性质研究
兰晶,冯小珍*,韩国成
桂林电子科技大学生命与环境科学学院,广西 桂林
收稿日期:2018年7月7日;录用日期:2018年7月26日;发布日期:2018年8月2日

摘 要
采用升华法和重结晶法制备乙胺嘧啶药物的A、B、C三种晶型,通过扫描电镜,XRD和红外光谱对三种多晶型进行表征,采用粉末直接压片法分别制得A、B晶型乙胺嘧啶片剂,对制备的片剂按《中国药典》2015版乙胺嘧啶片中规定的主要项目进行检测。结果表明,乙胺嘧啶药物存在ABC三种晶型。A晶型在280℃时升华转化成B晶型,B晶型乙醇重结晶得到C晶型,证实A和C为同一种晶型,B晶型为另一种晶型。AB晶型的溶解性是有差异的,A晶型略有引湿性,B晶型有引湿性,所制备片剂的重量差异、含量、含量均匀度、溶出度检测结果均符合《中国药典》2015版乙胺嘧啶片标准规定的范围。乙胺嘧啶药物AB两种晶型片剂的溶出曲线相似。
关键词 :乙胺嘧啶,药物多晶型,片剂,溶出度

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
自18世纪20年代磷酸钠多晶型现象被发现后,药物多晶型这一研究得到了生化科学界广泛的关注。特别是20世纪60年代之后,很多相干技术的进步和科学表征方法的提高,如X-射线衍射、扫描电镜、红外光谱法等表征方法,药物晶型的研究得到了长足的发展。多晶型现象在有机药物中广泛存在。多晶型在固体有机物质,尤其在具有多种官能团的有机物质中的常见现象 [1] [2] ,如在多晶型药物巴比妥类中(38种),有63%多晶型 [3] 。据统计,美国药典38版片剂药物中,约40%的药品具有多晶型。药物多晶型问题已成为药物开发过程中的重要项目以及药剂品质控制中不可缺失的研究内容。
对于固体化学药物,由于其质点的排列形式及空间对称性的差异,同一种物质可以形成不同的外观形态、晶体结构、药理性质多晶型药物。药物在重结晶因素的改变下。可以产生空间的差异,使药物质点之间作用力或结合形式的差异,和一些化合物的化学键位置变换、部分空间构象改变等等,导致药物晶体形成2种或2种以上的空间构象和晶胞数据 [4] 。药物的多晶型,有相同的分子式和分子量,但有不同的空间结构 [5] 。随后多晶型的类别也逐渐被人们所区分,药物多晶型主要分为6种类型:构象型多晶型、构型型多晶型、堆叠型多晶型、氧键型多晶型、假多晶型、药物成盐产生的多晶型。有的情况下,同一药物的不同晶体中某一晶型甚至是有毒的 [6] [7] [8] [9] 。因此,药物的多晶型研究在生产制造时和贮存过程中,研究药物的多晶型特征以及了解其理化性质是非常重要的。
生物利用度是药物或代谢物被吸收的速度和分量,进而能让药物或代谢物通过血液到达作用部位。固体药物由于空间结构的不同以及质点之间的作用力不同而导致晶型的不同,从而影响药物的形态和颗粒表面积,进而导致药物在体内时吸收的不同,继而使药物疗效存在差别 [10] [11] 。药物的多晶型可以分为不稳定型和亚稳定型以及稳定型。从亚稳定型转化为稳定型一般是很缓慢的过程,所以亚稳定型也能在一定环境下稳定的保存。亚稳定型位于两者之间。亚稳定型和不稳定型会在一某些的环境下渐渐向稳定型转化。药物的晶型在温度、湿度、放置时间等一定条件下可以相互转化。为确保每批次药物的等效性,从而研究不同晶型的稳定性,针对不同晶型制订相关保证制药和存储过程中的措施 [12] [13] [14] 。
药物多晶型表征,通过比较熔点、溶解度、外观等药理性质的差异,并且借助红外、X衍射等谱图,来判断区分是何种晶型,确定药物的稳定性、生物利用度以及疗效,从而影响药物稳定性、生物利用度等疗效的发挥 [15] 。
乙胺嘧啶(结构如图1所示)主要用于预防疟疾,其机制是影响疟原虫的核酸合成,阻碍疟原虫叶酸代谢过程,影响疟原虫的二氢叶酸还原酶,致使疟原虫的生长繁殖受到抑制,存在多晶型现象。本文采用升华法和重结晶法制备乙胺嘧啶药物的晶型,通过光学显微镜,扫描电镜,红外分光光度法对多晶型进行表征,采用粉末直接压片法分别制得晶型乙胺嘧啶片剂,对制备的片剂按《中国药典》2015版中规定的主要项目进行考察。
2. 实验部分
2.1. 实验试剂
实验所用试剂均为分析纯,乙胺嘧啶(原料药,常熟市联创化学有限公司),水为二次蒸馏水。
2.2. 实验仪器及过程
2.2.1. 药物晶体制备及性质测试
1) 乙胺嘧啶转晶试验。取乙胺嘧啶原料药适量,分别用乙醇、丙酮、乙酸乙酯等有机溶剂溶解,在一定条件下重结晶得到乙胺嘧啶(分别自然放置重结晶和加速蒸发重结晶)。经显微镜初步表征得出以上重结晶均为同一种,并未发生晶型转变,即同为晶型A。取乙胺嘧啶原料药(A晶型)约0.5 g,置于白色磁蒸发皿中,放入电热套中使之平稳,上面盖一块无色透明表面皿,以便观察,加热直到药品开始熔化,随后看见蒸发皿内药品熔融升华,直到药品刚好彻底熔融,并且沉积在蒸发皿的边沿,继续加热4 min,关掉电热套,冷却至室温,取下并小心刮至药品盒,得到针状结晶(B晶型)。再取晶型B少许,再用乙醇重结晶,得颗粒状晶体(C)。
2) 溶解性实验。分别称取0.02 g晶型A、B乙胺嘧啶样品置试管中,各6份,依次加入磷酸盐缓冲液(pH 6.8)、醋酸-醋酸钠缓冲液(pH 4.5)、pH 1.2盐酸溶液(0.1 mol/L)、三氯甲烷、乙醇、丙酮6种介质,记录30 min内观察溶解情况,直到彻底溶解,记录数据。
3) 引湿性测定。取烘干的具塞玻璃称量瓶,在试验前一天放置在装有硫酸铵饱和溶液的干燥器内,置于25℃ ±
4) 乙胺嘧啶晶型片剂的制备。分别取A晶型乙胺嘧啶和B晶型乙胺嘧啶约35 g用研钵研细,用显微镜放大倍数100倍时观察粒径为0.001 mm时,停止研磨,干燥后装入药瓶中。采用粉末直接压片法使用处方(1000片用量:乙胺嘧啶6.25 g、干淀粉15 g、聚维酮3.95 g、微晶纤维素42 g、羧甲淀粉钠8 g、

Figure 1. Structure of pyrimethamine
图1. 乙胺嘧啶结构
硬脂酸镁1.8 g)制备片剂,分别制得A、B晶型乙胺嘧啶片各2000片。
5) 重量差异。分别称取A晶型制作的片剂和B晶型制作的片剂20片总重量为MA = 1.5203 g,MB = 1.5698。并分别称取A晶型片剂和B晶型片剂的每片重量(mg),记录数据,计算片重差异。
2.2.2. 光学显微镜
将适量的A晶型、B1晶型、B2晶型放在BH200生物显微镜(上海长方光学仪器有限公司)下观察并拍照。
2.2.3. 红外光谱分析
分别用溴化钾在红外灯下置于玛瑙研钵中研细,压片,在岛津FTIR-8400红外分光光度计上绘制红外光吸收图谱。
2.2.4. 扫描电镜
采用JCM-600扫描电子显微镜扫描不同晶型的电子显微镜图。
2.2.5. X-射线衍射
将适量A、B晶型乙胺嘧啶制样后,置于Rigaku D/Max-2550v/pc粉末衍射仪(日本理学公司)上测定。测试条件为:Cu靶(λ = 1.54059 Å),扫描范围是5.0˚~40.0˚ 2θ,步长sampling:0.02˚,扫描速度5˚/min,电流150 mA,电压40 kV。
3. 结果与讨论
3.1. 晶型表征与确定
图2是乙胺嘧啶原料药(A晶型)根据加热时间的不同,分别加热3分钟、4分钟得出了外观不一样的B1、B2晶型。
如图2可见,B1为针状晶体,B2为片状晶体,其外观差别明显。计算B1晶型产率 = (0.12/0.5) × 100% = 24%,B2晶型产率 = (0.2/0.5) × 100% = 40%。下文的B晶型都为B2。将适量的A晶型、B1晶型、B2晶型放在BH200生物显微镜下观察并拍照,如图3。
从图3可知A晶型为块状晶型,大小较B1、B2晶型的小,B1晶型为针状晶型,B2为片状晶型,较A晶型明显不同。
取适量上述4种结晶A、B1、B2、C,分别扫描红外光吸收图谱,结果见图4。
由图4可见A和C为同一晶型,其红外光图谱与中国药典(2015年版)标准图谱一致。B1、B2为另一晶型(以下都称为B),其红外光图谱与英国药典(2012年版)标准图谱一致。两种晶体红外光吸收图谱的差异为,在1650 cm−1处A显双峰:1627 cm−1、1650 cm−1;B显单峰:1645 cm−1。在约1470 cm−1处A

Figure 2. Two crystals of pyrimethamine after heated A crystal
图2. A晶型经加热后的两种晶型

Figure 3. Optical micrographs of A, B1 and B2 crystal
图3. A晶型和B1、B2晶型的光学显微镜图
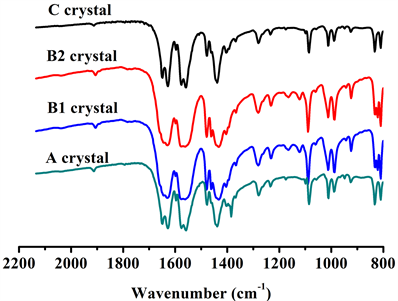
Figure 4. IR spectra of A, B1, B2 and C crystal
图4. A晶型和B1、B2晶型及C晶型的红外光谱图
为单峰:1478 cm−1;B为双峰:1461 cm−1、1479 cm−1。在约
分别取适量乙胺嘧啶晶型B及A,由于乙胺嘧啶的晶型都为不导电,为了防止样品电荷,减少试样表面的热损伤,以便提高试样电子的发射率,需要增加导电、导热性。我们的处理方法是在真空镀膜仪、离子溅射仪中喷镀一层金属铂。再放入扫描电子显微镜中进行观察,得图5。
由图5可知,A晶型放大倍数500倍时可见为块状晶体,B晶型放大200倍时明显可见为片状或针状晶型。二者明显不同。
将适量A、B晶型乙胺嘧啶制样后测定XRD如图6。
由图6可知乙胺嘧啶A晶型的特征衍射峰(2θ/˚)有:10.5、12.94、14.42、15.24、16.74、17.40、18.61、19.40、20.06、21.08、21.44、21.98、23.4、24.24、25.30、25.98、26.68、26.84、27.80、28.06、28.90、29.16、29.44、31.60。乙胺嘧啶B晶型的特征峰有:9.24、11.94、18.61、20.6、21.14、21.36、22.02、23.34、28.12、28.90、29.16、31.40、31.90、37.80、38.12、38.64,可见A晶型和B晶型除了存在四个重叠峰以外,二者其他峰明显不同,特别是在A晶型24.24、25.30、25.98、26.68、26.84区段和B晶型9.24、37.80、38.12、38.64更有直观上的差别,可知A晶型和B晶型为不同的晶型。
3.2. 晶型性质研究
3.2.1. 晶体的溶解性
晶型A、B乙胺嘧啶样品在不同溶液中的溶解情况如表1。

Figure 5. SEM of A and B crystal
图5. 晶型A和晶型B的扫描电镜图
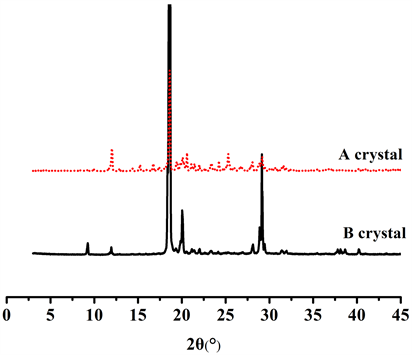
Figure 6. XRD of A and B crystal
图6. A晶型和B晶型的XRD图谱
Table 1. Dissultion of 1 gram of A and B crystal in different solution
表1. 溶解1 g A、B晶型所需要的溶剂量及溶解性
从表1可知在pH 1.2的盐酸溶液中,A晶型的溶解度要大于B晶型。在pH 6.8磷酸盐缓冲液、丙酮、三氯甲烷三种介质中A晶型与B晶型溶解性一样。在pH 4.5醋酸-醋酸钠缓冲液、乙醇介质中A晶型的溶解度小于B晶型的溶解度。可见不同晶型的乙胺嘧啶溶解性是有差异的。
3.2.2. 晶体的引湿性
根据药典引湿性原则:潮解:吸收足量水分形成液体。极具引湿性:引湿增重大于15%。有引湿性:引湿增重大于2%但小于15%。略有引湿性:引湿增重小于2%但不小于0.2%。无或几乎无引湿性:引湿增重小于0.2% [14] 。
由实验结果可知A增重百分比为1.47%,引湿增重在0.2%到2%之间,则略有引湿性。B增重百分比为2.37%,引湿增重在2%到15%之间,则有引湿性。
3.2.3. 重量差异
20片片剂A晶型和B晶型重差异结果如表2所示。
从表2可知,晶型A、B制作的片剂均符合小于±7.5%规定。
3.2.4. 紫外–可见分光光度法
分光光度法是通过测定被测物质在特定波长处或一定波长范围内的吸光度或发光强度,对该物质进行定性和定量分析的方法。
对照品比较法:根据药典乙胺嘧啶片,分别配制乙胺嘧啶A晶型、B晶型片剂溶液和对照品溶液,对照品溶液中所含被测成分的量应为供试品溶液中被测成分规定量的100% ± 10%,所用溶剂也应完全一致 [14] ,按下式计算供试品中被测溶液的浓度:
(1)
式中cX为供试品溶液的浓度;AX为供试品溶液的吸光度;CR为对照品溶液的浓度;
AR为对照品溶液的吸光度。
3.2.5. 标准曲线的绘制
分别称取乙胺嘧啶对照品10.2 mg、15.0 mg、20.4 mg、24.9 mg、29.6 mg,置于100 mL容量瓶中,用0.1 mol/L盐酸溶解并稀释至刻度,分别精密量取5 mL上述溶液至100 mL容量瓶中,用0.1 mol/L盐酸稀释至刻度,得到浓度分别为0.0051 mg/mL、0.0075 mg/mL、0.0102 mg/mL、0.01245 mg/mL、0.0148 mg/mL的溶液,在波长为272 nm下,以为0.1 mol/L盐酸空白,测定吸光度,见表3。
由图7可知,以浓度为横坐标,吸光度为纵坐标,用最小二乘法绘制标准曲线,得到线性方程Y = 29.251X + 0.0144,相关系数R2 = 0.9991,表明线性关系好。
3.2.6. 回收率
取9个100 mL容量瓶,按处方3配比分别加入各种辅料制备9份空白辅料,以中国药典2015版中乙胺嘧啶片含量测定浓度0.0125 mg/mL为100%,按高(120%)、中(100%)、低(80%)三个浓度依次加入乙胺嘧啶对照品30 mg、25 mg、20 mg至上述9份空白辅料中,每个浓度点做三个平行样,分别测定回收率,结果见表4。
Table 2. Weight difference of 20 pieces A and B crystal
表2. 20片A晶型片剂和B晶型重量差异
Table 3. The absorbance and concentration results of pyrimethamine
表3. 乙胺嘧啶线性测定结果表
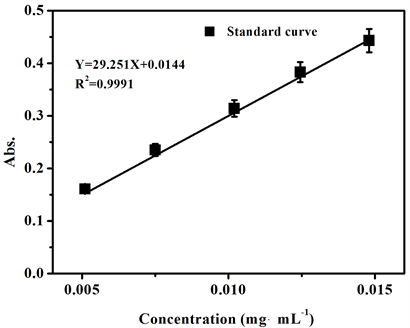
Figure 7. The standard curve of pyrimethamine
图7. 乙胺嘧啶标准曲线
Table 4. The recovery results of pyrimethamine
表4. 乙胺嘧啶回收率结果
由表4可知,三个浓度的平均回收率在98%~102%之间,说明本法准确度好。含量测定、含量均匀度、溶出度均采用单点对照法进行计算。
3.2.7. 溶出度
1) 实验前对ZRS
2) 取B晶型制备的片剂12片,同上操作,测出数据并记录。并制作溶出曲线。
3) 对照品的制备:取乙胺嘧啶对照品25 mg,精密称定,置100 mL量瓶中,加0.1 mol/L盐酸溶液70 mL,微温并时时振摇使乙胺嘧啶溶解,放冷,用0.1 mol/L盐酸溶液稀释至刻度,摇匀;滤过,精密量取续滤液5 mL置另一100 mL量瓶中,加0.1 mol/L盐酸溶液稀释至刻度,摇匀,在波长为272 nm下,以为0.1 mol/L盐酸空白,测定吸光度。
4) 计算公式及判断标准
(2)
式中:A样、A对分别为供试品和对照品溶液的吸光度,V样、V对分别为样品和对照品的稀释倍数,g对为对照品的称样量。
溶出度补液计算公式:最初介质体积500 mL,每次取样5 mL,补液5 mL,则:
5 × (1st溶出度/500 + 2st溶出度/500 + 3st溶出度/500 + 4st溶出度/500 + 5st溶出度/500)
溶出曲线判断标准:
若两者在15分钟内显示大于85%的溶出度,分布图被认为是相似的。如果小于85%,则计算f2值,如f2 ≥ 50,分布图被认为是相似的。
(3)
式中f2是相似因素,n是时间点数字;wR是对照品平均溶出百分比;wT是供试品平均溶出百分比。
5) 结论及分析:A晶型、B晶型乙胺嘧啶片各取样时间点平均累积溶出度见表5、表6,A晶型和B晶型片剂溶出曲线测定结果如表7,绘制溶出曲线如图8。
由图8可知,A晶型和B晶型片剂溶出基本可以达到90%以上,二者溶出曲线相似因子f2=69.04,相似性良好。
3.2.8. 含量测定
取乙胺嘧啶A晶型、B晶型片剂各20片,置于研钵中研细,精密称取药粉600 mg,用0.1 mol/L盐酸溶液适量溶解于200 mL量瓶中。微温并时时振摇使乙胺嘧啶溶解,放冷,用0.1 mol/L盐酸溶液稀释至
Table 5. The dissolution of A crystal pyrimethamine
表5. A晶型乙胺嘧啶片溶出度
Table 6. The dissolution of B crystal pyrimethamine
表6. B晶型乙胺嘧啶片溶出度
Table 7. The dissolution results of A and B crystal pyrimethamine
表7. A晶型和B晶型片剂溶出曲线测定结果
刻度,摇匀;滤过,精密量取续滤液10 mL置另一200 mL量瓶中,加0.1 mol/L盐酸溶液稀释至刻度 [14] ,摇匀,在波长为272 nm下,以为0.1 mol/L盐酸空白,测定吸光度。
分别取A、B晶型乙胺嘧啶制备的片剂采用上述方法检测含量。以及对照品的制备(方法同溶出度对照品的制备)。
(4)
检测结果及结论:A为97.20%,B为100.12%,A、B晶型乙胺嘧啶制备的片剂含量在中国药典2015版乙胺嘧啶片含量应在90.0%~110.0%范围内的规定。
3.2.9. 含量均匀度
1) 对照品的制备:方法同溶出度对照品的制备。
2) 取A晶型制备的片剂10片,分别置10个100 mL量瓶中,加0.1 mol/L盐酸溶液适量,超声处理使乙胺嘧啶溶解,放冷,用0.1 mol/L盐酸溶液稀释至刻度,摇匀,滤过,各精密量取续滤液5 mL置25 mL量瓶中,加0.1 mol/L盐酸溶液稀释至刻度 [14] ,摇匀,在波长为272 nm下,以为0.1 mol/L盐酸空白,测定吸光度。
3) 取B晶型制备的片剂10片,分别置10个100 mL量瓶中,操作同上。
4) 记录数据A对、A样、V对、V样、g对。根据公式求其均值X和标准差S以及标示量与均值之差的绝对值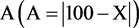 ;计算结果见表8。
;计算结果见表8。
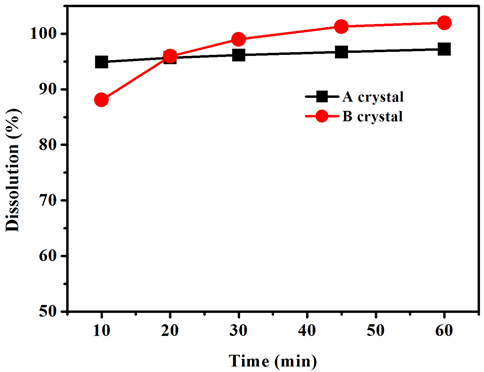
Figure 8. The dissolution curve of A and B crystal
图8. A晶型和B晶型片剂溶出曲线
Table 8. The content results of A and B crystal pyrimethamine
表8. A晶型与B晶型片剂含量均匀度
结论:A晶型与B晶型片剂含量均匀度均符合规定。
4. 结论
本文采用光学显微镜法、扫描电子显微镜法、粉末X射线衍射法、红外光谱法对乙胺嘧啶的不同晶型进行表征,A、B、C晶型均是因构型不同而引起的多晶型,并且A晶型、C晶型为同一种晶型,B晶型为另一种不同的晶型,A晶型为冰块状,B晶型为针状和片状。将A晶型在280℃加热处理,完全转变成B晶型。两种晶型制备的片剂各项质量指标(重量差异、鉴别、含量均匀度、溶出度、含量)均符合中国药典2015版规定的范围。溶出曲线表明两种片剂溶出曲线相似因子f2 = 69.04,相似性良好,测定其溶出度B晶型大于A晶型。
基金项目
大学生创新创业计划项目:抗微生物药物的多晶型研究(201510595206),广西中青年教师基础能力提升项目:乙胺嘧啶和甲氧苄啶药物多晶型研究(2017KY0189)。
文章引用
兰 晶,冯小珍,韩国成. 乙胺嘧啶药物的多晶型及性质研究
Study on the Polymorph and Properties of Pyrimethamine[J]. 分析化学进展, 2018, 08(03): 112-123. https://doi.org/10.12677/AAC.2018.83014
参考文献
- 1. 刘嘉, 郑明. 药物多晶型的研究进展[J]. 西北药学杂志, 2017, 32(3): 394-396.
- 2. Brittain, H.G. (2006) Polymorphism in Pharmaceutical Solids. New York: Marcel Dekker, Inc., 1999. Crystal Growth & Design, 6, 2333-2354.
- 3. 陈莉敏, 林友文, 蔡荣祥. 重视对固体口服药物多晶型的研究[J]. 中国药业, 2008, 17(4): 59-60.
- 4. 罗毅. 药物多晶型的稳定性研究进展[J]. 中国医药导报, 2009, 6(28): 5-6.
- 5. Threlfall, T.L. (1995) Analysis of Organic Polymorphs: A Review. Analyst, 120, 2435-2460.
https://doi.org/10.1039/an9952002435 - 6. Ye, D.Y. (1992) Study of the Polymorph of Etoposidum. Acta Pharmacologica Sinica, 27, 609-612.
- 7. 王海纳, 庞华, 董蓬, 等. 替莫唑胺多晶型的制备及其热稳定性[J]. 中国医药工业杂志, 2003, 34(4): 178-180.
- 8. Hansen, H.H., Feigh, M., Veidal, S.S., et al. (2017) Mouse Models of Nonalcoholic Steatohepatitis in Preclinical Drug Development. Drug Discovery Today, 22, 1707-1718.
https://doi.org/10.1016/j.drudis.2017.06.007 - 9. 魏树社, 张强. 生物药剂学与药物动力学 [M]. 第二版. 北京: 北京大学医学出版社, 2004.
- 10. 陈国满. 无味氯霉素的多晶形物[J]. 药学通报, 1982, 17(2): 29.
- 11. Kristl, A., Srcic, S., Vrecer, F., et al. (1996) Polymorphism and Pseudopolymorphism: Influencing the Dissolution Properties of the Guanine Derivative Acyclovir. International Journal of Pharmaceutics, 139, 231.
- 12. (2015) The United States Pharmacopoeia. 265.
- 13. 高晶, 滕再进, 束俭辉, 等. 固体制剂生产过程中的药物晶型转变[J]. 中国新药杂志, 2018, 27(9): 1000-1005.
- 14. 中国药典. 二部[S]. 2015: 3.
- 15. 郑丽莉. 药物多晶型对药物质量的影响[J]. 中国药师, 2008, 11(3): 347-349.
NOTES
*通讯作者。
