Advances in Analytical Chemistry
Vol.
10
No.
01
(
2020
), Article ID:
33747
,
12
pages
10.12677/AAC.2020.101004
Preparation of Gold Nanomaterials for Electrochemical Detection of Ascorbic Acid
Haiyan Huang, Hong Yuan, Jing Lan, Xiaozhen Feng*
College of Life and Environmental Sciences, Guilin University of Electronic Technology, Guilin Guangxi

Received: Dec. 10th, 2019; accepted: Dec. 26th, 2019; published: Jan. 2nd, 2020

ABSTRACT
Ascorbic acid (AA) is one of the nutrients necessary for life and health, so it is important to measure its content. In this paper, the glassy carbon electrode modified by gold nanomaterials was used to detect AA. Three gold nanomaterials (gold nano-cones, gold nano-blocks, gold nano-belts) were prepared by direct reduction method using different excipients. The morphology, size and absorption spectra of gold nanomaterials were analyzed by UV-Vis and SEM. Gold nano-cone modified electrode, gold nano-block modified electrode and gold nano-belt modified electrode were prepared by direct drop coating method. Cyclic voltammetry (CV) and differential pulse voltammetry (DPV) were used to study ascorbic acid (AA). The results showed the three gold nanomaterial modified electrodes had good electrocatalytic ability to ascorbic acid in phosphate buffer solution (PBS) containing a certain amount of ascorbic acid at pH 7.0, indicated that three modified electrodes can be used to detect ascorbic acid with 5.38 μmol·L−1 limit detection, and the average recovery was in the range of 97.10%~101.45%.
Keywords:Gold Nanomaterials, Electrochemical Catalysis, Modified Electrode, Ascorbic Acid, Detection

金纳米材料制备及用于抗坏血酸电化学检测
黄海雁,袁虹,兰晶,冯小珍*
桂林电子科技大学生命与环境科学学院,广西 桂林

收稿日期:2019年12月10日;录用日期:2019年12月26日;发布日期:2020年1月2日

摘 要
抗坏血酸(AA)是维持生命健康所必需的营养物质之一,所以对其进行测定具有重要意义。本文利用金纳米材料修饰玻碳电极实现对AA的检测。利用不同的塑型剂,通过直接还原法分别制备得到三种金纳米材料(金纳米锥、金纳米块、金纳米带)。用紫外–可见光谱(UV-Vis)和场发射电子扫描显微镜(SEM)对金纳米材料进行表征。采用直接滴涂法制备金纳米锥修饰电极、金纳米块修饰电极、金纳米带修饰电极,用循环伏安法(CV)和差分脉冲伏安法(DPV),研究抗坏血酸(AA)在不同金纳米材料修饰电极上的电化学行为。结果表明,在含有一定量AA的pH 7.0的磷酸盐缓冲溶液(PBS)中,三种金纳米材料修饰电极对抗坏血酸都有良好的电流响应能力。并考察三种金纳米材料修饰电极检测AA的线性关系、干扰性、稳定性、加标回收、实际样品检测等。最低检出限可达5.38 μmol·L−1,加标回收的平均回收率为97.10%~101.45%。
关键词 :金纳米材料,电化学催化,修饰电极,抗坏血酸,检测

Copyright © 2020 by author(s) and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
抗坏血酸(Ascorbic acid,简称AA),又名维生素C,广泛存在于食物、药品和生物有机体中。在蔬菜和水果中含量高,是维持生命的重要维生素之一。抗坏血酸是一种常用作食品添加剂的抗氧化剂 [1]。抗坏血酸可以激活羟化酶,有利于组织中形成胶原蛋白和加快生物体内的氧化还原代谢 [2]。抗坏血酸还参与体内氨基酸的代谢,能增加肌体的抗病能力,可用于预防坏血病。因此,有效检测抗坏血酸在食品和医学领域中具有重要意义 [3]。
近年来,金属纳米粒子由于其不寻常的物理和化学性质而在电分析中引起了更多的关注。金属纳米颗粒,尤其是贵金属纳米颗粒修饰的电极通常对于在裸电极处具有缓慢氧化还原过程的化合物表现出高的电催化活性。金纳米材料是一种比表面积大、吸附力强、导电性好、固定性好的功能型材料 [4]。由于外界环境会发生变化,材料表面和电子输运会随着其发生迅速地变化,利用内阻变化显著的特点,可以制作出快速响应、高灵敏度的传感器 [5]。
目前,AA的测定方法主要有电化学分析、氧化还原滴定、光度测定、荧光、高效液相色谱等 [6]。电化学分析法有着简单、快速、可靠的优点。由于在普通电极上抗坏血酸的过电位高和容易污染电极,检测的重现性非常差,这些缺点使裸电极直接检测样品中的AA有一定的难度 [7]。为了更好地检测AA,可以将某些导电性材料修饰在玻碳电极表面,形成一层膜。
本论文采用直接滴涂法制备了不同金纳米材料修饰电极。金纳米材料对AA有直接催化作用,可利用其作用对AA进行快速、灵敏的检测。
2. 实验部分
2.1. 实验仪器及试剂
本实验所用到的仪器:电化学工作站(CHI660e,上海辰华仪器公司);紫外分光光度计(UH5300,日本株式会社高新科技科学);集热式恒温磁力搅拌器(DF-101S,郑州长城科工贸有限公司);超声波清洗器(SK6210LHC,上海科导超声仪器);电子天平(EL-204,梅特勒–托利多仪器(上海有限公司);场发射环境扫描电子显微镜(Vario Micro Cube,德国Elementar公司)。
本实验所用到的实验试剂:氯金酸(国药集团化学试剂有限公司);抗坏血酸(国药集团化学试剂有限公司);十六烷基三甲基溴化铵(天津市光复精细化工研究所);二水合柠檬酸三钠(西陇化工股份有限公司);十二烷基硫酸钠(西陇科学股份有限公司);十二烷基磺酸钠(天津市光复精细化工研究说);无水乙醇(西陇化工股份有限公司);硝酸(廉江市爱廉化试剂有限公司);盐酸(廉江市爱廉化试剂有限公司);氧化铝抛光粉(浙江理协仪器设备有限公司);氯化钠(西陇化工股份有限公司);磷酸二氢钾(西陇化工股份有限公司);十二水合磷酸氢二钾(西陇化工股份有限公司);氯化钾(西陇化工股份有限公司);硫酸(廉江市爱廉化试剂有限公司);铁氰化钾(天津市福晨化学试剂厂)。
2.2. 实验过程
2.2.1. 溶液配制
0.1%氯金酸溶液:精密称取0.0500 g的HAuCl4固体,加入少量纯净水溶解于烧杯中,溶液呈淡黄色,将其移入50 mL的棕色容量瓶,再将其定容到刻度线,摇匀后,在容量瓶外层包上锡纸,放入冰箱中避光保存。
0.2 mol·L−1抗坏血酸(AA):精密称取0.3524 g的AA固体,倒入10 mL的容量瓶中,用纯净水定容到刻度线,摇匀,使用时需要现配现用。
0.1 mol·L−1的抗坏血酸(AA):精密准确称取0.1762 g的AA固体,直接移入10 mL容量瓶中,加纯净水定容到刻度线,摇匀。使用时需现配现用。
pH 7.0磷酸盐缓冲液(PBS):分别精密称取NaCl 4.0 g,KH2PO4 0.1 g,Na2HPO4·12H2O 1.45 g,KCl 0.1 g置于同一个小烧杯中,加入少量纯净水,用玻璃棒搅拌使其溶解,然后转入500 mL容量瓶中,纯净水定容至刻度线,用pH计调节溶液pH至7.0,高温灭菌20分钟,备用。
0.01 mol/多巴胺(DA):精密称取0.0189 g多巴胺置于10 mL容量瓶中,加入10 mL纯净水,超声使其溶解,放入冰箱保存备用。
0.01 mol/L尿酸(UA):精密称取0.0168 g尿酸,加入10 mL稀碱溶液,超声使其溶解,避光保存备用。
2.2.2. 直接还原法制备金纳米材料
称取三份0.6500 g十六烷基三甲基溴化铵(CTAB),各置于50 mL的锥形瓶中,第一份加入0.01 g的十二烷基磺酸钠,第二份加入0.01 g的十二烷基硫酸钠、第三份加入0.01 g十二烷基硫酸钠和0.01 g十二烷基磺酸钠,再分别加入35 mL的纯净水,使十六烷基三甲基溴化铵和塑形剂在40℃的恒温水浴锅中充分溶解,溶解后放置在室温下,各自加入1 mL 0.1%的HAuCl4水溶液,摇匀,使得HAuCl4水溶液和样品溶液充分混合,肉眼可观察到溶液变为淡黄色,将溶液静置5分钟;然后各自加入3 mL 0.2 mol·L−1的AA溶液,将其摇匀,溶液由淡黄色变为无色。将溶液放置于室温反应24小时,锥形瓶底部有沉淀生成。静置24 h后,溶液反应完全,将制备好的样品溶液弃掉约20 mL上清液后倒入离心管中,以6000 r/min离心5分钟,用移液枪吸出上清液,将得到沉淀物再分散于5 mL的纯净水中,保存于室温,以备研究使用。
2.2.3. 扫描电子显微镜(SEM)形貌表征样品的制备
将制备好的样品,在转速为6000 r/min条件下,离心5分钟,用移液枪吸取出上清液,加入4 mL纯净水,重复离心三次即可。然后对样品进行超声分散处理,使样品均匀的分散于纯净水中,再用移液枪移取0.5 μL金纳米材料,滴在已经用无水乙醇超声清洗干净的硅片的镜面上,自然晾干后将硅片粘贴到导电胶上,利用SEM对金纳米材料进行扫描分析。
2.2.4. 金纳米材料用于电化学研究抗坏血酸
1) 玻碳电极的预处理:将玻碳电极依次用湿润的0.3 μm、0.05 μm的氧化铝抛光粉,以“8”字形来回打磨至光滑镜面,再分别在无水乙醇和纯净水中超声清洗大约3~5 min [8]。
2) 玻碳电极的活化:在1.0 mol·L−1的硫酸溶液中,用循环伏安法以100 mV·s−1的扫描速率,在 −0.4~1.2 V电压范围内扫描 20圈,直至得到稳定的循环伏安曲线,此时电极已被活化 [9]。
3) 金纳米材料修饰电极的制备:先将金纳米材料进行离心洗涤,然后用移液枪吸取1 mL金纳米材料溶液,放入4 ml EP管中,再加入1 mL的乙醇,将其置于超声机中,使金纳米材料超声至分散。再用移液枪吸取10 μL金纳米材料均匀的滴涂在玻碳电极镜面上,待其自然晾干,即可得到金纳米材料修饰电极。
4) AA在金纳米材料修饰电极上的电化学行为:
采用循环伏安法(CV)和差示脉冲伏安法(DPV)对于不同金纳米材料修饰电极中抗坏血酸的电化学行为进行了研究。实验在三电极电解槽中进行。工作电极为裸玻碳电极(或三种金纳米材料修饰的玻碳电极),辅助电极为铂丝电极,参比电极为银/氯化银电极 [10] [11]。CV法扫描速率为100 mV/s,DPV法设置电压范围为−0.2~0.6 V,脉冲宽为0.05 s,脉冲间隔为0.5 s。
3. 结果与讨论
3.1. 金纳米材料的外观及表征
3.1.1. 金纳米材料溶液的外观图
本文的任务是使用合成的金纳米材料修饰玻碳电极,将其用于抗坏血酸含量测定的电化学方法研究。如图1所示,a溶液是以硫酸钠为塑形剂所制备的金纳米材料,b溶液是由磺酸钠为塑形剂所制备的金纳米材料,c溶液是由硫酸钠和磺酸钠共同为塑形剂所制备的金纳米材料。
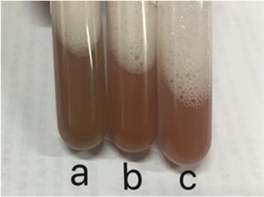
Figure 1. Appearance of gold nanomaterial solutions prepared with different shaping agents. a: Plastics: sodium sulfate; b: Plastics: sodium sulfonate; c: Plastics: sodium sulfate and sodium sulfonate
图1. 不同塑形剂制备的金纳米材料溶液的外观图。a:塑形剂:硫酸钠;b:塑形剂:磺酸钠;c:塑形剂:硫酸钠和磺酸钠
如图1为三种不同塑形剂制备的金纳米材料超声分散外观图。图1中a溶液的颜色为深褐色,肉眼能看到有些许黑色沉淀;图1中b溶液为红褐色,金纳米材料分散较均匀,肉眼几乎看不见沉淀;图1中c溶液为暗紫红色,溶液比较清澈。金纳米材料分散均匀,几乎无沉淀。
3.1.2. SEM形貌表征
将制备好的金纳米材料样品放入样品交换室内,采用20.00 KV的电压、0.1 m/s的速度对金纳米材料样品进行扫描,以下图均为金纳米材料的样品在扫描电子显微镜中所观察到的形貌:

Figure 2. SEM image of gold nanomaterials prepared with sodium sulfonate as shaping agent. a) Magnification of 24,000 times; b) Magnification of 50,000 times
图2. 磺酸钠为塑形剂所制备的金纳米材料的SEM图。a) 放大2.4万倍;b) 放大5万倍

Figure 3. SEM image of gold nanomaterials prepared by sodium sulfate as shaping agent. a) Magnification of 40,000 times; b) Magnification of 100,000 times
图3. 硫酸钠为塑形剂所制备的金纳米材料的SEM图。a) 放大4万倍;b) 放大10万倍

Figure 4. SEM images of gold nanomaterials prepared by sodium sulfonate and sodium sulfate together as shaping agents. a) Magnification of 20,000 times; b) Magnification of 40,000 times
图4. 磺酸钠和硫酸钠共同为塑形剂所制备的金纳米材料的SEM图。a) 放大2万倍;b) 放大4万倍
从SEM图(图2、图3、图4)可以看出,三种塑形剂所制备的金纳米材料形貌各不相同,材料的宽一般为几十纳米,长一般为几百纳米到微米级。磺酸钠为塑形剂制备的金纳米材料(图2),形貌较规则,大多数是锥形,具有一定的刚性,下文简称该纳米材料为金纳米锥。硫酸钠为塑形剂制备的金纳米材料(图3),形貌不规整,多为杂乱无章的块状,下文简称该纳米材料为金纳米块。磺酸钠和硫酸钠为塑形剂制备的金纳米材料(图4),形貌为丝带状,比上述两种材料制备的金纳米材料要柔软,下文简称该纳米材料为金纳米带。
3.1.3. 金纳米材料的吸收光谱表征
用紫外–可见光谱对金纳米材料表征,在300~1100 nm范围内,进行波长扫描,可得到以下吸收光谱图:
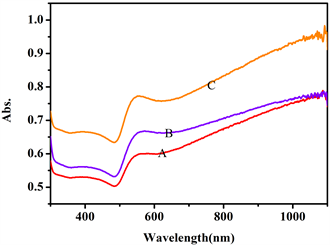
Figure 5. Absorption spectra of three gold nanomaterials. A: Gold nanocone; B: Gold nanoblock; C: Gold nanoribbon
图5. 三种金纳米材料的吸收光谱图。A:金纳米锥;B:金纳米块;C:金纳米带
从图5可见,三种金纳米材料均在800~1100 nm有优势吸收,分析原因可能是这些金纳米材料尺寸较大。此外在500 nm左右有一个倒峰,说明金纳米材料中几乎无微小颗粒。
3.2. AA在三种金纳米材料修饰电极上的CV信号
将上述三种金纳米材料,按照相同的方法对玻碳电极进行修饰,制成金纳米锥修饰电极、金纳米块修饰电极和金纳米带修饰电极。然后在相同的测定条件下,利用CV法进行研究。
3.2.1. 不同修饰电极测定空白溶液(pH 7.0的PBS溶液)的CV信号
将金纳米锥修饰电极、金纳米块修饰电极、金纳米带修饰电极和裸电极分别对pH 7.0的PBS溶液进行CV扫描。如图6所示,曲线A、B、C、D分别为裸电极、金纳米锥修饰电极、金纳米块修饰电极、金纳米带修饰电极在PBS溶液的CV信号。由图6可以看出,四种电极在PBS溶液中均没有氧化还原峰。
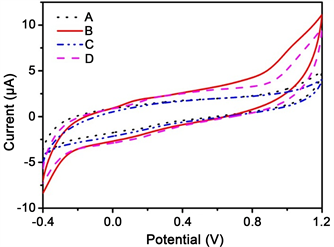
Figure 6. CV diagram of pure PBS solution detected with different modified electrodes. A: Bare electrode; B: Gold nanometer cone modified electrode; C: Gold nanometer block modified electrode; D: Gold nanometer strip modified electrode
图6. 不同修饰电极检测纯PBS溶液的CV图。A:裸电极;B:金纳米锥修饰电极;C:金纳米块修饰电极;D:金纳米带修饰电极
3.2.2. 不同修饰电极测定AA的电化学信号
为更好地比较不同电极对AA的电催化能力,将三种金纳米材料修饰电极分别对浓度为1.0 mmol·L−1的AA溶液(用pH 7.0的PBS溶液溶解稀释)进行CV扫描,并将其与裸电极检测相同浓度AA的氧化峰电位进行比较。如图7所示,曲线A、B、C、D分别为裸电极、金纳米锥修饰电极、金纳米块修饰电极、金纳米带修饰电极在1.0 mmol·L−1 AA溶液的CV信号。
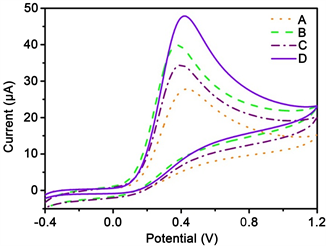
Figure 7. CV diagrams of AA detected by three modified electrodes and bare electrodes. A: Bare electrode; B: Gold nanometer cone modified electrode; C: Gold nanometer block modified electrode; D: Gold nanometer strip modified electrode
图7. 三种修饰电极和裸电极检测AA的CV图。A:裸电极;B:金纳米锥修饰电极;C:金纳米块修饰电极;D:金纳米带修饰电极
由图7可见,AA在四种电极上均产生不可逆的氧化反应。与裸电极相比,AA在修饰电极上产生的氧化峰电流更大,是因为金纳米材料是良好的导电物质,可加强玻碳电极的性能,对AA有很强的电流响应能力。AA在裸电极上(曲线A)的氧化峰电位为0.43 V,氧化峰电流值为27.73 μA。AA在金纳米锥修饰电极(曲线B)上的氧化峰电位为0.38 V,氧化峰电流为39.77 μA。AA在金纳米块修饰电极(曲线C)上的氧化峰电位为0.40 V,氧化峰电流为34.33 μA。AA在金纳米带修饰电极(曲线D)上的氧化峰电位为0.42 V,氧化峰电流为47.79 μA。
三种修饰物相比较,金纳米带修饰电极检测AA时氧化峰电流变化值最明显。金纳米锥修饰电极和金纳米块修饰电极均使AA的氧化峰发生负移,而金纳米带修饰电极测得的AA的氧化峰电位基本不变。金纳米带修饰电极对AA的电流响应信号最大。
3.3. DPV法对抗坏血酸(AA)的定量分析
由上述结果可知,三种金纳米材料修饰电极对AA的检测都有较强的催化作用,将三种金纳米材料的修饰电极用相同的检测参数,分别测定不同浓度的AA,并研究其浓度和电流之间的关系,计算其线性范围和检出限,然后进行抗干扰、重现性、稳定性和加标回收实验,计算其回收率。
3.3.1. 线性范围和检出限
通过DPV法研究了AA浓度与电流之间的关系。将三支金纳米材料修饰电极在相同的检测条件下,分别对不同浓度的AA进行扫描测定。得到其对应的DPV数据,计算其线性方程和检出限。
图8(a)是金纳米锥修饰电极对不同浓度AA的扫描结果,曲线由上到下,AA浓度从高到低。由图可知,AA的出峰电位基本不变,均保持在0.23 V左右。随着AA浓度的不断增加,其氧化峰的电流也不断变大。
图8(b)是金纳米锥修饰电极测定不同浓度的AA溶液和其氧化峰电流值之间的关系。线性范围为114.38~500 μmol·L−1,回归方程y = 0.0053x + 0.859,相关系数为r = 0.9979,检出限为11.23 μmol·L−1。
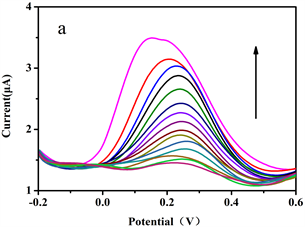
Figure 8. DPV (a) and linear relationship (b) of gold nanocone modified electrode scanning AA with different concentration
图8. 金纳米锥修饰电极扫描不同浓度AA的DPV图(a)和线性关系图(b)
图9(a)是金纳米块饰电极对于不同浓度AA的扫描检测结果,曲线由上到下,AA浓度从高到低。由图可知,AA的出峰电位基本不变,均保持在0.2 V左右。随着AA浓度的不断增加,其氧化峰的电流也不断变大。
图9(b)是金纳米块修饰电极测定不同浓度的AA溶液及其氧化峰电流值之间的关系。线性范围为92.65~500 μmol·L−1,回归方程为y = 0.0056x + 0.1876,相关系数为r = 0.9978,检出限为5.38 μmol·L−1。
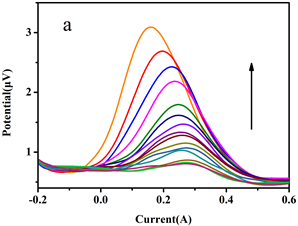
Figure 9. DPV (a) and linear relationship (b) of gold nanoblock modified electrode scanning AA with different concentration
图9. 金纳米块修饰电极扫描不同浓度AA的DPV图(a)和线性关系图(b)
图10(a)是金纳米带修饰电极对不同浓度AA的扫描检测结果,曲线由下到上,AA浓度逐渐增大。由图可知,AA的出峰电位基本不变,均保持在0.2 V左右。随着AA浓度的不断增加,其氧化峰的电流也不断变大。
图10(b)是金纳米带修饰电极测定不同浓度的AA溶液和其氧化峰电流值之间的关系。线性范围为52.33~1000 μmol·L−1,回归方程为y = 0.0055x + 0.3484,相关系数为r = 0.9995,检出限为9.1 μmol·L−1。
3.3.2. 干扰实验
为考察金纳米材料修饰电极对AA的选择性,选择了4种常见物质来考察金纳米材料修饰电极的抗干扰情况。在相同的检测参数下,分别以三种金纳米材料修饰电极为工作电极,固定AA的浓度为5.0 mmol·L−1,对2.0 mmol·L−1的尿酸(UA)、2.0 mmol·L−1的多巴胺(DA)、5.0 mmol·L−1的赖氨酸(Lys)、2.0 mmol·L−1的葡萄糖(Glu)进行检测。
实验结果表明,三种修饰电极在5.0 mmol·L−1 AA溶液中,加入UA、DA、Lys、Glu后,对AA的检测无明显干扰,即三种修饰电极对AA均有较好的选择性。
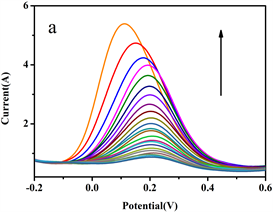
Figure 10. DPV (a) and linear relationship (b) of gold nanoribbon modified electrode scanning AA with different concentration
图10. 金纳米带修饰电极扫描不同浓度AA的DPV图(a)和线性关系图(b)
3.3.3. 三种修饰电极的稳定性
用同一支修饰电极放置不同时间(20 min、40 min、60 min、80 min、100 min)后对AA进行测定,作出其DPV图,计算RSD。
1) 金纳米锥修饰电极的稳定性:该电极放置不同时间后对AA进行测定(图11),RSD为1.53%。实验结果表明,金纳米锥修饰电极具有较好的稳定性。
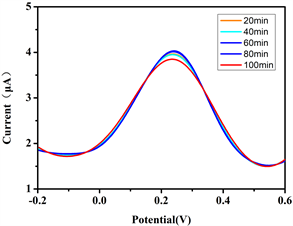
Figure 11. DPV diagram of stability detection of gold nanocone modified electrode
图11. 金纳米锥修饰电极稳定性检测的DPV图
2) 金纳米块修饰电极的稳定性:该电极放置不同时间后对AA进行测定(图12),RSD为15.16%。实验结果表明,金纳米块修饰电极稳定性较差。

Figure 12. DPV diagram of stability detection of gold nanoblock modified electrode
图12. 金纳米块修饰电极稳定性检测的DPV图
3) 金纳米带修饰电极的稳定性:该电极放置不同时间段对AA进行测定(图13),RSD为3.42%。实验结果表明,金纳米带修饰电极具有较好的稳定性。
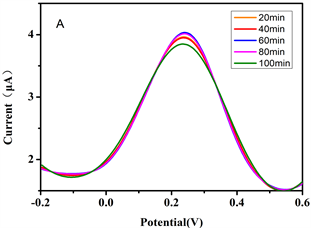
Figure 13. DPV diagram of stability detection of gold nanorib-modified electrode
图13. 金纳米带修饰电极稳定性检测的DPV图
3.3.4. 加标回收实验
取10片维生素C咀嚼片(规格:100 mg),碾碎成粉末状,称取0.09 g粉末,置100 mL容量瓶中,先加少量纯净水溶解,再用纯净水定容至刻度,将其过滤,可得到AA浓度为500 μmol·L−1的样品溶液。再配制3个不同浓度的AA标准品溶液各三份,进行加标回收实验,得出实验数据,计算回收率。
1) 金纳米锥修饰电极检测AA的加标回收实验
对三个不同浓度的AA溶液进行加标回收实验,平均回收率为97.10%,RSD为4.4%,效果良好。测得的数据如下表1所示。
Table 1. Experimental data of labeled recovery of gold nanocones
表1. 金纳米锥加标回收实验数据表
2) 在金纳米块修饰电极中进行的AA的加标回收实验
对三个不同浓度的AA溶液进行了加标回收实验,平均回收率为99.02%,RSD为4.40%,效果良好。测得的数据如下表2所示。
Table 2. Experimental data of labeled recovery of gold nanoparticles
表2. 金纳米块加标回收实验数据表
3) 在金纳米带修饰电极中进行的AA的加标回收实验
对三个不同浓度的AA溶液进行了加标回收实验,平均回收率为101.45%,RSD为2.2%,效果良好。测得的数据如下表3所示。
Table 3. Experimental data of labeled recovery of gold nanoribbons
表3. 金纳米带加标回收实验数据表
4. 结论
首先制备得到三种金纳米材料,并对其进行了紫外可见吸收光谱、SEM和电化学等性能表征;然后将其成功修饰于玻碳电极上,通过CV法发现修饰电极可增强电极检测AA的灵敏度,并对AA进行定量分析,得到线性关系方程、检出限,还对其选择性进行了检测,结果表明三种金纳米材料修饰电极均对抗坏血酸有良好的选择性。综合电流响应能力、线性范围、检出限、选择性、稳定性、准确度(回收率)、实际样品检测七个方面的检测数据,金纳米带修饰电极检测AA的效果最好,该修饰电极可作为一种有效灵敏的直接检测抗坏血酸的传感器,制作过程简单,成本较低,可重复使用,具有潜在的实用价值。
基金项目
广西自然科学基金项目(2018GXNSFBA281135)资助,大学生创新创业计划项目(201710595078)资助。
文章引用
黄海雁,袁 虹,兰 晶,冯小珍. 金纳米材料制备及用于抗坏血酸电化学检测
Preparation of Gold Nanomaterials for Electrochemical Detection of Ascorbic Acid[J]. 分析化学进展, 2020, 10(01): 24-35. https://doi.org/10.12677/AAC.2020.101004
参考文献
- 1. 张玲玲, 姚善卓. 催化动力学光度法对食品添加剂检测的研究进展[J]. 太原科技, 2009, 191(12): 68-70.
- 2. 林惠文, 李芳青, 毛燕妮, 等. 氨基-β-环糊精-单壁碳纳米管-二茂铁修饰电极对抗坏血酸的电化学行为研究[J]. 化工时刊, 2012, 26(6): 3-7.
- 3. 刘彦培, 张艳丽, 杨应彩, 等. 抗坏血酸在纳米金/石墨烯复合物修饰电极上的电化学行为研究[J]. 云南民族大学学报: 自然科学版, 2014(4): 251-255.
- 4. 牛得军. 基于无机纳米材料组装的信号增强型电化学免疫传感器的研究[D]: [硕士学位论文]. 信阳: 信阳师范学院, 2011.
- 5. 杨翠. 金纳米粒子修饰玻碳电极及其检测表阿霉素的研究[D]: [硕士学位论文]. 沈阳: 沈阳师范大学, 2012.
- 6. 刘素芹, 王启会, 刘慧宏. 抗坏血酸在聚槲皮素修饰电极上的电化学行为[J]. 分析科学学报, 2010, 26(1): 100-102.
- 7. 陶海升, 靳桂英, 程旺兴, 等. 抗坏血酸在聚阿魏酸修饰玻碳电极上的电化学行为研究[J]. 分析试验室, 2005, 24(10): 17-20.
- 8. 杨卉彦. 基于不同条件电沉积金的葡萄糖电化学传感器的研制[D]: [硕士学位论文]. 上海: 上海师范大学, 2012.
- 9. 桂娟. 纳米铂复合膜修饰电极的制备及其检测应用[D]: [硕士学位论文]. 武汉: 华中科技大学, 2008.
- 10. Huang, J., Liu, Y., Hou, H. and You, T. (2008) Simultaneous Electrochemical Determination of Dopamine, Uric Acid and Ascorbic Acid Using Palladium Nanoparticle-Loaded Carbon Nanofibers Modified Electrode. Biosensors and Bioelectronics, 24, 632-637.
https://doi.org/10.1016/j.bios.2008.06.011 - 11. Sun, C.-L., Lee, H.-H., Yang, J.-M. and Wu, C.-C. (2011) The Simultaneous Electrochemical Detection of Ascorbic Acid, Dopamine, and Uric Acid Using Graphene/Size-Selected Pt Nanocomposites. Biosensors & Bioelectronics, 26, 3450-3455.
https://doi.org/10.1016/j.bios.2011.01.023
NOTES
*通讯作者。
