Advances in Clinical Medicine
Vol.08 No.03(2018), Article ID:24926,6
pages
10.12677/ACM.2018.83049
Advance in Research on the Pharmacology and Clinical Use of Nalbuphine
Changmao Zhu, Cong Wang, Xianwei Zhang
Department of Anesthesiology, Tongji Hospital, Tongji Medical College, Huazhong University of Science and Technology, Wuhan Hubei

Received: Apr. 21st, 2018; accepted: May 10th, 2018; published: May 17th, 2018

ABSTRACT
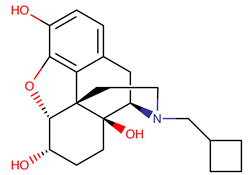
Nalbuphine is a synthetic opioid agonist-antagonist analgesic derivative of the phenanthrene group, and its structure is C21H27NO4, similar to those of naloxone and oxymorphone. It acts as a mu-opioid receptor antagonist and kappa-opioid receptor agonist, with analgesic potency equivalent to morphine and better safety profile. Nalbuphine is mainly used to treat and prevent moderate to severe pain.
Keywords:Nalbuphine, Pharmacology, Clinical Use
纳布啡的药理学和临床应用进展
朱昌茂,王聪,张咸伟
华中科技大学同济医学院附属同济医院麻醉科,湖北 武汉

收稿日期:2018年4月21日;录用日期:2018年5月10日;发布日期:2018年5月17日

摘 要
纳布啡是一种吗啡喃类半合成激动–拮抗镇痛药,分子式C21H27NO4,结构上类似于阿片受体拮抗剂纳洛酮和强效阿片类镇痛药羟吗啡酮,主要通过激动κ受体、拮抗μ受体发挥药理作用。镇痛效价与吗啡类似,但副作用较少,安全性较高,主要应用于中重度疼痛的治疗。
关键词 :纳布啡,药理学,临床应用

Copyright © 2018 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/


1. 引言
纳布啡是一种吗啡喃类半合成激动–拮抗镇痛药,分子式C21H27NO4,结构上类似于阿片受体拮抗剂纳洛酮和强效阿片类镇痛药羟吗啡酮,主要通过激动κ受体、拮抗μ受体发挥药理作用 [1] 。镇痛效价与吗啡类似,拮抗效价是喷他佐辛的10倍 [1] ,副作用较少,安全性较高,主要应用于中重度疼痛的治疗。纳布啡1965年首次合成,1979年在美国上市,已在临床应用30余年,但在国内应用时间很短,国产纳布啡2014年投入临床使用,目前国内医务人员对于纳布啡的使用经验较少,研究也比较匮乏,现就纳布啡药理作用及临床应用作一综述,以供临床参考。
2. 药理学
纳布啡作为激动–拮抗镇痛药其作用机制尚未完全阐述清楚。目前普遍认为纳布啡主要通过激动κ受体、拮抗μ受体发挥药理作用 [1] 。纳布啡通过激动κ受体产生镇痛、镇静、缩瞳、呼吸抑制等作用,然而,κ受体相关缩瞳及呼吸抑制较μ受体激动药小得多。同时,与μ受体产生欣快感不同,κ受体产生烦躁焦虑与致幻作用,因而依赖性较低。与μ受体激动药如吗啡合用时,纳布啡拮抗μ受体可预防或减轻μ受体激动药产生的呼吸抑制等副作用,且对镇痛效果几乎无影响,但应用于阿片依赖患者时可能会出现戒断反应。
2.1. 药动学
纳布啡给药途径多样,可通过静脉注射、肌肉注射、皮下注射、椎管内给药,口服给药镇痛效价约为静脉给药的1/5~1/4,无口服剂型 [2] 。纳布啡静脉给药后2~3分钟内即可起效,肌肉或者皮下注射15分钟内起效,起效血浆浓度12 μg/L,30分钟达到血浆峰浓度48 μg/L,半衰期约5小时,依据个体差异的不同,镇痛时间约3~6小时 [3] 。纳布啡主要在肝脏经过细胞色素酶P4503A4和2C19代谢,主要代谢产物是N-羟基酮环丁基甲基纳布啡与羟基化衍生物 [4] ,以原形在肾脏排出的纳布啡仅约4%,清除率主要依赖于肝脏血流 [4] [5] 。肝血流量随着年龄增长而下降,因而不同年龄层半衰期存在较大差异。P. Jaillon等人研究测定,23-32岁人群中纳布啡半衰期t1/2 = (1.96 ± 0.45) h,血浆清除率Vl = (1.78 ± 0.20) L/kg·h,表观分布容积Varea = (5.45 ± 1.43) L/kg。而儿童(5~8.5岁)半衰期较短(0.95 ± 0.24) h,老年人(65~90岁)较长(2.28 ± 1.49) h [5] 。国内学者对于中国人的研究显示,纳布啡代谢符合线性药动学特征,无性别间差异 [6] 。
2.2. 药效学
1) 镇痛作用:纳布啡镇痛效价和作用时间与吗啡相近,但是纳布啡最大镇痛强度较吗啡低。0.15 mg/kg的纳布啡与同剂量吗啡对止血带耐受的提高程度类似,但是继续增大剂量到0.6 mg/kg时,吗啡效果逐步增加,纳布啡效果不再增强。在一篇纳布啡与吗啡效果对比的荟萃分析中,通过分析618位患者的镇痛效果发现,纳布啡的镇痛效果与吗啡不存在明显差异([RRs], 1.01; 95% CI, 0.91 to 1.11; P = 0.90) [7] 。
2) 拮抗效应:在羟考酮诱发的兔子呼吸抑制试验中,静脉注射纳布啡的拮抗效果是纳洛芬的1/3。解救羟考酮诱发的昏迷时,纳布啡效力是纳洛芬的1/2,喷他佐辛的8倍 [1] 。在临床应用中,纳布啡可以拮抗μ受体引起的副反应,如呼吸抑制、瘙痒、尿潴留等。
3) 对呼吸功能影响:纳布啡在小剂量使用时与同剂量吗啡呼吸抑制程度类似 [1] 。然而,与吗啡不同的是,纳布啡的呼吸抑制存在封顶效应,当达到封顶剂量时,继续增加纳布啡剂量,呼吸抑制不再加重。在动物实验中,持续给大鼠静脉输注纳布啡,在0~20 μg∙kg−1∙min−1时,PaCO2逐步增加,但是在20~50 μg∙kg−1∙min−1之间时,大鼠PaCO2达到一个平台值,之后继续增加剂量直到200 μg∙kg−1∙min−1时,PaCO2才继续升高,而200 μg∙kg−1∙min−1远大于治疗量 [8] 。同样,在对志愿者的研究中,大于0.1 mg/kg时,呼吸抑制程度不再增加,直到0.5~1 mg/kg时才加重。纳布啡说明书推荐单次最大注射剂量是20 mg,复合麻醉时维持剂量是每次注射0.25~0.5 mg/kg,因而在非麻醉诱导情况下单次注射剂量不会超过平台期剂量。
4) 对循环系统影响:纳布啡在低剂量用于镇痛和大剂量用于复合麻醉时对于循环影响均很小,可用于循环不稳定患者。稳定性心绞痛患者中使用纳布啡,心率、动脉压、肺动脉压、肺循环和体循环阻力、心搏量、左室射血分数无显著变化。急性心肌梗死患者静脉10 mg纳布啡使用后,患者动脉压、肺动脉压、左室充盈压,心搏量和左室每搏功指数保持稳定。但是心率与左心收缩力轻微下降,因这两项指标是心肌耗氧量的重要决定因素,因而纳布啡可能存在防止急性心梗患者心肌缺血加重的作用。
5) 依赖性:与μ受体产生欣快感不同,κ受体引起烦躁焦虑与致幻作用。在一项对既往嗜毒者的研究中,8 mg纳布啡与同剂量的吗啡主观效应类似,但是在24~72 mg时则表现出类似纳洛酮样效应,更大剂量时(90 mg)则导致令人厌烦的感受 [1] 。纳布啡大剂量、长期服用并无致欣快作用,且存在诸多不适反应,因而纳布啡依赖性及滥用风险很低。
3. 临床应用
3.1. 临床麻醉
1) 复合麻醉:纳布啡可满足中小手术镇痛需要,而对于大型手术则镇痛效力不足。纳布啡用于如无痛人流、无痛胃肠镜等短小手术,可提供满意镇痛,减少静脉麻醉药物用量,苏醒更快,术后疼痛发生率低。在腹腔镜胆囊切除术中,单纯使用纳布啡提供镇痛,患者术中生命体征稳定,苏醒迅速 [9] 。而在主动脉搭桥术中,单纯应用纳布啡或芬太尼提供镇痛,纳布啡组不能充分抑制手术操作中心血管和激素反应,术后镇痛效果也较芬太尼欠佳。纳布啡可满足中小手术镇痛需要,而对于大型手术则镇痛效力不足。
2) 预防术后寒战:研究报道纳布啡与哌替啶、曲马多类似,均可有效抑制术后寒战。在一项前瞻双盲随机研究中,30例术后寒战患者注射0.08 mg/kg纳布啡,30例注射0.5 mg/kg哌替啶,30例注射生理盐水,5分钟后,纳布啡、哌替啶、生理盐水反应率分别是80%、83%、0,30分钟后反应率分别是90%、93%、17% [10] 。在另一项纳布啡、曲马多、昂丹司琼、生理盐水对比研究中,发现纳布啡与曲马多反应率类似,分别是81%、88%,高于昂丹司琼61%与生理盐水36% [11] 。
3.2. 疼痛治疗
1) 术后疼痛:纳布啡可以单独应用,也可联合阿片类药物或局麻药用于术后镇痛,但是单独应用时,镇痛效力不足以用于胸腹部或骨科等大型手术。台湾的研究发现,在子宫或子宫肌瘤切除术后,纳布啡患者静脉自控镇痛(PCIA)与吗啡PCIA相比,镇痛效果类似,副反应低 [12] 。纳布啡与吗啡联合应用于PCIA时,镇痛效力并不会因为纳布啡的μ受体拮抗效应而下降,0.5 mg/ml纳布啡与0.5 mg/ml吗啡合用VRS评分反而略优于0.1 mg/ml吗啡,同时瘙痒发生率显著降低 [13] 。在患者硬膜外自控镇痛PCEA中纳布啡与氢吗啡酮合用,同样可加强氢吗啡酮镇痛作用,且尿储留、恶心呕吐、瘙痒发生率均降低 [14] 。因其呼吸抑制程度较低,亦可用于术后病房静脉补救镇痛 [15] [16] 。
2) 癌痛: 吗啡是最常用的治疗癌痛药物,纳布啡与吗啡相比镇痛效果类似,但副反应低,可提高癌痛患者生活质量,减少因副作用导致的治疗中断。在使用纳布啡与吗啡治疗慢性重度癌痛的平行、双盲研究中,纳布啡镇痛效果与吗啡类似,均可提供充分镇痛,但是恶心呕吐、头晕等副反应更少。但是,因纳布啡的拮抗作用,既往阿片类药物使用者均出现了戒断反应 [1] 。因而纳布啡用于慢性疼痛或癌痛治疗时,不适于对吗啡等μ受体镇痛药的替代治疗。
3) 内脏痛:κ受体在外周主要分布于表皮角质细胞、真皮成纤维细胞、关节肌肉和内脏器官的神经末梢、背根神经节和三叉神经节、淋巴细胞和巨噬细胞等。有报道指出在实验性测痛中,κ受体激动剂对内脏痛抑制效果较好 [17] 。但是目前关于κ受体激动剂对内脏痛的临床随机对照研究较少,纳布啡相关研究更是匮乏,需要更多研究以确定纳布啡对于内脏痛疗效。
4) 院前急救镇痛:在2001年以前,纳布啡是英国唯一可由急救护理人员使用的静脉镇痛药。在用于外伤等患者的院前急救镇痛时,患者平均视觉疼痛模拟评分(VAS)显著下降且没有发现明显的副反应 [18] 。值得注意的是,纳布啡对于吸毒患者急救镇痛效果不佳 [19] 。同时,在使用纳布啡后,可能会出现戒断反应及入院后阿片类镇痛药较常规使用量显著增加的问题,这些都需要急救人员及急诊医生充分考虑。
3.3. 治疗μ受体导致的副反应
1) 呼吸抑制:Julien等人研究发现,静脉注射0.1 mg/kg纳布啡,可以有效逆转1.5 mg羟吗啡酮引起的呼吸抑制,之后再追加0.4 mg纳洛酮,呼吸改变轻微 [20] 。有病例报道,在因使用二乙酰吗啡出现的迟发性呼吸抑制患者,20 mg纳布啡静脉注射,呼吸频率在2 min内由8次/min增加到15次/min,观察30 min,患者呼吸维持在15次/min左右,同时对镇痛效果无影响 [21] 。
2) 瘙痒:瘙痒是阿片类药物常见的副反应,其机制尚未被完全阐述清楚,可能与μ受体、组胺、5-HT系统等有关 [22] 。虽然纳布啡说明书中适应症无此项,许多研究报道纳布啡治疗阿片类药物引起的瘙痒效果佳。2016年的一篇系统综述全面分析了此前阿片诱发瘙痒的治疗情况,发现小剂量纳布啡对于阿片类药物引起的瘙痒疗效优于安慰剂、苯海拉明、纳洛酮、丙泊酚,并且不会降低阿片药物的镇痛作用,因而推荐纳布啡作为阿片诱发瘙痒治疗的一线用药 [23] 。
4. 副作用
因研究标准、患者体质、原发病、麻醉残余、伴随用药及治疗等原因,不同研究间副作用发生率差别较大。据纳布啡说明书(Hospira Inc., Lake Forest, IL, 2007)数据,在1066例接受纳布啡治疗的患者中常见不良反应的发生率:镇静(36%)、出汗(9%)、恶心呕吐(6%)、头晕(5%)、口干(4%)、头痛(3%)。包含15项研究820例患者的荟萃分析发现,纳布啡与吗啡副反应相比较,恶心、呕吐、瘙痒、呼吸抑制发生率分别是吗啡的78%、65%、17%、27%,发生率分别是19.9%、16.0%、4.7%、7.5% [7] 。罕见副反应中,有精神错乱与肺水肿的病例报道。
5. 结论与展望
纳布啡安全范围大,常规剂量很少导致呼吸抑制,与吗啡等阿片类药物相比,瘙痒、恶心呕吐等副反应发生率低。纳布啡可单独使用,也可与非甾体类药物,吗啡、芬太尼等μ受体激动药联合应用,在降低μ受体激动药副反应发生率的同时,不影响镇痛效果,可提高患者满意度。在多模式镇痛的时代,纳布啡因其镇痛效果良好,副反应发生率低,安全性高,在临床麻醉及疼痛治疗方面,纳布啡具有良好的应用前景。虽然纳布啡的临床应用及科学研究逐渐增多,但纳布啡的药理学仍未被充分理解,对于纳布啡药理学特点依旧值得更加广泛的研究,潜在的临床应用仍值得深入发掘。
文章引用
朱昌茂,王 聪,张咸伟. 纳布啡的药理学和临床应用进展
Advance in Research on the Pharmacology and Clinical Use of Nalbuphine[J]. 临床医学进展, 2018, 08(03): 289-294. https://doi.org/10.12677/ACM.2018.83049
参考文献
- 1. Errick, J.K. and Heel, R.C. (1983) Nalbuphine. A Preliminary Review of Its Pharmacological Properties and Therapeutic Efficacy. Drugs, 26, 191-211.
https://doi.org/10.2165/00003495-198326030-00002 - 2. Wang, H.J., Hsiong, C.H., Ho, S.T., et al. (2014) Commonly Used Excipients Modulate UDP-Glucuronosyltransferase 2B7 Activity to Im-prove Nalbuphine Oral Bioavailability in Humans. Pharmaceutical Research, 31, 1676-1688.
https://doi.org/10.1007/s11095-013-1272-4 - 3. Beaver, W.T., Feise, G.A. and Robb, D. (1981) Analgesic Effect of Intramuscular and Oral Nalbuphine in Postoperative Pain. Clinical Pharmacology and Therapeutics, 29, 174-180.
https://doi.org/10.1038/clpt.1981.28 - 4. Bressolle, F., Khier, S., Rochette, A., et al. (2011) Population Pharmacokinetics of Nalbuphine after Surgery in Children. British Journal of Anaesthesia, 106, 558-565.
https://doi.org/10.1093/bja/aer001 - 5. Jaillon, P., Gardin, M.E., Lecocq, B., et al. (1989) Pharmacokinetics of Nalbuphine in Infants, Young Healthy Volunteers, and Elderly Patients. Clinical Pharmacology & Therapeutics, 46, 226.
https://doi.org/10.1038/clpt.1989.130 - 6. 蔡立婧, 张俊, 彭文兴, 等. 纳布啡注射液在健康受试者中的药代动力学研究[J]. 中国药学杂志, 2011, 46(20): 1597-1600.
- 7. Zeng, Z., Lu, J., Shu, C., et al. (2015) A Comparison of Nalbuphine with Morphine for Analgesic Effects and Safety: Meta-Analysis of Randomized Controlled Trials. Sci-entific Reports, 5, 10927.
- 8. Difazio, C.A., Moscicki, J.C. and Magruder, M.R. (1981) Anesthetic Potency of Nal-buphine and Interaction with Morphine in Rats. Anesthesia and Analgesia, 60, 629-633.
https://doi.org/10.1213/00000539-198109000-00003 - 9. Khan, F.A., Zaidi, A. and Kamal, R.S. (1997) Com-parison of Nalbuphine and Buprenorphine in Total Intravenous Anaesthesia. Anaesthesia, 52, 1095-1101.
https://doi.org/10.1111/j.1365-2044.1997.211-az0347.x - 10. Wang, J.J., Ho, S.T., Lee, S.C., et al. (1999) A Comparison among Nalbuphine, Meperidine, and Placebo for Treating Postanesthetic Shivering. Anesthesia and Anal-gesia, 88, 686-689.
https://doi.org/10.1213/00000539-199903000-00041 - 11. Kyokong, O., Tamdee, D. and Charuluxananan, S. (2007) Comparison of the Efficacy of Nalbuphine, Tramadol, Ondansetron and Placebo in the Treatment of Postanesthetic Shivering after Spinal Anesthesia for Cesarean Delivery. Asian Biomedicine, 1, 189-194.
- 12. Ho, S.T., Wang, J.J., Liu, H.S., et al. (1998) Comparison of PCA Nalbuphine and Morphine in Chinese Gynecologic Patients. Acta Anaesthesiologica Sinica, 36, 65-70.
- 13. Yeh, Y.C., Lin, T.F., Lin, F.S., et al. (2008) Combination of Opioid Agonist and Agonist-Antagonist: Patient-Controlled Analgesia Requirement and Adverse Events among Different-Ratio Morphine and Nalbuphine Admixtures for Postoperative Pain. British Journal of Anaesthesia, 101, 542-548.
https://doi.org/10.1093/bja/aen213 - 14. Parker, R.K., Holtmann, B. and White, P.F. (1997) Patient-Controlled Epidural Analgesia: Interactions between Nalbuphine and Hydromorphone. Anesthesia and Analgesia, 84, 757-763.
https://doi.org/10.1213/00000539-199704000-00011 - 15. Ganesh, A., Adzick, N.S., Foster, T., et al. (2008) Ef-ficacy of Addition of Fentanyl to Epidural Bupivacaine on Postoperative Analgesia after Thoracotomy for Lung Resection in Infants. Anesthesiology, 109, 890-894.
https://doi.org/10.1097/ALN.0b013e31818aa6cb - 16. 罗爱林, 郑华. 外科患者术后疼痛管理[J]. 临床外科杂志, 2015(1): 21-23.
- 17. Rivière, J.M. (2004) Peripheral Kappa-Opioid Agonists for Visceral Pain. British Journal of Pharmacology, 141, 1331-1334.
https://doi.org/10.1038/sj.bjp.0705763 - 18. Chambers, J.A. and Guly, H.R. (1994) Prehospital Intravenous Nalbuphine Administered by Paramedics. Resuscitation, 27, 153-158.
https://doi.org/10.1016/0300-9572(94)90008-6 - 19. Stene, J.K., Stofberg, L., Macdonald, G., et al. (1988) Nal-buphine Analgesia in the Prehospital Setting. American Journal of Emergency Medicine, 6, 634-639.
https://doi.org/10.1016/0735-6757(88)90109-X - 20. Julien, R.M. (1982) Effects of Nalbuphine on Normal and Oxymorphone-Depressed Ventilatory Responses to Carbon Dioxide Challenge. Anesthesiology, 57, A320.
- 21. Hammond, J.E. (1984) Reversal of Opioid-Associated Late-Onset Respiratory Depression by Nalbuphine Hydrochloride. The Lancet (London, England), 2, 1208.
https://doi.org/10.1016/S0140-6736(84)92760-0 - 22. 王莉莉, 刘慧丽, 黄宇光. 阿片类药物椎管内镇痛引起皮肤瘙痒的发生机制及其防治[J]. 临床麻醉学杂志, 2006(5): 397-398.
- 23. Jannuzzi, R.G. (2016) Nalbuphine for Treatment of Opioid-Induced Pruritus a Systematic Review of Literature. Clinical Journal of Pain, 32, 87-93.
https://doi.org/10.1097/AJP.0000000000000211