Hans Journal of Food and Nutrition Science
Vol.04 No.01(2015), Article ID:14860,6
pages
10.12677/HJFNS.2015.41004
Detection of Anti-Oxidation Function Progress of Caenorhabditis elegans
Jie Zhou, Shengquan Mi
College of Applied Arts and Science of Beijing Union University, Beijing
Email: msq365@hotmail.com
Received: Jan. 26th, 2015; accepted: Feb. 8th, 2015; published: Feb. 17th, 2015
Copyright © 2015 by authors and Hans Publishers Inc.
This work is licensed under the Creative Commons Attribution International License (CC BY).
http://creativecommons.org/licenses/by/4.0/



ABSTRACT
Caenorhabditis elegans (C. elegans) as a model organism has been widely used in the field of life sciences. This paper introduces the research progress of detection method using C. elegans as experimental material to study antioxidant function of bioactive substances, compares several com- monly used antioxidant detection methods and their advantages and disadvantages, and proposes a set of biologically active substances combined antioxidant function testing methods.
Keywords:Caenorhabditis elegans, Anti-Oxidant, Detection Method
秀丽隐杆线虫抗氧化功能检测研究进展
周杰,米生权
北京联合大学应用文理学院,北京
Email: msq365@hotmail.com
收稿日期:2015年1月26日;录用日期:2015年2月8日;发布日期:2015年2月17日

摘 要
秀丽隐杆线虫(Caenorhabditis elegans, C. elegans)作为模式生物被被广泛应用于生命科学领域,本文介绍了以C. elegans作为实验材料研究生物活性物质的抗氧化功能检测方法的研究进展,比较了几种常用的抗氧化检测方法及其优缺点,并提出了一套生物活性物质抗氧化功能检测的组合方法。
关键词 :秀丽隐杆线虫,抗氧化,检测方法

1. 引言
C. elegans是体长不超过2 mm的小型土壤线虫,通身透明,能感知气味,对温度和光有反应的线形动物。自从1974年Sydney Brenner首次以C. elegans为材料揭示了动物细胞凋亡的分子机制以来备受关注 [1] 。近几年来,由于其种种优势[2] ,C. elegans作为模式生物已被广泛应用于生物学和医学领域。本文基于C. elegans介绍了几种常见的抗氧化检测方法,突出强调用C. elegans作为实验材料来从生物整体水平上检测抗氧化功能的检测方法,更能真实地反映生物个体的体内抗氧化情况。
人体在生命活动的过程中不断产生自由基,自由基的反应活性很强,当产生过量时,它就会攻击人体的生物大分子使其结构遭到破坏,从而产生一系列的疾病。有研究表明 [3] - [6] ,一些生物活性物质可改善机体氧化应激能力。因此,研究生物活性物质的抗氧化作用对预防和治疗一些疾病具有重要意义。
2. C. elegans的生物特征
C. elegans呈蠕虫状,两侧对称,成虫体长约1.0~1.5 mm,肉眼很难观察,需借助光学显微镜才能清晰观察。C. elegans以微生物为食,如埃希氏大肠杆菌。
C. elegans按性别可分为雄性和雌雄同体两种,绝大多数的线虫个体为雌雄同体。实验室研究一般用雌雄同体线虫[3] 。C. elegans生长发育很快,雌雄同体的个体产生的卵经孵化后经历四个幼虫期(L1、L2、L3、L4),当处于食物短缺等恶劣环境中,C. elegans会从L2期进入dauer期而不是L3期,处于dauer期的幼虫抗逆能力很强,并且不会老化。在环境条件较好时,线虫可从dauer期继续发育到L4期,因此利用该特性可保存线虫[3] 。
3. C. elegans抗氧化功能研究基础
氧化反应是人们生命活动的基础,在氧化过程中,会有各种各样的自由基的产生,这些具有高度反应活性的物质会与生物大分子反应从而对机体造成伤害。自由基是指能独立存在的,含有一个或一个以上未成对电子的任何原子或原子团[7] 。自由基主要可以分为三种[4] :氧自由基,包括超氧阴离子自由基,羟自由基,过氧化氢,单线态氧等。人体内总自由基中约95%以上属于氧自由基[8] ;非氧自由基,包括氢自由基,有机自由基等;氮自由基,包括一氧化氮,二氧化氮。
正常情况下,机体内有两种体系可以使自由基维持在损伤阈值以下,即酶体系和非酶体系。酶系统主要是由各种抗氧化酶,如超氧化物歧化酶(SOD)、过氧化氢酶(CAT)、谷胱甘肽过氧化酶(GSH-Px)等组成,这些酶能快速高效地清除体内产生的羟自由基、过氧化氢等氧自由基;非酶体系包括各种抗氧化因子,如维生素C、维生素E等维生素以及多酚类、黄酮类等天然产物[9] ,这些抗氧化因子同样可以有效地清除体内的自由基。
C. elegans有五对常染色体和一对性染色体,是一个染色体数很少的二倍体[2] 。其基因组也很小,仅有8 × 107 bps,约为人类基因组的3%。研究发现线虫中的19,000个基因约40%与人类同源[10] ,孟德尔人类遗传资料库2466个人类疾病基因中有533个和C. elegans同源[11] ,因而对于人体的抗氧化系统在C. elegans中也是存在的,C. elegans中存在的抗氧化酶与人体的抗氧化酶十分相似,主要是SOD和CAT。另外,C. elegans体内还含有谷胱甘肽S-转移酶(GST)和过氧化物酶基因(PRDX)等[12] 。因此,用C. elegans作为抗氧化功能检测对研究人体抗氧化功能有着重要意义。与其他生物材料相比,以C. elegans作为实验对象,具有以下几点优势[13] -[15] :(1) 易培养。实验用的C. elegans一般在琼脂平板上或液体培养基于20℃培养,食物是大肠杆菌OP50;(2) 通体透明,易于观察;(3) 野生型的C. elegans生长周期仅3天左右,寿命一般在20天左右(20℃下);(4) 价格成本低廉,可操控性强;(5)基因组全序列已知且容量小;(6)实验以动物整体为对象,且实验规模容易放大。近几年来,国内对于C. elegans的抗氧化功能的研究也越来越多[5] [6] [16] -[21] 。例如,张健炜等[16] 以C. elegans为模型,研究了红茶在环境氧化应激中对秀丽线虫寿命的延长作用;黄正杰等[5] 通过测定秀丽线虫寿命、后代数、虫体大小及线虫的急性热应激和急性氧应激能力,研究了人工养殖大鲵粗提物延缓秀丽线虫衰老的功能性质。
4. C. elegans抗氧化功能检测方法
检测抗氧化功能的方法有很多,按生物体是否参与实验可分为体外检测和体内检测,体外检测方法常用的主要是氧自由基吸收能力(Oxygen Radical Absorbance Capacity, ORAC)法、ABTS法、DPPH法、DMPD法、端粒重复扩增法(Telomeric Repeat Amplification Protocol, TRAP)、DCFH-DA法、总氧自由基清除能力检测法(Total Oxyradical Scavenging Capacity Assay, TOSCA)等;体内检测方法主要是针对于酶的含量及活性进行检测,如SOD、CAT等。体外法操作简单,检测快速,广泛应用于生产实践中[22] [23] 。但很多体外法的结果是矛盾的,而且也没有统一的方法去精确衡量所有的抗氧化物质的能力,此外由于这些方法生物相关性低,测量结果也不能准确反映生物体内抗氧化情况。而体内法生物相关性高,检测结果更加真实。C. elegans抗氧化功能检测是一种高效、低成本的体内检测方法。可以基于对活性氧的清除能力、抗氧化酶的含量与活性以及DNA氧化损伤程度等方面的检测。下面就其中常用的几种方法加以说明。
4.1. 活性氧(ROS)的含量的检测
荧光分析法可用于直接检测细胞内的ROS水平。荧光分析法是利用某些物质被紫外光照射后所发生的能反映出该物质特性的荧光,可以进行定性或定量分析的方法。目前常用的荧光物质是2’,7’-二氯二氢荧光素二乙酸酯(H2DCFDA)。该方法被广泛应用于直接测量C. elegans中ROS的含量[6] [18] -[20] 。Li WH等[18] 用H2DCFDA对C. elegans中的ROS进行了测定以确定在氧化应激和热应力作用下经治疗的线虫生存率是否增加。结果表明,经亚硒酸钠处理的线虫生存率显著增加。Qiuli Wu等人[19] 在研究不同的检测系统在C. elegans中检测DMSA包膜的Fe2O3纳米颗粒的安全浓度时,用含1 mM CM-H2DCFDA的M9缓冲液中预孵育3小时,然后再安装在琼脂片上在激发波长为510 nm和发射滤波器波长为488 nm处用激光扫描共聚焦显微镜检测。
荧光分析法具有灵敏性高、选择性好和动态响应范围极宽等优点[21] ,并且较为简便经济,是一种用途广泛的分析方法。但由于荧光物质相对较少,并且很多检测基团会对荧光光谱有吸收作用,使荧光强度减小导致检测准确度降低。另外,背景干扰、一些非检测成分的干扰也会影响检测的灵敏度[24] 。
4.2. 检测氧化损伤产物
氧化损伤产物是指由ROS损伤 DNA、蛋白质、脂质等生物大分子而产生的加合物。由ROS作用DNA可产生的8-羟基脱氧鸟苷(8-OHdG),在体内非常稳定,通过测定其含量可以反映个体整个体内DNA氧化损伤的程度[25] ,它被公认为是20多种DNA氧化损伤产物中最主要的标记物[21] 。Aan G.J.等[26] 在研究生育三烯酚(TRF)在氧化应激下对C. elegans的寿命和生物氧化标志物的影响时,利用8-OHdG EIA试剂盒对8-OHdG的含量进行了测量。结果表明,用TRF处理的有效地降低8-OHdG水平(P < 0.05)。Katarzyna D.等[27] 用气相色谱/串联质谱(GC/MS/MS)检测8-OH鸟嘌呤(8-OHG)以及8-OH腺嘌呤(8-OHA)在C. elegans的水平,从而确定了DNA损伤程度。
8-OHdG检测除了酶联免疫吸附(ELISA)法和气相色谱/质谱(GC/MS)分析法之外,还有32P后标记法、高效液相色谱–电化学(HPLC-ECD)分析法等。虽然检测8-OHdG灵敏度高,特异性好,并且在一定范围内有很好的线性关系[21] ,但很多检测方法仪器昂贵,成本高,样本前处理操作复杂,干扰因素较多等缺点[23] ,使其应用受到限制。
4.3. 检测酶的活性
SOD是体内重要的抗氧化酶,也是清除自由基的主要物质,在医药、食品及化妆品领域应用较为广泛[28] 。SOD作用于超氧阴离子自由基,发生歧化反应产生H2O2和O2,可以用检测超验阴离子自由基的方法间接检测SOD的含量及活性。如NBT法、邻苯三酚自氧化法以及细胞色素C还原法。另外,极谱氧电极法[29] 应用脉冲射解技术进行毫微秒级快速动力学跟踪及快速冰冻结合电子自旋共振波谱观察来直接获取SOD和O2的动力学信息,是一种较直接的方法。唐晓明[3] 采用邻苯三酚自氧化法测定秀丽线虫体内SOD的活性。除了上述方法外,还可以用荧光分析法检测SOD的含量。王丽萍[30] 等人在研究次血红素六肽(DhHP-6)延长秀丽线虫寿命的作用机制时,用荧光酶标仪定量检测CF1553 (SOD-3::GFP)突变体秀丽线虫的GFP绿色荧光强度。陈亮稳[31] 用荧光显微镜以FITC波段激发观察并放大400倍拍照,再分析照片相对荧光强度,测量了携带SOD-3::GFP的CF1553品系C. elegans SOD-3的表达量。
CAT是催化H2O2分解成O2和H2O的酶,也是过氧化物酶体的标志酶。CAT活性测定方法主要有碘量滴定法和紫外分光光度法,两者也可以结合使用。碘量滴定法是利用H2O2能将KI中的I氧化生成I2,以淀粉作为指示剂,用硫代硫酸钠滴定,通过消耗的H2O2可以测定CAT活性。紫外分光光度法更为简单,利用H2O2在294 nm处有个吸收峰,测定其吸光度检测H2O2测定CAT活性。
检测酶活性实质上是利用一些化学方法检测,通过酶活性大小间接反映抗氧化能力大小。这种方法反映的是线虫内抗氧化情况,但由于酶的特性、检测的化学物质等因素使该方法应用受到很大限制。
4.4. 线虫存活率
由于该方法简单方便,无复杂的操作步骤以及昂贵的检测仪器,因此目前国内外使用也较为广泛[32] -[34] 。但该方法只能粗略地估计线虫抗氧化能力的强弱,可靠性较差。Patricia M.等[33] 通过计算C. elegans存活率研究可可多酚对氧化应激抗性的影响。Chen W.等[34] 研究了白藜芦醇对C. elegans氧化应激性和寿命的影响。C. elegans在加或不加白藜芦醇的标准条件下进行培养培养。用胡桃醌诱导急性氧化应激后,测量线虫存活率和hsp-16.2::GFP的表达,研究结果表明白藜芦醇可以减轻胡桃醌诱导的氧化应激反应。
4.5. 细胞抗氧化活性分析法
细胞抗氧化活性(Cellular Antioxidant Activity, CAA)分析法是一种基于荧光分析法原理的抗氧化检测方法,由刘瑞海和Kelly L. [35] 提出。该方法最早被应用于分析、量化植物化学物质、食品提取物和膳食补充剂的抗氧化活性。到目前为止,已有数次利用该方法研究蔬菜水果抗氧化物质的报道[36] -[38] 。检测原理是:非极性的2’,7’-二氯荧光素二乙酸酯(DCFH-DA)与细胞膜结合而进入细胞内,在细胞内被水解为极性的DCFH和DA,这样DCFH就无法通过细胞膜而流出细胞。2,2’-偶氮双(2-脒基丙烷)二盐酸(ABAP)可产生ROS,用ABAP处理细胞,ABAP可在细胞外自发分解,形成过氧自由基,过氧自由基再与细胞膜作用生成更多的ROS;也可以自由进入细胞内产生过氧自由基,再氧化的细胞内DCFH产生荧光物质DCF,经磷酸缓冲液(PBS)洗去细胞外部和表面的荧光物质,检测DCF发光强度就可定量计算细胞内的ROS含量。
为了计算ROS含量,刘瑞海和Kelly L. Wolfe引进了CAA单位以及EC50值的概念。

其中, 和
和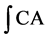 分别是被测样品和空白反应的动力学曲线下的积分面积。EC50即半数有效量,
分别是被测样品和空白反应的动力学曲线下的积分面积。EC50即半数有效量,

其中ƒa表示发挥抗氧化作用的部分,ƒu表示未发挥抗氧化作用的部分。刘瑞海和Kelly L.建议以槲皮素当量为标准计算。
CAA分析法是一种生物相关性更高的化学抗氧化活性的测定法,因为该方法考虑了生物吸收代谢过程,综合了生物利用率,检测的是细胞内的抗氧化活性,因此灵敏度更高,更能准确反映出细胞内抗氧化活性情况。首先,该方法考虑了底物的生理学性质,并且也仿真了生物系统的条件,其次,氧化剂的水平较低,ABAP浓度为600 uM,在该水平下可引发氧化反应产生过氧自由基,同时避免了抗氧化剂含量过高对细胞产生影响。另外,该方法采用了动力学曲线下的面积来计算细胞的抗氧化活性,考虑了氧化滞后时间和ROS的影响。
5. 展望
目前的检测抗氧化能力的方法种类繁多,但在国内将这些方法应用到对C. elegans的抗氧化活性的研究却鲜有报道。同时,这些方法也并不能完全地评价物质在体内的抗氧化能力。而CAA分析法是考虑了生物利用率和生物代谢过程的方法,可以有效反应细胞内抗氧化的实际情况,因此是一种较为理想的研究C. elegans抗氧化的方法。C. elegans是作为整体动物而言,比一般的细胞以及部分的生物组织作为研究对象研究机体抗氧化活性更有说服力,并且在个体层面上的比较,C. elegans的优势也十分突出。将CAA分析法与C. elegans结合起来用于研究个体水平的抗氧化情况,并且结合C. elegans寿命以及存活率应该是一个不错的选择。
基金项目
北京市教委研究项目资助(SQKM201311417014)。
文章引用
周杰,米生权, (2015) 秀丽隐杆线虫抗氧化功能检测研究进展
Detection of Anti-Oxidation Function Progress of Caenorhabditis elegans. 食品与营养科学,01,26-32. doi: 10.12677/HJFNS.2015.41004
参考文献 (References)
- 1. Brenner, S. (1974) The genetics of Caenorhabditis elegans. Genetics, 77, 71-94.
- 2. 刘恩岐, 仓林让 (2003) 模型动物——C. elegans研究进展. 动物科学与动物医学, 10, 23-24.
- 3. 唐晓明 (2012) 香豆素对C. elegans抗氧化作用研究. 硕士论文, 长春理工大学, 长春.
- 4. 阙斐 (2006) 黄酒的抗氧化活性及其中的酚类物质. 硕士论文, 浙江大学, 杭州.
- 5. 黄正杰, 崔建云, 任发政, 赵慧 (2013) 大鲵粗提物延缓秀丽线虫衰老的研究. 食品工业, 1, 122-125.
- 6. 何露, 李中, 韦睿, 雷清锋, 赵云燕 (2014) 姜黄类化合物提高线虫的抗氧化应激能力. 中国病理生理杂志, 1, 154-158.
- 7. 赵保路 (1999) 氧自由基和天然抗氧化物. 科学出版社, 北京.
- 8. 马淑慧 (2009) 羟基自由基和超氧阴离子自由基测定的荧光分析法研究. 硕士论文, 山东农业大学, 泰安.
- 9. 罗成, 周达, 鲁晓翔 (2009) 天然产物抗氧化机理的研究进展. 食品工业科技, 4, 336-338.
- 10. Lai, C.H., Chou, C.Y., Ch’ang, L.Y., Liu, C.S. and Lin, W. (2000) Identification of novel human genes evolutionarily con-served in Caenorhabditis elegans by comparative proteomics. Genome Research, 10, 703-713.
- 11. O’Brien, K.P., Westerlund, I. and Sonnhammer, E.L. (2004) Ortho disease: A database of human disease orthologs. Human Mutation, 24, 112-119.
- 12. 高大文, 李伟光, 高艳, 张成岗 (2013) C. elegans在植物提取物抗氧化活性研究中的应用. 军事医学, 4, 316-318.
- 13. 赵晴, 蒋湉湉 (2010) 秀丽隐杆线虫研究综述. 安徽农业科学, 19, 10092-10095.
- 14. Christiaan, F.L. and Arjan, B. (2013) Current methods in quantifying ROS antoxidative damage in Caenorhabditis elegans and other model organism of aging. Ageing Research Reviews, 12, 918-930.
- 15. 贾熙华, 曹诚 (2009) 秀丽隐杆线虫在医药学领域的应用和进展. 药学学报, 7, 687-694.
- 16. 张健炜, 熊哲, 高燕, 彭雨轩, 龚雨顺, 刘仲华 (2013) 红茶延长秀丽线虫在环境氧化应激中寿命的研究. 茶叶科学, 4, 295-300.
- 17. 刘璇 (2012) 细胞荧光探针的合成与应用. 硕士论文, 湖南师范大学, 长沙.
- 18. Li, W.H., Shi, Y.C., Chang, C.H., Huang, C.W. and Hsiu-Chuan Liao, V. (2014) Selenite protects Caenorhabditis elegans from oxidative stress via DAF-16 and TRXR-1. Molecular Nutrition Food Research, 58, 863-874.
- 19. Wu, Q., Li, Y., Tang, M. and Wang, D. (2012) Evaluation of environmental safety concentrations of DMSA coated Fe2O3-NPs using different assay systems in nematode Caenorhabditis elegans. PloS ONE, 7, 1-11.
- 20. Wang, Y., Jian, F., Wu, J. and Wang, S. (2012) Stress-response protein expression and DAF-16 translocation were induced in tributyltin-exposed Caenorhabditis elegans. Bulletin of Environmental Contamination and Toxicology, 89, 704-711.
- 21. 高瑞霄, 姚朱华, 邵红霞 (2009) 尿8-OHdG与糖尿病性动脉粥样硬化相关性的研究进展. 天津医药, 9, 809-811.
- 22. 张明 (2010) 几种体外抗氧化检测方法的评价研究. 硕士论文, 陕西师范大学, 西安.
- 23. Niki, E. (2010) Assessment of antioxidant capacity in vitro and in vivo. Free Radical Biology Medicine, 49, 503-515.
- 24. 王永利, 张江伟, 王立华, 敖登高娃, 黄慧婷, 李美红 (2011) 荧光分析法在药物分析中的应用研究进展. 中国实验方剂学杂志, 12, 253-255.
- 25. 熊萌瑶 (2011) DNA氧化性损伤生物标志物的化学发光分析新方法及应用研究. 硕士论文, 南昌航空大学, 南昌.
- 26. Aan, G.J., Zainudin, M.S., Karim, N.A. and Nqah, W.Z. (2013) Effect of the tocotrienol-rich fraction on the lifespan and oxidative biomarkers in Caenorhabditis elegans under oxidative stress. Clinics, 68, 599-604.
- 27. Arczewska, K.D., Tomazella, G.G., Lindvall, J.M., Kassahun, H., Maglioni, S., Torgovnick, A., Henriksson, J., Matilainen, O., Marquis, B.J., Nelson, B.C., Jaruga, P., Babaie, E., Holmberg, C.I., Bürglin, T.R., Ventura, N., Thiede, B. and Nilsen, H. (2013) Active transcriptomic and proteomic reprogramming in the C. elegans nucleotide excision repair mutant xpa-1. Nucleic Acids Research, 41, 5368-5381.
- 28. 章慧慧, 励建荣 (2007) 超氧化物歧化酶的研究和应用现状. 农产品加工•学刊, 8, 28-31.
- 29. 严海燕, 劳伟思, 钟日辉, 罗玲, 何建, 谢文锋 (2010) 邻苯三酚法检测血清超氧化物歧化酶参考值范围的验证和建立. 实用医技杂志, 12, 1144-1145.
- 30. 王丽萍, 金鑫, 黄磊, 李鹏飞, 王立成 (2012) DhHP-6延长秀丽线虫寿命的作用机制. 吉林大学学报, 5, 1045- 1048.
- 31. 陈亮稳 (2012) 蜜环菌菌索多糖延缓C. elegans衰老机理的初步研究. 硕士论文, 安徽大学, 合肥.
- 32. Martorell, P., Bataller, E., Llopis, S., Gonzalez, N., Alvarez, B., Montón, F., Ortiz, P., Ramón, D. and Genovés, S. (2013) A cocoa peptide protects Caenorhabditis elegans from oxidative stress and β-amyloid peptide toxicity. PLoS ONE, 8, 1-12.
- 33. Martorell, P., Forment, J.V., de Llanos, R., Montón, F., Llopis, S., González, N., Genovés, S., Cienfuegos, E., Monzó, H. and Ramón, D. (2011) Use of Saccharomyces cerevisiae and Caenorhabditis elegans as model organisms to study the effect of cocoa polyphenols in the resistance to oxidative stress. Journal of Agricultural and Food Chemistry, 59, 2077-2085.
- 34. Chen, W., Rezaizadehnajafi, L. and Wink, M. (2013) Influence of resveratrol on oxidative stress resistance and lifespan in Caenorhabditis elegans. Journal of Pharmacy and Pharmacology, 65, 682-688.
- 35. Wolfe, K.L. and Liu, R.H. (2007) Cellular antioxidant activity (CAA) assay for assessing antioxidants, foods, and dietary supplements. Journal of Agricultural and Food Chemistry, 55, 8896-8907.
- 36. Chen, Y., Wang, G., Wang, H., Cheng, C., Zang, G., Guo, X. and Liu, R.H. (2014) Phytochemical profiles and antioxidant activities in six species of ramie leaves. PLoS ONE, 9, 1-9.
- 37. Song, W., Derito, C.M., Liu, M.K., He, X., Dong, M. and Liu, R.H. (2010) Cellular antioxidant activity of common vegetables. Journal of Agricultural and Food Chemistry, 58, 6621-6629.
- 38. Wolfe, K.L., Kang, X., He, X., Dong, M., Zhang, Q. and Liu, R.H. (2008) Cellular antioxidant activity of common fruits. Journal of Agricultural and Food Chemistry, 56, 8418-8426.